Aufgabe 1 – Biochemie, Immunbiologie
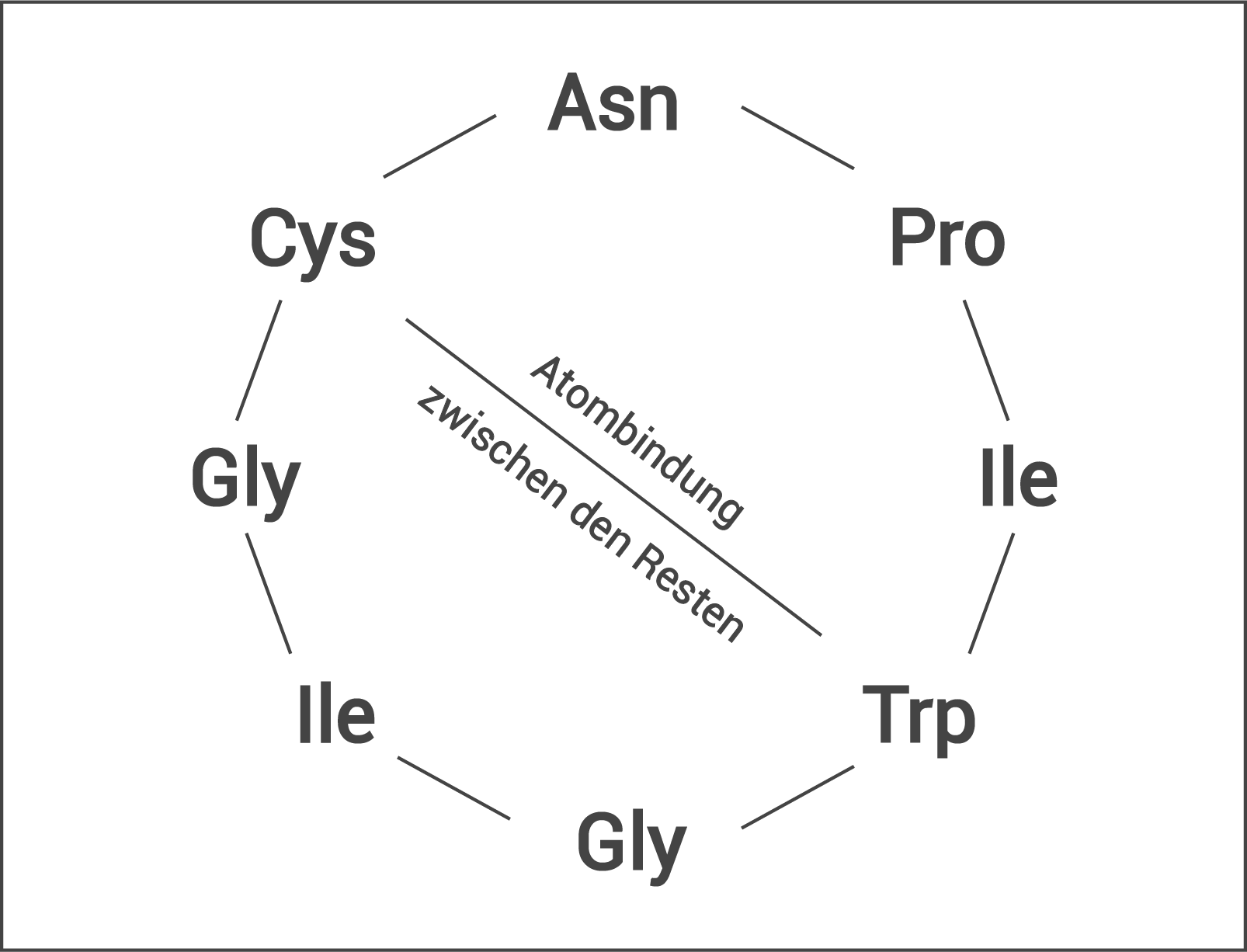
Alljährlich sterben in Deutschland Menschen nach dem Verzehr des Grünen Knollenblätterpilzes (Amanita phalloides, Abbildung 1). Bereits ein einziger Pilz kann tödlich sein. Der Grüne Knollenblätterpilz enthält unter anderem das Gift  -Amanitin, ein kleines Peptid, bestehend aus nur acht Aminosäuren (Abbildung 2).
-Amanitin, ein kleines Peptid, bestehend aus nur acht Aminosäuren (Abbildung 2).  -Amanitin wird weder beim Kochen zerstört noch durch die Proteasen des Verdauungstraktes abgebaut.
-Amanitin wird weder beim Kochen zerstört noch durch die Proteasen des Verdauungstraktes abgebaut.

 -Amanitin verhindert die Transkription in Zellen des menschlichen Organismus. Acht bis zwölf Stunden nach dem Verzehr kommt es zunächst zu Übelkeit, Erbrechen und Durchfall. Im schlimmsten Fall führt die Vergiftung nach mehreren Tagen zum Tod durch Leberversagen.
-Amanitin verhindert die Transkription in Zellen des menschlichen Organismus. Acht bis zwölf Stunden nach dem Verzehr kommt es zunächst zu Übelkeit, Erbrechen und Durchfall. Im schlimmsten Fall führt die Vergiftung nach mehreren Tagen zum Tod durch Leberversagen.
 -Amanitins in der Krebstherapie einzusetzen. Es gelang ihnen im Experiment mit Mäusen, Tumore der Bauchspeicheldrüse effektiv zu bekämpfen. Abbildung 3 zeigt das Prinzip dieser gezielten Bekämpfung einer Krebszelle mit
-Amanitins in der Krebstherapie einzusetzen. Es gelang ihnen im Experiment mit Mäusen, Tumore der Bauchspeicheldrüse effektiv zu bekämpfen. Abbildung 3 zeigt das Prinzip dieser gezielten Bekämpfung einer Krebszelle mit  -Amanitin-gekoppelten Antikörpern.
-Amanitin-gekoppelten Antikörpern.
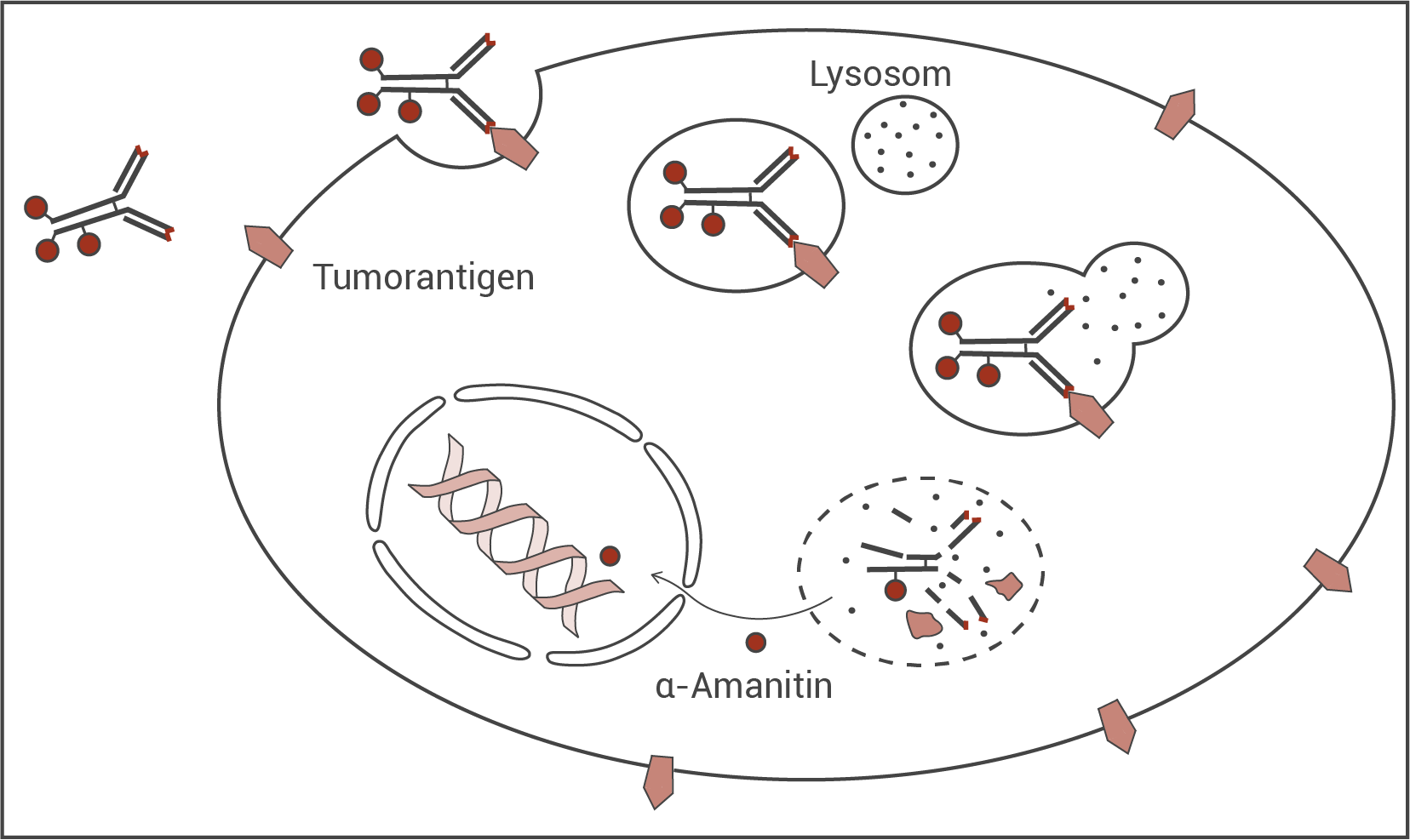
 -Amanitin-gekoppelten Antikörpern manchmal erhebliche Nebenwirkungen auf.
-Amanitin-gekoppelten Antikörpern manchmal erhebliche Nebenwirkungen auf.

Abb. 1: Grüner Knollenblätterpilz

Abb. 2: Struktur von alpha-Amanitin (schematisch)
1.1
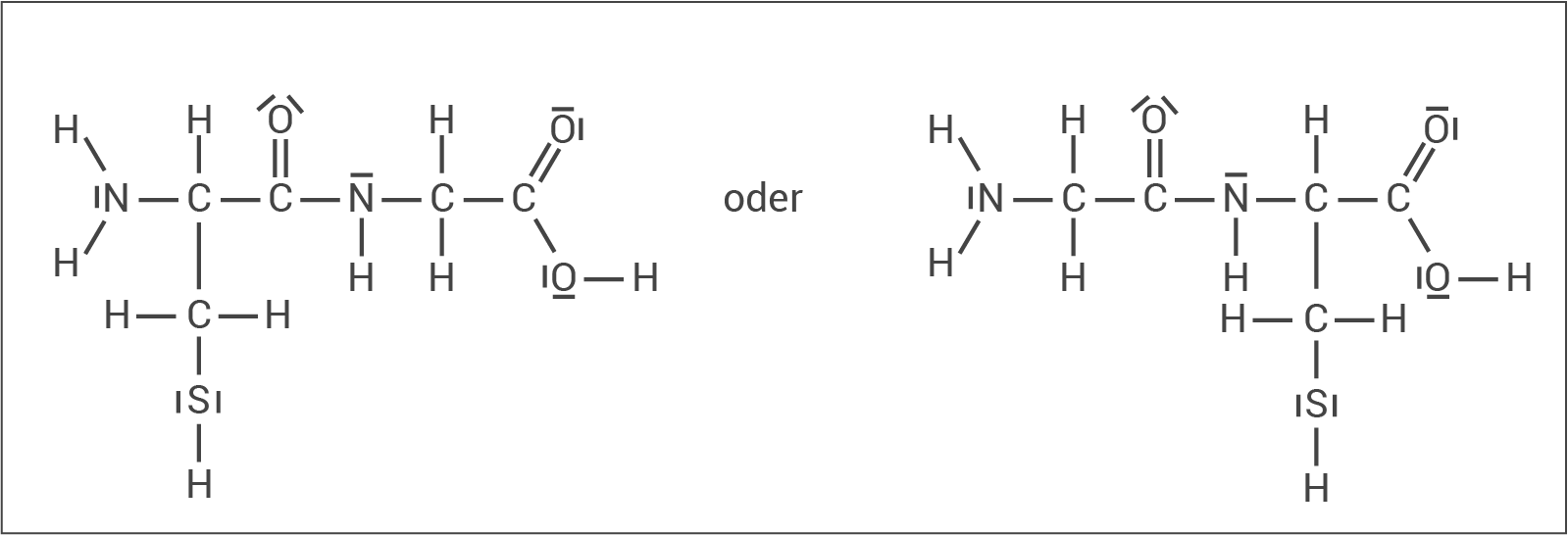
Zeichne die Strukturformel eines möglichen Dipeptids, das aus den Aminosäuren Cystein (Rest: -CH -SH) und Glycin (Rest: -H) besteht.
-SH) und Glycin (Rest: -H) besteht.
2 VP
1.2
Erläutere die Hitzedenaturierung von Proteinen und gib unter Berücksichtigung von Abbildung 2 eine Erklärung für die Hitzebeständigkeit von  -Amanitin.
-Amanitin.
2 VP
2.1
Beschreibe den Ablauf der Transkription.
3 VP
2.2
Erläutere zwei mögliche Mechanismen, wie  -Amanitin die Transkription verhindern könnte.
-Amanitin die Transkription verhindern könnte.
2 VP
2.3
Erkläre, warum die tödliche Wirkung von  -Amanitin erst nach mehreren Tagen eintritt.
-Amanitin erst nach mehreren Tagen eintritt.
Wissenschaftler des Deutschen Krebsforschungszentrums versuchen die Giftwirkung des
2 VP

Abb. 3: Bekämpfung einer Krebszelle mit  -Amanitin-gekoppelten Antikörpern (stark vereinfacht)
-Amanitin-gekoppelten Antikörpern (stark vereinfacht)
3
Erläutere unter Berücksichtigung von Abbildung 3 und der Informationen aus den Vortexten das spezifische Absterben von Krebszellen bei dieser Therapie.
Die ersten in dieser Krebstherapie bei Mäusen eingesetzten Antikörper stammten von Ratten. Diese therapeutischen Ratten-Antikörper führten nur kurzzeitig zu einem Therapieerfolg, da sie eine Immunantwort bei den Mäusen auslösten.
3 VP
4.1
Beschreibe die humorale Immunantwort im Körper der Maus nach einer Injektion therapeutischer Ratten-Antikörper und erläutere, warum die Wirksamkeit der Therapie nach mehreren Behandlungen mit therapeutischen Ratten-Antikörpern stark nachlässt.
Neben einem möglichen Wirkungsverlust treten bei der Krebstherapie mit
4 VP
4.2
Erläutere unter Berücksichtigung von Abbildung 3 eine mögliche Nebenwirkung beim Einsatz von  -Amanitin-gekoppelten Antikörpern in der Krebstherapie.
-Amanitin-gekoppelten Antikörpern in der Krebstherapie.
Bildnachweise [nach oben]
2 VP
20 VP
Amanita_phalloides_1.JPG: Archenzo derivative work: Ak ccm (talk), 2009-05 Amanita phalloides crop, CC BY-SA 3.0
1.1
Strukturformel des Dipeptids Cys-Gly oder Gly-Cys:

1.2
Erläuterung der Hitzedenaturierung:
Hohe Temperaturen (> 40 °C) bewirken zunehmende Molekularbewegungen, wodurch es zur Aufhebung von v.a. schwache Anziehungskräften wie Wasserstoffbrücken und hydrophobe Wechselwirkungen zwischen den Aminosäure(reste)n eines Proteins kommt. Das hat eine Veränderung der Sekundär- und Tertiärstruktur (Konformation) von Proteinen zur Folge und bedingt häufig den Funktionsverlust. Erklärung der Hitzestabilität von -Amanitin:
-Amanitin:
Bei dem kleinen Molekül kommt es durch Peptidbindungen (Atombindungen) zwischen allen Aminosäuren zu einem Ringschluss. Die beim Kochen erreichte Temperatur, die maximal 100 °C beträgt, reicht nicht aus, um Atombindungen zu lösen und deshalb verändert sich die formgebende Ringstruktur nicht. Außerdem wird die Ringstruktur zusätzlich durch eine Atombindung zwischen den Resten der Aminosäuren Tryptophan und Cystein stabilisiert.
Hohe Temperaturen (> 40 °C) bewirken zunehmende Molekularbewegungen, wodurch es zur Aufhebung von v.a. schwache Anziehungskräften wie Wasserstoffbrücken und hydrophobe Wechselwirkungen zwischen den Aminosäure(reste)n eines Proteins kommt. Das hat eine Veränderung der Sekundär- und Tertiärstruktur (Konformation) von Proteinen zur Folge und bedingt häufig den Funktionsverlust. Erklärung der Hitzestabilität von
Bei dem kleinen Molekül kommt es durch Peptidbindungen (Atombindungen) zwischen allen Aminosäuren zu einem Ringschluss. Die beim Kochen erreichte Temperatur, die maximal 100 °C beträgt, reicht nicht aus, um Atombindungen zu lösen und deshalb verändert sich die formgebende Ringstruktur nicht. Außerdem wird die Ringstruktur zusätzlich durch eine Atombindung zwischen den Resten der Aminosäuren Tryptophan und Cystein stabilisiert.
2.1
Beschreibung der Transkription:
- Initiation: Die Startsequenz auf der DNA (Promotor) wird durch die RNA-Polymerase erkannt. Sie bindet sich daran und entspiralisiert einen kurzen Abschnitt des DNA-Doppelstrangs. Durch die Trennung entstehen zwei komplementäre Einzelstränge.
- Elongation: Freie RNA-Nukleotide lagern sich komplementär an den codogenen Strang an. Die RNA-Polymerase verknüpft die RNA-Nukleotide in 5'
3'- Richtung zur mRNA.
- Termination: Die RNA-Polymerase löst sich von der DNA, wenn die Stopp-Sequenz (Terminator) am Ende des Gens erreicht wird. Daraufhin wird die mRNA freigegeben.
2.2
Erläuterung möglicher Mechanismen zur Verhinderung der Transkription (zwei erforderlich):
Bei der Initiation:
-Amanitin bindet an die Promotorregion, wodurch sich die RNA-Polymerase nicht mehr anlagern kann.
-Amanitin bindet sich an die RNA-Polymerase, wodurch sich die Tertiärstruktur verändert. Das Enzym kann daraufhin nicht mehr an den Promotor binden.
-Amanitin blockiert die Region der RNA-Polymerase, die an die DNA bindet und verhindert so die Bindung an den Promotor (Initiationskomplex).
-Amanitin hemmt das Enzym, welches die Ribonukleotide als Substrate für die RNA-Polymerase bereitstellt. Dadurch kann keine mRNA-Synthese erfolgen.
-Amanitin blockiert das katalytische Zentrum der RNA-Polymerase. Dadurch können die RNA-Nukleotide nicht verknüpft werden.
-Amanitin bindet an die Terminationssequenz der DNA. Die Ablösung der RNA-Polymerase wird damit verhindert und das RNA-Transkript kann nicht freigesetzt werden.
2.3
Erklärung der nach mehreren Tagen eintretenden tödlichen Wirkung:
Funktionelle Proteine, die noch in der Zelle vorhanden sind, und bereits synthetisierte RNA-Transkripte, die weiterhin translatiert werden können, halten wichtige Stoffwechselfunktionen über mehrere Tage hinweg aufrecht, auch wenn die Transkription blockiert wird. Erst wenn diese verbraucht bzw. enzymatisch abgebaut wurden und auch keine neue mRNA nachgebildet wird, versagen die Organe, welches tödlich ist. Organe mit hohen Stoffwechselraten (z.B. die Leber) sind dabei zuerst betroffen.
Funktionelle Proteine, die noch in der Zelle vorhanden sind, und bereits synthetisierte RNA-Transkripte, die weiterhin translatiert werden können, halten wichtige Stoffwechselfunktionen über mehrere Tage hinweg aufrecht, auch wenn die Transkription blockiert wird. Erst wenn diese verbraucht bzw. enzymatisch abgebaut wurden und auch keine neue mRNA nachgebildet wird, versagen die Organe, welches tödlich ist. Organe mit hohen Stoffwechselraten (z.B. die Leber) sind dabei zuerst betroffen.
3
Erläuterung des spezifischen Absterbens von Krebszellen:
Die Therapie basiert darauf, dass Krebszellen auf ihrer Oberfläche Tumorantigene besitzen, an die -Amanitin-gekoppelte Antikörper spezifisch binden können. Bei Körperzellen ist das nicht der Fall.
-Amanitin-gekoppelte Antikörper spezifisch binden können. Bei Körperzellen ist das nicht der Fall.
Die Therapie basiert darauf, dass Krebszellen auf ihrer Oberfläche Tumorantigene besitzen, an die
- Die Antigen-Bindestellen der
-Amanitin-gekoppelte Antikörper binden spezifisch (Schlüssel-Schloss-Prinzip) an das Epitop eines Tumorantigens, welches in die Membran einer Krebszelle integriert ist.
- Die
-Amanitin-gekoppelte Antikörper werden durch rezeptorvermittelte Endocytose in die Zelle in Vesikel aufgenommen.
- Durch das Verschmelzen der Lysosomen mit den Vesikeln zerstören die darin enthaltenen lysosomalen Enzyme das Tumorantigen,
-Amanitin-gekoppelte Antikörper und die Vesikelmembran (bzw. bewirken deren Durchlässigkeit).
4.1
Beschreibung der humoralen Immunantwort:
Durch die humorale Immunantwort bildet sich nach mehreren Behandlungen eine große Anzahl an B- und T-Helfer-Gedächtniszellen. Diese führen zu einer zunehmend schnelleren und stärkeren (sekundären) Immunantwort gegen die injizierten -Amanitin-gekoppelten Ratten-Antikörper. Dadurch kommt es bevor die Zielzelle erreicht wird zur Bindung von den zahlreichen und schnell gebildeten Antikörpern.
-Amanitin-gekoppelten Ratten-Antikörper. Dadurch kommt es bevor die Zielzelle erreicht wird zur Bindung von den zahlreichen und schnell gebildeten Antikörpern.
- Erkennungsphase: Die Makrophagen erkennen die
-Amanitin-gekoppelten Ratten-Antikörper (
AK) als Antigene und phagozytieren und zerlegen sie. Daraufhin werden diese Fragmente mithilfe spezieller Membranproteine (MHC II) auf der Membranoberfläche der Makrophagen präsentiert und ruhende spezifische T-Helferzellen binden mit ihrem spezifischen T-Zell-Rezeptor an das präsentierte
AK-Fragment. Durch einen Signalstoff (Zytokin) des Makrophagen wird die T-Helferzelle aktiviert und zur Teilung (Proliferation) und Differenzierung in aktive T-Helferzellen und T-Helfer-Gedächtniszellen angeregt. Gleichzeitig wird die
AK durch spezielle B-Lymphozyten mit passenden Rezeptoren erkannt und phagozytiert und teilweise abgebaut. Die
AK-Fragmente werden (über MHC-II-Proteine) auf der Membranoberfläche präsentiert. Nun binden die zuvor aktivierten T-Helferzellen über ihren spezifischen T-Zell-Rezeptor an die präsentierten
AK-Fragmente, woraufhin Signalstoffe (Zytokine) ausgeschüttet werden.
- Differenzierungsphase: Durch die ausgeschütteten Signalstoffe werden B-Lymphozyte zur Vermehrung (Proliferation) und Differenzierung in Plasmazellen und B-Gedächtniszellen angeregt.
- Wirkungsphase: Die Plasmazellen produzieren Antikörper, die spezifisch gegen
AK wirken. Daraus folgt, dass die freigesetzten Antikörper zusammen mit
AK zu
AK-Antikörper-Komplexen verklumpen und von Makrophagen phagozytiert werden.
Durch die humorale Immunantwort bildet sich nach mehreren Behandlungen eine große Anzahl an B- und T-Helfer-Gedächtniszellen. Diese führen zu einer zunehmend schnelleren und stärkeren (sekundären) Immunantwort gegen die injizierten
4.2
Erläuterung einer möglichen Nebenwirkung:
Wenn -Amanitin in den extrazellulären Raum freigesetzt wird, was durch Absterben und Lyse der Krebszellen (oder durch Exocytose oder erleichterte Diffusion aus vergifteten Krebszellen) geschieht, nehmen normale Körperzellen den Giftstoff auf und werden beschädigt. Dadurch wird die Proteinbiosynthese gehemmt (z.B. wichtiger Verdauungsenzyme) und Gewebe sterben ab.
Weitere mögliche Nebenwirkungen, die sich nicht aus Abb. 3 entnehmen lassen:
-Amanitin in den extrazellulären Raum freigesetzt wird, was durch Absterben und Lyse der Krebszellen (oder durch Exocytose oder erleichterte Diffusion aus vergifteten Krebszellen) geschieht, nehmen normale Körperzellen den Giftstoff auf und werden beschädigt. Dadurch wird die Proteinbiosynthese gehemmt (z.B. wichtiger Verdauungsenzyme) und Gewebe sterben ab.
Weitere mögliche Nebenwirkungen, die sich nicht aus Abb. 3 entnehmen lassen:
Wenn
- Es könnte zur Schädigung von Makrophagen und B-Lymphhozyten kommen, wenn diese durch Phagozytose
-Amanitin-gekoppelten Ratten-Antikörper aufnehmen und
-Amanitin freisetzen. Daraus würde die Schwächung des Immunsystems folgen.
- Durch das injizierte Fremdprotein könnte eine Allergie ausgebildet werden, bei der aufgrund von Histamin-Freisetzung aus Mastzellen (nach einer Mehrfachbehandlung mit den
-Amanitin-gekoppelten Ratten-Antikörpern) die typischen Symptome einer allergischen Reaktion auftreten.