Aufgabe 1 – Neurobiologie, Biochemie
Der Vielgebänderte Krait (Bungarus multicinctus) aus Südostasien ist eine der giftigsten Schlangenarten der Welt. Sein Gift ist ein Gemisch aus verschiedenen neurotoxischen Polypeptiden. Darin enthalten sind unter anderem die Polypeptide alpha-Bungarotoxin und beta-Bungarotoxin (siehe Abb. 1). Der Biss eines Kraits führt innerhalb kürzester Zeit zum Tod. Traditionelle Maßnahmen zur Lebensrettung sind das Ausbrennen und das Abbinden der Bissstelle.
1.1
Nenne die dargestellten Strukturebenen des beta-Bungarotoxins und die jeweiligen Wechselwirkungen bzw. Bindungen, die diese Strukturebenen stabilisieren.
3 VP
1.2
Erkläre die Wirksamkeit der traditionellen lebensrettenden Maßnahmen bei einem Schlangenbiss.
2 VP
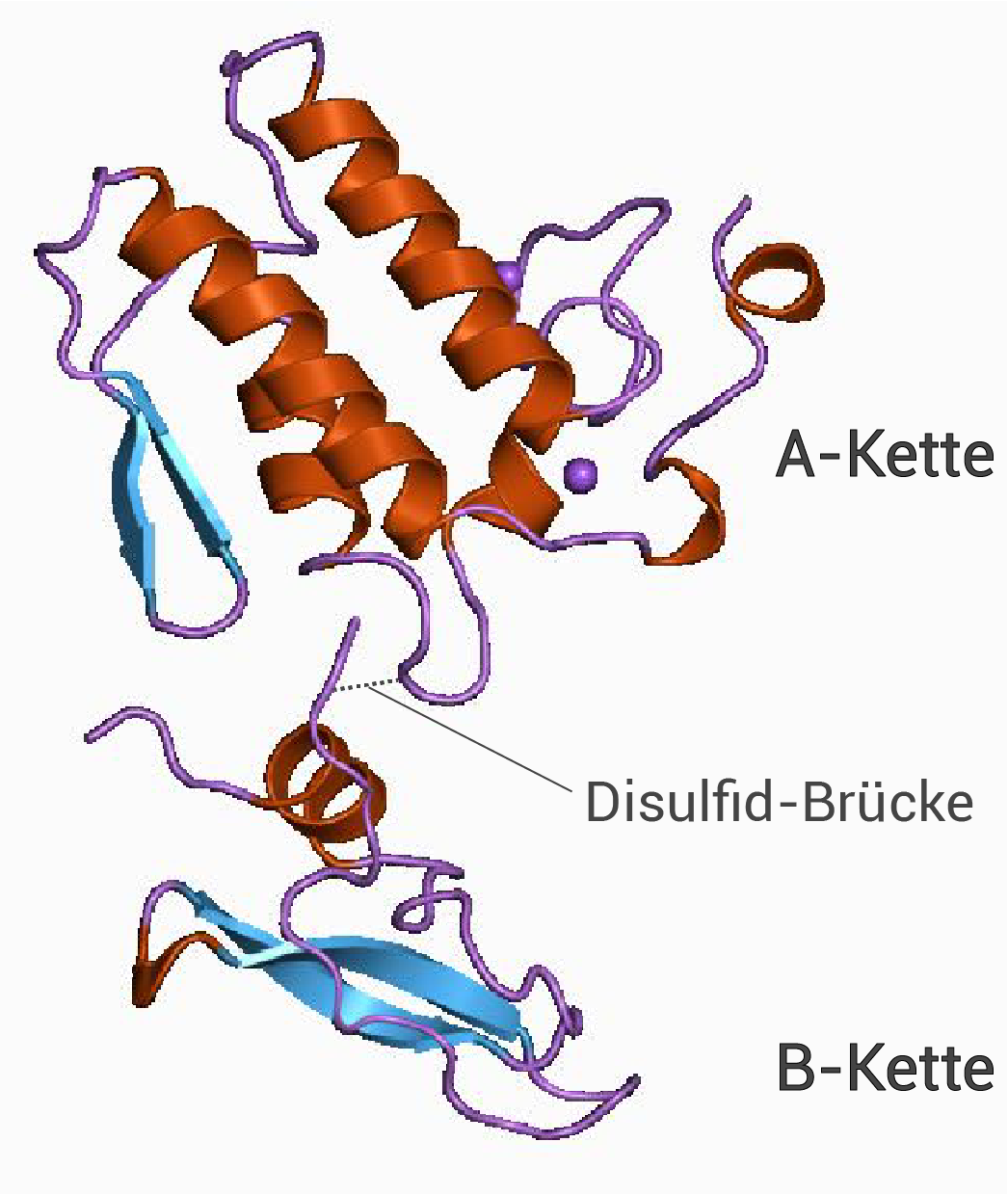
Abb. 1: Struktur des beta-Bungarotoxins
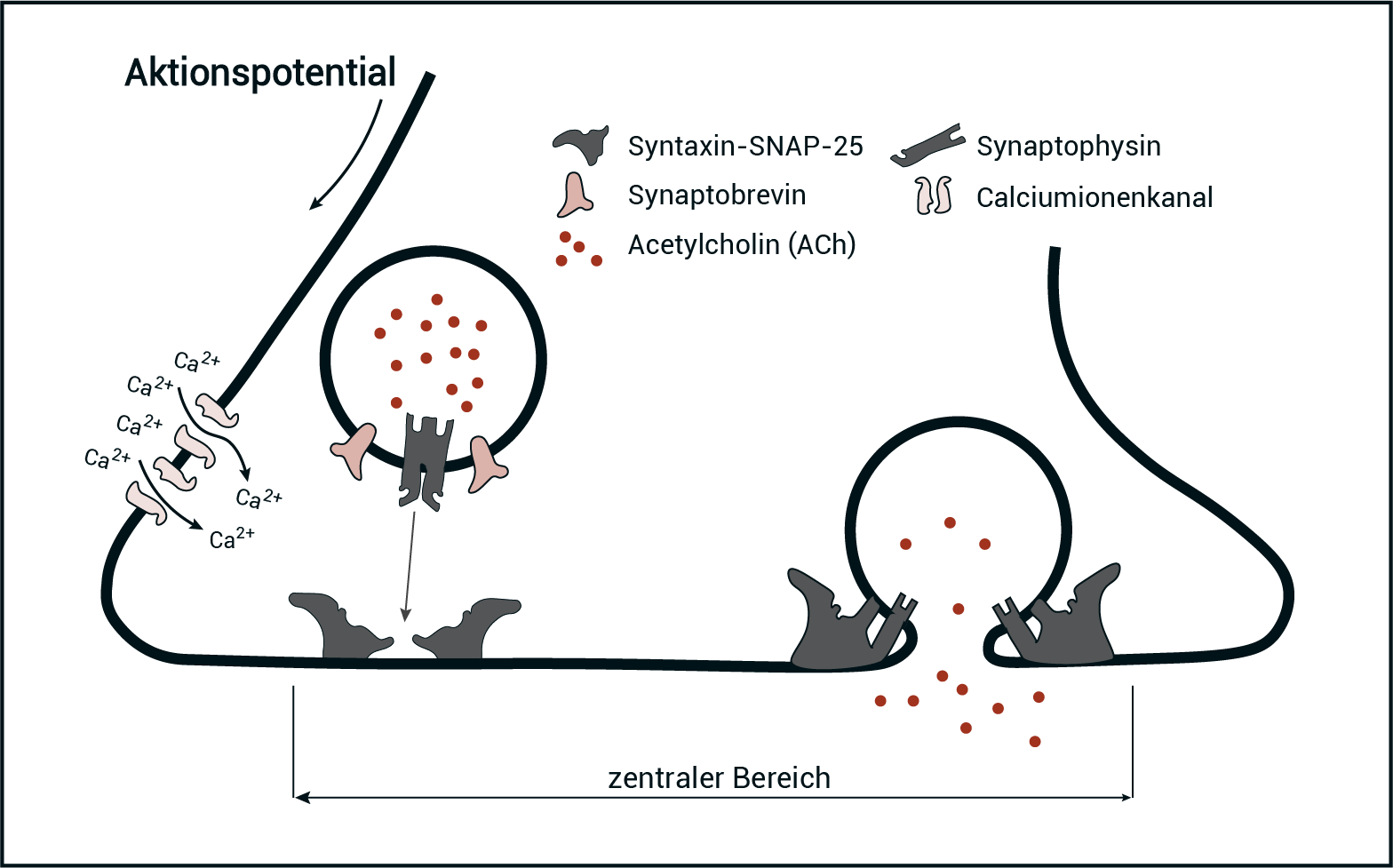
Abb. 2: Schematische Darstellung der Vorgänge an einer präsynaptischen Endigung ohne Bungarotoxin
2.1
Beschreibe die Vorgänge bei der Erregungsübertragung an einer Synapse. Beziehe dabei auch die in der Abbildung 2 dargestellten Vorgänge mit ein.
4 VP
2.2
Erkläre, wie sichergestellt ist, dass im zentralen Bereich des synaptischen Spalts eine hohe Transmitterkonzentration vorhanden ist.
An einer Synapse wurde mit alpha-Bungarotoxin aus dem Gift des Vielgebänderten Kraits experimentiert (siehe Abb. 3).
2 VP
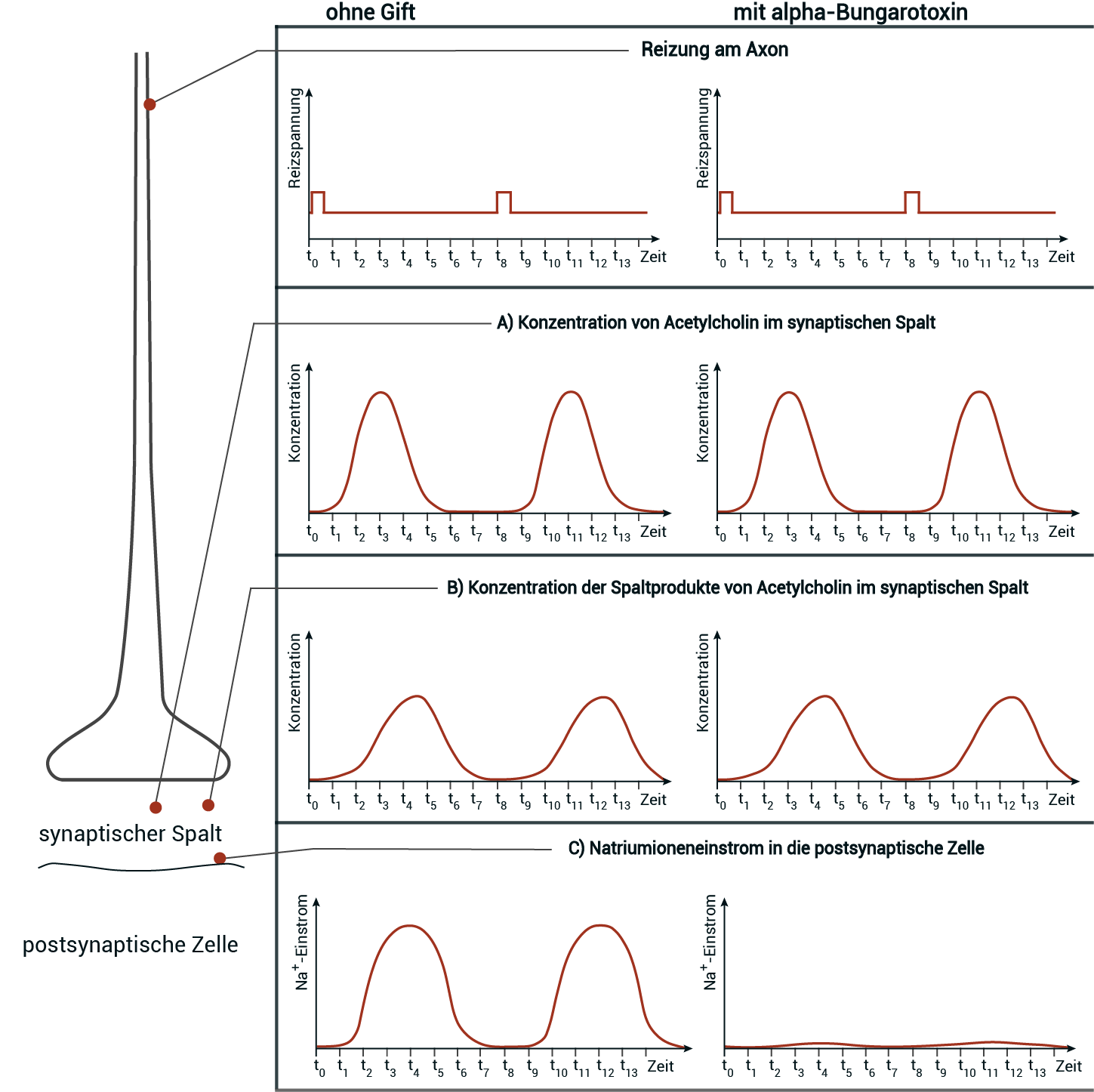
Abb. 3: Messungen (A, B und C) an einer Synapse mit und ohne alpha-Bungarotoxin bei zwei aufeinanderfolgenden Reizen
3
Formuliere die Fragestellung, die dieser Messreihe zugrunde liegt. Werte dazu jede der Messungen im Hinblick auf die Fragestellung aus.
Beta-Bungarotoxin wirkt an der präsynaptischen Membran. Die genaue molekulare Wirkungsweise ist noch ungeklärt. Durch elektronenmikroskopische Untersuchungen konnte gezeigt werden, dass am Endknöpfchen unter Einwirkung von beta-Bungarotoxin die in Abbildung 4 gezeigten Veränderungen auftreten.
3 VP
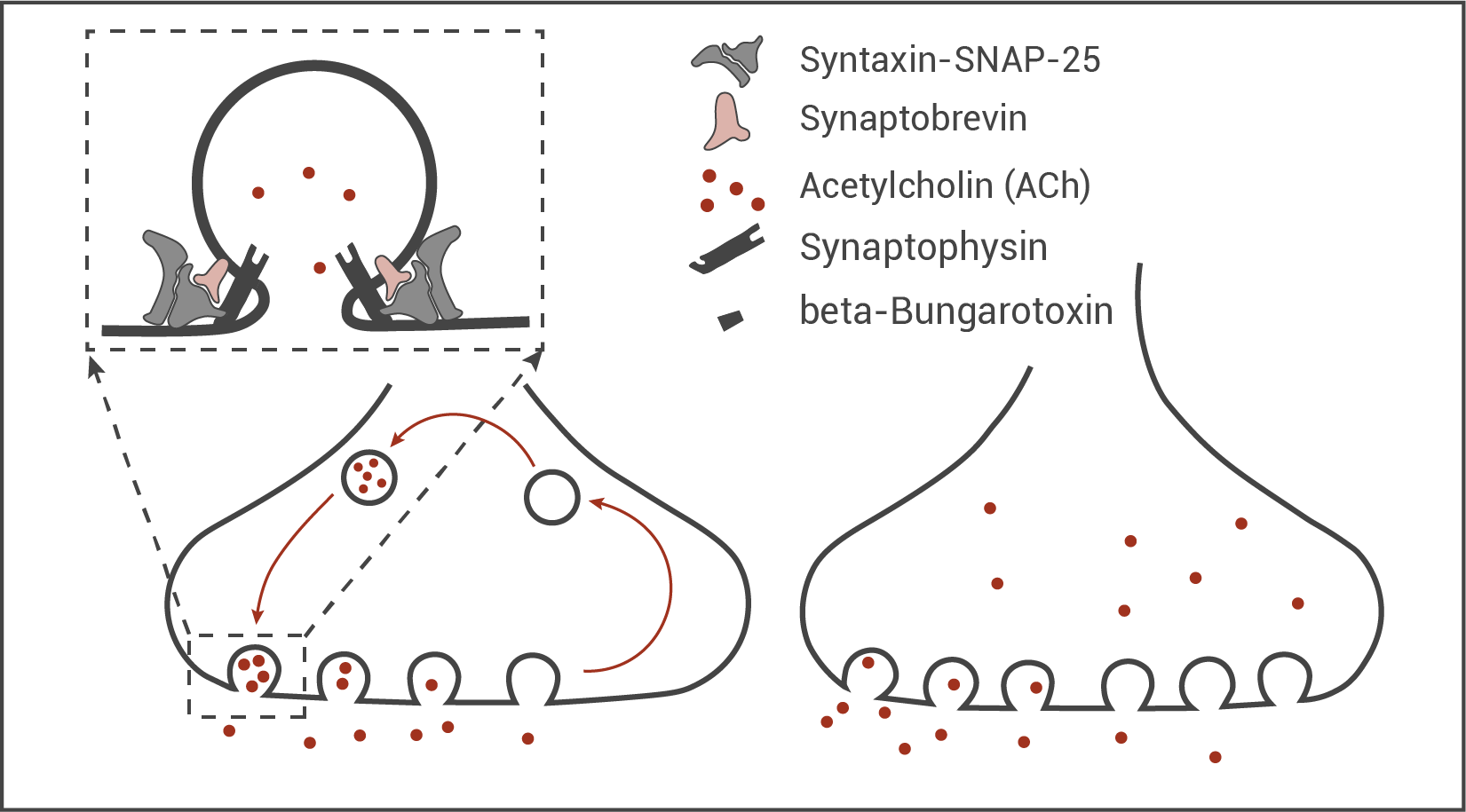
Abb. 4: Schematische Darstellung der Veränderungen an einem Endknöpfchen ohne (links) und mit (rechts) Einwirkung von beta-Bungarotoxin auf Grundlage elektronenmikroskopischer Untersuchungen
4.1
Formuliere unter Berücksichtigung von Abbildung 4 eine Vermutung zur Wirkungsweise des beta-Bungarotoxins und begründe deine Vermutung.
3 VP
4.2
Erläutere, wie sich die Messergebnisse aus Abbildung 3 (Spalte „ohne Gift", A - C) bei gleichzeitiger Einwirkung von alpha- und beta-Bungarotoxin verändern.
Bildnachweise [nach oben]
3 VP
20 VP
Jawahar Swaminathan and MSD staff at the European Bioinformatics Institute, PDB 1bun EBI, bearbeitet, CC0 1.0
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Dargestellte Strukturebenen und die sie stabilisierenden Wechselwirkungen bzw. Bindungen:
Die Primärstruktur wird hier nicht verlangt, da sie lediglich die Abfolge der Aminosäuren einer Polypeptidkette beschreibt und nicht deren räumlichen Aufbau.
- Sekundärstruktur: Wasserstoffbrückenbindung zwischen der C=O- und der N-H-Gruppe der Peptidbindungen des Peptidrückgrats (AS-Reste nicht beteiligt)
- Tertiärstruktur: Disulfidbrücken, Ionenbindung, Wasserstoffbrücken, hydrophobe Wechselwirkungen und Van-der-Waals-Kräfte (zwischen AS-Resten)
- Quartärstruktur: Disulfidbrücke zwischen A- und B-Kette
1.2
Erklärung der Wirksamkeit:
- Ausbrennen: Hohe Temperaturen (über 40°C) um die Bisstelle herum führen zu einer Veränderung der Sekundär- und Tertiärstruktur (Hitzedenaturierung). Grund dafür ist, dass durch zunehmende Molekularbewegungen v.a. schwache Anziehungskräfte wie Wasserstoffbrücken und hydrophobe Wechselwirkungen zwischen den AS-Resten der neurotoxischen Polypeptide "aufbrechen". Durch die Veränderung der Konformation geht die neurotoxische Wirkung der im Schlangengift enhaltenen Polypeptide verloren.
- Abbinden: Hierbei wird die Durchblutung der Bissstelle unterbrochen, wodurch akut eine weitere Ausbreitung der neurotoxischen Polypeptide über den Blutkreislauf im ganzen Körper verhindert wird.
2.1
Beschreibung der Vorgänge:
- Am Endknöpfchen trifft ein Aktionspotenzial (AP) ein und depolarisiert das Membranpotenzial (in diesem Bereich).
- Die spannungsabhängigen Ca
-Ionenkanäle werden geöffnet, wodurch es zu einem Ca
-Ioneneinstrom entlang ihres Konzentrationsgefälles in die präsynaptische Endigung kommt.
- Daraufhin bewegen sich die mit Acetylcholin (ACh) gefüllten Vesikel zur präsynaptischen Membran.
- Nach dem Schlüssel-Schloss-Prinzip verbinden sich die in die Vesikelmembran eingelagerten Synaptobrevin- und Synaptophysin-Proteine mit den Syntaxin-SNAP-25-Proteinen, die in die präsynaptische Membran integriert sind.
- Räumliche Umlagerungen der entstandenen Membran-Protein-Komplexe bewirken eine Verschmelzung der Vesikelmembran mit der präsynaptischen Mebran und eine Ausschüttung des Transmitters ACh in den synaptischen Spalt (Exozytose).
- Die Transmittermoleküle diffundieren zur postsynaptischen Membran, wo die ACh-Moleküle an Rezeptoren binden, die mit ligandenabhängigen Na
-Ionenkanälen gekoppelt sind.
- Diese werden dadurch geöffnet und die Na
-Ionen strömen entlang ihres Konzentrationsgefälles ein. Die postsynaptische Membran (erregendes postsynaptisches Potenzial) wird depolarisiert.
- Durch das Enzym Acetylcholinesterase in Cholin und Acetat wird der Transmitter ACh gespalten.
- Über ein Transportprotein in der präsynaptischen Membran wird Cholin ins Endknöpfchen aufgenommen und mit Actyl-CoA zu Acetylcholin resynthetisiert und in synaptischen Vesikeln gespeichert.
2.2
Erklärung der Sicherstellung:
Die Syntaxin-SNAP-25-Moleküle, an die die synaptischen Vesikel zur Exozytose über Synaptobrevin und Synaptophysin andocken, befinden sich nur im zentralen Bereich an der präsynatpischen Membran. Dadurch findet nur in diesem Bereich eine Transmitterausschüttung statt und damit kommt es zu einer hohen Transmitterkonzentration im zentralen Bereich des synaptischen Spalts.
Die Syntaxin-SNAP-25-Moleküle, an die die synaptischen Vesikel zur Exozytose über Synaptobrevin und Synaptophysin andocken, befinden sich nur im zentralen Bereich an der präsynatpischen Membran. Dadurch findet nur in diesem Bereich eine Transmitterausschüttung statt und damit kommt es zu einer hohen Transmitterkonzentration im zentralen Bereich des synaptischen Spalts.
3
Formulierung der Fragestellung:
Für die Formulierung ist es sinnvoll den experimentellen Aufbau und Ablauf zu analysieren. Es wurden zwei Messreihen durchgeführt, einmal ohne Gift und einmal unter alpha-Bungarotoxin Einfluss. Nach zwei kurzen, aufeinanderfolgenden Reizen am Axon wurden jeweils die Konzentration von ACh, die Konzentration der Spaltprodukte von ACh im synaptischen Spalt sowie der Natriumioneneinstrom in die postsynaptische Zelle bei t und t
und t gemessen. Durch die eingesetzte Reizspannung kam es im Neuron zu einer überschwelligen Depolarisation, woraufhin ein Aktionspotenzial enstanden ist. Diese Erregung hielt bis zum synaptischen Endknöpchen an. Im synaptischen Spalt und an der postsynaptischen Zelle fanden die eigentlichen Messungen statt.
gemessen. Durch die eingesetzte Reizspannung kam es im Neuron zu einer überschwelligen Depolarisation, woraufhin ein Aktionspotenzial enstanden ist. Diese Erregung hielt bis zum synaptischen Endknöpchen an. Im synaptischen Spalt und an der postsynaptischen Zelle fanden die eigentlichen Messungen statt.
 Welcher Teilprozess der synaptischen Erregungsübertragung bzw. welche Struktur an der Synapse wird durch alpha-Bungarotoxin beeinflusst?
Auswertung der Messungen:
Welcher Teilprozess der synaptischen Erregungsübertragung bzw. welche Struktur an der Synapse wird durch alpha-Bungarotoxin beeinflusst?
Auswertung der Messungen:
- Messung A: Bei der Messung ohne Gift kommt es mit ca. einer halben Einheit Zeitverzug nach Reizung am Axon zu einem steilen Anstieg der Konzentration von ACh im synaptischen Spalt. Bei t
bzw. t
ist ein Höhepunkt zu erkennen. Danach sinkt die Konzentration wieder auf den Ausgangswert ab. Der Kurvenverlauf stimmt mit der Messkurve unter Einwirkung von alpha-Bungarotoxin überein und es lässt sich schließen, dass durch alpha-Bungarotoxin die Exozytose der mit ACh gefüllten synaptischen Vesikel in den synaptischen Spalt nicht beeinflusst wird.
- Messung B: Bei der Messung ohne Gift kommt es kurz nach der Reizung zu einem zunächst langsamen und nach ca. zwei Zeiteinheiten steilen Anstieg der Konzentration der Spaltprodukte von ACh im synaptischen Spalt bis auf ein Maximum zwischen t
und t
bzw. t
und t
. Dies ist mit der katalytischen Aktivität des in der postsynaptischen Membran eingelagerten Enzyms Acetylcholinesterase zu begründen. Danach ist eine rasche Senkung auf den Ausgangswert zu erkennen. Der Kurvenverlauf ist identisch zur Messkurve unter Einwirkung von alpha-Bungarotoxin und es lässt sich schlussfolgern, dass alpha-Bungarotoxin die Enzymaktivität der Acetylcholinesterase nicht beeinflusst.
- Messung C: Mit ca. einer Zeiteinheit nach Reizung des Axons ist bei der Messung ohne Gift ein steiler Anstieg des Na
-Ioneneinstroms in die postsynaptische Zelle zu erkennen. Nach einem Höhepunkt bei t
bzw. t
sinkt der Einstrom wieder auf den Ausgangswert. Die Messkurve unter Einwirkung von alpha-Bungarotoxin ist zwischen t
und t
bzw. zwischen t
und t
hingegen nur sehr flach und geht nicht über die Grundlinie hinaus. Daraus folgt eine Unterbindung des Na
-Ioneneinstroms in die postsynaptische Zelle durch alpha-Bungarotoxin, durch z.B. Blockade der ACh-Bindestellen und Verhinderung der Öffnung der Natriumionenkanäle.
4.1
Formulierung einer Hypothese:
Beta-Bungarotoxin ist für die Verhinderung der Wiederablösung der synaptischen Vesikel von der präsynaptischen Membran verantwortlich. Es wäre denkbar, dass Toxin aufgrund seiner Form nach der Verschmelzung der Vesikelmembran mit der präsynaptischen Membran beta-Bungarotoxin an Synaptophysin im Vesikel bindet. Dadurch könnte sich der Membran-Protein-Komplex aus Synaptobrevin, Synaptophysin und Syntaxin-SNAP-25, durch z.B. eine Konformationsänderung, nicht mehr lösen und die Vesikel würden im Zustand der Exozytose mit der präsynaptischen Membran verschmolzen bleiben. Begründung:
An der präsynaptischen Membran findet eine Anhäufung synaptischer Vesikel in entleertem bzw. exozytierendem Zustand statt, die synaptischen Vesikel im Zytoplasma der präsynaptischen Endigung fehlen und es liegen frei Acetylcholinmoleküle vor. Das alles deutet daraufhin, dass nach erfolgter Exozytose (und damit deren "Recycling" und ihr Befüllen mit ACh) beta-Bungarotoxin die Ablösung der Vesikel von der präsynaptischen Membran verhindert.
Beta-Bungarotoxin ist für die Verhinderung der Wiederablösung der synaptischen Vesikel von der präsynaptischen Membran verantwortlich. Es wäre denkbar, dass Toxin aufgrund seiner Form nach der Verschmelzung der Vesikelmembran mit der präsynaptischen Membran beta-Bungarotoxin an Synaptophysin im Vesikel bindet. Dadurch könnte sich der Membran-Protein-Komplex aus Synaptobrevin, Synaptophysin und Syntaxin-SNAP-25, durch z.B. eine Konformationsänderung, nicht mehr lösen und die Vesikel würden im Zustand der Exozytose mit der präsynaptischen Membran verschmolzen bleiben. Begründung:
An der präsynaptischen Membran findet eine Anhäufung synaptischer Vesikel in entleertem bzw. exozytierendem Zustand statt, die synaptischen Vesikel im Zytoplasma der präsynaptischen Endigung fehlen und es liegen frei Acetylcholinmoleküle vor. Das alles deutet daraufhin, dass nach erfolgter Exozytose (und damit deren "Recycling" und ihr Befüllen mit ACh) beta-Bungarotoxin die Ablösung der Vesikel von der präsynaptischen Membran verhindert.
4.2
Erläuterung der Veränderung der Messergebnisse:
Wichtig zu berücksichtigen: Aufgrund der Wirkung von beta-Bungarotoxin stehen bei aufeinanderfolgenden Reizungen des Axons zunehmend weniger mit ACh gefüllte synaptische Vesikel für die synaptische Erregungsübertragung im Endknöpfchen zur Verfügung.
- Messung A: Der Kurvenverlauf ist nach der ersten Reizung gleich wie in Messung A "ohne Gift" (Abb.3). Das liegt am alpha-Bungarotoxin, welches keinen Einfluss auf die Exozytose der mit ACh gefüllten synaptischen Vesikel in den synaptischen Spalt hat. Außerdem entfaltet beta-Bungarotoxin seine neurotoxische Wirkung erst nach erfolgter Exozytose. Abhängig davon, wie viele Vesikel ursprünglich im Endknöpfchen vorhanden waren, kommt es im synaptischen Spalt infolge der zweiten Reizung zu einer sehr viel geringeren bis kaum noch messbaren ACh-Konzentration, weil die Vesikel nach der Exozytose durch die Wirkung von beta-Bungarotoxin nun an der präsynaptischen Membran gebunden bleiben. Daraufhin können sie nicht erneut mit ACh befüllt werden und stehen somit bei einer nachfolgenden Reizung nicht für eine erneute Exozytose zur Verfügung.
- Messung B: Die katalytische Aktivität der Acetylcholinesterase wird weder von alpha- noch beta-Bungarotoxin beeinflusst, weswegen die Konzentration der Spaltprodukte von der ausgeschütteten ACh-Konzentration im synaptischen Spalt abhängt. Somit ist der Kurvenverlauf nach der ersten Reizung gleich wie in Messung B "ohne Gift" (Abb.3). Abhängig von der ACh-Ausschüttung und der Entfernung der Spaltprodukte aus dem synaptischen Spalt ist nach der zweiten Reizung die Konzentration der Spaltprodukte von ACh im synaptischen Spalt stark reduziert bis nicht mehr messbar.
- Messung C: Nach der ersten Reizung kommt es zu einem ähnlichen Kurvenverlauf wie in Messung C "mit alpha-Bungarotoxin" (Abb. 3), da durch alpha-Bungarotoxin der Na
-Ioneneinstrom in die postsynaptische Zelle fast vollständig verhindert wird. Nach der zweiten Reizung ist der Na
-Ioneneinstrom geringer bzw. kaum vorhanden. Grund dafür ist die Einwirkung von alpha-Bungarotoxin und die Verhinderung der Bildung zusätzlicher neuer synaptischer Vesikel durch beta-Bungarotoxin, wodurch die Ausschüttung von Transmitter nach erneuter Reizung in den synaptischen Spalt verhindert wird. Infolgedessen können die transmittergesteuerten Na
-Ionenkanäle in der postsynaptischen Membran vermutlich gar nicht mehr aktiviert werden.