Aufgabe 4 – Mikrobiologie, Evolution
Laut eines Berichts der Europäischen Seuchenbehörde starben im Jahr 2015 ca. 30 000 Menschen in der EU an multiresistenten Bakterien, also an Bakterien, die gegen eine Vielzahl von Antibiotika resistent sind. Multiresistente Bakterien verursachten damit mehr Todesfälle als die Erreger von Grippe, Aids und Tuberkulose zusammen. Es wird erwartet, dass die Zahl tödlich verlaufender Infektionen mit multiresistenten Bakterien weiter steigen wird. Daher bedarf es intensiver Forschung, um der Entstehung multiresistenter Bakterien entgegenzuwirken bzw. diese effektiv zu bekämpfen. Abbildung 1 zeigt eine Schemazeichnung einer Bakterienzelle im Vergleich zu einer eukaryotischen Zelle.
_light.png)
_light.png)
Abb. 1: Aufbau einer Bakterienzelle (links) und einer Eukaryotenzelle (rechts)
1.1
Benenne die in Abbildung 1 mit Ziffern bezeichneten Strukturen.
2 VP
1.2
Erläutere anhand der Struktur Nummer 6 den Zusammenhang von Struktur und Funktion (zwei Angaben).
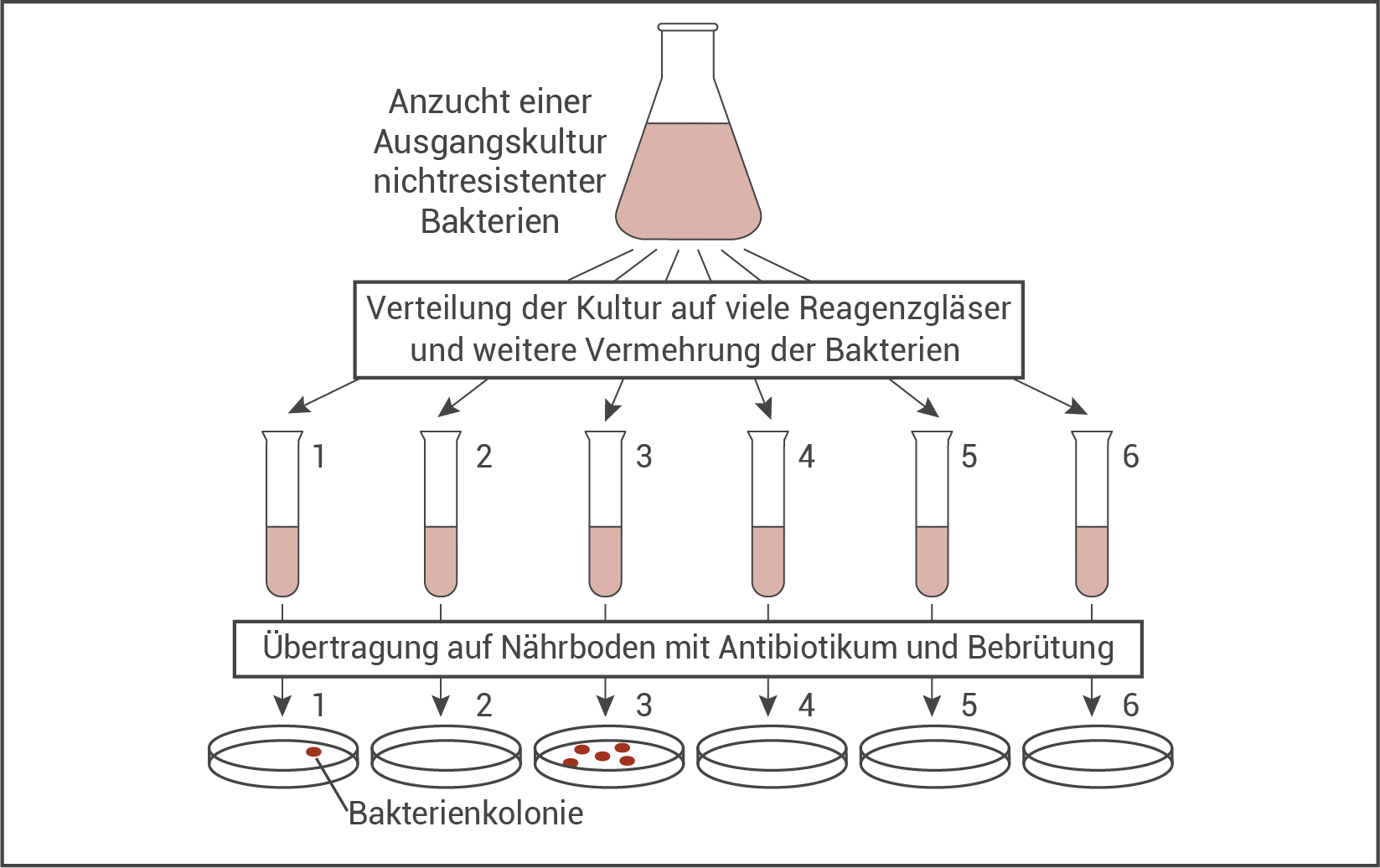
Bereits in der Mitte des letzten Jahrhunderts führten die Forscher LURIA und DELBRÜCK Experimente zur Resistenzbildung bei Bakterien durch. Dabei stellten sie die Hypothese auf, dass die Resistenz gegen ein bestimmtes Antibiotikum nicht erst durch den Kontakt mit diesem, sondern unabhängig davon entsteht. Abbildung 2 zeigt eine vereinfachte Darstellung des Experiments von LURIA und DELBRÜCK.
3 VP

Abb. 2: Experiment zur Resistenzbildung bei Bakterien
2.1
Erläutere, ob die Ergebnisse des Experiments (Abbildung 2) die im Vortext genannte Hypothese der Forscher belegen.
3 VP
2.2
Begründe, warum die Ergebnisse des Experiments die Aussagen LAMARCKs zur Evolution nicht unterstützen.
2 VP
2.3
Erkläre im Sinne der Evolutionstheorie DARWINs die Entstehung multiresistenter Bakterien, wie sie beispielsweise in Krankenhäusern auftritt.
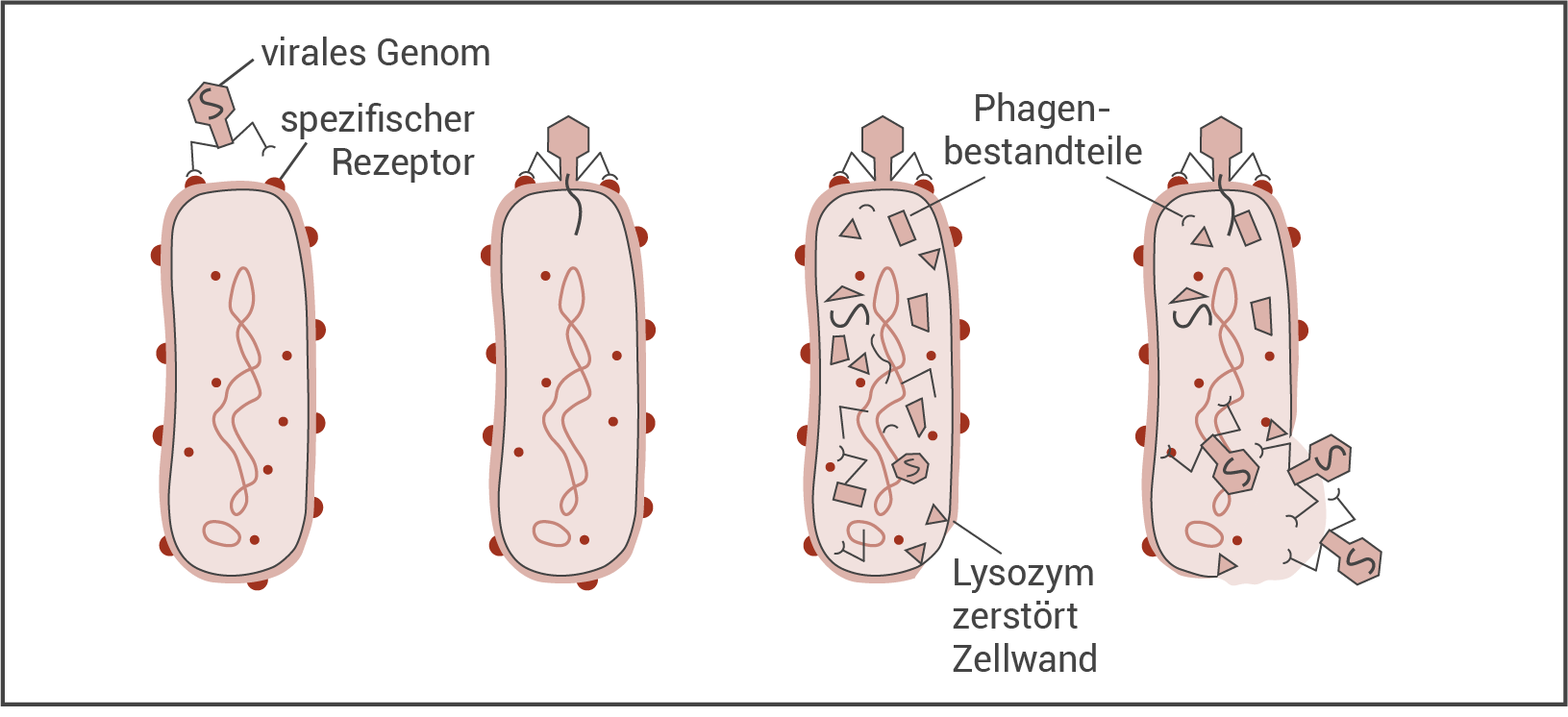
Als Alternative zur Antibiotikatherapie wird hinsichtlich der Bekämpfung multiresistenter Bakterien auch vermehrt an der Therapie mit Bakteriophagen geforscht, die in Osteuropa schon lange zum Standard gehört und dort erfolgreich angewendet wird. Dabei werden den Patienten zum Krankheitserreger passende Bakteriophagen verabreicht. Bakteriophagen sind Viren, die gezielt prokaryotische Zellen befallen (Abbildung 3).
3 VP

Abb. 3: Vermehrungszyklus von Bakteriophagen
3.1
Beschreibe den Vermehrungszyklus von Bakteriophagen mithilfe der Abbildung 3.
2 VP
3.2
Erläutere einen Vorteil und einen Nachteil der Phagentherapie.
Antibiotika-Resistenzgene in Bakterien können in der Gentechnik als Markergene eingesetzt werden.
2 VP
4
Erläutere ein Verfahren zur Selektion transgener Zellen.
3 VP
20 VP
1.1
Benennung der Strukturen:
1 - Dictyosom oder Golgi-Apparat/-Zisterne
2 - Plasmid
3 - Mitochondrium
4 - Zellplasma
2 - Plasmid
3 - Mitochondrium
4 - Zellplasma
5 - Ribosom
6 - Zellmembran
7 - glattes endoplasmatisches Reticulum
8 - Zellkern, Karyoplasma (oder Chromatin)
6 - Zellmembran
7 - glattes endoplasmatisches Reticulum
8 - Zellkern, Karyoplasma (oder Chromatin)
1.2
Erläuterung von Struktur-Funktions-Zusammenhängen (zwei Angaben erforderlich):
Es können alle strukturellen Bestandteile der Biomembran (Phospholipide, Membranproteine, membranassoziierte Kohlenhydrate) genannt werden. Bei einer Zellmembran:
Es können alle strukturellen Bestandteile der Biomembran (Phospholipide, Membranproteine, membranassoziierte Kohlenhydrate) genannt werden. Bei einer Zellmembran:
- Barrierefunktion: Zellmembranen besitzen hydrophobe Eigenschaften, da sie aus einer Phospholipiddoppelschicht bestehen und die Fettsäureschwänze der einzelnen Phospholipid-Moleküle nach innen gerichtet sind. Das Zellplasma und das Außenmedium werden hierdurch getrennt und die Membran wird für hydrophile Moleküle (im Gegensatz zu hydrophoben Molekülen) unpassierbar (selektive Permeabilität).
- Transportfunktion: Durch integrale Kanalproteine, die die Membran durchspannen, wird eine selektive Permeabilität (unterschiedlich großer, polarer und geladener Moleküle) gewährleistet.
- Oberflächenvergrößerung: Durch Einstülpungen (z.B. intrazelluläre Membranfalten bei Bakterien vgl. Abb. 1) bzw. Ausstülpungen (z.B. Mikrovilli tierischer Epithelzellen) der Cytoplasmamebran wird die Kapazität der Zelle für enzymatisch katalysierte Stoffwechselreaktionen bzw. für den Stoffaustausch erhöht.
- Signalerkennung und Weitergabe: Rezeptorproteine, die in die Membran eingelagert sind und nach außen ragen, ermöglichen die Erkennung und Weiterleitung von Signalen vom Außenmedium ins Zellinnere (Signaltransduktion). Das erfolgt durch die Bindung von Liganden nach dem Schlüssel-Schloss-Prinzip.
- Erkennungsfunktion: Auf der Membranaußenseite sind membranassoziierte Kohlenhydrate (Glycolipide, -proteine), die der Zell-Zell-Erkennung dienen (z.B. Fremd-Eigen-Erkennung des Immunsystems, Gewebebildung).
2.1
Erläuterung der Versuchsergebnisse im Hinblick auf die Hypothese der Forscher:
Beschreibung des Versuchsablaufs (nicht verlangt, aber für die Strukturierung empfehlenswert):
In dem Experiment (Abb. 2) wurde eine Suspension von nicht antibiotikumresistenten Zellen (Ausgangskultur ohne Antibiotikum) auf mehrere Reagenzgläser verteilt. Nach einer gewissen Vermehrungszeit wurden diese Ansätze auf je einen Nährboden mit Antibiotikum platziert und nach der Bebrütung wurde dokumentiert wie viele Kolonien auf den einzelnen Nährböden anwuchsen. Erläuterung der Ergebnisse: Auf zwei Nährböden mit Antibiotikum konnte nach Bebrütung eine unterschiedliche Anzahl an Bakterienkolonien festgestellt werden, während die anderen vier Schalen keine einzige Kolonie aufwiesen. Wenn es erst durch den Kontakt mit dem Antibiotikum (auf dem Nährboden) zur Induktion der Antibiotikum-Resistenz der Bakterienzelle kommen würde, könnte man nach einer gewissen Zeit nach der Bebrütung auf allen Platten (mit der gleichen Wahrscheinlichkeit) spontan mutierte Bakterien erwarten, die dann zu Kolonien heranwachsen. Da die Platten keine ähnliche Anzahl an Kolonien aufweisen, ist die Resistenz gegen das auf den Nährböden enthaltene Antibiotikum auf eine Mutation zurückzuführen, durch die sie sich bereits vor dem Kontakt mit dem Antibiotikum in den Reagenzgläsern (1 und 3) entwickelt hat. Die Hypothese der unabhängigen Entwicklung kann hiermit bestätigt werden.
Es liegen unterschiedliche Anzahlen an Kolonien vor, da sich die Mutationen an unterschiedlichen Zeitpunkten ereignet haben und ein früherer Zeitpunkt (Reagenzglas 3) auch mehr Zellteilungen und damit mehr mutierte einzelne Bakterien zur Folge hat.
In dem Experiment (Abb. 2) wurde eine Suspension von nicht antibiotikumresistenten Zellen (Ausgangskultur ohne Antibiotikum) auf mehrere Reagenzgläser verteilt. Nach einer gewissen Vermehrungszeit wurden diese Ansätze auf je einen Nährboden mit Antibiotikum platziert und nach der Bebrütung wurde dokumentiert wie viele Kolonien auf den einzelnen Nährböden anwuchsen. Erläuterung der Ergebnisse: Auf zwei Nährböden mit Antibiotikum konnte nach Bebrütung eine unterschiedliche Anzahl an Bakterienkolonien festgestellt werden, während die anderen vier Schalen keine einzige Kolonie aufwiesen. Wenn es erst durch den Kontakt mit dem Antibiotikum (auf dem Nährboden) zur Induktion der Antibiotikum-Resistenz der Bakterienzelle kommen würde, könnte man nach einer gewissen Zeit nach der Bebrütung auf allen Platten (mit der gleichen Wahrscheinlichkeit) spontan mutierte Bakterien erwarten, die dann zu Kolonien heranwachsen. Da die Platten keine ähnliche Anzahl an Kolonien aufweisen, ist die Resistenz gegen das auf den Nährböden enthaltene Antibiotikum auf eine Mutation zurückzuführen, durch die sie sich bereits vor dem Kontakt mit dem Antibiotikum in den Reagenzgläsern (1 und 3) entwickelt hat. Die Hypothese der unabhängigen Entwicklung kann hiermit bestätigt werden.
Es liegen unterschiedliche Anzahlen an Kolonien vor, da sich die Mutationen an unterschiedlichen Zeitpunkten ereignet haben und ein früherer Zeitpunkt (Reagenzglas 3) auch mehr Zellteilungen und damit mehr mutierte einzelne Bakterien zur Folge hat.
2.2
Begründung des Widerspruchs der Versuchsergebnisse zu LAMARCKs Aussagen:
Die Evolutionstheorie nach LAMARCK besagt, dass Umweltveränderungen eine aktive Anpassung der Organismen an die sich veränderte Umweltbedingung zur Folge haben (hier: Überführung der Ansätze auf einen Nährboden mit Antibiotikum). Das liegt an dem inneren Bedürfnis nach Vervollkommnung, welches hier der Entwicklung einer Antibiotikum-Resistenz entspricht und nach LAMARCK werden diese entwickelte Merkmale an die Nachkommen vererbt. Würden seine Annahmen hier zutreffen, hätte man mehr resistente Bakterienkolonien mit ähnlichen Anzahlen auf den Platten festgestellt. Die Theorie von LAMARCK wird hier also durch die Versuchsergebnisse nicht gestützt.
Die Evolutionstheorie nach LAMARCK besagt, dass Umweltveränderungen eine aktive Anpassung der Organismen an die sich veränderte Umweltbedingung zur Folge haben (hier: Überführung der Ansätze auf einen Nährboden mit Antibiotikum). Das liegt an dem inneren Bedürfnis nach Vervollkommnung, welches hier der Entwicklung einer Antibiotikum-Resistenz entspricht und nach LAMARCK werden diese entwickelte Merkmale an die Nachkommen vererbt. Würden seine Annahmen hier zutreffen, hätte man mehr resistente Bakterienkolonien mit ähnlichen Anzahlen auf den Platten festgestellt. Die Theorie von LAMARCK wird hier also durch die Versuchsergebnisse nicht gestützt.
2.3
Erklärung der Entstehung multiresistenter Bakterien nach DARWIN:
In Krankenhäusern sind zahlreiche Bakterienarten vorhanden, welche sich auf geeigneten Substraten stammweise vermehren (z.B. auf verschmutzten Binden). Dies geschieht teilweise explosionsartig und es kommt zu einer Überproduktion von Nachkommen. Dies führt zu einer Konkurrenz zwischen den Individuen ("struggle for life"). Viele Bakterien sind kaum resistent gegen Antibiotika, aber einige besitzen eine erbliche Variation, durch die sie unempfindlich gegen ein bestimmtes Antibiotikum sind. Wird das betreffende Antibiotikum eingesetzt (Umweltveränderung) können nur sie dagegen wirken, überleben und teilen sich weiter ("survival of the fittest"). Diese vorteilhafte Eigenschaft wird weitervererbt und alle Zellen, die durch Teilung aus ihnen hervorgerufen werden, sind resistent gegen das eingesetzte Antibiotikum. Wenn es im Krankenhaus zum Einsatz weiterer Antibiotika kommt, wiederholt sich der Vorgang und der erhöhte Selektionsdruck bewirkt die Ausbildung von Multiresistenzen.
Viele Bakterienarten können außerdem Plasmide mit Resistenzgenen austauschen, wodurch die Multiresistenzbildung verstärkt wird.
In Krankenhäusern sind zahlreiche Bakterienarten vorhanden, welche sich auf geeigneten Substraten stammweise vermehren (z.B. auf verschmutzten Binden). Dies geschieht teilweise explosionsartig und es kommt zu einer Überproduktion von Nachkommen. Dies führt zu einer Konkurrenz zwischen den Individuen ("struggle for life"). Viele Bakterien sind kaum resistent gegen Antibiotika, aber einige besitzen eine erbliche Variation, durch die sie unempfindlich gegen ein bestimmtes Antibiotikum sind. Wird das betreffende Antibiotikum eingesetzt (Umweltveränderung) können nur sie dagegen wirken, überleben und teilen sich weiter ("survival of the fittest"). Diese vorteilhafte Eigenschaft wird weitervererbt und alle Zellen, die durch Teilung aus ihnen hervorgerufen werden, sind resistent gegen das eingesetzte Antibiotikum. Wenn es im Krankenhaus zum Einsatz weiterer Antibiotika kommt, wiederholt sich der Vorgang und der erhöhte Selektionsdruck bewirkt die Ausbildung von Multiresistenzen.
Viele Bakterienarten können außerdem Plasmide mit Resistenzgenen austauschen, wodurch die Multiresistenzbildung verstärkt wird.
3.1
Beschreibung des Vermehrungszyklus von Bakteriophagen :
- Auf der Oberfläche der Bakterienzelle dockt der Phage an einen spezifischen (Zellwand-)Rezeptor an und injiziert sein virales Genom ins Zellinnere.
- Es werden daraufhin Phagenbestandteile (Kopf, Schwanz mit Schwanzfasern, virales Erbgut)und Lysozym-Moleküle von der Bakterienzelle produziert.
- Die produzierten Phagenbestandteile werden zu neuen Phagen zusammengebaut und die Lysozym-Moleküle lösen die Zellwände auf.
- Durch die Lysozym-Aktivität kommt es zum Platzen der Bakterienzelle und die neu produzierten Phagen werden freigesetzt, welche weitere Bakterienzellen infizieren können.
3.2
Erläuterung der Vor- und Nachteile der Phagentherapie
Mögliche Vorteile (nur eins erforderlich):
- Hohe Spezifität: Bakteriophagen binden sehr spezifisch an (Zellwand-)Rezeptoren der bakteriellen Wirtszelle und infizieren diese, wodurch nützliche Bakterien (z.B: der Darmflora) aber auch menschliche Zellen selbst geschont werden.
- Vermeidung von Multiresistenzen: Durch einen reduzierten Antibiotikaeinsatz zur Bekämpfung bakterieller Infektionen wird der Entstehung multiresistenter Bakterienstämme entgegengewirkt.
- Alternative zu Antibiotika: Durch die Therapie können Patienten mit einer Antibiotika-Unverträglichkeit (z.B. Penicillin-Allergie) oder die mit multiresistenten Bakterienstämmen infiziert sind behandelt werden
- Kosten- und zeitintensive Herstellung: Damit eine möglichst hohe Wirtsspezifität erreicht wird und um das Risiko, dass auch nützliche Bakterien (z.B. des Darms) befallen werden, zu senken, ist ein großer biotechnologischer Aufwand bei der "Entwicklung" spezifischer Bakteriophagen notwendig.
- Risiko des Wirksamkeitsverlusts: Wenn sich mutationsbedingt die Zellwandrezeptorproteine so stark verändern, dass die Phagen nicht mehr andocken können, werden die hoch spezifischen Bakteriophagen wirkungslos.
- Keine schnelle Verfügbarkeit: Die Wirtsspezifität der Phagen erfordert eine Ermittlung der Bakterienart und daraufhin eine abgestimmte passende Verabreichung der Phagen.
- Unwirksamkeit durch Immunabwehr: Da vor allem bei intravenöser Phagentherapie Viren vom Immunsystem erkannt und unschädlich gemacht werden, wird der Therapieerfolg reduziert und bei Bildung von Gedächtniszellen eine mehrmalige intravenöse Verabreichung unmöglich gemacht.
- Risiko des Gentransfers: Wenn temperente Phagen verwendet werden, die ihr Erbgut ins Genom des Bakteriums integrieren, kommt es durch Phagen möglicherweise zu einem horizontalen Gentransfer von Antibiotikum-Resistenzgenen von einem Bakterium auf ein anderes und daraufhin zur Ausbildung von multiresistenten Bakterienstämmen.
4
Mögliche Verfahren der Selektion von transgenen Zellen (nur eins erforderlich):
Es eignen sich Verfahren, die eine leichte phänotypische Identifizierung der transgenen Zellen ermöglichen, was durch die Verwendung von Markergenen möglich wird. Diese werden zusammen mit dem Transgen exprimiert. Möglich sind Resistenzgene (z.B. Ampicillin- und Tetracyclin-Resistenzgene), Gene für fluoreszierende Proteine (z.B. GFP = grpn fluoreszierendes Protein) oder das -Galactosidase-Gen (Blau-Weiß-Verfahren).
-Galactosidase-Gen (Blau-Weiß-Verfahren).
Es eignen sich Verfahren, die eine leichte phänotypische Identifizierung der transgenen Zellen ermöglichen, was durch die Verwendung von Markergenen möglich wird. Diese werden zusammen mit dem Transgen exprimiert. Möglich sind Resistenzgene (z.B. Ampicillin- und Tetracyclin-Resistenzgene), Gene für fluoreszierende Proteine (z.B. GFP = grpn fluoreszierendes Protein) oder das
- Selektion mithilfe des Blau-Weiß-Verfahrens: Die für das Fremdgen verwendeten Plasmide, enthalten ein Antibiotikum-Resistenzgen und das
-Galactosidase-Gen (lacZ-Gen). Das Enzym
-Galactosidase (Genprodukt) katalysiert nun die Umsetzung einer farblosen Vorstufe in einen blauen Farbstoff und das Fremdgen wird so eingesetzt, dass das lacZ-Gen zerschnitten und so zerstört werden kann. Bei den rekombinanten Plasmiden kommt es zur Übertragung in Bakterienzellen (Transformation), welche auf Nährböden mit Antibiotikum kultiviert werden. Nur die Bakterien mit Resistenzgen (also solche mit Plasmid) überleben hier. Wenn anschließend
-Galactosidase (Substrat des Enzyms) hinzugegeben wird, verfärben sich alle Kolonien ohne Fremdgenzellen blau, da hier ein intaktes lacZ-Gen vorhanden ist. Kolonien, die Bakterien mit dem Fremdgen besitzen, bleiben weiß, da hier das lacZ-Gen nicht mehr exprimiert werden kann.
- Selektion mit zwei Antibiotikum-Resistenzgenen: Die Plasmide, in die ein Fremdgen eingebaut werden soll, enthalten zwei verschiedene Resistenzgene. Das kann z.B. eines, das Resistenz gegen das Antibiotikum Ampicillin (Amp
) vermittelt, und eines für die Resistenz gegen Tetracyclin (Tetra
) sein. Nun wird das Fremdgen so in das Plasmid eingebaut, dass es in eines der Resistenzgene (z.B. Amp
) inseriert und dieses zerstört. Es erfolgt der Übertrag von rekombinanten Plasmiden in Bakterienzellen (Transformation) und diese werden dann auf Nährböden mit Tetracyclin kultiviert. Nur Bakterien mit Tetra
, also solche mit aufgenommenem Plasmid, überleben hier und wenn danach ein Stempelabdruck dieser Kolonien auf ein Ampicilin-Medium übertragen wird, können sich nur Zellen mit intaktem Amp
ohne integriertes Fremgen teilen. Nun können die transgenen Bakterienzellen als Kolonien, die nur auf dem Nährboden mit Tetra
gewachsen sind, identifiziert werden.