Aufgabe 4 – Blutgruppen
Im Jahre 1930 erhielt der Österreicher KARL LANDSTEINER für die Entdeckung des AB0-Blutgruppensystems den Nobelpreis für Medizin. Beim Menschen gibt es die Blutgruppen A, B, AB und 0 . Die Ursache hierfür sind unterschiedliche Kohlenhydratketten, die an Proteine (Glycophorine) in der Zellmembran von Erythrozyten (Rote Blutzellen) gebunden sind. Bei den unterschiedlichen Blutgruppen kommen verschiedene Kohlenhydratketten vor.


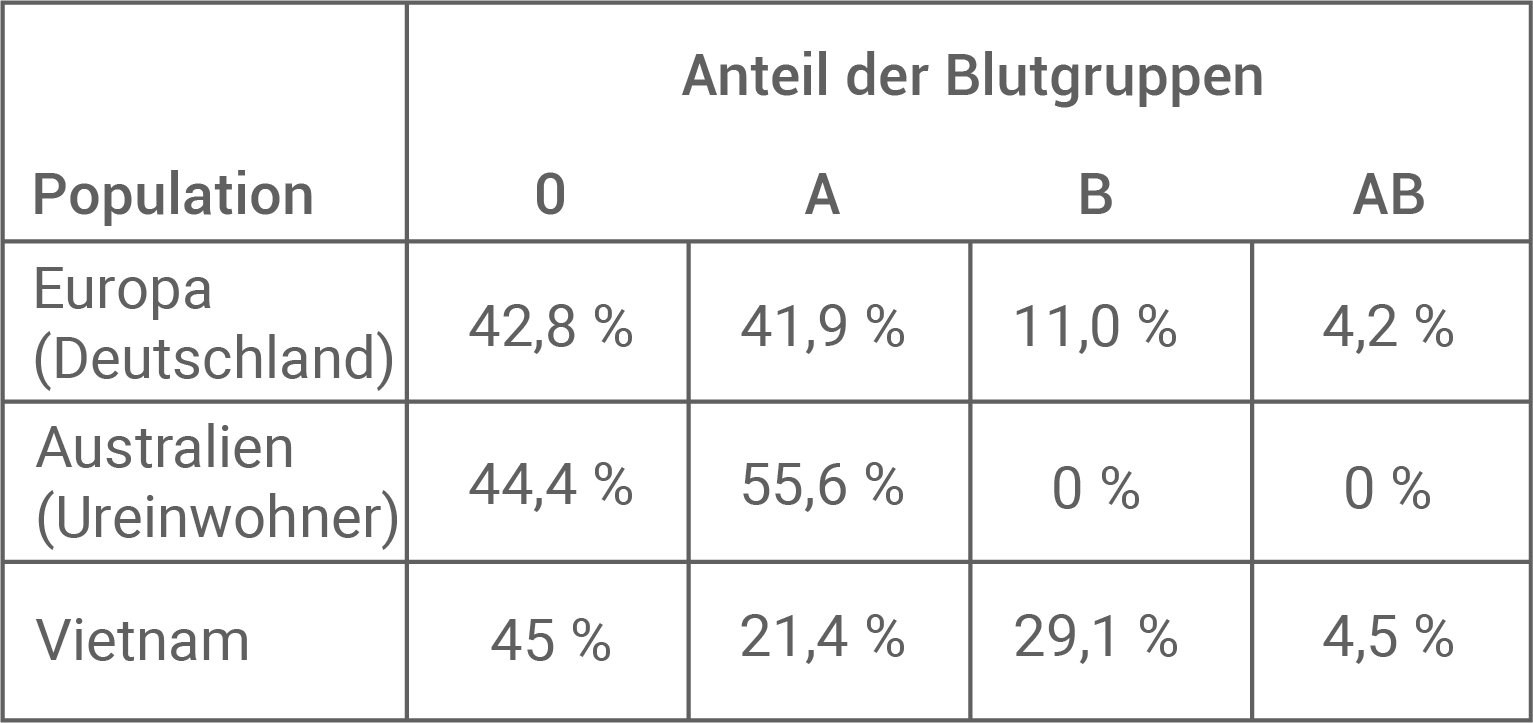 Tab. 2: Prozentuale Verteilung der AB0-Blutgruppen in verschiedenen Populationen
Tab. 2: Prozentuale Verteilung der AB0-Blutgruppen in verschiedenen Populationen
1
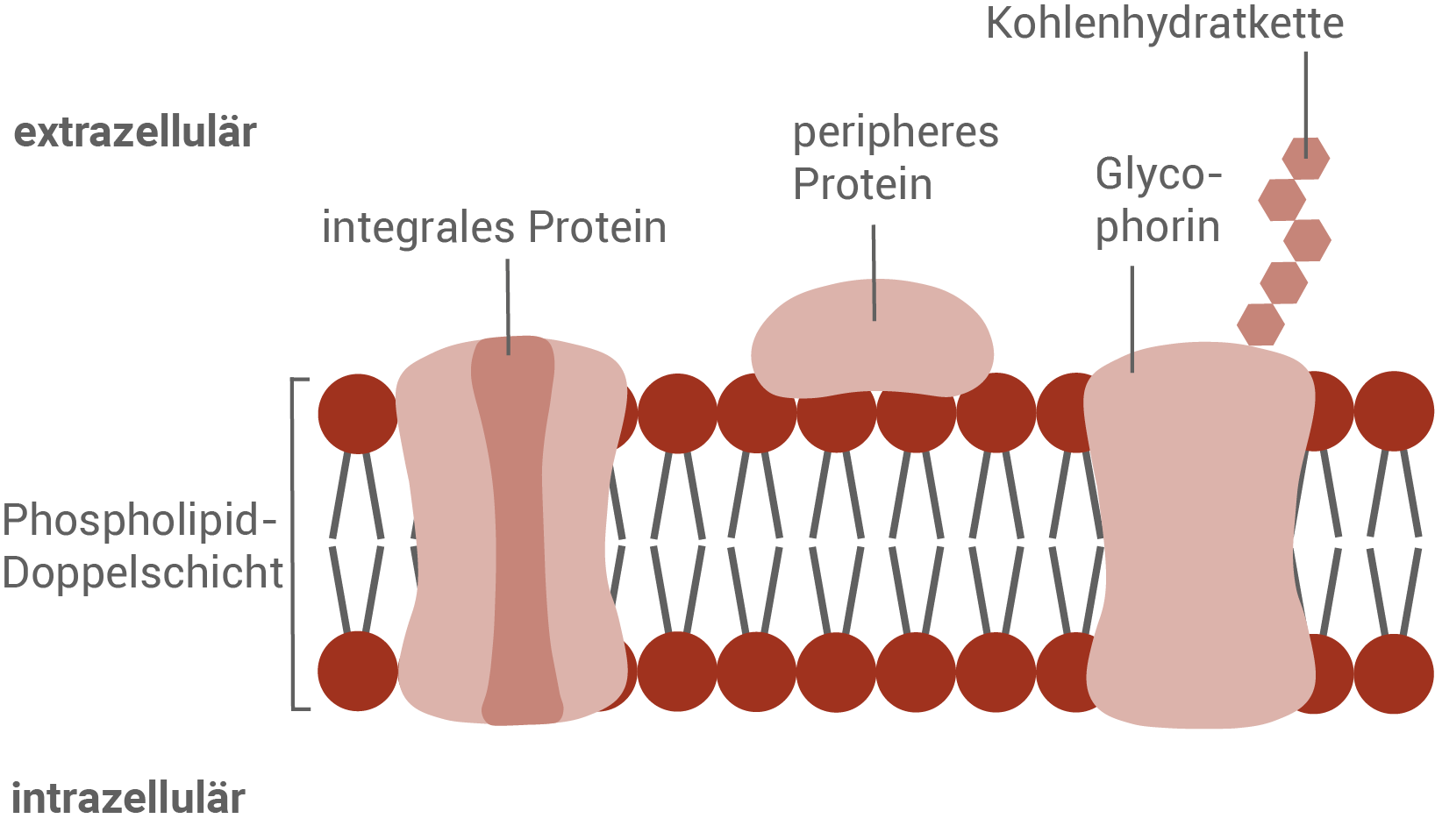
Erstelle eine beschriftete Schemazeichnung der Zellmembran eines Erythrozyten auf der Grundlage des Flüssig-Mosaik-Modells (Größe ca.  Seite).
Seite).
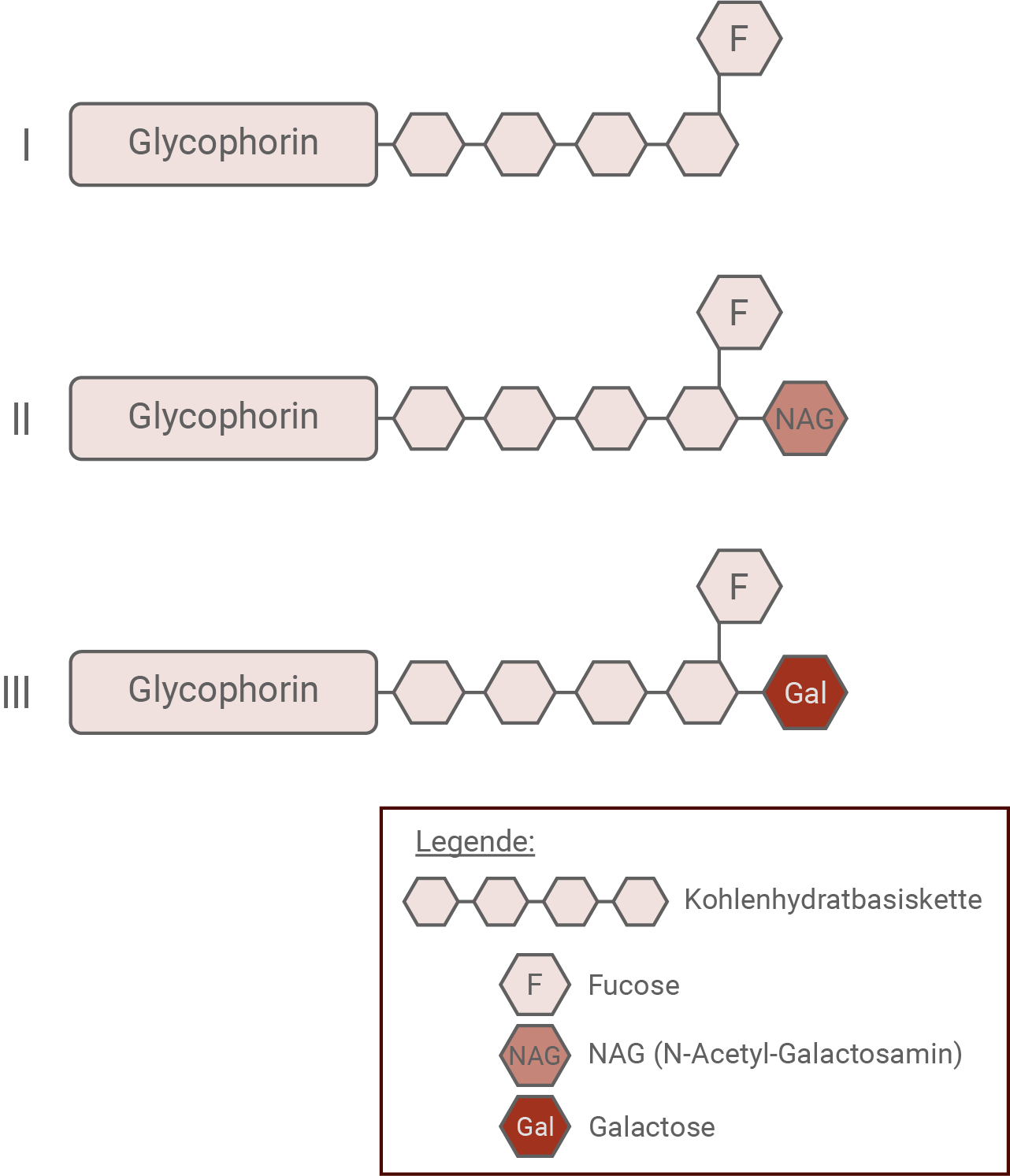
Die Glycoproteine der Blutgruppen unterscheiden sich in ihrem Aufbau (Abb. 1).
3 VP

Abb. 1: Glycoproteine l bis lll des AB0-Systems

Tab. 1: Enzyme zur Bildung der Glycoproteine des AB0-Systems
2
Vergleiche den Aufbau der drei verschiedenen Glycoproteine I bis III und ordne diese mithilfe von Tabelle 1 den Erythrozyten der vier Blutgruppen begründet zu.
Das Enzym NAGT (N-Acetyl-Galactosaminyl-Transferase) besteht aus 354 Aminosäuren. Die Abbildung 2 zeigt einen Ausschnitt des codogenen Strangs des NAGT-Gens, der für die Aminosäuren 10 bis 16 codiert. Der Austausch des Guanin-Nukleotids (siehe Unterstreichung) durch eines der anderen Nukleotide führt bei homozygot betroffenen Personen zu unterschiedlichen Auswirkungen bei der Ausprägung der Blutgruppe.
4 VP

Abb. 2: Ausschnitt des codogenen Strangs des NAGT-Gens
3
Ermittle mithilfe der Codesonne (siehe Anlage) die zugehörige Aminosäuresequenz. Erläutere die Auswirkungen der drei auf einem Nucleotidaustausch beruhenden möglichen Punktmutationen auf die Ausprägung der Blutgruppe einer von der jeweiligen Mutation homozygot betroffenen Person.
4 VP
Im AB0-System liegen bei Erwachsenen Antikörper gegen die nicht körpereigenen Blutgruppen-Glycoproteine vor. Dies trifft auch ohne vorherigen Kontakt mit dem Blut einer anderen Blutgruppe zu.
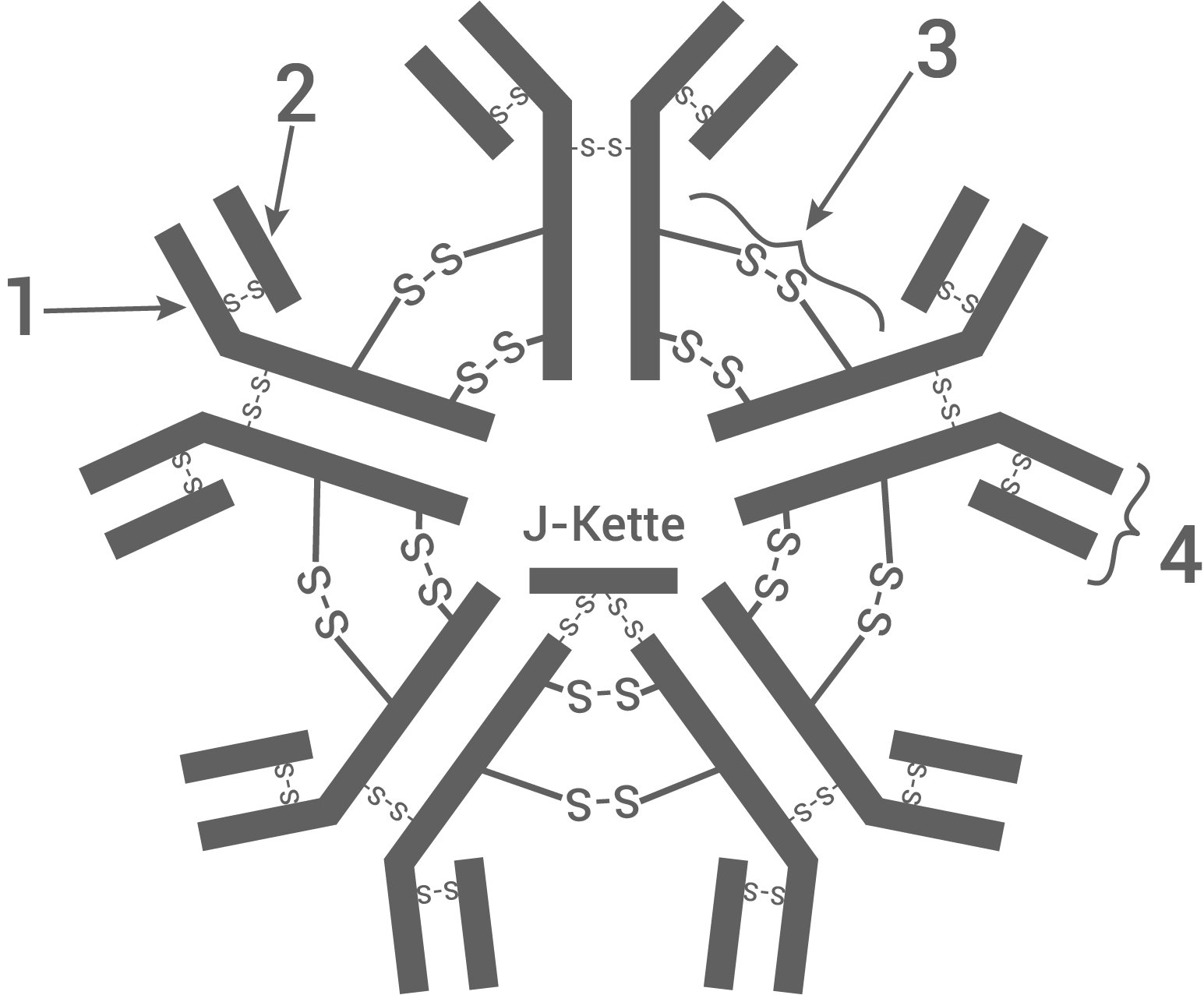
Es wird vermutet, dass Menschen im frühen Säuglingsalter mit Bakterien und Viren in Kontakt kommen, die auf ihrer Oberfläche Molekülstrukturen besitzen, die den Glycoproteinen des AB0-Systems stark ähneln. Bei der darauffolgenden Immunantwort werden Antikörper vom Typ IgM (Abb. 3) gebildet, die ausschließlich an körperfremde Strukturen binden können. Die Antikörperausstattung bei unterschiedlichen Blutgruppen ist folglich verschieden. Obwohl sich die Glycoproteine (Abb. 1) der Erythrozyten-Membran nur wenig unterscheiden, werden die Glycoproteine II und III als unterschiedliche Antigene erkannt und es werden spezifische Antikörper gebildet. Gegen das Glycoprotein I werden jedoch keine Antikörper gebildet.
Es wird vermutet, dass Menschen im frühen Säuglingsalter mit Bakterien und Viren in Kontakt kommen, die auf ihrer Oberfläche Molekülstrukturen besitzen, die den Glycoproteinen des AB0-Systems stark ähneln. Bei der darauffolgenden Immunantwort werden Antikörper vom Typ IgM (Abb. 3) gebildet, die ausschließlich an körperfremde Strukturen binden können. Die Antikörperausstattung bei unterschiedlichen Blutgruppen ist folglich verschieden. Obwohl sich die Glycoproteine (Abb. 1) der Erythrozyten-Membran nur wenig unterscheiden, werden die Glycoproteine II und III als unterschiedliche Antigene erkannt und es werden spezifische Antikörper gebildet. Gegen das Glycoprotein I werden jedoch keine Antikörper gebildet.

Abb. 3: IgM-Antikörper (schematisch)
4.1
Benenne die Strukturen 1 bis 4 der schematischen Darstellung eines IgM-Antikörpers (Abb. 3) mit den entsprechenden Fachbegriffen. Erkläre die Funktion der Struktur 3.
2 VP
4.2
Gib eine mögliche Erklärung, weshalb es im Blut keine Antikörper gegen Glycoprotein I (Abb. 1) gibt.
Pockenviren tragen auf ihrer Oberfläche dem Antigen A ähnliche Antigene.
2 VP
5
Erläutere, was in Bezug auf die Verteilung der Blutgruppen des AB0-Systems in Populationen zu erwarten wäre, die früher wiederholt von Pocken betroffen waren.
Die Blutgruppen sind in verschiedenen Populationen nicht gleichmäßig verteilt (Tabelle 2).
3 VP
 Tab. 2: Prozentuale Verteilung der AB0-Blutgruppen in verschiedenen Populationen
Tab. 2: Prozentuale Verteilung der AB0-Blutgruppen in verschiedenen Populationen
6
Formuliere eine Hypothese zur Entstehung der in Tabelle 2 dargestellten prozentualen Verteilung der Blutgruppen bei den australischen Ureinwohnern im Vergleich zu anderen Populationen.
2 VP
20 VP
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Zellmembran eines Erythrozyten:

2
Aufbau der Glycoproteine und Zuordnung zu den Blutgruppen:
Die drei Glycoproteine haben den gleichen Grundbau aus Glycophorin und Kohlenhydratbasiskette. An die Kohlenhydratkette werden in Abhängigkeit der vorhandenen Enzyme weitere Zucker gebunden.
- Blutgruppe 0: Gehört zu Glycoprotein I, da nur das Enzym FUT1 vorhanden ist, welches an den letzen Zucker der Kohlenhydratkette Fucose bindet.
- Blutgruppe A: Gehört zu den Glycoproteinen I und II. Die Enzyme FUT1 und NAGT sind vorhanden, es werden also Glycoproteine mit Fucose und welche mit Fucose und NAG gebildet.
- Blutgruppe B: Gehört zu den Glycoproteinen I und III. Die Enzyme FUT1 und GalT sind vorhanden, es werden also Glycoproteine mit Fucose und welche mit Fucose und Galactose gebildet.
- Blutgruppe AB: Gehört zu den Glycoproteinen I, II und III. Es sind alle Enzyme vorhanden, und es werden entsprechend auch alle Glycoprotein-Arten gebildet.
3
Zugehörige Aminosäuresequenz:
... Gly-Lys-Pro-Lys-Cys-His-Ala ...
Auswirkungen von Punktmutationen an der markierten Stelle:
- Unmutierter Zustand: Die Sequenz des Codons lautet ACG. Die entsprechende mRNA Sequenz ist UGC und es wird die Aminosäure Cys gebildet. Es entsteht das Blutgruppen-Antigen A und die Person hat die Blutgruppe A bzw. AB.
- Austausch von Guanin mit Adenin: Es handelt sich um eine stumme Mutation, da das Codon ACA die mRNA-Sequenz UGU bildet, welche ebenfalls für Cys codiert. Die Mutation hat damit keine Auswirkungen auf die Blutgruppe.
- Austausch von Guanin mit Cytosin: Die Sequenz des Codons lautet ACC, und es wird die mRNA-Sequenz UGG gebildet. Infolgedessen codiert das Codon für Trp statt Cys. Je nachdem, an welcher Stelle diese Aminosäure im Protein liegt, kann es zu Fehlfaltungen kommen, bei denen das aktive Zentrum des Enzyms betroffen ist. Somit könnte sich eine Auswirkung auf die Blutgruppe ergeben, sodass die betroffene Person eine andere Blutgruppe besitzt.
- Austausch von Guanin mit Thymin: Die Sequenz des Codons lautet ACT, und die zugehörige mRNA-Sequenz ist UGA. Es entsteht ein vorzeitiges Stopp-Codon im Leseraster, sodass die Translation nach der 13. Aminosäure abbricht. Das entstehende Protein ist höchstwahrscheinlich enzymatisch inaktiv. Daher entsteht eine Kohlenhydratseitenkette wie bei der Blutgruppe 0.
4.1
Strukturen des IgM-Antikörpers:
- Lange Kette
- Kurze Kette
- Disulfidbrücke
- Antigenbindestelle
4.2
Grund für fehlende Antikörper gegen Glycoprotein I:
Das Enzym FUT1 kommt in den Erythrozyten aller Blutgruppen vor. Daher entstehen auch bei allen Blutgruppen Gylcoproteine von Typ I. Für den Körper ist Glycoprotein I kein Antigen, und es werden keine Antikörper gegen Glycoprotein I produziert.
5
Verteilung der Blutgruppen des AB0-Systems in Populationen, die wiederholt von Pocken betroffen waren:
Bei Personen mit Blutgruppe A oder AB wird nach einer Infektion mit Pocken das Antigen der Pocken nicht so schnell erkannt, da es dem körpereigenen Antigen A stark ähnelt. Personen mit diesen Blutgruppen haben keine Antikörper gegen das Antigen A (Glycoprotein II). Personen mit den Blutgruppen B und 0 allerdings schon. Diese Personen haben dadurch einen Selektionsvorteil, da sie eine Infektion mit dem Pockenvirus besser bekämpfen können. Der erhöhte Reproduktionserfolg der Personen mit Blutgruppe 0 und B vermindert die Allelfrequenz des NAGT-Gens (und damit die Häufigkeit des Glycoproteins II). In Populationen, die oft von Pocken betroffen waren, ist also eine größere Häufigkeit der Blutgruppen 0 und B zu erwarten.
6
Hypothese zur Entstehung der prozentualen Verteilung der Blutgruppen bei den australischen Ureinwohnern im Vergleich zu anderen Populationen:
Betrachtet man Tabelle 2, so wird deutlich, dass bei den australischen Ureinwohnern die Blutgruppen B und AB nicht vorkommen. Australische Ureinwohner stammen vermutlich von einer sehr kleinen Gründerpopulation ab. In dieser Population gab es die Blutgruppen B und AB durch Zufall nicht und die Allelfrequenz wurde in dieser Population verschoben (Gendrift). Die australischen Ureinwohner hatten zudem lange keinen Kontakt zu anderen Populationen, wodurch sich die Verteilung der Blutgruppen innerhalb ihrer Population stabilisierte.