Sauerstoffverbindungen
Einführung und Definition
Wir wollen uns in diesem Skript mit Sauerstoffverbindungen in der organischen Chemie beschäftigen. Viele der relevanten Verbindungen und funktionellen Gruppen sowie deren Reaktivität haben wir schon an anderer Stelle angesprochen. Im Folgenden findest du einen kurzen Überblick hierzu:
- Chemie der Makromoleküle: Alkohole, Carbonsäuren, Carbonsäureester, Isocyanate und Urethane
- Naturstoffe: Alkohole, Aldehyde, Halbacetale, Vollacetale, Carbonsäuren, Peptidgruppen
- Aromaten: Alkohole
Alkohole
Die OH-Gruppe und ihre Eigenschaften
Die OH-Gruppe und Typen von Alkoholen
Alkohole lassen sich durch das Auftreten der Hydroxygruppe -Gruppe erkennen. Tritt mehr als eine OH-Gruppe an einem Molekül auf, dann spricht man auch von mehrwertigen Alkoholen (vgl. Abb. 1).
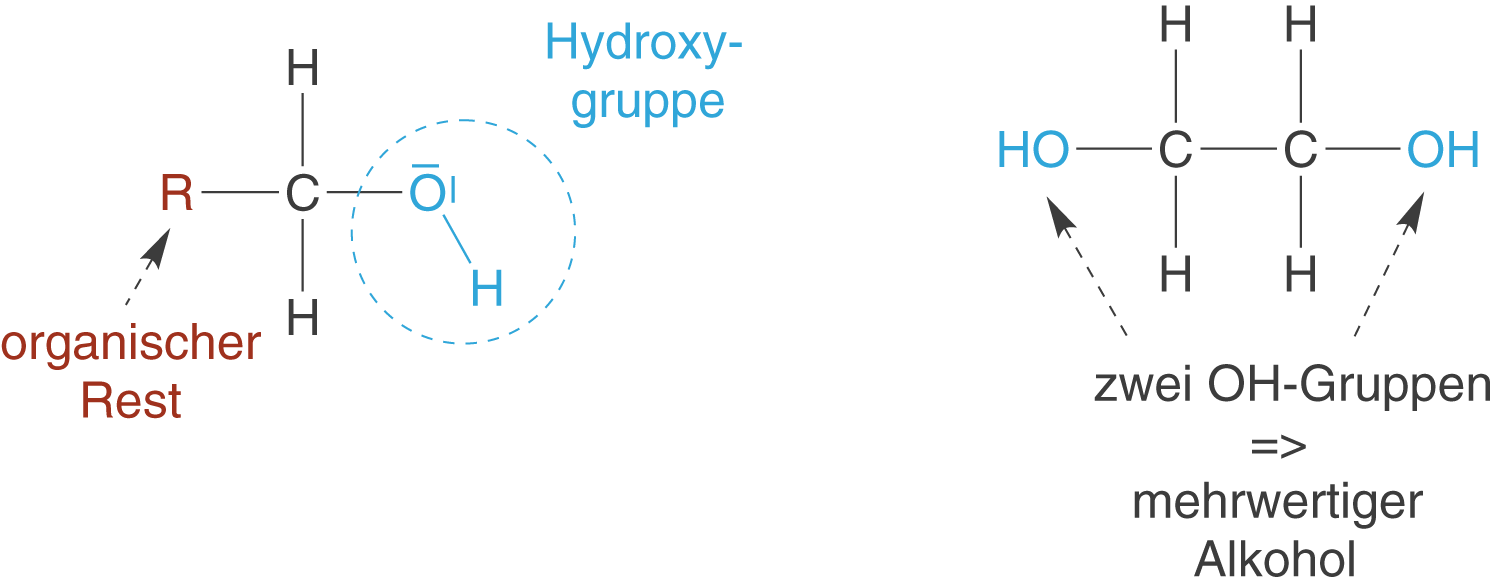
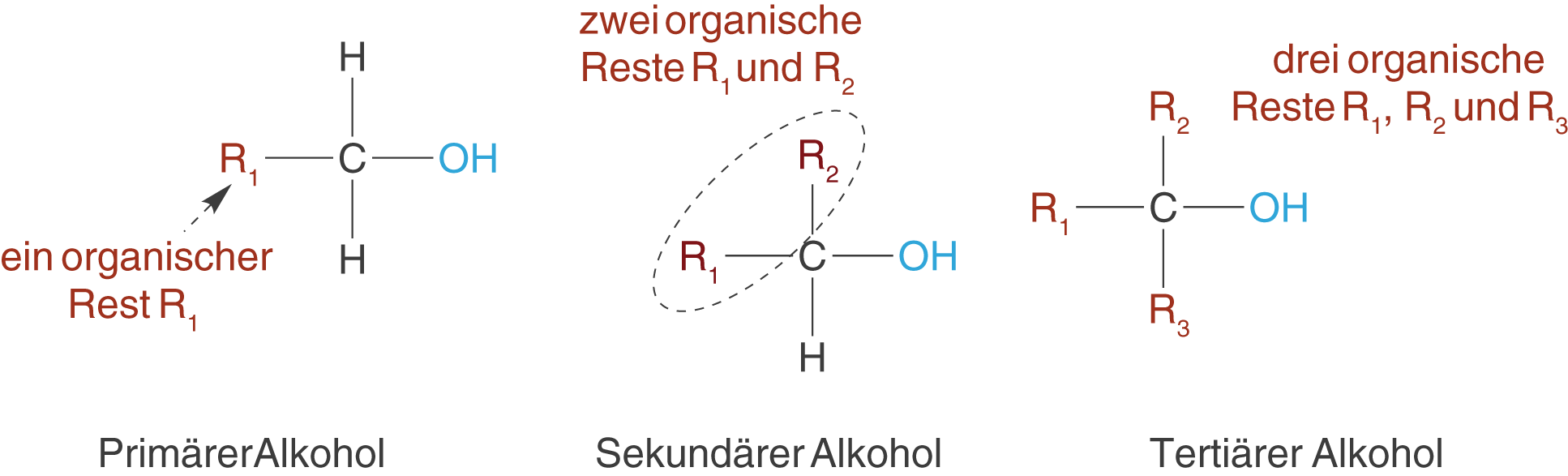
Neben der Anzahl der OH-Gruppen innerhalb eines Moleküls, unterscheidet man auch die Anzahl der Substituenten am C-Atom, an welches die OH-Gruppe gebunden ist. Je nachdem ob ein, zwei oder drei Substituenten R vorhanden sind, spricht man von primären, sekundären oder tertiären Alkoholen (vgl. Abb. 2). Wichtig ist, dass es sich um organische Substituenten handelt, also solche, die mindestens ein weiteres C-Atom aufweisen. Die Wasserstoffatome werden nicht beachtet. Der Unterschied zu den mehrwertigen Alkoholen besteht also darin, dass es hier im Prinzip um das Kohlenstoffatom geht, an welches die OH-Gruppe gebunden ist und um die restlichen drei Substituenten. Mehrwertige Alkohole weisen dahingegen mehr als eine OH-Gruppe auf.
Die einfachsten Alkohole bauen sich genauso auf, wie die unverzweigten Alkane (vgl. ChemieLV-Skript Kohlenwasserstoffe) mit dem einzigen Unterschied, dass an einem Ende eine OH-Gruppe hängt. Um innerhalb des Namens kenntlich zu machen, dass es sich um einen Alkohol handelt, hängen wir an den Namen des Alkans noch die Endung -ol; aus diesem Grund bezeichnet man Alkohole auch als Alkanole. Damit ergeben sich folgende Bezeichnungen:
| Name | Summenformel |
|---|---|
| Methanol | |
| Ethanol | |
| Propanol | |
| Butanol | |
| Pentanol | |
| Hexanol | |
| Heptanol | |
| Octanol | |
| Nonanol | |
| Decanol |
Eigenschaften der OH-Gruppe
Die Hydroxygruppe ist in der Lage Wasserstoffbrückenbindungen (H-Brücken) auszubilden. Diese Tatsache geht darauf zurück, dass der Unterschied der Elektronegativität zwischen Sauerstoff und Wasserstoff relativ groß ist und das H-Atom somit positiv polarisiert wird. In Anwesenheit von Verbindungen mit freien Elektronenpaaren (Protonenakzeptoren) wie Stickstoff- oder Sauerstoffatomen, kommt es zu Ausbildung von H-Brücken durch die Wechselwirkung zwischen dem positiv polarisierten H-Atom und dem freien Elektronenpaar (vgl. Abb. 3).
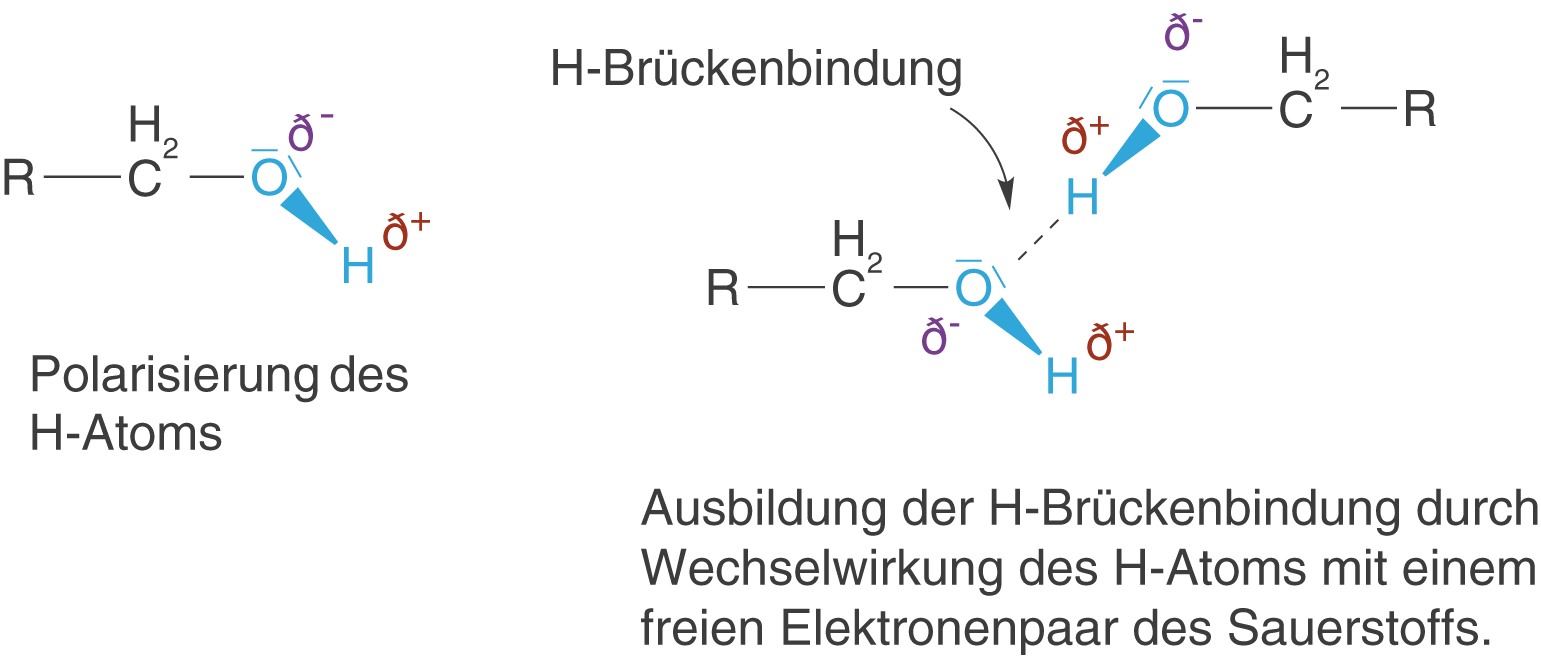
Im ChemieLV-Skript Bindungstypen und Wechselwirkungen sprechen wir die Eigenschaften der H-Brückenbindung ein wenig detaillierter im Kontext anderer intermolekularer Kräfte (zwischenmolekular) an. An dieser Stelle reicht es aus zu wissen, dass die H-Brücken sehr stabil sind und sich somit direkt auf die Eigenschaften der Alkohole niederschlagen. Diese Tatsache können wir gut erkennen, wenn wir die Siedepunkte der ersten fünf Alkane mit denen der ersten fünf Alkohole vergleichen (vgl. Abb. 4).
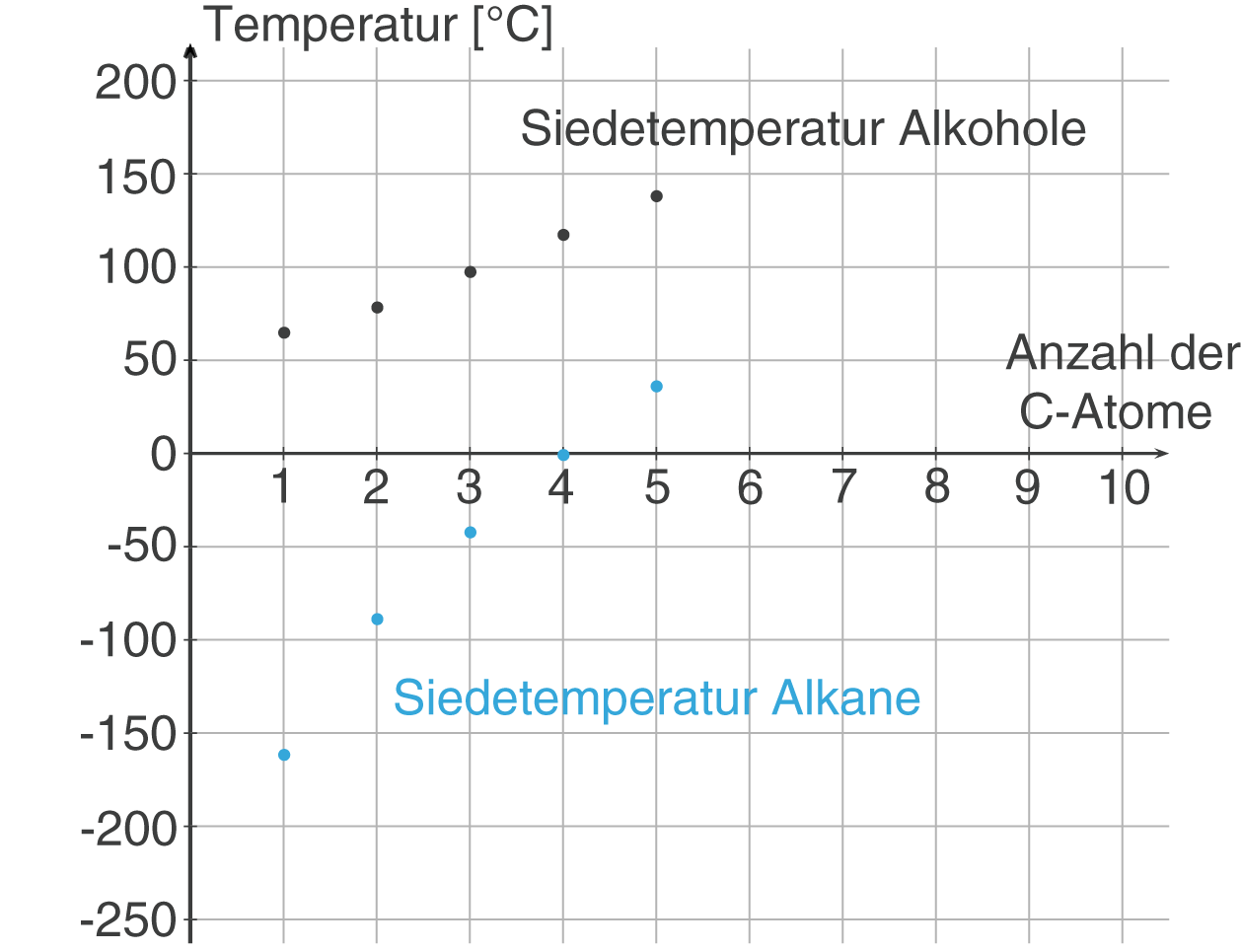
Die Siedetemperaturen der Alkohole fallen bei vergleichbaren Kettenlängen deutlich höher aus, was wir mit den stabilen Wasserstoffbrücken erklären konnten.
Chemie der OH-Gruppe
Säure-Base-Chemie
Alkohole können sowohl als Säuren als auch als Basen reagieren. Wenn wir uns die Protolyse eines Alkohols (hier Methanol) unter Anwesenheit einer Base anschauen, dann fällt auf, dass es sich hierbei um sehr schwache Säuren handelt. Der
-Wert ist sehr viel größer als Null.
Wenn wir uns an den Zusammenhang zwischen und
erinnern, dann erhalten wir für Methanol:
Dies bedeutet, dass es sich im Fall des Alkoholat-Anions in unserem Fall das Methanolat-Anion (), um eine sehr starke Base handelt.
Gleichzeitig kann ein Alkohol aber auch bei Anwesenheit einer starken Säure HB als Base reagieren.
Hier erhalten wir dann ein Oxoniumion . Da Alkohole relativ schwache Basen sind, ist dieses Ion eine sehr starke Säure, die leicht wieder deprotoniert wird.
Eine interessante Ausnahme bzgl. der Säurestärke von Alkoholen findest du im Kontext zu Phenol (vgl. ChemieLV-Skript Aromaten). Dort wird der Einfluss des Phenylrests auf den Säurecharakter der OH-Gruppe deutlich. Wenn du ein Blick in besagtest Skript wirst, dann findest du dort eine ausführliche Darstellung des hier angesprochenen Phänomens.
Der nukleophile Charakter der OH-Gruppe
Eine Eigenschaft der Hydroxygruppe ist zentral für viele Reaktionstypen, die wir im Rahmen des ChemieLV-Basiswissen besprechen: ihr nukleophile Charakter. Den Begriff nukleophil kannst du mit „kernliebend“ übersetzen. Wenn wir uns daran erinnern, dass sich im Kern eines Atoms die positiv geladenen Protonen befinden (vgl. ChemieLV-Skript Atommodelle und die Elektronenstruktur von Atomen), dann wird deutlich, dass nukleophile Verbindungen Reaktionen mit positiv geladenen Atomen eingehen wollen. Bei einer solchen positiven Ladung kann es sich auch um eine positive Partialladung handeln, die durch unterschiedliche Elektronegativitäten innerhalb eines Moleküls hervorgerufen wird. Die Reaktion wird durch die Anwesenheit von freien Elektronenpaaren am Nukleophil möglich (vgl. Abb. 5).

Das Gegenteil des Nukleophils ist das Elektrophil, welches wir im ChemieLV-Skript Kohlenwasserstoffe kennen gelernt haben.
Im weiteren Verlauf dieses Skripts werden wir die Carbonylgruppe kennen lernen. Diese ist ein gutes Beispiel für einen Reaktionspartner von Alkoholen, wobei die Reaktion auf Grundlage des nukleophilen Charakters des Alkohols abläuft. Eine solche Reaktion wäre bspw. die Veresterung von Carbonsäuren.
Im ChemieLV-Skript DNA-Träger der Erbinformation kommen die Ester der Phosphorsäure zur Sprache, die zur Verknüpfung der einzelnen Nucleotide führen. Hierbei ist es wichtig zu beachten, dass die Veresterung der Phosphorsäure mit der OH-Gruppe des Zuckers nicht vergleichbar ist mit der Veresterung einer Carbonsäure; die OH-Gruppe nimmt in diesem speziellen Fall nicht die Rolle des Nukleophils ein! Das bedeutet, dass du den Reaktionsmechanismus der Carbonsäureveresterung nicht ohne weiteres auf die Veresterung der Phosphorsäure übertragen kannst.
Die Carbonylgruppe
Grundlegendes zur Carbonylgruppe
Alle nachfolgenden Stoffklassen gehen auf die Carbonylgruppe zurück und unterscheiden sich nur in den Substituenten (Resten) dieser Gruppe. Wir wollen uns deshalb ganz allgemein mit den Eigenschaften der Carbonylgruppe (vgl. Abb. 6) beschäftigen, um im weiteren Verlauf die Reaktivität der dargestellten Stoffklassen bewerten und den Einfluss der Substituenten verstehen zu können.

Die charakteristische Eigenschaft der Carbonylgruppe ist die positive Polarisierung des C-Atoms durch das Sauerstoffatom. Letzteres hat eine höhere Elektronegativität als das C-Atom, womit es die Elektronen der Doppelbindung zu sich zieht. Das Resultat ist eine positive Partialladung am C-Atom.
Anfälligkeit für nukleophile Angriffe
Nun können wir das Nukleophil ins Spiel bringen, welches bspw. in Form einer OH-Gruppe vorliegt. In diesem Fall haben wir an der Carbonylgruppe ein positiv polarisiertes C-Atom vorliegen und mit dem Nukleophil ein Molekül, welches mit seinen freien Elektronen eine Reaktion mit dem besagten C-Atom eingehen kann. Man spricht in diesem Zusammenhang auch vom „Angriff des Nukleophils“ am C-Atom (vgl. Abb. 7).
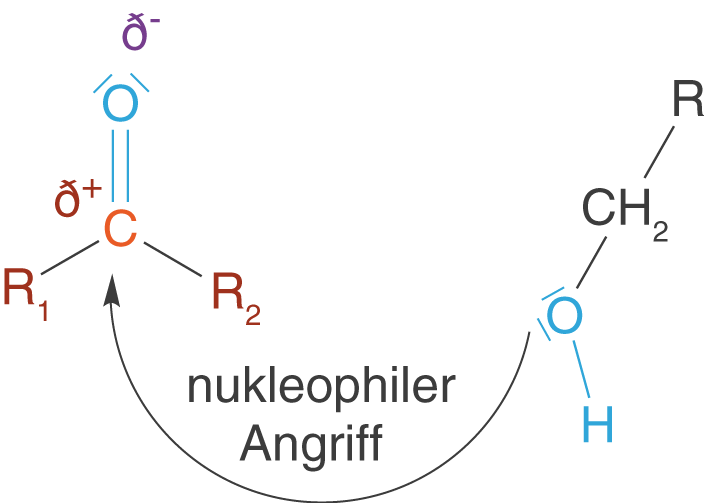
Im Folgenden gehen wir nacheinander auf die Aldehyde, Ketone, Carbonsäuren und Carbonsäurester ein und besprechen ihre Reaktivität auf Grundlage der Informationen zur Carbonylgruppe. Wir werden hierbei auch immer die relevanten ChemieLV-Skripte aufgreifen, in denen diese funktionellen Gruppen eine zentrale Rolle spielen.
Aldehyde
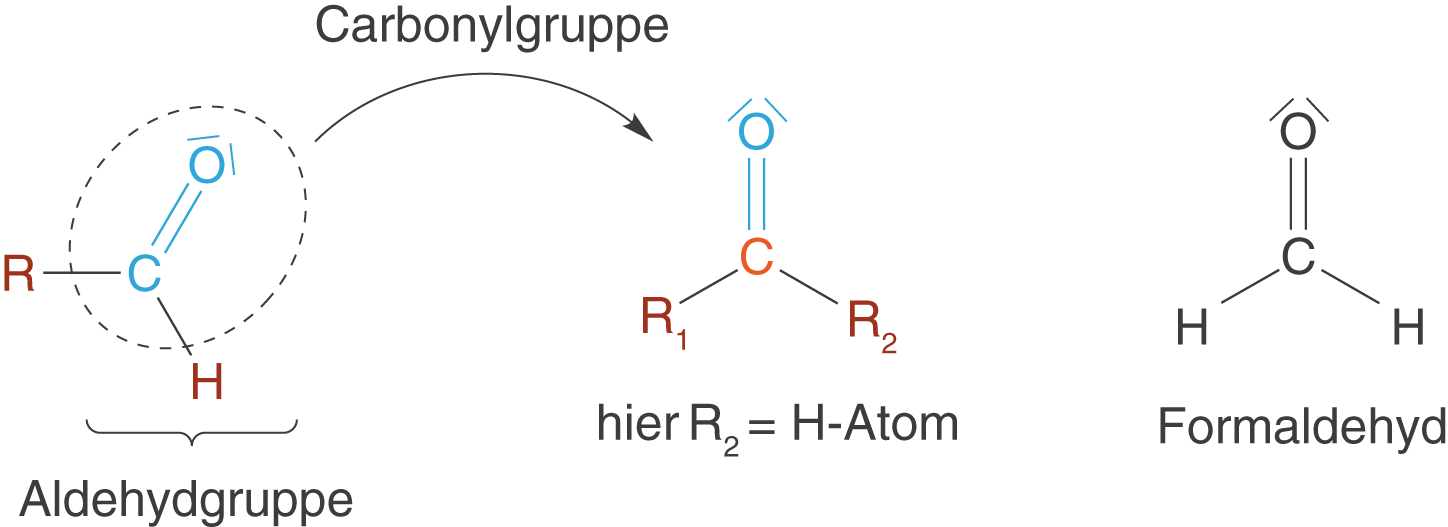
Aldehyde sind Verbindungen mit endständigen CHO-Gruppen. Wenn wir von der Carbonylgruppe ausgehen bedeutet das, dass ein Substituent in Form eines H-Atoms vorliegt während der andere ein Alkylrest ist. Der letzte Fall gilt nicht für das einfachste Aldehyd: Formaldehyd besitzt zwei H-Atome als Substituenten (vgl. Abb. 8)
Im Rahmen des ChemieLV-Basiswissen werden die Aldehyde insbesondere im Themengebiet Naturstoffe relevant, wenn es um den Ringschluss von offenkettigen Monosacchariden geht (vgl. Abb. 9).
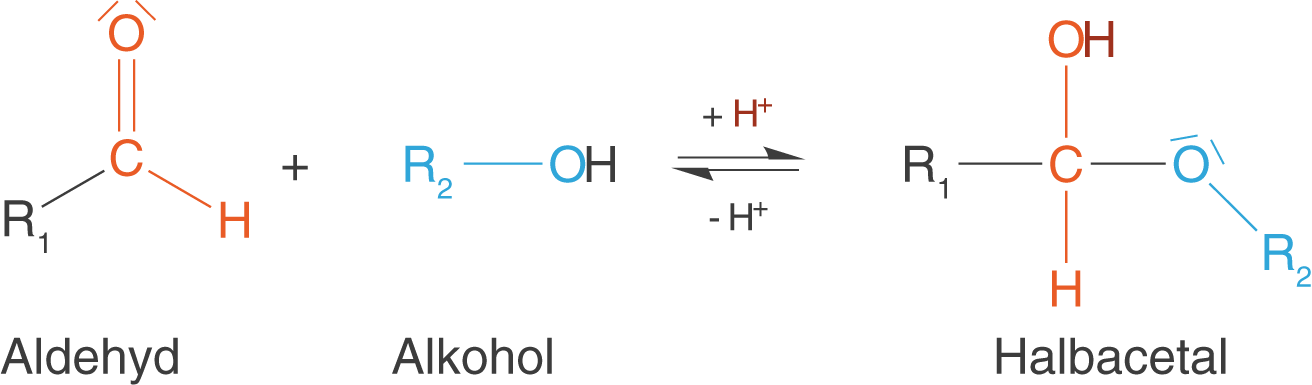
Eine Aldehydgruppe reagiert mit einem Alkohol zu einem Halbacetal.
Ketone
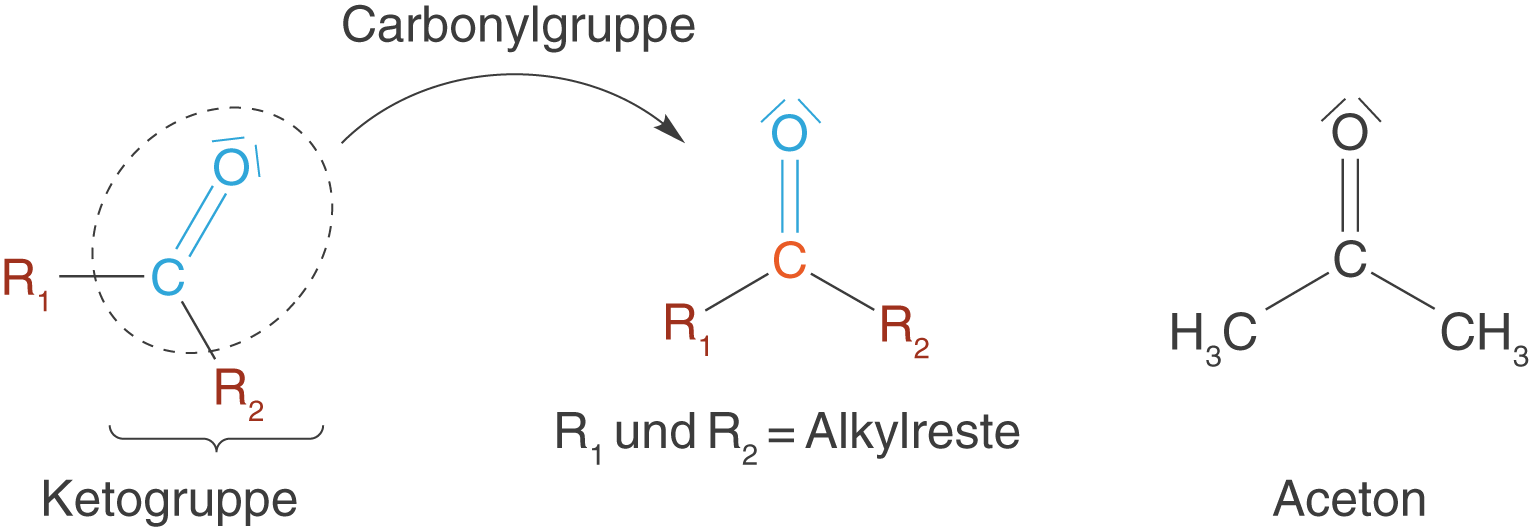
Sind beide Substituenten der Carbonylgruppe Alkylreste, dann erhalten wir ein Keton (vgl. Abb. 10).
Ein prominentes Beispiel für ein Keton im ChemieLV--Basiswissen ist die Fructose in offenkettiger Form (vgl. Abb. 11).
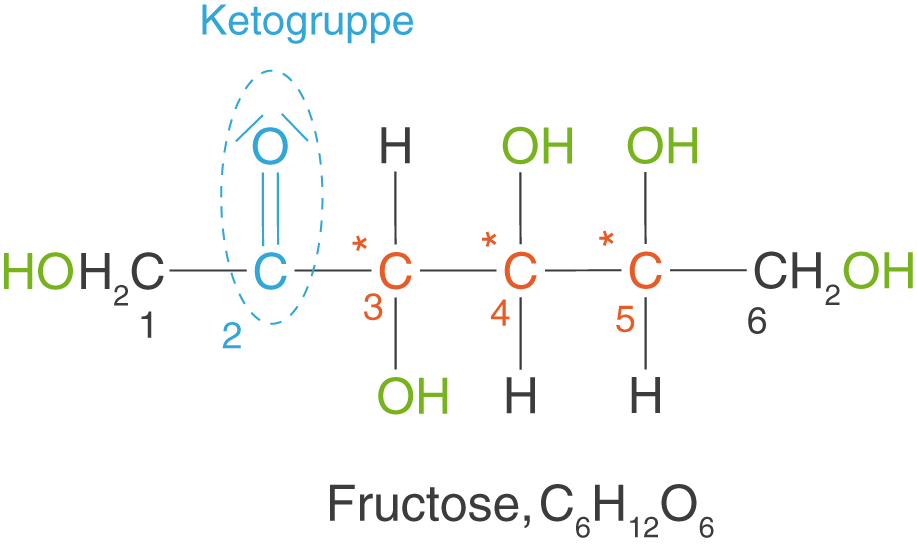
Hier befindet sich die Ketogruppe am C2-Atom.
Carbonsäuren
Carbonsäuren zeichnen sich durch die sogenannte Carboxygruppe () aus. Diese ist für den Säure-Charakter der Verbindung verantwortlich (vgl. Abb. 12).
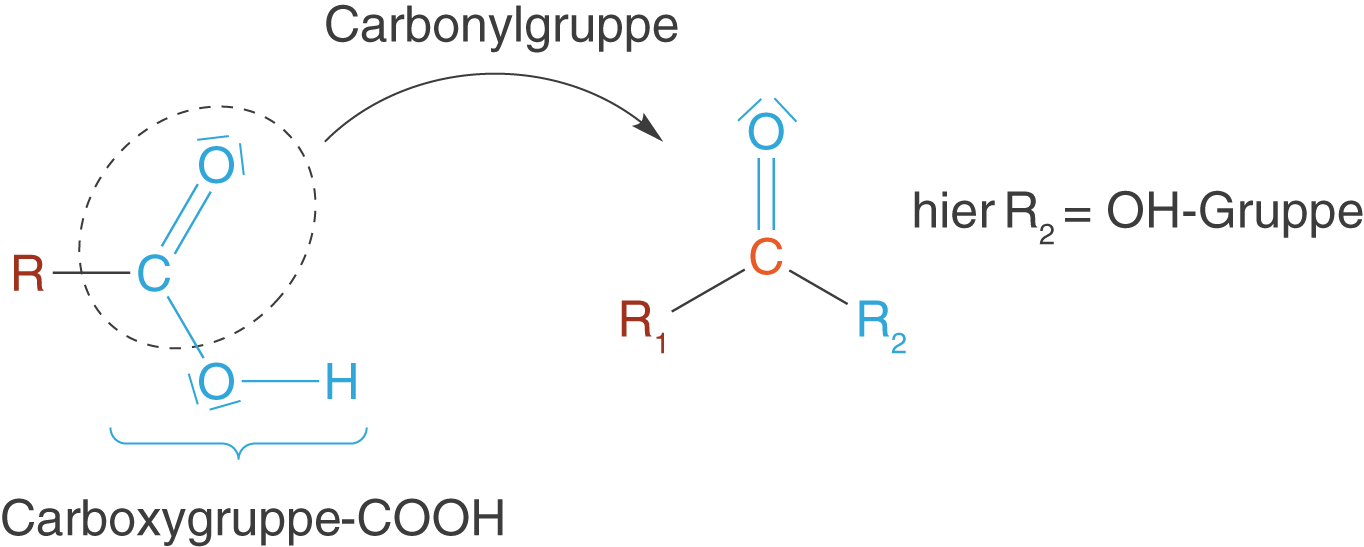
Im ChemieLV-Basiswissen spielen die Carbonsäuren insbesondere in zwei Bereichen eine zentrale Rolle: Einmal im Zusammenhang mit der Polykondensation, wo sie die Monomere der Polyester darstellen (vgl. ChemieLV-Skript Polymersynthese II: Polykondensation) und das andere mal im Zusammenhang mit den Aminosäuren, in welchen sie im Zusammenspiel mit der Aminogruppe () die Chemie dieser Verbindungen ganz maßgeblich mitbestimmen. Ein Stichwort ist an dieser Stelle das Zwitterion (vgl. ChemieLV-Skript Aminosäuren).
Säure-Base-Chemie von Carbonsäuren
Wir schauen uns beispielhaft die Säure-Base-Reaktion einer Carbonsäure () mit Wasser (
) an:
?;
Hierbei bildet sich ein Carboxylat-Anion. Die Carboxylate sind also die Salze der Carbonsäuren. Der saure Charakter der Carboxygruppe geht insbesondere auf die Mesomeriestabilisierung des Carboxylats zurück. Wir wollen uns dieses Phänomen am Beispiel der Essigsäure (Ethansäure) in Abbildung 13 anschauen.
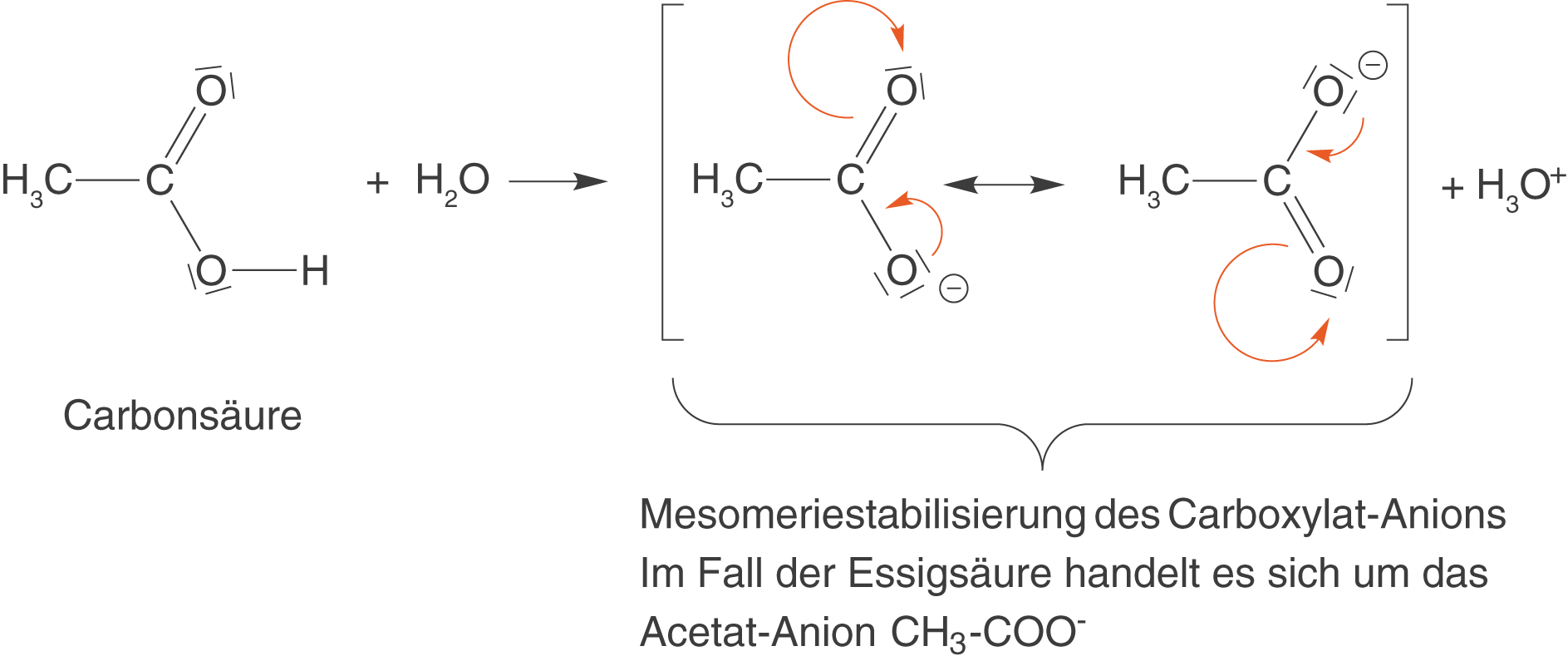
Die orangefarbenen Pfeile markieren den Weg der Elektronenpaare, um die jeweils andere Grenzformel zu erhalten. Wird die Essigsäure deprotoniert, dann erhalten wir die korrespondierende Base in Form des Acetat-Anions. Damit es nicht zur Verwirrung kommt: das Carboxylat-Anion ist im allgemeinen das Salz einer Carbonsäure, wohingegen das Acetat-Anion das Salz der Essigsäure ist. Dieses Acetat-Anion ist mesomeriestabilisiert, was wir durch die Abbildung 13 dargestellten Grenzformeln zeigen können. Das bedeutet, dass die Essigsäure relativ leicht ihr Proton abgibt, um somit das stabile obwohl geladene Acetat-Anion auszubilden.
Carbonsäuren und Kondensationsreaktionen
Im Rahmen des ChemieLV-Basiswissen taucht die Carbonsäure an zwei Stellen als Edukt einer Kondensationsreaktion auf: Im Fall der Veresterung und im Fall der Bildung einer Peptidbindung. Die Veresterung schauen wir uns im Abschnitt der Carbonsäureester an. Hier werfen wir einen kurzen Blick auf die Bildung der Peptidgruppe (vgl. Abb. 14).
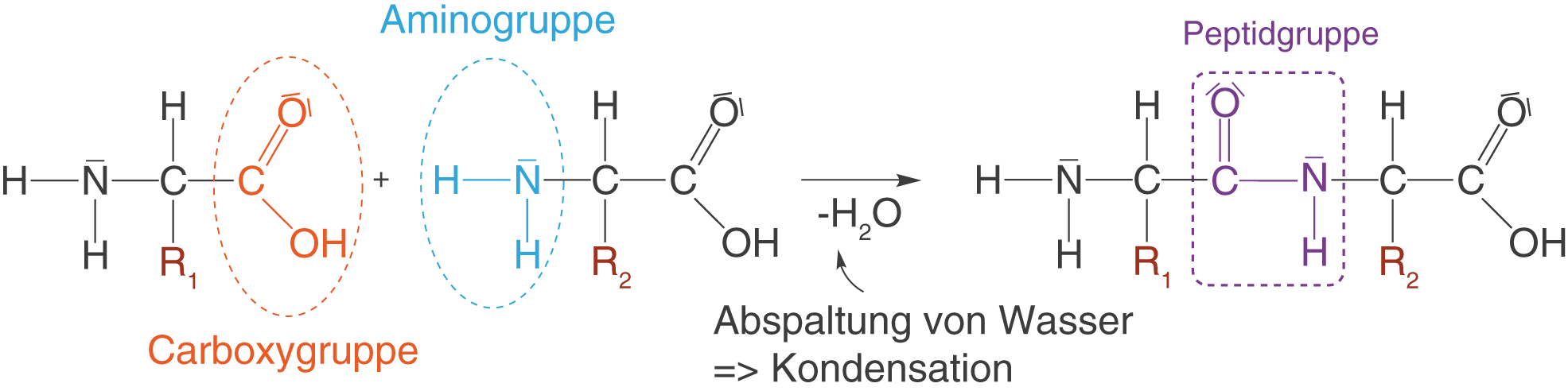
Bei einer Kondensationsreaktion wird ein niedermolekulares Spaltprodukt, also ein kleines Nebenprodukt gebildet, während sich zwei Edukte vereinigen. In diesem Fall liegt das niedermolekulare Spaltprodukt in Form von Wasser vor.
Carbonsäureester
Carbonsäureester sind die Ester der Carbonsäuren. Dabei unterscheidet sich die Molekülstruktur dadurch, dass das H-Atom der Carboxygruppe durch einen Alkylrest (Rest eines Kohlenwasserstoffs) ersetzt ist (vgl. Abb. 15).
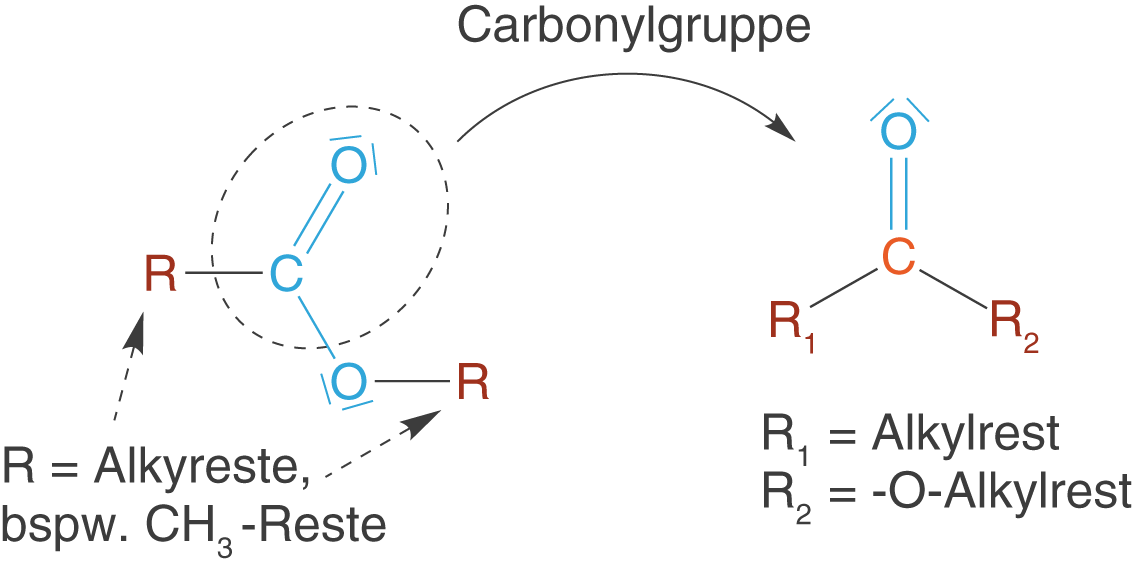
Es ist wichtig, dass die beiden Reste keine Wasserstoffatome sein dürfen bzw. insbesondere der Rest der an das Sauerstoffatom der ehemaligen OH-Gruppe bindet darf kein Wasserstoffatom sein, da wir in diesem Fall dann wieder eine Carbonsäure vorliegen hätten.
Die Veresterung und die Hydrolyse
Wir kommen nun zur zweiten wichtigen Kondensationsreaktion innerhalb des ChemieLV-Basiswissen: die Veresterung. Bei einer Veresterung reagieren eine Carbonsäure (\text{R}-\text{COOH}) und ein Alkohol () unter Abspaltung von Wasser zu einem Ester (
). Wir wollen uns diese Reaktion am Beispiel von Essigsäure und Methanol anschauen (vgl. Abb. 16).
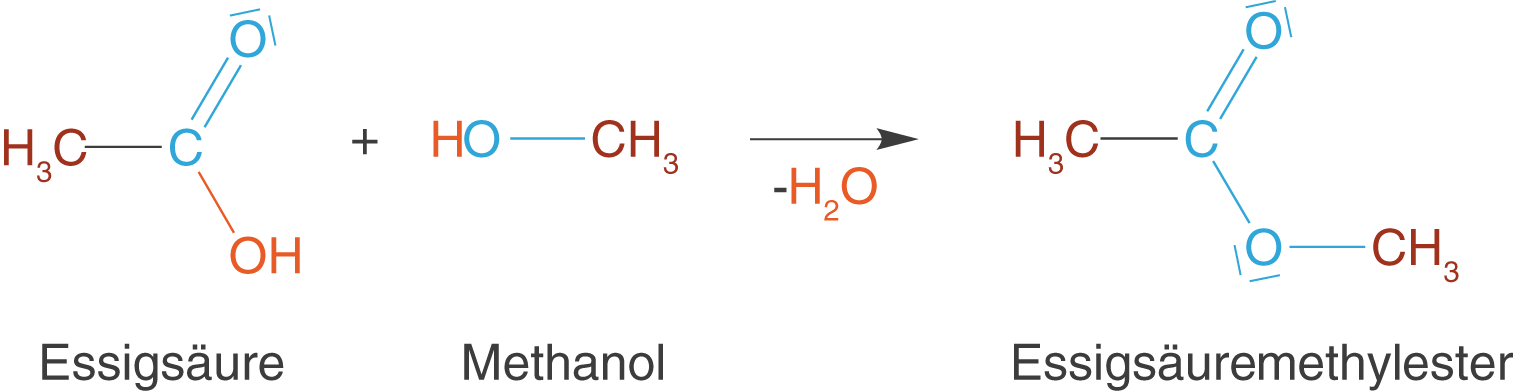
In Abbildung 16 sind alle relevanten Bereiche der Moleküle eingefärbt, sodass deutlich wird, welche Bestandteile sich nach der Reaktion wo befinden. Im Zusammenhang mit dem Carbonsäureester können wir zwei interessante Aspekte festhalten:
- Hier haben wir eine klassische nukleophile Substitution vorliegen: Der Alkohol ist das Nukleophil, welches am positiv polarisierten C-Atom der Carbonylgruppe der Carbonsäure angreift. Unter Wasserabspaltung entsteht dann der Carbonsäureester. Die
-Gruppe substituiert (ersetzt) somit die OH-Gruppe. Damit stammt das O-Atom mit dem Alkylrest vom Alkohol und nicht von der Säure.
- Im Kapitel 2.2 findest du diesen Hinweis bereits im Kasten am Ende des Kapitels. Die Veresterung von Mineralsäuren wie Schwefelsäure und in unserem speziellen Fall Phosphorsäure mit Alkoholen verläuft nicht so wie die Carbonsäureveresterung. Das O-Atom mit dem Alkylrest stammt dort nämlich von der Säure und nicht wie hier vom Alkohol!
Wollen wir den gerade gebildeten Ester wieder spalten, dann kommt die Hydrolyse ins Spiel. Während es sich bei der Veresterung um eine Reaktion handelte, die unter Abspaltung von Wasser (Kondensationsreaktion) ablief, führt im Fall der Hydrolyse die Reaktion mit Wasser zur Spaltung des Esters. Diese Reaktion findest du auch im ChemieLV-Skript Polymersynthese II: Polykondensation. In Abbildung 17 betrachten wir die hydrolytische Spaltung des Essigsäuremethylesters.
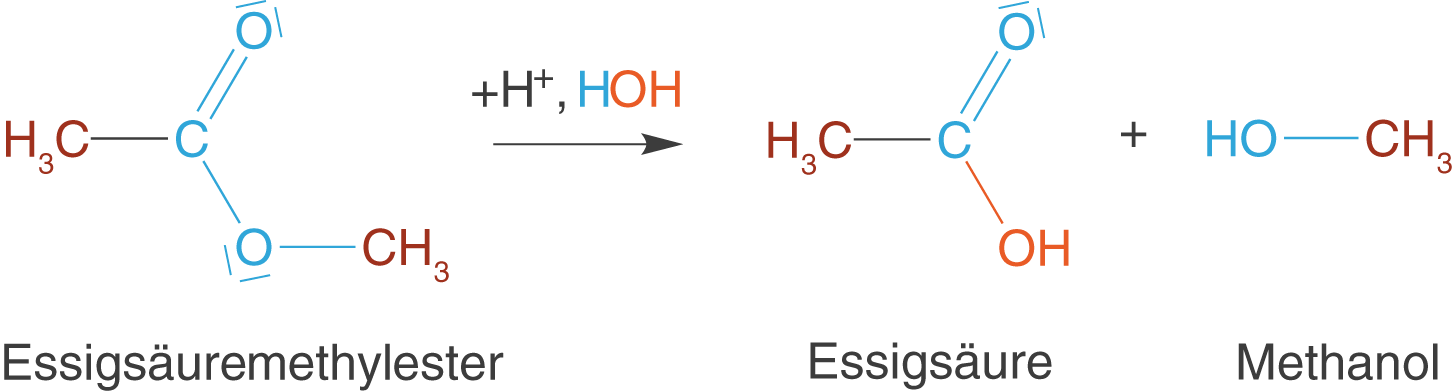
Wie du sehen kannst, taucht in der Reaktionsgleichung ein über dem Reaktionspfeil auf. Das bedeutet, dass diese Reaktion säurekatalysiert abläuft:
greift in die Reaktion ein, wird jedoch nicht verbraucht, sondern kommt unverändert aus der Reaktion hervor. Die Hydrolyse liefert uns dann wieder die Edukte unserer Kondensationsreaktion: Essigsäure und Methanol.
Zusammenfassung
- Die funktionelle Gruppe der Alkohole ist die Hydroxygruppe (
Gruppe).
- Die einfachsten Alkohole leiten sich von den Alkanen ab.
- Die Siedepunkte der Alkohole liegen im Vergleich zu ähnlichen Alkanen deutlich höher, da bei den Alkoholen Wasserstoffbrückenbindungen ausgebildet werden.
- Alkohole sind gute Nukleophile, d.h. sie reagieren gerne mit Atomen, die positiv geladen sind.
- Die Carbonylgruppe (
) besitzt ein positiv polarisiertes C-Atom wodurch sie anfällig für nukleophile Angriffe wird.
- Aldehyde besitzen die Aldehydgruppe
als funktionelle Gruppe und finden sich bspw. in der offenkettigen Form der Glucose wieder.
- Die funktionelle Gruppe der Ketone ist die Ketogruppe
, wobei es sich bei den Resten R um Alkylreste handelt. Ein bekanntes Molekül mit einer Ketogruppe ist Fructose.
- Carbonsäuren zeichnen sich durch eine Carboxygruppe (
) aus.
- Die Salze der Carbonsäuren nennt man Carboxylate. Diese sind mesomeriestabilisiert.
- Carbonsäuren reagieren in Kondensationsreaktionen mit Aminosäuren unter Abspaltung von Wasser zu Peptiden.
- Carbonsäureester sind an der Estergruppe
zu erkennen, wobei die Reste R und R‘ jeweils Alkylreste sind.
- Carbonsäureester sind das Produkt einer Kondensationsreaktion von Carbonsäuren und Alkoholen.
- Die Spaltung der Esterbindung wird als Hydrolyse bezeichnet.