PSE-Einführung
Definition
Das Periodensystem der Elemente, kurz auch PSE, umfasst alle experimentell gefundenen Elemente und ordnet diese nach steigender Protonenzahl. Dabei handelt es sich nicht etwa nur um die Elemente, die jemals auf der Erde gefunden wurden, sondern allgemein um alle Elemente die im Universum zu finden sind! Das bedeutet, dass der Wasserstoff auf der Erde mit seinen Eigenschaften identisch zu einem Wasserstoffmolekül in einem Sternennebel irgendwo im Universum ist.
Das PSE ist der beste Freund und Helfer des Chemikers. Wir interessieren uns für die Reaktivität der Elemente und den daraus aufgebauten Molekülen, folglich ist es notwendig einen Überblick über die existierenden Elemente zu haben und Gemeinsamkeiten zu erkennen. Im Rahmen des ChemieLV - Themengebiets Grundlagen - Periodensystem der Elemente wollen wir uns mit dem Aufbau des PSE beschäftigen und insbesondere lernen es zu lesen. Dieses Vorhaben wollen wir in drei Skripten umsetzen, die im Folgenden aufgezählt sind:
- Einführung und Grundlagen zum PSE
- Gruppen, Tendenzen und Reaktivität
- Steckbriefe ausgewählter Elemente
Dieses Themengebiet unterscheidet sich ein wenig von den anderen: Das vorliegende Skript legt die Grundlagen bzgl. der Anordnung der Elemente im Periodensystem. Weiterhin konzentrieren wir uns hier auf die allgemeine Struktur des PSE, wollen also lernen, wie wir uns darin zurechtfinden können. Im zweiten Skript gehen wir dann explizit auf Eigenschaften der Elemente ein und beschäftigen uns mit den Tendenzen dieser Eigenschaften im PSE. Hierbei kommen wir dann auf die Oktettregel und die Edelgaskonfiguration zu sprechen und betrachten die Ionisierungsenergie, die Elektronegativität, die Elektronenaffinität sowie die Atomradien. Das letzte Skript in dieser Reihe beschäftigt sich dann mit ausgewählten Elementen, ihren Eigenschaften und Hinweisen auf ihre Reaktivität. Dieses kannst du als Anwendung der Inhalte der ersten beiden Skripte verstehen. Zusammengefasst bedeutet das, dass zwar jedes Skript für sich alleine stehen kann und wir die entsprechenden Themen jeweils geschlossen abhandeln, dennoch sind die Informationen aller drei Skripte relevant einen Einblick und Überblick in und über das PSE zu erhalten.
Entwicklung des PSE
Das Periodensystem der Elemente wurde in seiner heutigen Form im späten 19. Jahrhundert entwickelt (zwischen 1864 und 1870). Hierbei spielten zwei Wissenschaftler eine zentrale Rolle: der russische Chemiker Dimitri Mendelejew und der deutsche Chemiker Julius Lothar Meyer (vgl. Abb. 1). Mendelejew ordnete die Elemente in seinem Periodensystem nach aufsteigender Atommasse an und fasst Elemente mit ähnlichen Eigenschaften zusammen, indem er sie in Spalten untereinander schrieb. Der große Triumph seiner Arbeit lag darin begründet, dass er auf der Grundlage seines Vorgehens die Existenz bisher unbekannter Elemente vorhersagen konnte. Zusätzlich war es ihm ebenfalls möglich die Eigenschaften dieser Elemente im Zusammenhang mit seiner Anordnung einzugrenzen. Im Detail handelte es sich hierbei um die Elemente Gallium, Scandium und Germanium. Zur gleichen Zeit entwickelte der deutsche Chemiker Julius Lothar Meyer ebenfalls eine solche tabellarische Darstellung der bis dahin bekannten Elemente. Diese verwendete er jedoch zu Beginn nur in seinen eigenen Vorlesungen und veröffentlichte eine verbesserte Darstellung um 1870, angeregt durch die Arbeiten von Dimitri Mendelejew. Im Jahr 1870 hatte das Periodensystem der Elemente nach weiteren Verbesserungen Mendelejews im weitesten Sinne seine heutige Form erreicht.

Der Aufbau des PSE
Das PSE ist der beste Freund und Helfer des Chemikers. Ganz prinzipiell finden wir hier die relevantesten Informationen zu allen existenten Elemente. Dementsprechend bietet es sich an, wenn man dieses Wissen auch nutzen kann, d.h. wir müssen das PSE „lesen“ können. Ganz allgemein können wir das PSE in drei Blöcke unterteilen: die Hauptgruppen, die Nebengruppen sowie die Lanthanoide und Actinoide (vgl. Abb. 2).
Jede dieser drei Gruppen umfasst ihre typischen Elemente. Dass diese nicht willkürlich geordnet sind, sonder systematisch im PSE verzeichnet, wollen wir nun betrachten. Die Nebengruppen sowie die Lanthanoide und Actinoide sind ein wenig spezieller, insbesondere auch was ihre Eigenschaften angehen. Aus diesem Grund wollen wir uns in diesem Themengebiet vor allem mit den Elementen der Hauptgruppen beschäftigen.
Ordnung im PSE
Hauptgruppen und Perioden
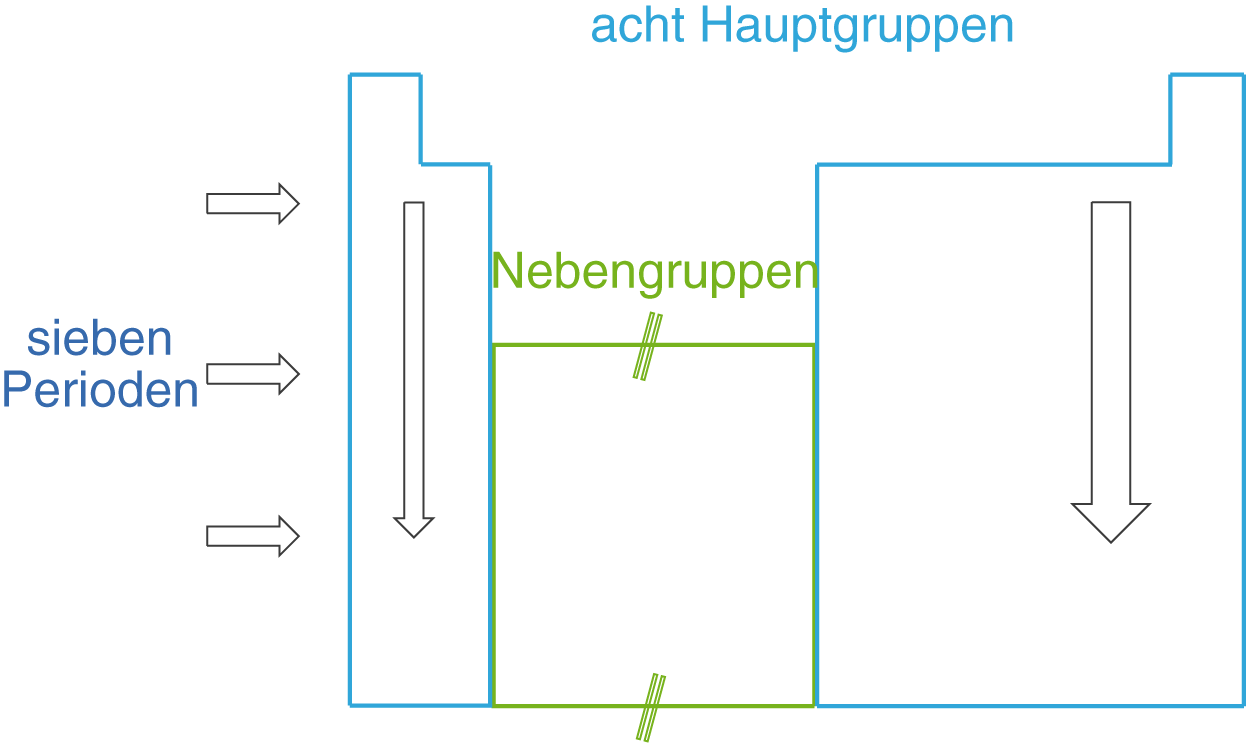
Wir beginnen mit dem schematischen Aufbau und betrachten anschließend die Details. Die Aufteilung des PSE erfolgt im ersten Schritt durch eine Einteilung in
- senkrechte Spalten: die Hauptgruppen
- waagrechte Reihen: die Perioden
Diese Einteilung führt auf acht Hauptgruppen und sieben Perioden (vgl. Abb. 3)
Die acht Hauptgruppen umfassen jeweils eine spezielle Gruppe von Elementen, die mit folgenden Namen bezeichnet werden:
- Hauptgruppe: Alkalimetalle
- Hauptgruppe: Erdalkalimetalle
- Hauptgruppe: Borgruppe
- Hauptgruppe: Kohlenstoff-Silicium-Gruppe
- Hauptgruppe: Stickstoff-Phosphor-Gruppe
- Hauptgruppe: Chalkogene
- Hauptgruppe: Halogene
- Hauptgruppe: Edelgase
Ordnung der Elemente
Jedes Atom ist aus einem Atomkern und einer Elektronenhülle aufgebaut. Der Atomkern besteht weiterhin aus positiv geladenen Protonen und ladungsneutralen Neutronen.
Die Anordnung der Elemente erfolgt von links nach rechts. Somit erhalten wir die oben dargestellte Struktur des Periodensystems.
Kenngrößen der Elemente
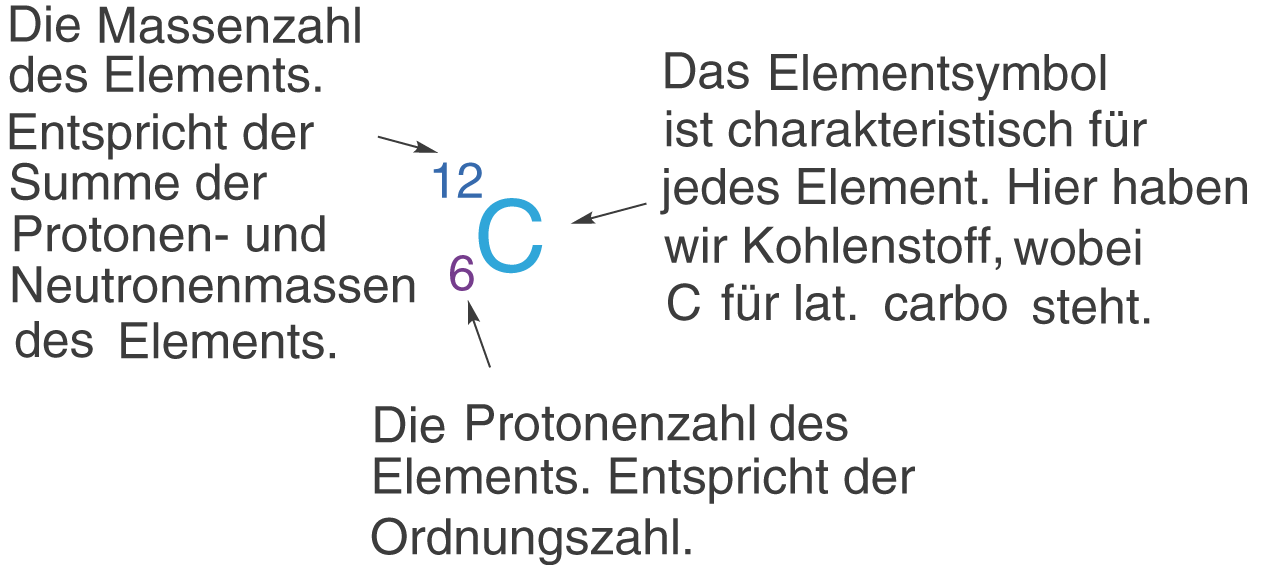
Die Protonenzahl Z und die Massenzahl A
Wir betrachten nun ein einzelnes „Elementkästchen“ und die wichtigsten dargestellten Informationen.
Die Massenzahl A gibt uns Informationen bezüglich der Masse eines Elements. Diese Masse trägt im PSE die Einheit u, was für unified atomic mass unit steht. Dabei entspricht ein unit genau der Masse des C - 12 Isotops des Kohlenstoffs. Da diese Größe uns relativ wenig sagt, können wir die SI-Einheit Kilogramm heranziehen:
Die Neutronenzahl N
Aus der Massenzahl A erhalten wir die Anzahl der Neutronen im Kern. Die Neutronenzahl N berechnet sich wie folgt:
Die Neutronenzahl N ist folglich die Differenz zwischen der Protonenzahl Z und der Massenzahl A.
Achtung: Es kann gut vorkommen, dass du im Periodensystem Massenzahlen siehst, die keine ganzen Zahlen aufweisen. Beispielsweise hat Kohlenstoff wenn man es genau nimmt eine Massenzahl von . Dieser Wert geht darauf zurück, dass hier die Massen der Isotope des Kohlenstoffs anteilsmäßig berücksichtigt wurden (vgl. ChemieLV-Skript Atommodell - Atommodelle und die Elektronenstruktur von Atomen).
Elektronenzahl
Ein weiterer sehr wichtiger Aspekt liegt auf der Anzahl von Protonen und Elektronen in einem Atom. Wir wissen bereits, dass uns die Ordnungszahl Auskunft über die Protonenzahl gibt. Des Weiteren ist bekannt, dass Atome elektrisch neutral sind. Diese elektrische Neutralität kommt dadurch zu Stande, dass sich die Protonenladungen und Elektronenladungen gerade ausgleichen (vgl. ChemieLV-Skript Atommodell-Atommodelle und die Elektronenstruktur von Atomen).
Die Elektronenkonfiguration und das PSE
Als Chemiker interessieren wir uns vor allem für die Elektronen, da diese und ihr Verhalten die Grundlage der Chemie bilden. Die Möglichkeit der Anordnung der Elemente im PSE geht insbesondere auf die Elektronenkonfiguration der Elemente zurück, die in vergleichbaren Eigenschaften resultiert. Gehen wir beispielsweise die zweite Periode entlang, dann passieren wir jede Hauptgruppe einmal. Dabei erhalten wir für jedes Element ein Elektron mehr auf der Valenzschale als beim vorhergehenden Element. Lithium (Li) weist bspw. ein Valenzelektron auf, während es bei Beryllium (Be) bereits zwei sind. Dieser Trend setzt sich fort bis im Fall von Neon (Ne) die Anzahl von acht Valenzelektronen erreicht ist. Gehen wir in die dritte Periode, dann wiederholt sich dieses Spiel von vorne. Damit können wir folgende Besonderheit festhalten:
- In den Hauptgruppen wiederholen sich die Valenzelektronenzahlen in jeder Periode, was die chemische Ähnlichkeit der Elemente einer Hauptgruppe erklärt.
- Die Systematik des PSE liegt also nicht nur in den Atommassen begründet, sondern insbesondere auch in den vergleichbaren Eigenschaften der Element bzgl. ihrer Valenzelektronenzahl.
Zusammenfassung
- Das PSE geht auf den russischen Chemiker Dimitri Mendelejew und den deutschen Chemiker Julius Lothar Meyer zurück.
- Im PSE sind alle experimentell nachgewiesenen Elemente aufgeführt.
- Das PSE gliedert sich in die Haupt- und Nebengruppen sowie die Lanthanoide und Actinoide.
- Es gibt acht senkrechte Hauptgruppen und sieben waagrechte Perioden.
- Die Elemente sind im PSE nach steigender Protonenzahl geordnet.
- Die Protonenzahl wird auch als Ordnungszahl Z bezeichnet.
- Die Massenzahl A ergibt sich als Summe der Protonenzahl und der Neutronenzahl.
- Die Massenzahl wird in der unified atomic mass unit angegeben. Ein u entspricht
des Gewichts des C-12 Isotops. Damit entspricht
ungefähr der Masse eines Kernbausteins.
- „Krumme“ Zahlen im Bezug auf die Massenzahl kommen durch die anteilsmäßige Berücksichtigung der Isotopenmassen zustande.
- Die Protonenzahl eines Elements entspricht seiner Elektronenzahl, da ein Atom elektrisch neutral ist.