Katalysator
Einführung
Bevor wir uns nun genauer mit dem Begriff des Katalysators auseinandersetzen wollen, knüpfen wir hier an das letzte Kapitel an. Im Rahmen der Reaktionsgeschwindigkeit sind wir auf so genannte kinetisch gehemmte Gleichgewichtssysteme gestoßen - also solche Gleichgewichtssysteme, bei denen die Reaktionen durch zu hohe Aktivierungsenergien nicht ablaufen können. Dieser Umstand führt dazu, dass die Reaktionsgeschwindigkeit sehr klein wird und die Reaktion somit quasi nicht stattfindet.
Bevor wir dieses Problem mit Hilfe der Katalyse lösen werden, ziehen wir noch einmal die Knallgasreaktion heran, um die Problematik daran im Detail zu betrachten, was uns bereits eine grundlegende Richtlinie für den erfolgreichen Einsatz von Katalysatoren liefern wird.
Formulieren wir an dieser Stelle das Massenwirkungsgesetz (vgl. ChemieLV--Skript Das Massenwirkungsgesetz) für diese Reaktion, dann erhalten wir:
Das chemische Gleichgewicht liegt in diesem Fall weit auf der Seite des Produkts. Dennoch läuft diese Reaktion nicht ab, solange sie nicht durch die Zufuhr von Energie aktiviert wird. Diese Reaktion ist thermodynamisch gesehen möglich, wird jedoch durch eine hohe Aktivierungsenergie daran gehindert abzulaufen. Man sagt auch, die Reaktion ist kinetisch gehemmt.
Viele Reaktionen, die entweder im technischen oder biologischen Sinn von grundlegender Bedeutung sind, sind mit dieser Situation vergleichbar. Abhilfe schaffen Katalysatoren, deren Wirkungsweise wir im Folgenden detaillierter betrachten wollen.
Der Katalysator
Katalysatoren sind Verbindungen, die in den Reaktionsmechanismus eingreifen, durch die Reaktion aber nicht verbraucht werden. Ein Katalysator geht unverändert aus einer Reaktion hervor.
Wir betrachten in diesem Skript einen beispielhaften Katalysator Kat. Der einleitenden Satz enthält zwei zentrale Aussagen, die Katalysatoren charakterisieren.
- Katalysatoren verändern den Reaktionsmechanismus einer Reaktion. Der neue Reaktionsmechanismus läuft energetisch gesehen unter günstigeren Bedingungen ab: Die Aktivierungsenergie wird gesenkt.
- Katalysatoren greifen zwar aktiv in die Reaktion ein, werden jedoch nicht verbraucht. Diese Verbindungen sind folglich nicht Teil des Produkts, sondern gehen unverändert aus der Reaktion hervor.
Unkatalysierte Reaktionen
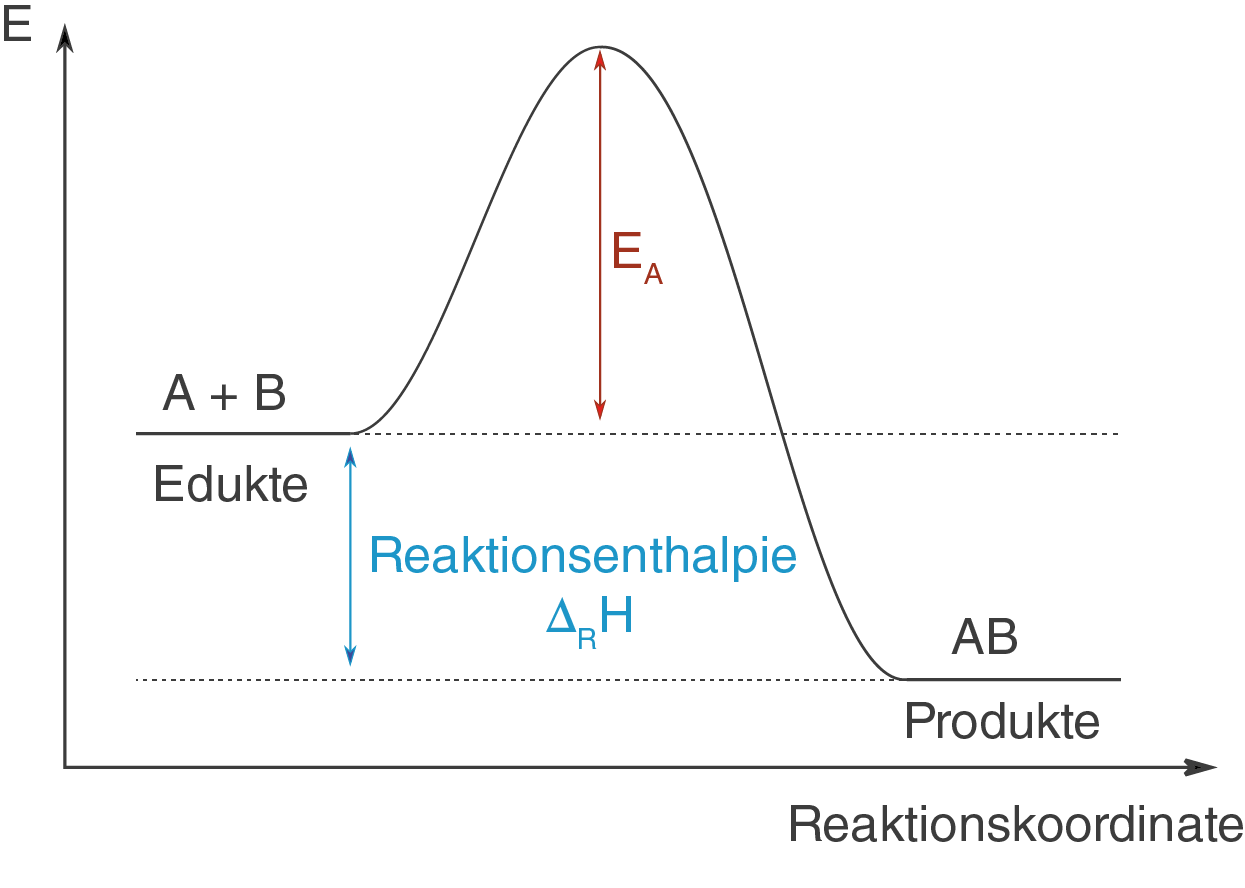
Die beiden Edukte A und B sollen unkatalysiert zur Reaktion gebracht werden.
Hierbei handelt es sich nun beispielhaft um eine kinetisch gehemmte Reaktion, die ohne eine gewisse Aktivierungsenergie nicht ablaufen wird. Vergleiche hierzu Abbildung 1:
Die Reaktion der beiden Edukte und
zum Produkt
wird so nicht stattfinden, da die Aktivierungsenergie
zu hoch ausfällt. In vielen Fällen ist es aber notwendig, dass Reaktionen ablaufen, ohne dass enorme Mengen an Aktivierungsenergie notwendig sind. Abhilfe schaffen Katalysatoren.
Katalysierte Reaktionen
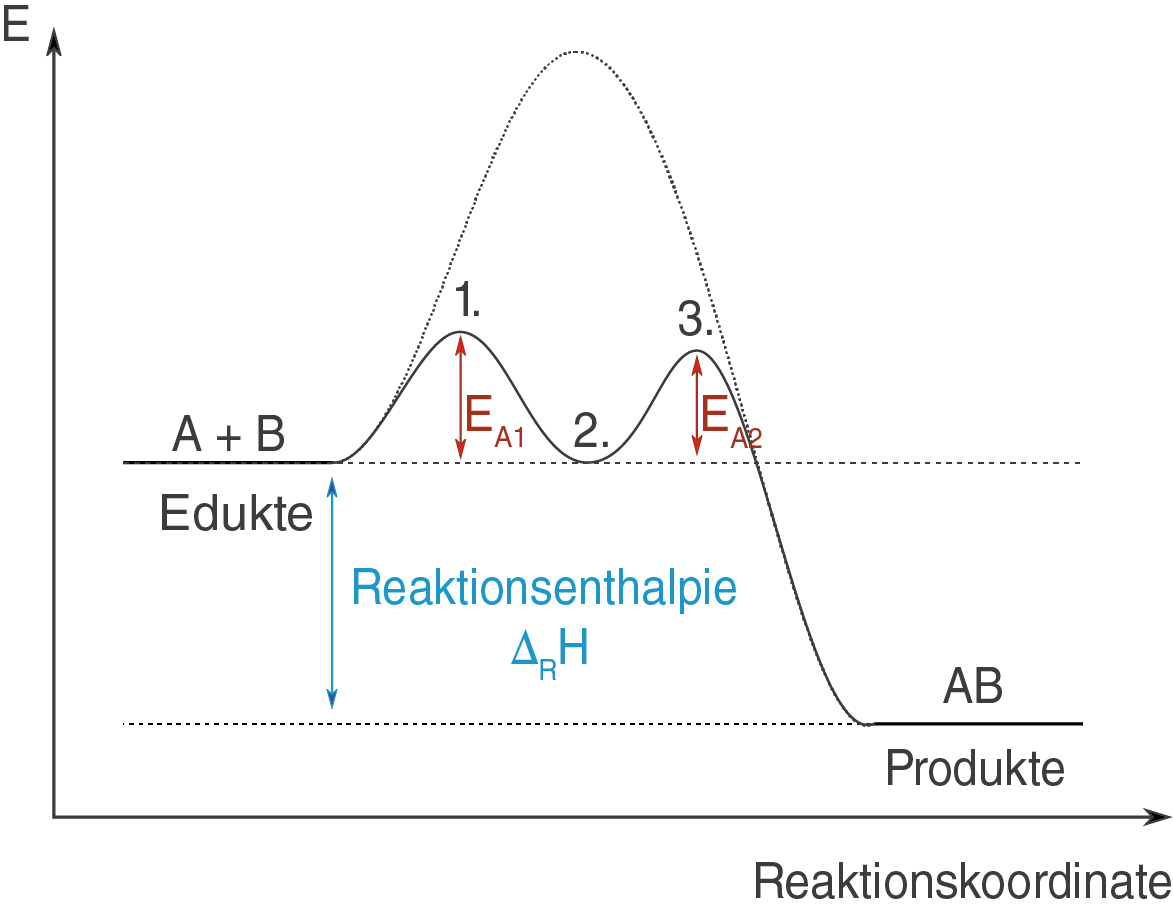
Wir wollen zunächst das Energiediagramm für diese katalysierte Reaktion heranziehen (vgl. Abb. 2) und daran die Wirkungsweise des Katalysators diskutieren.
Wir betrachten nun die gleiche Reaktion wie vorhin, mit dem großen Unterschied, dass wir einen Katalysator Kat verwenden. Formulieren wir zu dieser Reaktion eine Reaktionsgleichung, dann lautet diese folgendermaßen:
Um die Wirkungsweise des Katalysators zu verstehen, wollen wir diese Reaktion nun in ihre Einzelschritte zerlegen und mithilfe von Abbildung 2 erklären.
1. SchrittStatt in einem Schritt, läuft die katalysierte Reaktion in zwei Schritten ab: Der Mechanismus der Reaktion wird durch den Katalysator verändert. Zunächst reagiert der Katalysator mit dem Edukt zu einem Zwischenprodukt
Kat:
Betrachte die markierten Positionen in Abbildung 2:
- Durch die Reaktion des Edukts
mit dem Kat bildet sich zunächst ein Übergangszustand (auch aktivierter Komplex) aus, der sich energetisch gesehen im Bereich des ersten Maximums befindet.
- Aus dem Übergangszustand heraus bildet sich ein stabiles Intermediat
Kat (Zwischenprodukt).
Durch die Änderung des Reaktionsmechanismus eröffnet sich ein neuer Reaktionspfad, der unter deutlich geringeren energetischen Anstrengungen beschritten werden kann.
Wichtig:Der Übergangszustand einer Reaktion stellt die Anordnung der Reaktanden zueinander dar, bei welcher die höchste potentielle Energie erreicht wird. Betrachte dies als Zusatzinformation, die zur Erklärung des Energieverlaufs dient. Im Rahmen der ChemieLV-Skripte werden wir jedoch nicht näher auf dieses Konzept eingehen.
2. Schritt
Anschließend reagiert das Intermediat Kat mit dem Edukt
unter Abspaltung des Katalysators Kat zum Produkt
. Die hierfür bereitgestellt Aktivierungsenergie wird mit
bezeichnet.
Der Katalysator geht unverändert aus der Reaktion hervor. Punkt (3.) in Abbildung 2 markiert das zweite Maximum des Energieverlaufs, an dem sich ein weiterer Übergangszustand ausgebildet hat. Dieser zerfällt im Anschluss in das gewünschte Produkt und den Katalysator Kat.
Im Bezug auf die beiden Schaubilder und die besprochenen Sachverhalte ergeben sich zwei weitere wichtige Aspekte:
- Die Gleichgewichtslage der betrachteten Gleichgewichtsreaktionen wird durch die Verwendung eines Katalysators nicht beeinflusst.
- Die Reaktionsenthalpie
der unkatalysierten und der katalysierten Reaktion ist bei gleichen Reaktanden gleich.
Wenn wir diesen Katalysator beispielsweise in das Gasgemisch der Edukte der Knallgasreaktion bringen, dann senkt dieser die Aktivierungsenergie und die Reaktion läuft explosionsartig ab.
Biokatalysatoren: Enzyme
Viele verschiedene biochemische Prozesse in lebenden Organismen, dazu gehören bspw. die Verdauung oder die Replikation von DNA, werden erst durch Katalysatoren ermöglicht. Solche Biokatalysatoren werden als Enzyme bezeichnet. Auf Grund ihrer enormen Relevanz in der Biochemie sollen sie hier nicht unerwähnt bleiben. Enzyme sind überwiegend Proteine, welche sowohl als Monomere, als auch als Oligomere vorkommen. Letztere bestehen dann aus Untergruppen.
Zwei Beispiele für Enzymgruppen sind die Oxidoreduktasen, welche Redoxreaktionen katalysieren, sowie die Hydrolasen, die Hydrolysen katalysieren. Bei der Hydrolyse handelt es sich um die Spaltung eines Moleküls durch die Anlagerung von Wasser.
Bei Interesse kannst du einen Blick ins Kapitel Enzyme des Basiswissens BiologieLV werfen. Dort findest du eine detaillierte Beschreibung der Biokatalysatoren und ihrer Wirkung mit vielen anschaulichen Beispielen.
Katalyse
Katalytische Prozesse lassen sich in zwei Klassen einteilen:
- Homogene Katalyse: Reaktanden und Katalysator befinden sich in der gleichen Phase
- Heterogene Katalyse: Reaktanden und Katalysator befinden sich in unterschiedlichen Phasen
Homogene Katalyse
Bei der homogenen Katalyse liegen Reaktanden und Katalysator in der gleichen Phase vor. In der Regel ist das bei der homogenen Katalyse die flüssige Phase, d.h. Katalysator und Edukte befinden sich in Lösung und sind miteinander mischbar. Ein Beispiel aus der anorganischen Chemie ist die katalytische Spaltung von Wasserstoffperoxid durch
-Ionen in Wasser und freien Sauerstoff:
Die -Ionen dienen hierbei als Katalysator, welcher die Spaltung von Wasserstoffperoxid unter moderaten Bedingungen möglich macht.
Heterogene Katalyse
Bei der heterogenen Katalyse liegen Reaktanden und Katalysator in unterschiedlichen Phasen vor. Die Reaktanden liegen hierbei meist als Flüssigkeiten oder in der Gasphase vor und werden an festen Katalysatoren zur Reaktion gebracht. Das bedeutet, dass diese Reaktion nur an der Phasengrenzfläche stattfindet. Deshalb ist eine entscheidende Eigenschaft dieser Katalysatoren die Größe und Beschaffenheit ihrer Oberfläche. Ein Vorteil bei der heterogenen Katalyse ist die relativ einfache Abtrennung des Katalysators vom Reaktionsgemisch.
Wir können die katalytische Spaltung von Wasserstoffperoxid auch als heterogene Katalyse durchfü,hren:
Als Katalysator wird hierbei Mangan(IV)-oxid verwendet, welches auch unter dem Trivialnamen Braunstein bekannt ist.
Eines der prominentesten Beispiele der heterogenen Katalyse wird im Rahmen des Haber-Bosch-Verfahrens angewandt um Ammoniak aus den Elementen Sauerstoff und Wasserstoff zu synthetisieren. Dieses Verfahren besprechen wir im letzten Skript dieses Basiswissens.
Zusammenfassung
- Katalysatoren sind Verbindungen, die den Reaktionsmechanismus so verändern, dass die benötigte Aktivierungsenergie gesenkt wird.
- Ein Katalysator wird während einer Reaktion nicht verbraucht, sondern geht unverändert aus ihr hervor.
- Die Gleichgewichtslage einer Reaktion wird durch den Einsatz von Katalysatoren nicht beeinflusst.
- Die Reaktionsenthalpie zwischen Produkten und Edukten wird durch Katalysatoren nicht verändert.
- Enzyme sind Biokatalysatoren und spielen eine zentrale Rolle in biochemischen Prozessen.
- Die Katalyse wird je nach Aggregatszustand der Reaktanden in homogene und heterogene Katalyse unterschieden.