PSE-Steckbriefe
Definition
Dieses Skript umfasst eine Auswahl von Elementen mit Informationen zu ihren Eigenschaften, ihrer Reaktivität und einer Auswahl wichtiger Verbindungen. Die Grundlagen für dieses Skript findest du in den ersten beiden Skripten des ChemieLV Themengebiets Das Periodensystem der Elemente: Einführung und Grundlagen zum PSE sowie Gruppen, Tendenzen und Reaktivität.
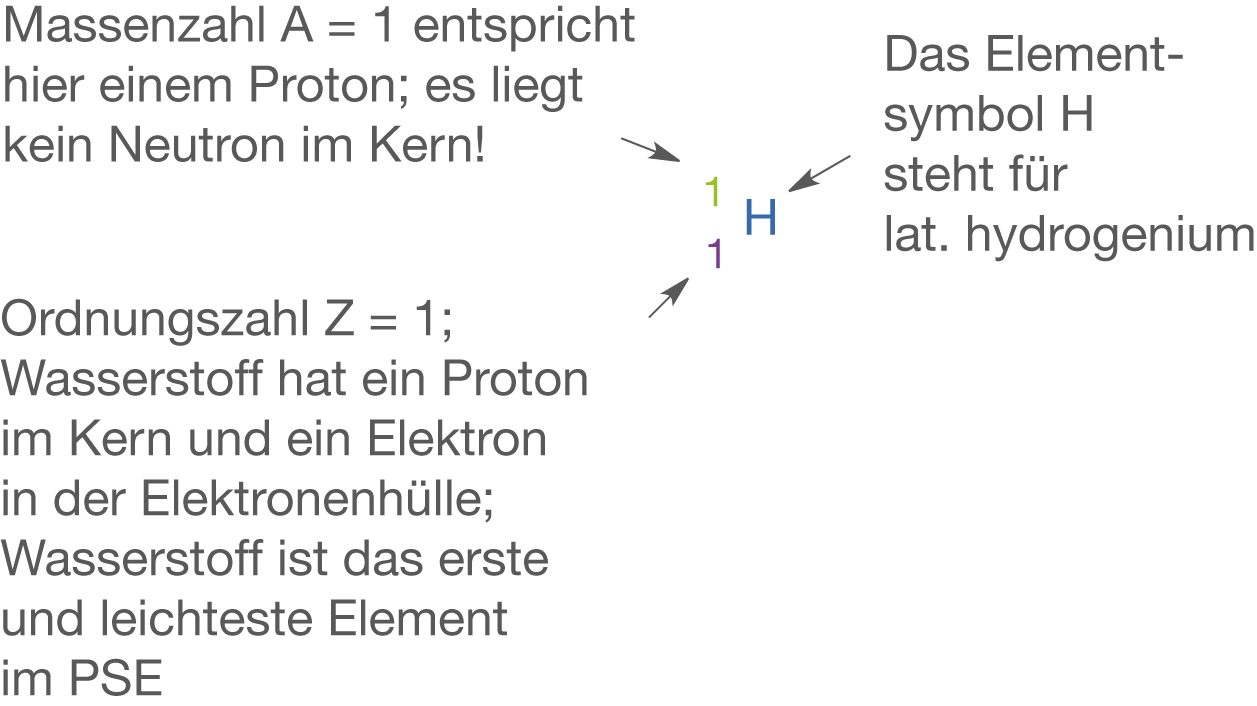
Wasserstoff 
Wasserstoff (vgl. Abb. 1) ist das leichteste aller Elemente im PSE. Das häufigste Isotop () weist genau ein Proton im Kern und ein Elektron in der Elektronenhülle auf. Die beiden anderen Isotope in Form von Deuterium
und Tritium
besitzen jeweils ein Neutron bzw. zwei Neutronen im Kern.
Elektronenstruktur und Eigenschaften
Elektronenstruktur und Position im PSE
Wasserstoff steht in der ersten Periode, weist also genau eine Schale auf. Diese ist mit einem Valenzelektron besetzt. Elementar liegt Wasserstoff in Form des zweiatomigen Moleküls vor. Somit ist die Oktettregel in diesem Fall für beide Bindungspartner erfüllt, da sie sich die Elektronen der Bindung teilen. An dieser Stelle könnten wir im Zusammenhang mit der Oktettregel nach der Elektronenaffinität von Wasserstoff fragen. Obwohl prinzipiell nur ein Elektron notwendig ist, um die Edelgaskonfiguration von Helium (He) zu erreichen, ist der Energiegewinn bei Wasserstoff im Vergleich zu den Halogenen deutlich geringer. Aus diesem Grund ist das sogenannte Hydrid-Anion
nur in Zusammenhang mit sehr starken Reduktionsmitteln, wie den Alkalimetallen realisierbar. Durch seine Position in der 1. Hauptgruppe nimmt Wasserstoff eine Sonderstellung im PSE ein. Es zählt nicht zu den Alkalimetallen sondern ist ein klassisches Nichtmetall.
Ionisierung und Grundlage der Säure-Base-Chemie nach Broensted
Obwohl Wasserstoff in der ersten Hauptgruppe steht, ist die Ionisierungsenergie deutlich höher, als bei den Alkalimetallen. Ionisieren wir ein Wasserstoffatom, dann entfernen wir das einzige Elektron aus der Elektronenhülle und erhalten effektiv ein einzelnes Proton, wobei wir hier nicht sondern
schreiben.
Die Säure-Base-Theorie nach Broensted baut auf den Konzepten der Protonendonatoren und -akzep-toren auf. Damit stellt das unscheinbare -Ion die Grundlage für die gesamte Säure-Base-Chemie nach Broensted dar, welche wir ausführlich im ChemieLV Themengebiet Säure- und Base-Gleichgewichte behandeln. Ein zentraler Aspekt liegt hierbei darauf, dass
-Ionen oder Protonen in wässrigen Phasen nie isoliert vorliegen. Sie treten immer in Zusammenhang mit Wasser in Form eines Oxonium-Ions auf.
Wichtige Verbindungen und deren Reaktivität
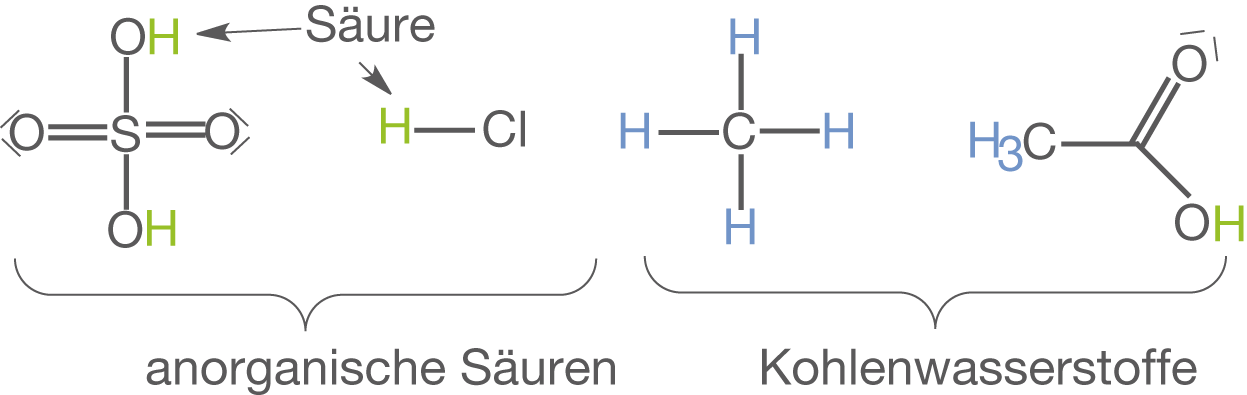
Wasserstoff tritt insbesondere in der organischen Chemie in nahezu allen Verbindungen auf, weshalb man in diesem Fall auch von Kohlenwasserstoffen spricht. Dabei schwankt die Reaktivität je nach der Position des H-Atoms. In jedem Fall ist es aber zentral für den Säure-Charakter vieler Verbindungen. Das wohl prominenteste anorganische Beispiel ist ganz klar Wasser . Daneben sind insbesondere auch anorganische Säuren wie bspw. Salzsäure (
), Schwefelsäure (
) und Salpetersäure (
) zu nennen. In Abbildung 2 sind einige der angesprochenen Verbindungen dargestellt.
Dies ist natürlich nur eine kleine Auswahl an Verbindungen, in welchen Wasserstoff vorkommt bzw. in denen dieser eine zentrale Rolle für die Reaktivität einnimmt. Daneben existieren natürlich auch exotischere Beispiele für Wasserstoffverbindungen wie die Metallhydride (MnH bspw.). In diesen nimmt Wasserstoff ausnahmesweise eine Oxidationszahl von an.
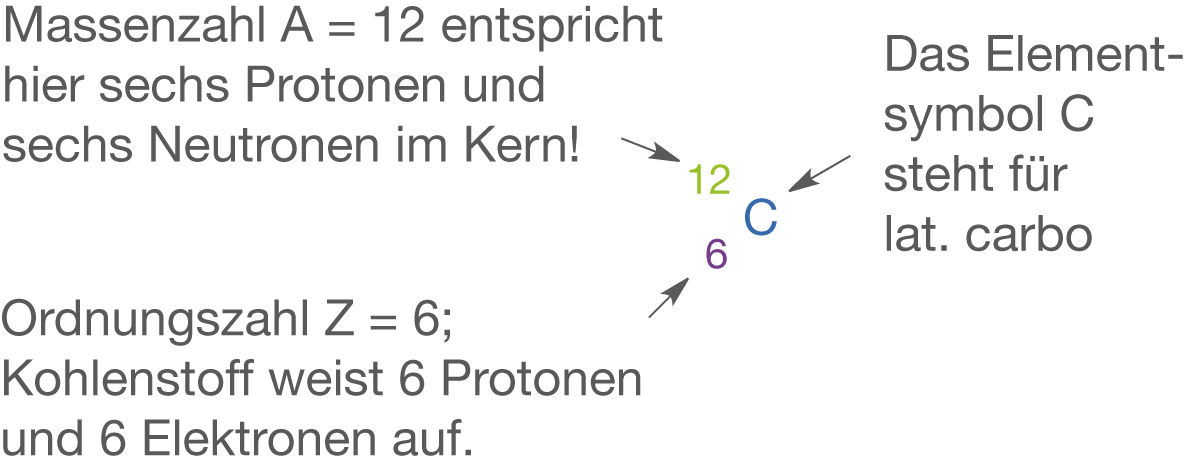
Kohlenstoff 
Kohlenstoff (vgl. Abb. 3) weist die Ordnungszahl 6 auf, steht in der 4. Hauptgruppe und zählt zu den Nichtmetallen. Damit liegen hier vier Valenzelektronen vor. Kohlenstoff ist ein extrem vielseitiges Element, welches unfassbar viele molekulare Strukturen ausbilden kann. Diese Vielseitigkeit ist dermaßen hoch, dass es innerhalb der Chemie sogar eine eigene Disziplin gibt, die sich primär nur mit der Chemie von Kohlenstoffverbindungen beschäftigt: die organische Chemie.
Elektronenstruktur und Eigenschaften
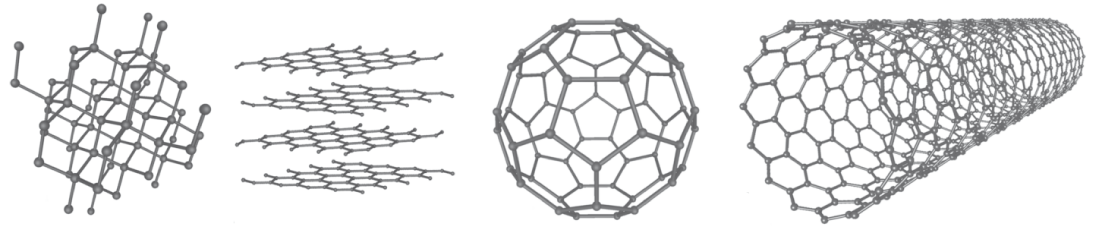
Um die Oktettregel zu erfüllen, kann Kohlenstoff vier Bindungen eingehen. Dadurch und durch das Bestreben sich mit vielen gleichartigen Atomen zu Verketten, erhalten wir eine große Strukturvielfalt. Beschränken wir uns auf reine Kohlenstoffverbindungen, dann finden wir beispielsweise folgende Strukturvarianten:
- Diamant: Jedes Kohlenstoffatom weist vier Nachbarn auf und ist tetraedrisch koordiniert.
- Graphit: Ist aus Schichten aufgebaut, wobei in jeder Schicht jedes Kohlenstoffatom von drei weiteren koordiniert wird.
- Graphen: Eine einzige Lage der Schichten von Graphit (vgl. hier Abb. 4 und denke dir eine einzige der vier dargestellten Lagen).
- Fullerene: Ballartige Strukturen. Das
-Fulleren wird auch als Buckyball bezeichent (nach dem amerikanischen Archtiekten Richard Buckminster Fuller).
- Nanoröhrchen: Röhrenförmige Strukturen, die aus „aufgerollten“ Graphen-Molekülen bestehen.
In Abbildung 4 sind einige der oben genannten Strukturen dargestellt:
Wichtige Verbindungen und deren Reaktivität
Zentral ist natürlich die Chemie der Kohlenwasserstoff in Form der organischen Chemie. Diese wollen wir aufgrund ihres Umfangs aber hier nicht weiter ansprechen. Grundlegende Informationen zu diesem Thema findest du in folgenden ChemieLV Themengebieten:
- Organische Chemie (umfasst in diesem Rahmen die Kohlenwasserstoffe, die Sauerstoffverbindungen sowie die Schwefel- und Stickstoffverbindungen).
- Aromaten
- Chemie der Makromoleküle (hier beschäftigen wir uns ausführlich mit Kunststoffen)
- Naturstoffe (dieses Themengebiet behandelt insbesondere biologisch relevante Makromoleküle und ihre Chemie)
Ausgewählte anorganische Kohlenstoffverbindungen
Wir wollen an dieser Stelle einen Blick auf eine Auswahl relevanter anorganischer Kohlenstoffverbindungen werfen. Hierbei schauen wir uns die Komponenten des Kohlensäure-Carbonat-Puffersystems an. Wir beginnen mit einem der gesellschaftlich gesehen wohl bekanntesten Moleküle: Kohlenstoffdioxid . Dieses taucht als Gas in der Erdatmosphäre auf. Löst sich dieses Gas in Wasser, dann erhalten wir die nächste relevante Verbindung: Kohlensäure
.
Dieses Gleichgewicht beschreibt den Prozess, der deinen Sprudel zum sprudeln bringt. zerfällt und gasförmiges
wird freigesetzt. Wir können sehen, dass Kohlensäure zwei H-Atome besitzt, die dieser Verbindung ihren Säurecharakter verleiht. Betrachten wir das erste Protolysegleichgewicht der Kohlensäure, dann erhalten wir eine weitere Verbindung: das Hydrogencarbonat
.
Im zweiten Protolysegleichgewicht wird das Hydrogencarbonat-Anion deprotoniert und wir erhalten das Carbonat-Anion .
Dieses Anion bildet die Grundlage für den Fluch aller Duschen und Bäder, den Kalk oder Calcit . Betrachten wir die oben dargestellten Reaktionen, dann erhalten wir zusammen mit dem Protolysegleichegwicht von Wasser zu
und
alle Komponenten des Kohlensäure-Carbonat-Puffers. Dieses Puffersystem ist zentral für die pH-Stabilität natürlich Gewässer oder Böden und lässt sich ebenfalls im Körper des Menschen finden, wo es dieselbe Rolle einnimmt.
Stickstoff 
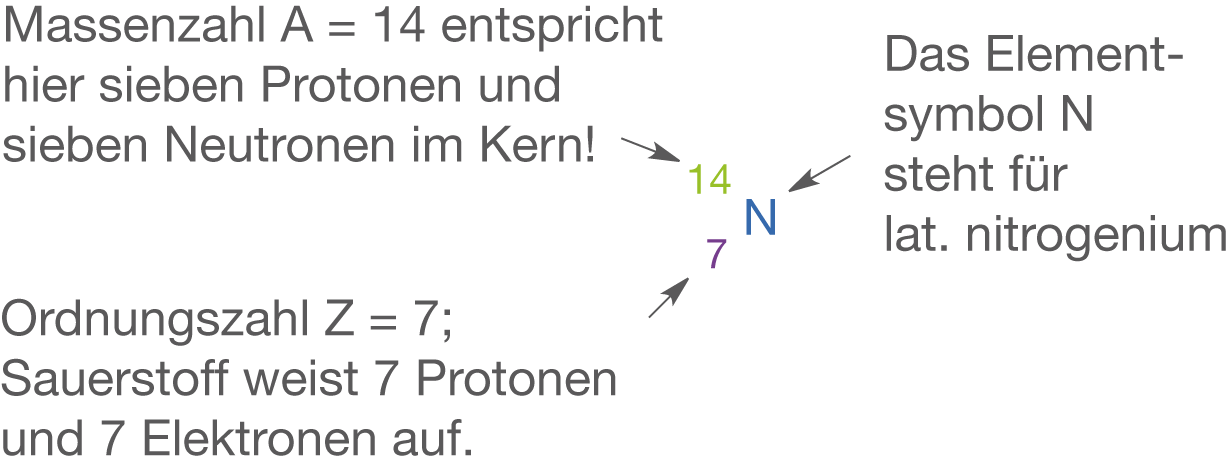
Stickstoff ist ein Element der 2. Periode, das in der 5. Hauptgruppe steht. Folglich hat es fünf Valenzelektronen. In Abbildung 5 siehst du das zugehörige Elementsymbol sowie Informationen zum Atomaufbau.
Elektronenstruktur und Eigenschaften
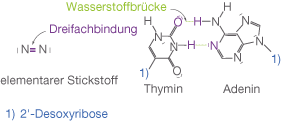
Stickstoff hat wie bereits erwähnt fünf Valenzelektronen. Das bedeutet, dass es bezüglich der Edelgaskonfiguration noch drei weitere Elektronen aufnehmen kann. Aus diesem Grund finden wir vor allem dreibindige Stickstoffverbindungen, die ein zusätzliches freies Elektronenpaar aufweisen. Eine wichtige Eigenschaft von Stickstoffverbindungen mit Wasserstoff tritt im Zusammenspiel mit der relativ hohen Elektronegativität des Elements und dem freien Elektronenpaar auf. Das Wasserstoffatom wird stark positiv polarisiert. Dementsprechend kann es mit anderen Protonenakzeptoren, Molekülen, die freie Elektronenpaare aufweisen, in Wechselwirkung treten. Hierbei bilden sich dann die bekannten Wasserstoffbrückenbindungen aus (vgl. Abb. 6). Die Relevanz dieser Wechselwirkung wird insbesondere am Beispiel der DNA deutlich. Die Doppelhelixstruktur wird durch Wasserstoffbrückenbindungen zusammemgehalten, die sich zwischen den Nukleobasen ausbilden. Elementar liegt Stickstoff in Form von vor (vgl. Abb. 6). In diesem Fall haben wir einen Dreifachbindung vorliegen, was bedeutet, dass Stickstoff in elementarer Form sehr widerstandsfähig ist - es ist sehr aufwendig die Dreifachbindung zu spalten.
Wichtige Verbindungen und deren Reaktivität
Stickstoff in der organischen Chemie
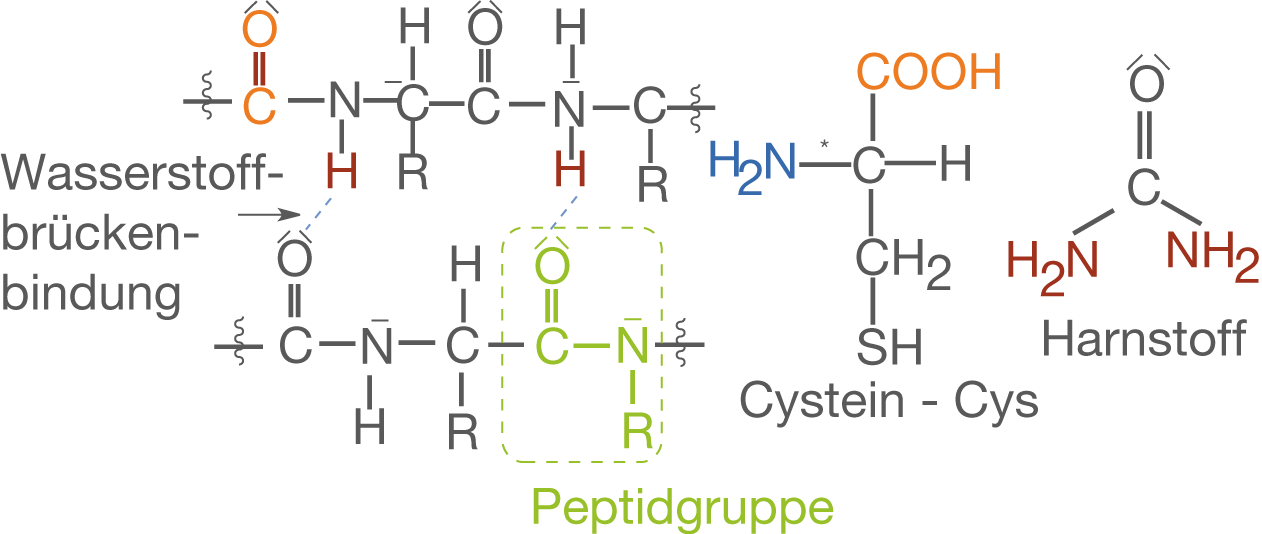
Im Zusammenspiel mit Kohlenstoff bildet Stickstoff einige Verbindungen aus, die insbesondere biologisch hochrelevant sind. Das klassische Beispiel sind hierbei die Aminosäuren in welchen der Stickstoff in Form einer Aminogruppe (-
) vorliegt. Aminosäuren werden durch die Reaktion von Aminogruppen und Carboxygruppen über die Peptidbindung (
-(CO)-HN-
) miteinander verknüpft. Somit entstehen in Form der Polypeptide die grundlegenden Strukturen der Proteine (vgl. Abb. 7).
Eine weitere, auch geschichtlich sehr interessante organische Stickstoffverbindung, ist der Harnstoff (vgl. Abb. 7). Dieser gilt als erste organische Verbindung, die aus rein anorganischen Edukten synthetisiert wurde.
Stickstoff in der anorganischen Chemie
Eines der prominentesten Beispiele für eine anorganische Stickstoffverbindung ist Ammoniak . In diesem Zusammenhang ist vor allem das Haber-Bosch-Verfahren zu nennen, welches die großindustrielle Ammoniaksynthese aus den Elementen und damit verbunden die Produktion von künstlichen Stickstoffdüngern ermöglichte. Einen wenig rühmlicheren Ruf haben die Stickoxide, die im Allgemeinen durch die Summenformel
dargestellt werden. Diese umfassen bspw. einfache Verbindungen wie
und
aber auch
(Lachgas). Stickoxide sind vor allem durch ihr problematisches Umweltverhalten bekannt. In der Atmosphäre tragen Stickoxide beispielsweise zu folgenden Prozessen bei:
- Ozonabbau
durch die Oxidation von
zu
.
- Saurer Regen durch die Bildung von Salpetersäure aus
und
.
- Klimaerwärmung; wird insbesondere durch Lachgas
gefördert (deutlich klimaschädlicher als
).
Sauerstoff 
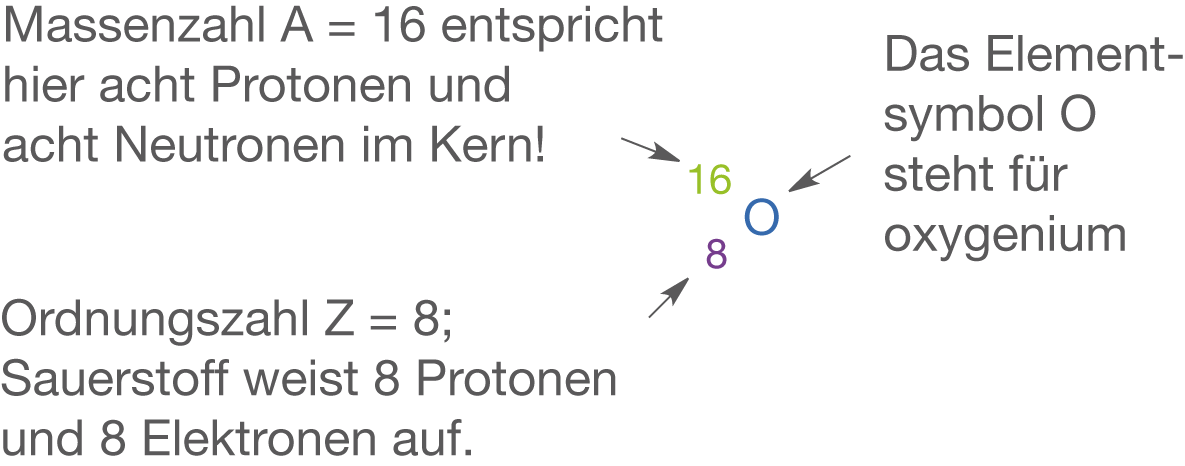
Sauerstoff (vgl. Abb. 8) steht in der 6. Hauptgruppe (Chalkogene), weist folglich sechs Valenzelektronen auf und ist das Element mit der Ordnungszahl 8. Sauerstoff ist ein gasförmiges Element und liegt elementar in Form eines zweiatomigen Moleküls vor. Im flüssigen Zustand, also bei ca. , weist Sauerstoff eine hellblaue Farbe auf. Des Weiteren gehört Sauerstoff wohl zu den gesellschaftlich bekanntesten Elementen, da wir ihn jeden Tag zum Atmen benötigen.
Elektronenstruktur und Eigenschaften
Wir bereits erwähnt liegt der Sauerstoff elementar in Form eines zweiatomigen Moleküls vor. Hierbei sind die beiden Sauerstoffatome durch eine Doppelbindung verbunden. Sauerstoff ist im allgemeinen ein starkes Oxidationsmittel, wobei der Begriff der Oxidation auf die Reaktion mit Sauerstoff zurückgeht. Eine der bekanntesten Reaktionen in dieser Hinsicht ist die Verbrennung im Zusammenhang mit Kohlenstoff:
Kohlenstoff wird durch Sauerstoff oxidiert, sodass als Produkt aus der Reaktion hervorgeht.
Wichtige Verbindungen und deren Reaktivität
Sauerstoff in der anorganischen Chemie
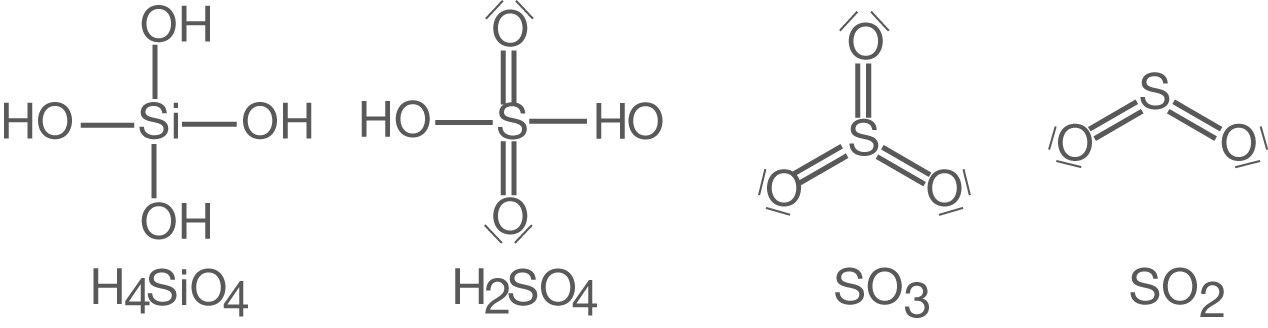
Sauerstoff kommt in einer weiten Bandbreite von anorganischen Verbindungen vor. Hierzu zählen beispielsweise Oxide und Hydroxide, wie und
, Silikate als Salze der Ortho-Kieselsäure (
) oder Schwefeloxide wie
,
oder
(vgl. Abb. 9).
Sauerstoff in der organischen Chemie
Auf Sauerstoff in organischen Verbindungen gehen wir ausführlich im ChemieLV-Skript Organische Chemie - Sauerstoffverbindungen ein.
Schwefel 
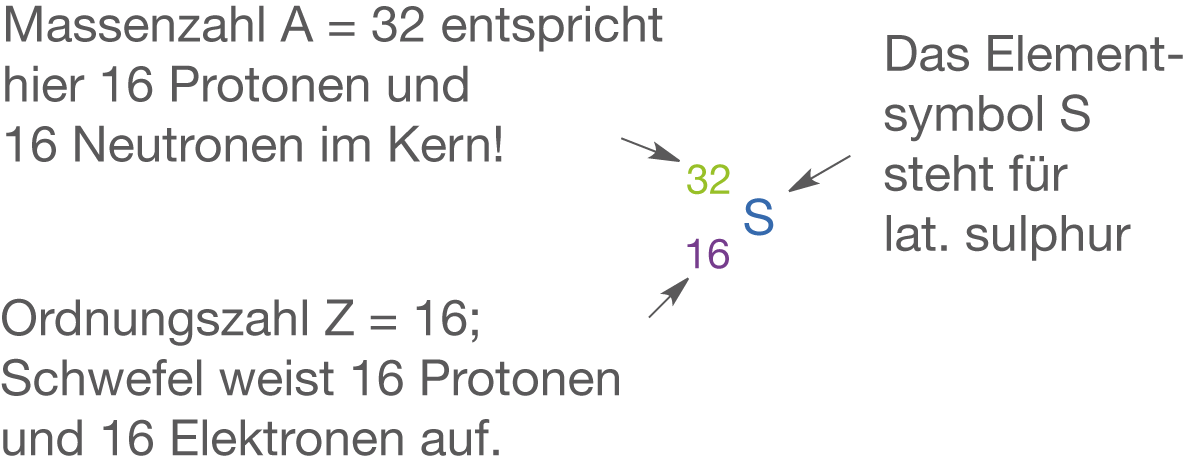
Schwefel (vgl. Abb. 10) ist wie Sauerstoff ein Element der 6. Hauptgruppe (Chalkogene) und besitzt folglich sechs Valenzelektronen. Im Gegensatz zum Sauerstoff befindet sich Schwefel jedoch mit der Ordnungszahl 32 in der dritten Periode.
Elektronenstruktur und Eigenschaften
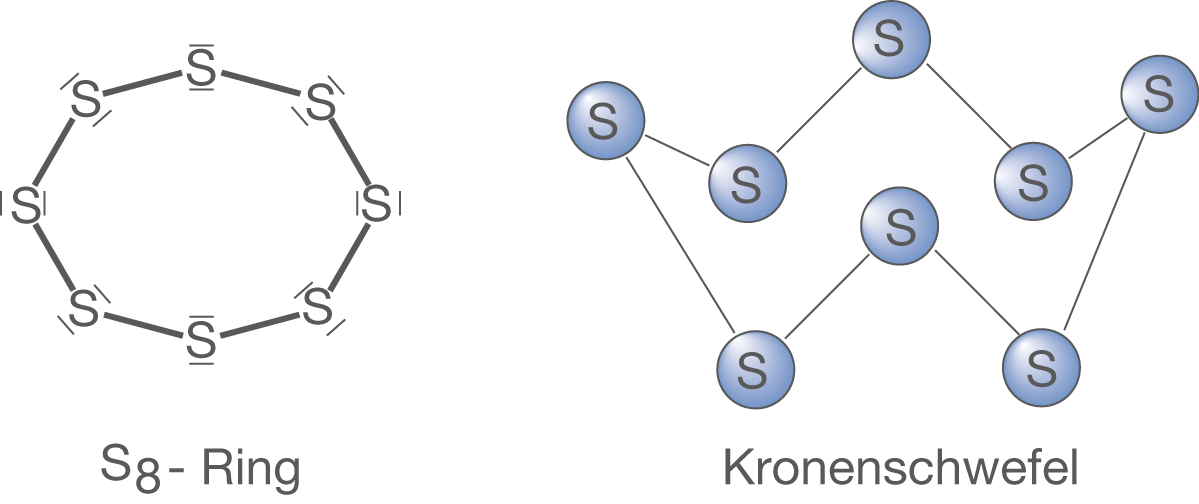
Schwefel bildet mit Vorliebe ring- oder kettenförmige Strukturen aus. Die stabilste Konfiguration des elementaren Schwefels ist ein -Ring, der aufgrund seiner Struktur auch Kronenschwefel genannt wird (vgl. Abb. 11).
Weitere Ringe sind die Verbindungen ,
und
.
und niedermolekulare Verbindungen sind dahingehend kettenförmig gebaut. Schwefel ist ein kristalliner Feststoff, der bei Normalbedingungen aus
-Ringen aufgebaut ist. Der Kronenschwefel in Form des
-Rings ist nicht sehr reaktiv, sondern eher träge.
Wichtige Verbindungen und deren Reaktivität
Schwefel in der anorganischen Chemie
Die anorganische Schwefelchemie ist sehr umfangreich, weshalb wir uns hier wieder nur auf ein paar einfache aber sehr relevante Verbindungen konzentrieren wollen. Dabei beschränken wir uns auf zwei Gruppen: die Sulfide und Polysulfide in denen Schwefel relativ niedrige Oxidationszahlen aufweist, sowie die Schwefeloxide, die wir bereits beim Sauerstoff kennen gelernt haben, in denen der Schwefel meist hoch oxidiert vorliegt. Das einfachste Sulfid leitet sich vom Schwefelwasserstoff
ab, der für seinen sehr unangenehmen Geruch nach „faulen Eiern“ bekannt ist. Dabei entsteht das
-Anion bspw. durch die Protolyse von
in Wasser:
Betrachten wir nicht nur ein Schwefelatom, wie in sondern
Schwefelatome, dann erhalten wir die Polysulfane
, deren Anionen die Polysulfide darstellen:
. Diese Schwefelverbindungen spielen insbesondere für die Chemie natürlicher Systeme, wie für die anoxischen Sedimente der Meere, eine zentrale Rolle. Durch Oxidation von Sulfiden erhalten wir Schwefeloxide. Ein wichtiges Beispiel ist hierbei die sogenannte Röstreaktion, in welcher Eisen(II)-disulfid (Pyrit) zu Eisen(III)-oxid (Hämatit) oxidiert wird, wobei als weiteres Produkt Schwefeldioxid
anfällt.
Eines der bekanntesten Schwefeloxide ist wohl das Salz der Schwefelsäure , das Sulfat
. Wenn sich Schwefeltrioxid
unter Anwesenheit von
in Wasser löst, dann bildet sich zunächst Dischwefelsäure
aus, die im Anschluss unter Anwesenheit von Wasser in
zerfällt.
Dies sind nur einige beispielhafte Verbindungen und ihr chemisches Verhalten; die Liste kann erschöpfend fortgeführt werden.
Schwefel in der organischen Chemie
Auf relevante Verbindungen des Schwefels in der organischen Verbindungen gehen wir im ChemieLV-Skript Organische Chemie - Stickstoff- und Schwefelverbindungen ein.
Uut, Uup, Uus und Uuo - die vier Neuen
„Das Periodensystem hat vier weitere Elemente!“ Das war am 4. Januar 2016 DIE Schlagzeile aus der Chemie.Entdeckt wurden diese vier Elemente der siebten Hauptgruppe bereits 2004 (Uut und Uup), 2006 (Uuo) und 2010 (Uus) von Forschergruppen in Asien, USA und Russland. Die Internationale Union für Reine und Angewandte Chemie (IUPAC) hat die Elemente erst jetzt offiziell anerkannt. Grund dafür ist, dass alle Elemente mit der Ordnungszahl größer als 104 nicht in der Natur vorkommen. Sie müssen künstlich erzeugt werden, sind radioaktiv und extrem kurzlebig. Ununtrium (Uut) Uut wurde von amerikanischen und russischen Wissenschaftlern in mehreren Versuchen bereits 2003 hergestellt und nachgewiesen. 2012 gelang dies auch einer japanischen Forschergruppe, welche über sechs
Für Ununtrium sind zwei weitere Isotope bekannt:
- 283Uut mit einer Halbwertszeit von 100 ms
- 284Uut mit einer Halbwertszeit von 0,48 s
Von Ununpentium sind fünf Isotope bekannt, welche eine Halbwertszeit zwischen 32 ms und 1 min haben. Ununseptium (Uus) Durch den Beschuss von Berkelium mit Calcium wurde 2010 am Vereinigten Institut für Kernforschung in Dubna (Russland) Ununseptium erzeugt. Bei diesem Beschuss entstanden sechs Isotope. Fünf Isotope wurden als 293Uus mit einer Halbwertszeit von 14 ms identifiziert. Das sechste Atom ist das Isotop 294Uus mit einer Zerfallszeit von 78 ms.
Die Synthese von Ununseptium gilt als der Höhepunkt des Joint-Ventures des Vereinigten Institut für Kernforschung und des Lawrence Livermore National Laboratory, welches 1989 gestartet wurde.
Ebenfalls nachgewiesen wurde Uus 2014 im GSI Helmholtzzentrum für Schwerionenforschung. Ununoctium (Uuo) Dies ist das momentan (Stand: Januar 2016) schwerste, bekannte Element, mit der Ordnungszahl 118. Im Jahr 2006 wurde dieses Element von einer Forschungsgruppe in Dubna (Russland) künstlich hergestellt. Und zwar entstehen durch den Beschuss von Californium mit Calcium-Ionen zwei verschiedene, superschwere Atomkerne. Nach dem Beschuss verschmelzen wenige dieser Atome für eine kurze Zeit und wurden als Element mit der Ordnungszahl 118 erkannt.
Auf Grund seiner Position im Periodensystem könnte 294Uuo den Edelgasen zugeordnet werden. Da dieses Element mit einer Halbwertszeit von 0,89 ms kurzlebig ist, kann allerdings nicht nachgewiesen werden, ob es bei Raumtemperatur tatsächlich gasförmig ist. Ununoctium liegt, wie Astat, außerdem auch auf der Diagonalen der Halbmetalle. Weitere Analysen und Nachforschungen sind notwendig um herauszufinden, welcher Gruppe Uuo zuzuordnen ist. Die Namensgebung wird von den jeweiligen Forschungsgruppen, gemäß den IUPAC-Regeln, beantragt. Demnach müssen die Namen nach einer Eigenschaft, einem Wissenschaftler, einem Mineral, einem Ort oder Land sowie einer mythologischen Gestalt benannt werden.
Wir sind gespannt, was aus Uut, Uup, Uus und Uuo wird und wie wir sie bald nennen dürfen.
Verändert durch SchulLV, CC-BY-SA 3.0