Aromatische Kohlenwasserstoffe
In diesem Skript beschäftigen wir uns mit der Stoffklasse der Aromaten. Wir werden uns die Struktur dieser Moleküle genau anschauen sowie ihre Besonderheit kennen und verstehen lernen.
Historisch gesehen sind die aromatischen Kohlenwasserstoff schon zu Beginn des 19. Jahrhunderts bekannt gewesen. Auf diese Zeit geht auch ihre Bezeichnung zurück: Die bekannteste aromatische Verbindung Benzol weist einen angenehmen aromatischen Geruch auf. Aus diesem Grund leitet sich die Bezeichnung der Stoffklasse auch von „aroma“, dem griechischen Wort für Duft, ab. Dem englischen Naturforscher und Experimentalphysiker Michael Faraday fiel 1825 auf, dass bei der thermischen Zersetzung von Walrat, einer fett- und wachshaltigen Substanz aus dem Vorderkopf von Pottwalen, eine farblose Flüssigkeit entstand. Durch die Analyse dieser Substanz fand Faraday eine neue Kohlenstoffverbindung, die in den Folgejahren ihren Namen Benzol erhielt.
Die Struktur von Benzol war lange ein viel diskutiertes Thema und erst 1865 schlug der deutsche Chemiker August Kekulé eine mögliche Strukturformel vor, die der heutigen sehr nahe kam. Problematisch bei der Behandlung der Struktur war, dass alle Ansätze, die von bekannten Einzel- und Doppelbindungen ausgingen, keine zufriedenstellenden Ergebnisse lieferten. Insbesondere die Produkte von Reaktionen, an welchen Benzol beteiligt war, passten nicht mit einer solchen Vorstellung zusammen. Kekulé schlug daraufhin vor, dass Benzol zwei Strukturen aufweisen sollte, die sehr schnell von einer zu anderen wechseln sollten. Heute wissen wir, dass das nicht ganz richtig war und Benzol ein einziges Molekül darstellt.
Benzol und dessen Bindungsverhältnisse
Eigenschaften und Struktur von Benzol
Benzol oder auch Benzen ist eine bei Raumtemperatur flüssige organische Verbindung mit der Summenformel
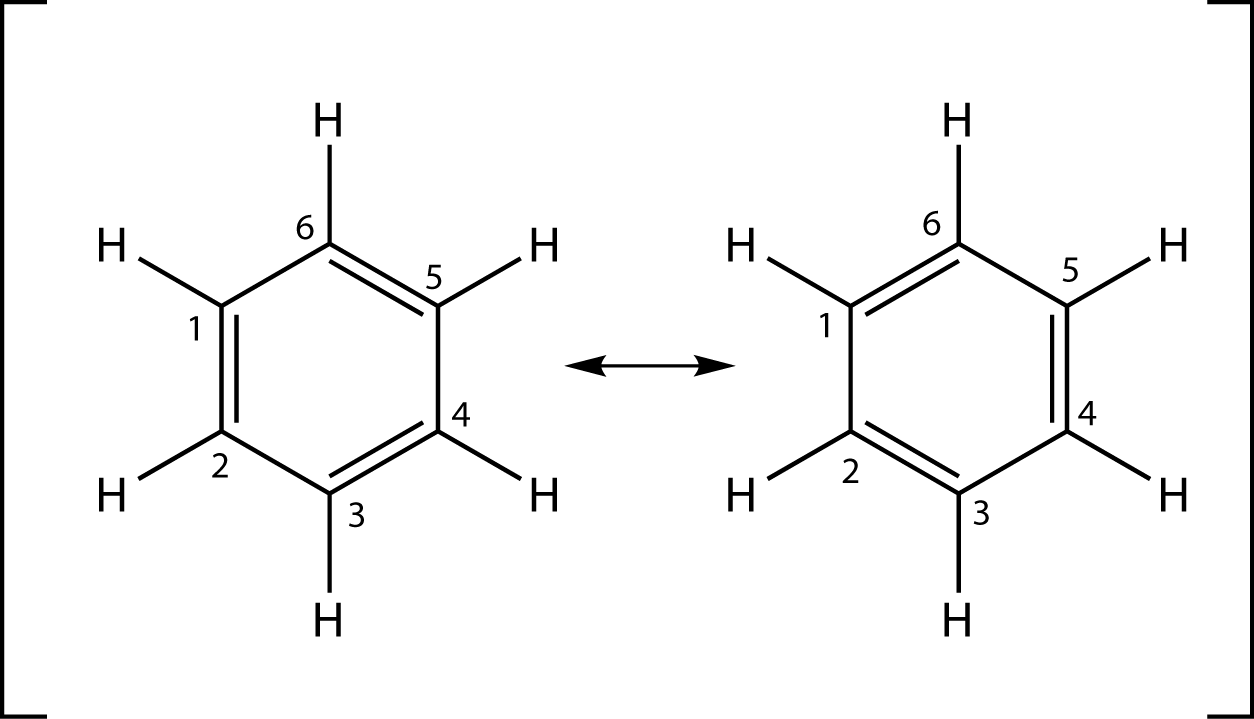
Hier sehen wir die mesomeren Grenzformeln von Benzol, welche du an dem Doppelpfeil erkennst - dem Mesomeriepfeil. Die Mesomerie oder Resonanz findet dann Verwendung, wenn wir Strukturen von Molekülen nicht mit einer einzigen Strukturformel realitätsgetreu darstellen können. Was das bedeutet, können wir uns an diesem Beispiel klar machen: Benzol weist keine Doppelbindungen auf und keine der beiden Strukturen oben ist bevorzugt. Beide Schreibweisen sind Grenzfälle der tatsächlichen Struktur. Eine andere Schreibweise, welche das Molekül realitätsgetreuer darstellt, sieht folgendermaßen aus:

Hier siehst du die andere Schreibweise des Benzolmoleküls. Dieses enthält tatsächlich keine Doppelbindung, weshalb diese Strukturformel der Realität näher kommt als die beiden mesomeren Grenzformeln. Trotzdem wirst du oft eine dieser beiden finden, wenn du dich mit Benzol beschäftigst. Es ist dann nur wichtig zu wissen, dass dies nicht die tatsächliche Struktur darstellt, dann geht auch die Verwendung in Ordnung. Wir werden in diesem Skript eben diese Darstellungsform verwenden, da sie in vielen Fällen zweckmäßiger ist.
Weiter oben siehst du eine räumliche Darstellung des Benzolmoleküls, wobei die dicken schwarzen Bindungen im Vordergrund des Bildes sind. Benzol ist ein planares Molekül, wobei alle Atome in einer Ebene liegen. Dies ist ein wichtiges Kriterium für aromatische Kohlenwasserstoffe wie wir später noch sehen werden. Des Weiteren weisen die einzelnen Bindungen Winkel von
Delokalisierte  -Elektronen
-Elektronen
Anmerkung: Wir beschäftigen uns hier mit den Bindungen im Benzolmolekül. Dabei werden wir einige Begriffe kennen lernen, die in der Schule nicht zwangsweise geläufig sind. Für die richtige Bezeichnung der einzelnen Elemente sind diese aber wichtig. Aus diesem Grund werden wir diese Begriffe auch immer zusammen mit den schulüblichen verwenden und einführen.
An den Anfang stellen wir das Benzolmolekül und dessen Struktur. Die Bindungen zwischen C- und H-Atomen sind gewöhnliche Einfachbindungen, welche auch als
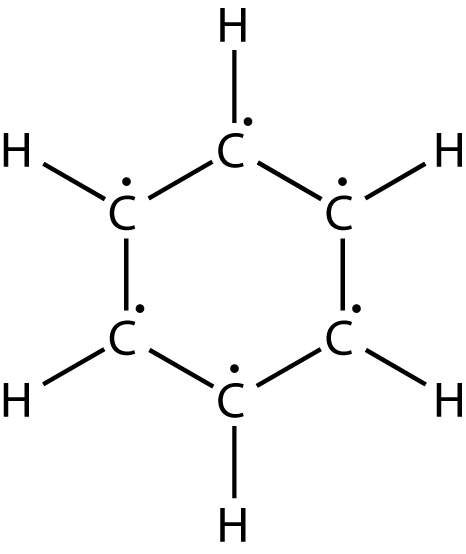
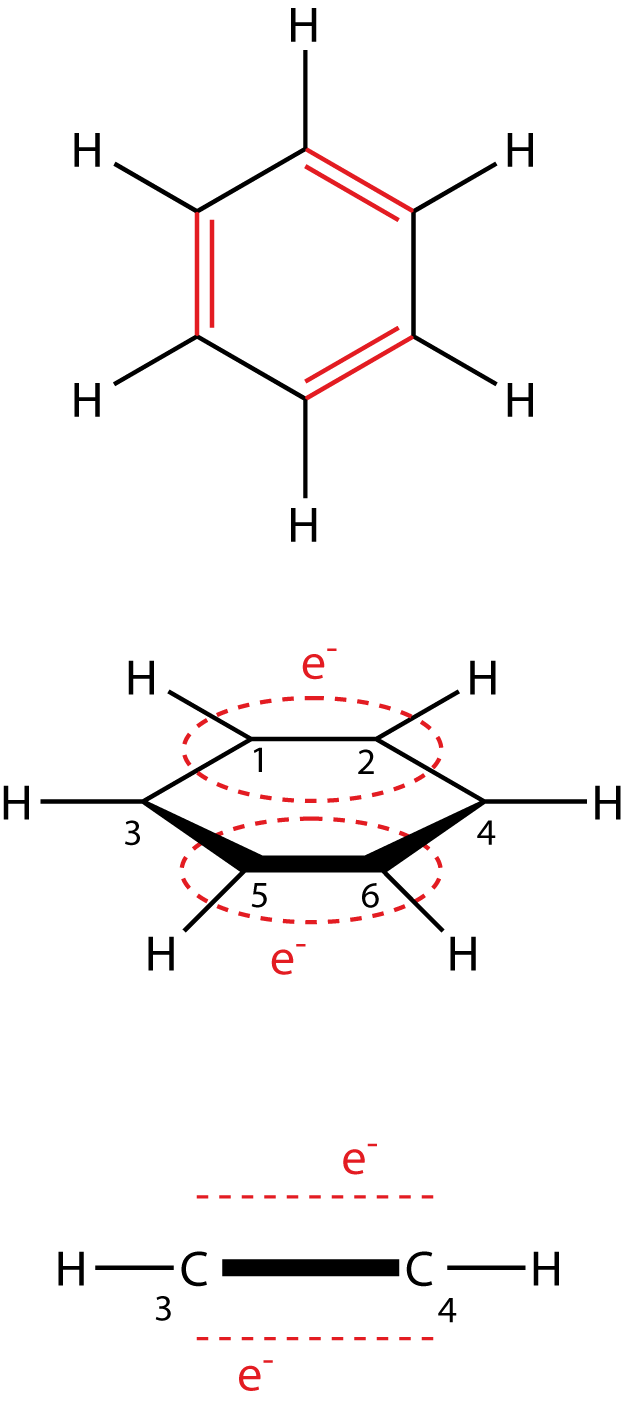
Heutzutage ist es neben dem Messen von Bindungslängen auch möglich, den bevorzugten Aufenthaltsort von Elektronen in Molekülen zu bestimmen. Durch die Betrachtung dieser Elektronendichte können wir sehen, dass alle Elektronen gleichmäßig über das Benzolmolekül verteilt sind. Aus diesem Grund werden diese sechs Elektronen auch als delokalisierte Elektronen bezeichnet. Diese Delokalisierung ist ein permanenter Zustand und du kannst dir das so vorstellen, wie wenn sich alle C-Atome des Benzols diese Elektronen teilen würden. Wenn wir uns das Benzolmolekül noch einmal aus einer anderen Perspektive anschauen, dann fällt auf, dass sich diese Elektronen über bzw. unter dem Sechserring aufhalten. In diesem Zusammenhang wird auch von delokalisierten
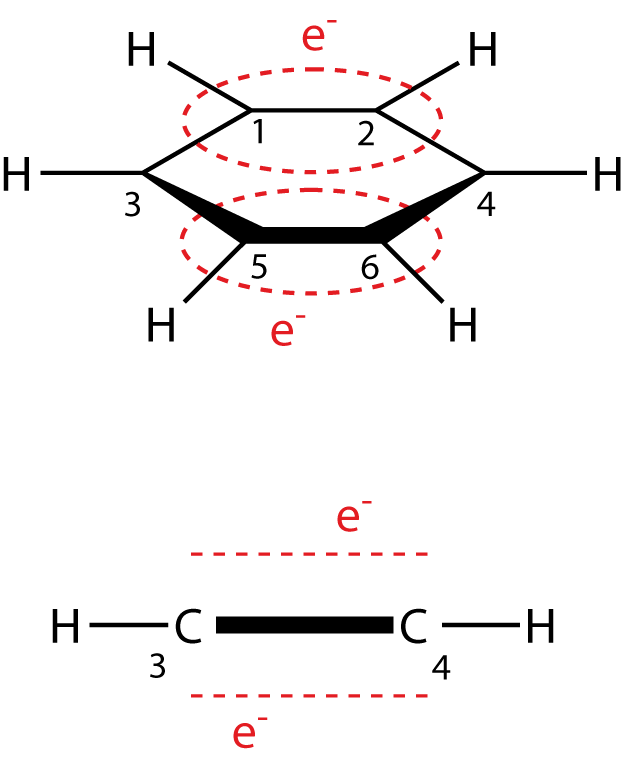
Die rot gestrichelten Linien in Abbildung 1 sollen die bevorzugten Aufenthaltsorte der delokalisierten Elektronen aufzeigen: über und unter dem Benzolring. Diese Anordnung siehst du in der linken Abbildung. Rechts siehst du das Benzolmolekül in der Waagrechten, wo wir aus einer anderen Perspektive sehen können, wo sich die Elektronen aufhalten. Du kannst die Nummern der Kohlenstoffatome vergleichen, um dir die Lage besser vorstellen zu können: Die Atome Nr. 1 und 2 ragen quasi in das Blatt hinein, während Nr. 5 und 6 aus dem Blatt in deine Richtung herausragen.
Diese Struktur führt dazu, dass in Benzol eine Bindungssituation vorliegt, die sich von gewöhnlichen Einfach- und Doppelbindungen deutlich unterscheidet und charakteristisch für Aromaten ist. Welche Auswirkungen diese auf die Stabilität des Benzolmoleküls hat, schauen wir uns im nächsten Kapitel an.
Anmerkung: Wir können uns an dieser Stelle nicht erklären, warum diese delokalisierten -Elektronen sich bevorzugt über und unter dem planaren Benzolring aufhalten. Die Antwort auf diese Frage ist mit dem Wissen, das du in der Schule erhältst, nicht zu finden. Die Frage, die sich dahinter eigentlich verbirgt, bezieht sich auf die Beschaffenheit und den Aufbau der chemischen Bindung - der Elektronenbindung. Wenn wir diese mithilfe des Orbitalmodells, dem aktuellsten Atommodell, untersuchen, dann sehen wir, dass die Geometrie der Bindungen zur dieser Anordnung führt. Die Anordnung der Elektronen geht also auf die Eigenschaften und Geometrie der chemischen Bindungen in Benzol zurück.
Energetische Betrachtung von Aromaten
Wir haben uns im letzten Kapitel mit den Bindungsverhältnissen in Benzol beschäftigt, haben den Begriff der delokalisierten
- Cyclohexen
- 1,3-Cyclohexadien
- 1,3,5-Cyclohexatrien (dieses Molekül existiert nicht; es ist hypothetisch!)
Um diesen Vergleich möglich zu machen, lassen wir diese drei Moleküle und Benzol mit elementarem Wasserstoff (
Hydrierung von Cyclohexen
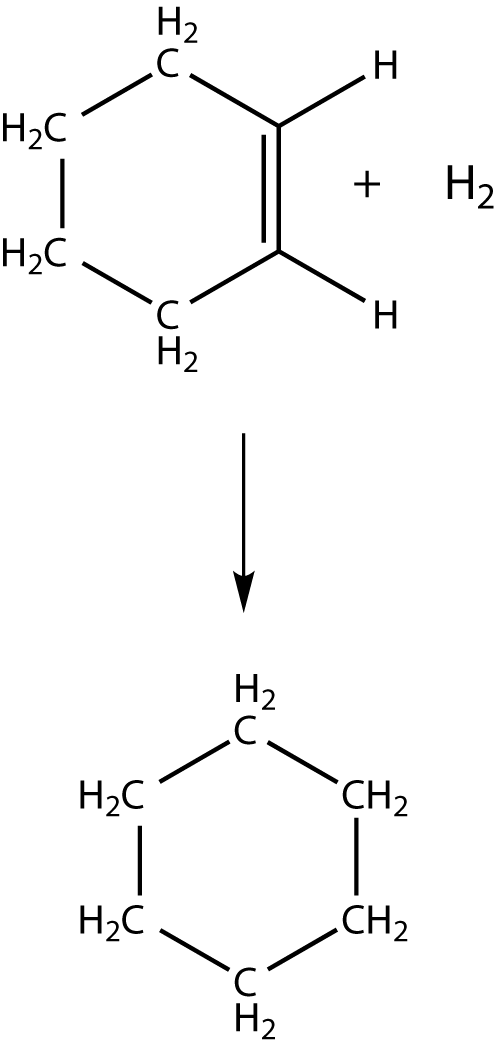
Bei der Hydrierung von Cyclohexen wirde eine Reaktionsenthalpie von
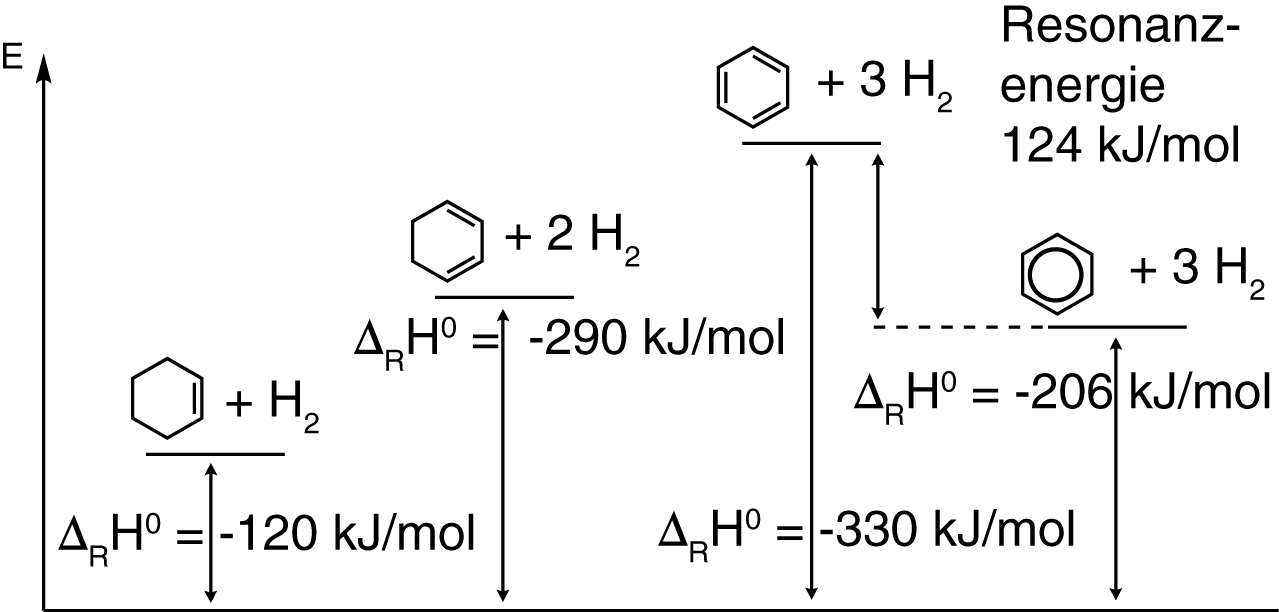
In Abbildung 2 siehst du die einzelnen Hydrierungsreaktionen und deren Reaktionsenthalpien aufgetragen. Diese Reaktionsenthalpien werden auch Hydrierungswärmen genannt und stellen ein Maß für die Stabilität der einzelnen aufgeführten Verbindungen dar. Ganz rechts kannst du die Hydrierungswärme sehen, die wir erhalten, wenn wir Benzol mit Wasserstoff reagieren lassen (was nur unter Verwendung eines Katalysators möglich ist):
Die Hückel-Regel und weitere Aromaten
Allgemeines zu Aromaten und konjugierte Bindungen
Benzol ist zwar der bekannteste aromatische Kohlenwasserstoff, aber bei weitem nicht der einzige. Wir wollen uns nun mit weiteren Vertretern dieser Stoffklasse beschäftigen und herausfinden, wie es uns möglich ist, Aromaten zu erkennen. Die wichtigsten Aspekte, die ein aromatisches System charakterisieren, sind hier nochmal kurz zusammengefasst.
- cyclisch konjugierte Kohlenwasserstoffe
- delokalisierte
-Elektronen
- planare Geometrie
Weiter unten siehst du drei Darstellungen der Elektronenstruktur von Benzol. Zuerst die Eigenschaft, die wir als cyclisch konjugiert bezeichnen: Das Molek/uuml;l weist abwechselnd Doppel- und Einfachbindungen auf. Bedenke, dass wir Doppelbindungen als mesomere Grenzformeln im Benzol erhalten. Die Eigenschaft der Konjugation ist insbesondere für die Stabilität der Moleküle wichtig, was wir später im Zusammenhang mit dem Begriff der Mesomeriestabilisierung feststellen werden. An zweiter Stelle siehst du die rot eingefärbten Aufenthaltsbereiche der delokalisierten
Mesomeriestabilisierung und polycyclische aromat. Kohlenwasserstoffe
Bevor wir uns nun den Aromaten zuwenden, klären wir den wichtigen Begriff der Mesomeriestabilisierung. Dazu fangen wir mit Doppelbindungen in cyclischen (kreisförmig) und acyclischen (offenkettigen) Kohlenwasserstoffen an. Hier können wir zwei Typen unterscheiden:
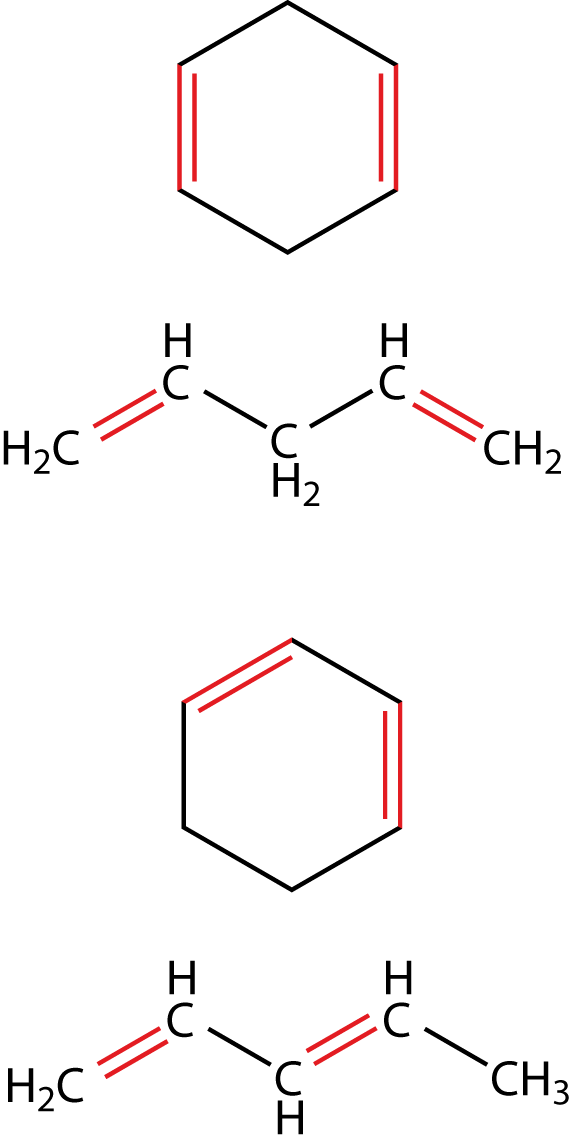
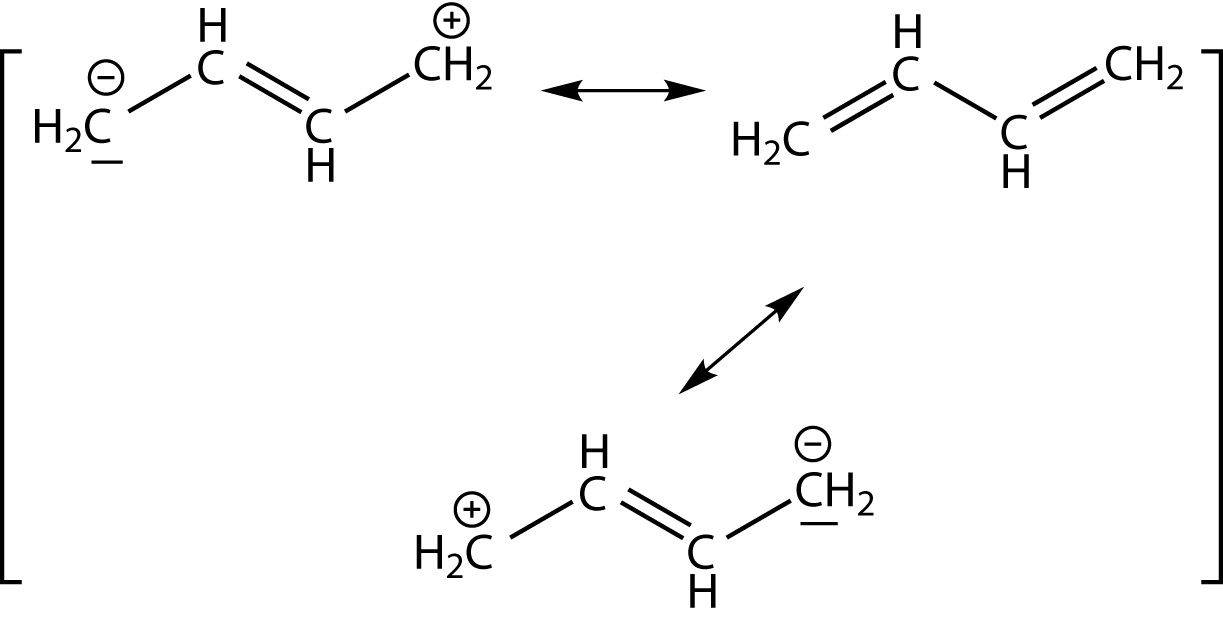
Hier siehst du Beispiele für isolierte Doppelbindungen: Zwischen diesen liegen mehr als eine Einfachbindung! Rechts kannst du ein Beispiel für konjugierte Doppelbindungen sehen: Doppelbindungen wechseln sich hier mit Einfachbindungen ab (alternierende Bindungen). Wenn wir nun die mesomeren Grenzformeln dieser Moleküle zeichnen wollen, dann müssen wir darauf achten, dass Elektronenpaare immer nur eine Position weiter klappen können und dass die Formalladungen in der Summe null ergeben müssen, wenn das Molekül ungeladen war. Wir wollen uns das am Beispiel des 1,3-Butadiens anschauen (vgl. weiter unten). In diesem Fall sind wir in der Lage mesomere Grenzstrukturen zu zeichnen. Je mehr davon möglich sind, desto stabiler ist ein Molekül. Im Fall der Aromaten treten delokalisierte Elektronen auf, das bedeutet, dass diese ebenfalls mesomeriestabilisiert sind. Beachte, dass diese Eigenschaft zwar wichtig für Aromaten ist, keinesfalls aber nur bei diesen auftritt. Auch andere Verbindungen können mesomeriestabilisiert sein.
Bevor wir uns nun der Identifizierung von Aromaten zuwenden, betrachten wir die einfachsten polycyclischen Kohlenwasserstoffe (vgl. weiter unten) und schauen uns hier die Relevanz der strukturbedingten Mesomeriestabilisierung an.
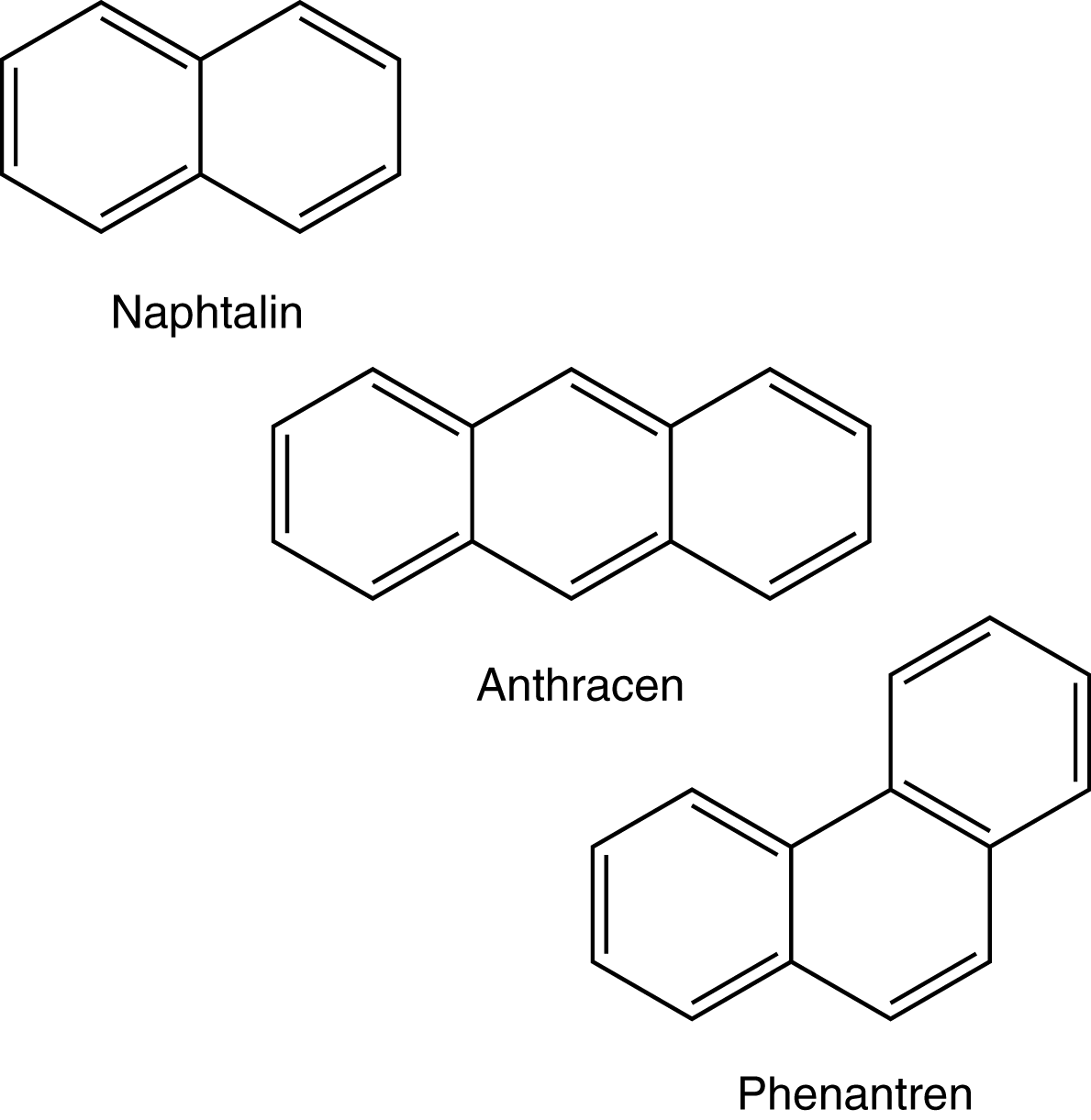
Hier interessieren uns nun die Grenzformel von Anthracen und Phenanthren, die sich nur in der Struktur unterscheiden.
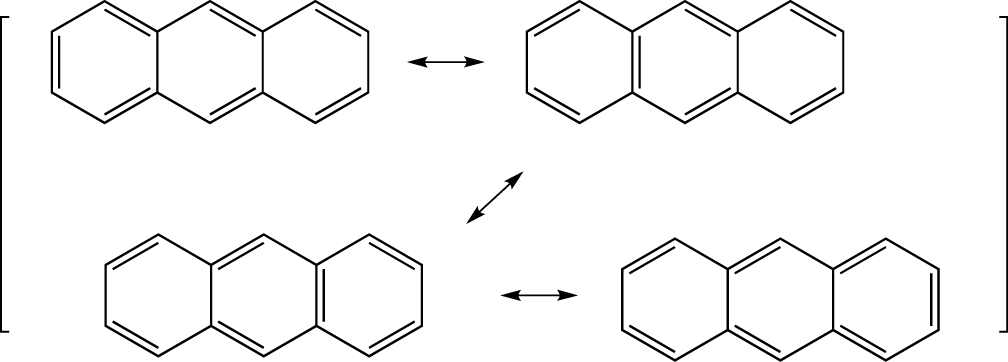
Anthracen weist vier mesomere Grenzformeln auf.
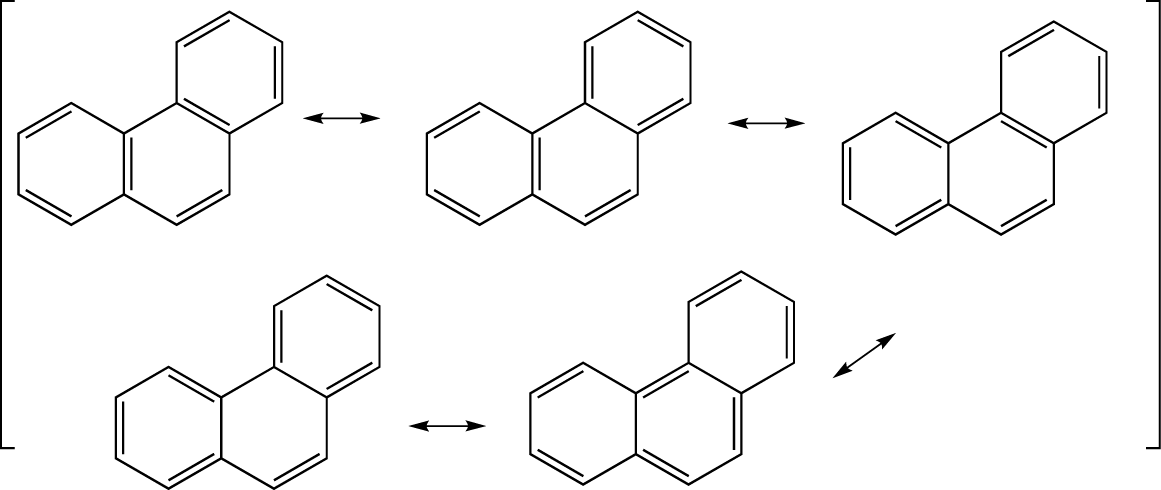
Während Phenanthren strukturbedingt fünf mesomere Grenzformel aufweist und somit relativ gesehen das stabilere Molekül darstellt.
Die Hückel-Regel
Mithilfe der Hückel-Regel können wir Moleküle als Aromaten identifizieren oder diese Eigenschaft ausschließen. Diese Regel hilft uns anhand der Anzahl der
Diese Regel können wir gleich auf Benzol anwenden. Dieses Molekül besitzt sechs delokalisierte
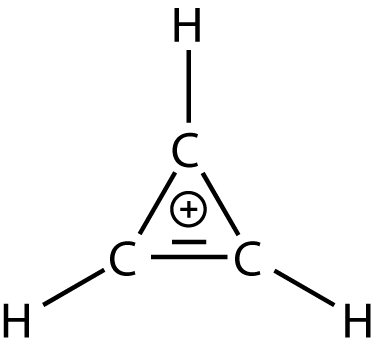
Es besitzt genau zwei delokalisierte
Mehr als Kohlenstoff und Wasserstoff - Benzolderivate und Heteroaromaten
Bisher haben wir uns mit Aromaten beschäftigt, die nur aus Kohlenstoff- und Wasserstoffatomen bestehen. In diesem Kapitel wollen wir uns einmal sogenannte Derivate von Benzol anschauen, die als Stammverbindung einen Benzolring aufweisen und zusätzlich noch verschiedene funktionelle Gruppen. Anschließend betrachten wir aromatische Kohlenwasserstoffe, die nun auch andere Atome, wie beispielsweise Schwefel (S), Sauerstoff (O) und Stickstoff (N) umfassen. Diese Gruppe kann unter dem Begriff der Heteroaromaten zusammengefasst werden. Zunächst drei wichtige Benzolderivate. Derivate sind Verbindungen, die sich von einer Stammverbindung (hier Benzol) ableiten und aufweisen.
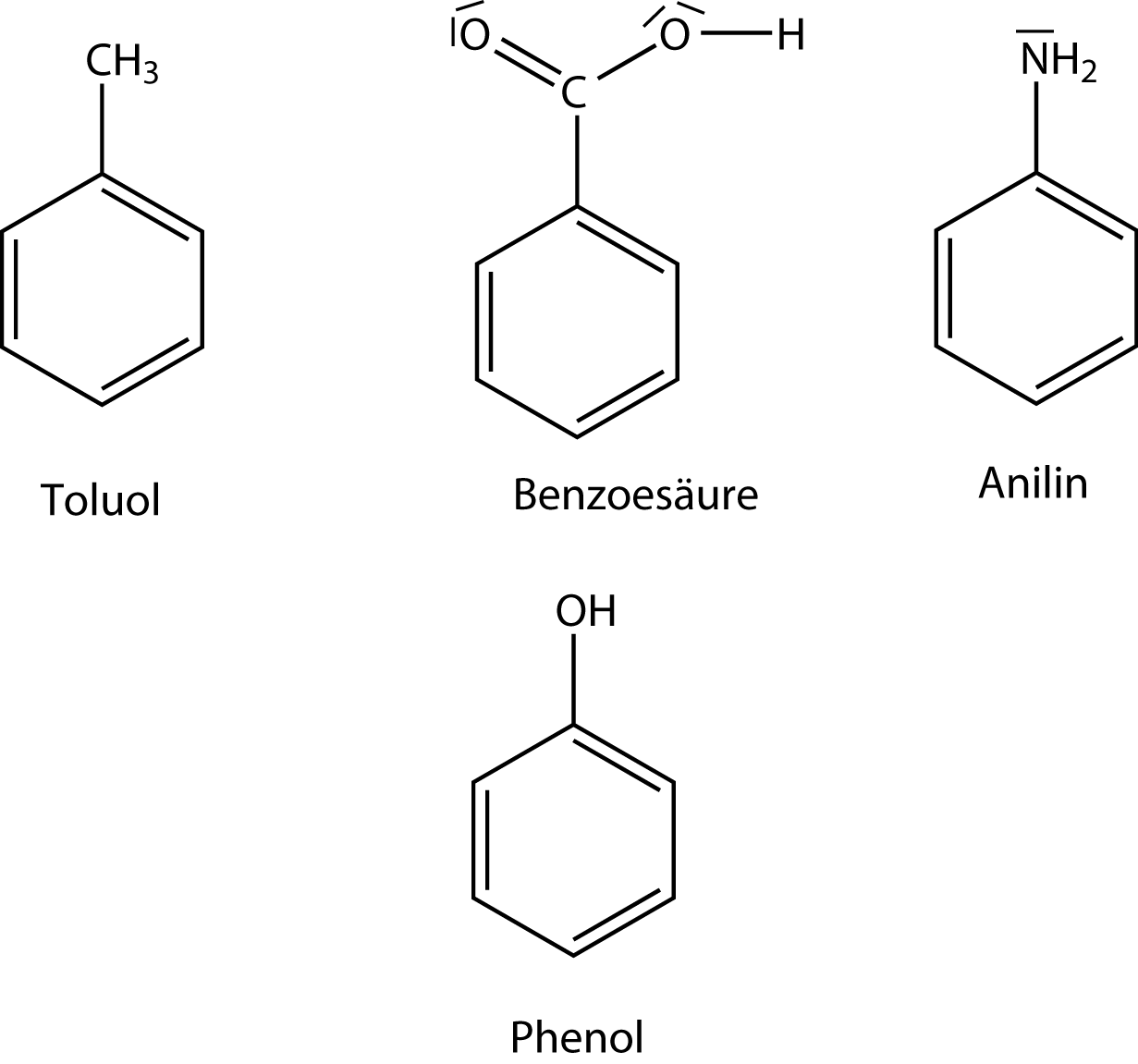
Anmerkung:
Vielleicht hast du schon einmal was vom weltgrößten Chemiekonzern BASF gehört. Mit unserem Wissen um Benzolderivate können wir jetzt auch den vollständigen Namen verstehen: Badische Anilin- und Sodafabrik! Anilin hast du gerade kennen gelernt. Soda ist ein Natriumcarbonat.
Hier siehst du einige wichtige Heteroaromaten.
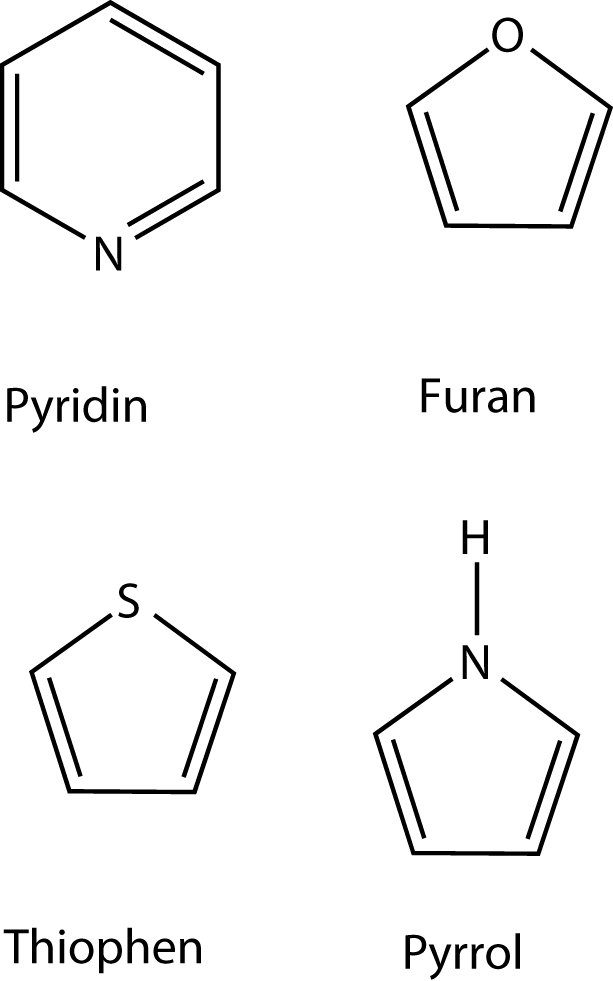
Neben Kohlenstoff sind hier auch andere Elemente in die Ringstruktur eingebaut. Trotzdem erfüllen diese Moleküle alle Voraussetzungen eines Aromaten.
Aromaten im Alltag
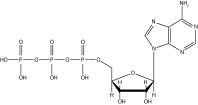
Du hast im Verlauf dieses Skript die aromatische Kohlenwasserstoffe, ihre Besonderheiten und wichtige Reaktionen kennen gelernt. Zum Abschluss werfen wir noch einen kurzen Blick auf wichtige Verbindungen, die aromatische Bestandteile aufweisen. Eine der wichtigsten Verbindungen ist wohl die Nukleinbase Adenin, die in Form von Adenosintriphosphat (kurz ATP) den Energieträger einer lebenden Zelle darstellt.
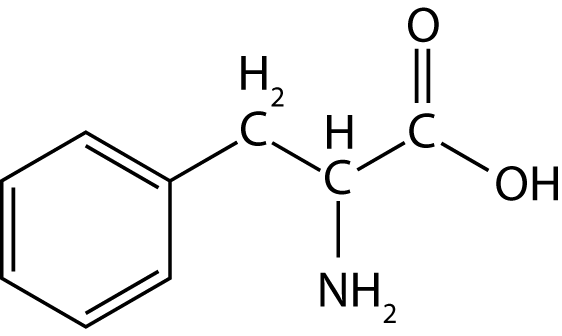
Ein anderes Beispiel ist L-Phenylalanin, eine proteinogene Aminosäure.
Das sind nur zwei Beispiele. Aromaten sind Bestandteil einer riesigen Anzahl an verschiedensten Molekülen und bestimmen deren Eigenschaften entscheidend mit.