Anwendungen: Färben mit Indigo
Definition
In diesem Skript beschäftigen wir uns mit dem Farbstoff Indigo, seinen farbgebenden Eigenschaften und dem speziellen Verfahren der Küpenfärberei.


In Kapitel 2 beschäftigen wir uns mit dem Farbstoff Indigo an sich. Hier werden uns insbesondere die Molekülstruktur sowie die vorhandenen delokalisierten -Elektronen interessieren, die die Ursache für die charakteristische blaue Farbe sind. Des Weiteren werfen hier auch einen kurzen Blick auf die geschichtliche Relevanz des Farbstoffs Indigo in Zusammenhang mit der Badischen Anilin und Soda Fabrik (BASF).
Im 3. Kapitel erarbeiten wir dann die chemischen Grundlagen der Küpenfärberei, die es uns erlaubt Stoffe mithilfe von Indigo blau einzufärben.
Indigo
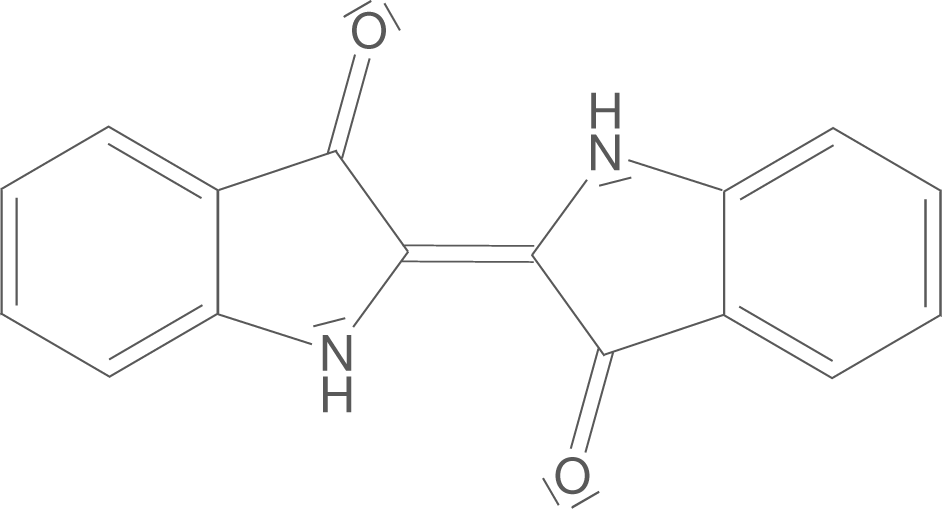
Zunächst werfen wir einen Blick auf das Indigomolekül an sich. In Abbildung 2 ist die Strukturformel des Indigomoleküls dargestellt.
Einige Strukturelemente wollen wir hier hervorheben und uns merken, denn diese tauchen im Abschnitt Eigenschaften des Farbstoffs wieder auf.
- Die aromatischen Ringe an den Enden des Moleküls.
- Die beiden Carbonylgruppen (R-C=O) an den 5er-Ringen sowie die beiden Stickstoffatome mit ihren freien Elektronenpaaren.
- Die Doppelbindung, die die beiden Molekülhälften überbrückt.
Wichtig ist, dass es sich hierbei nicht um einen Azofarbstoff handelt. Die Azogruppe R-N=N-R‘ ist hier nicht vorhanden! Diese funktionelle Gruppe war nur eine Möglichkeit einem Molekül eine farbige Eigenschaft zu verleihen.
Eigenschaften des Farbstoffs
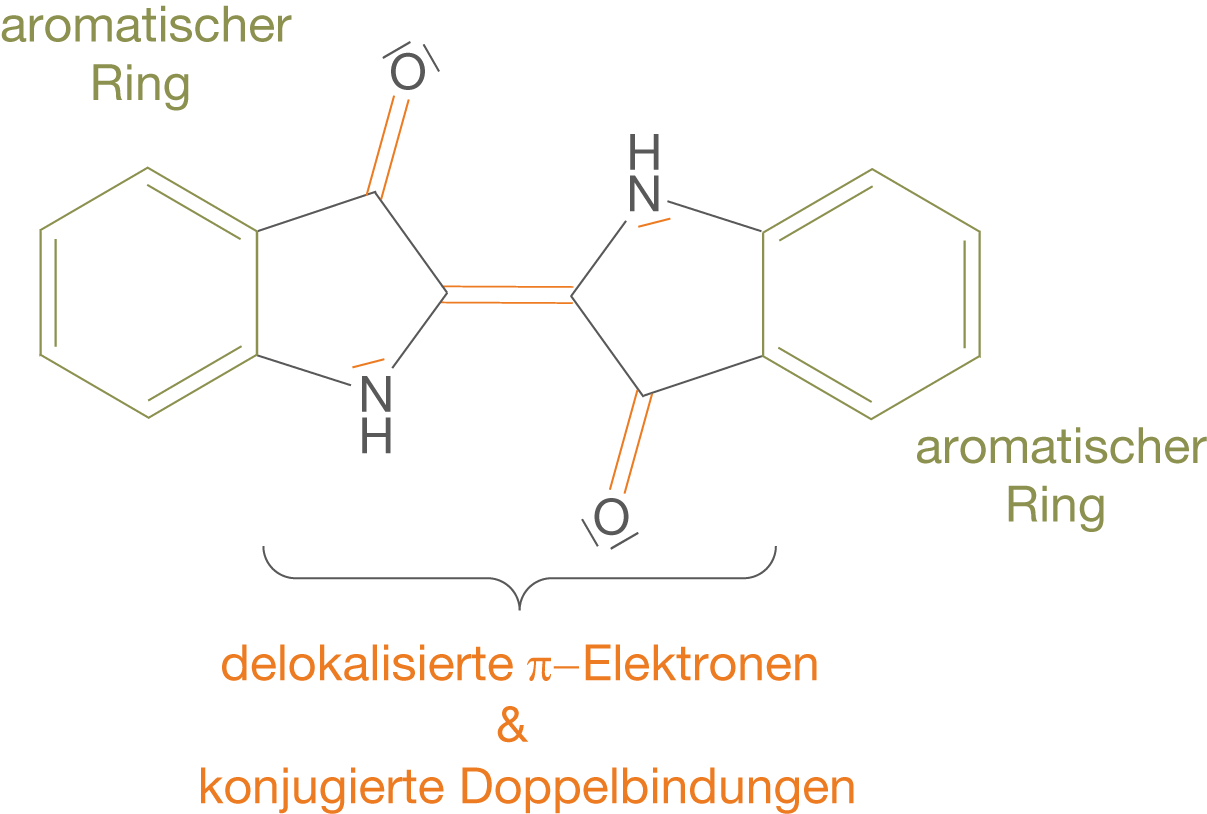
In Abbildung 2 haben wir die Strukturformel des Indigomoleküls kennen gelernt. Nun wollen wir einen Blick auf die Bereiche werfen, die für die Farbigkeit verantwortlich sind. Nach den Grundlagen, die wir im ChemieLV-Skript Azofarbstoffe und die Absorption von Licht erarbeitet haben, halten wir Ausschau nach Systemen, die delokalisierte -Elektronen aufweisen. Dazu zählen vor allem aromatische Bereiche und konjugierte Doppelbindungen (vgl. Abb. 3).
In Abbildung 3 haben wir die relevanten Bereiche des Moleküls, die mit ihren delokalisierten -Elektronen zur Farbigkeit beitragen, hervorgehoben. Wir halten folgendes fest:
- In den aromatischen Ringen sind bekannterweise delokalisierte
-Elektronen vorhanden (vgl. ChemieLV-Skript Aromaten).
- Wir haben drei Doppelbindungen, die zueinander und zu den aromatischen Bereichen des Moleküls konjugiert sind und somit die beiden aromatischen Systeme am linken und rechten Ende miteinander verknüpfen. Zwei Doppelbindungen sind dabei Bestandteil der Carbonylgruppen und eine bildet eine Brücke zwischen dem linken und dem rechten Molekülteil.
- Die freien Elektronenpaare der beiden Stickstoffatome tragen ebenfalls zu dem System delokalisierter
-Elektronen bei.
Zusammengefasst bedeutet das, dass sich das System der delokalisierten -Elektronen auf das gesamte Molekül erstreckt. Wenn wir uns nun an die Anregung der
-Elektronen erinnern, die wir im ChemieLV-Skript Azofarbstoffe und die Absorption von Licht besprechen, dann wissen wir, dass die Anregungsenergie mit zunehmender Größe des
-Systems abnimmt. Es wird also Licht mit längeren Wellenlängen absorbiert. Diese These stimmt mit dem Absorptionsmaximum
von Indigo gut überein, dass sich etwa bei
befindet, was orangefarbenem Licht entspricht. Da wir nur die Farben zu sehen bekommen, deren Wellenlängen nicht absorbiert werden, erhalten wir als Komplementärfarbe von Orange die charakteristische tiefblaue Farbe von Indigo.
Geschichtliches zu Indigo
Indigo ist ein natürlicher Farbstoff, der aus der hauptsächlich auch in Indien beheimateten Indigopflanze gewonnen wurde. In der zweiten Hälfte des 19. Jahrhunderts zählte Indigo zu den wichtigsten Farbstoffen der Welt. Eine problematische Situation entstand, als es in Europa während dieser Zeit zur Mechanisierung der Textilproduktion kam: Die Mengen des natürlichen Farbstoffs waren nicht in dem Ausmaß vorhanden, das für die nun produzierbaren Textilmengen von Nöten gewesen wäre. Um das Farbstoffproblem im allgemeinen zu lösen, machten sich europaweit Chemiker ans Werk, um eine Möglichkeit zu finden künstliche Farbstoffe zu synthetisieren.
Der Mannheimer Leuchtgasfabrikant Friedrich Engelhorn hatte zu dieser direkten Zugriff zum Rohstoff der künstlichen Farbstoffe, Steinkohleteer, der im Rahmen seiner Fabrik anfiel. Er erkannte das Potential des Farbstoffmarktes und gründete 1865 die Aktiengesellschaft „Badische Anilin- und Soda-Fabrik“, die im Jahr 2014 bekannt als BASF das weltgrößte Chemieunternehmen darstellt.
In den Jahren nach der Gründung entwickelten Chemiker den ersten Syntheseweg eines natürlichen Farbstoffs. Das Problem war bis dahin, dass insbesondere die beiden natürlichen Farbstoffe Indigo und Krapp den damaligen Weltmarkt dominierten, da sie gute Eigenschaften bzgl. ihrer Wasch- und Lichtechtheit aufwiesen.
Um 1880 schafft es der deutsche Chemiker Adolf von Baeyer in Straßburg die erste synthetische Herstellung von Indigo durchzuführen. Im Laufe der nächsten Jahre bemühte man sich stetig verschiedene Probleme zu beheben, die beim Transfer des Labormaßstabs in die industrielle Produktion auftraten. Des Weiteren waren die Ausbeuten des bisher gewählten Synthesewegs sehr niedrig und unwirtschaftlich, weshalb die Synthese insbesondere durch den Züricher Professor Karl Neumann ständig verbessert wurde bzw. bessere Wege gefunden wurden. Die BASF sicherte sich immer wieder die Rechte an diesen Neuentwicklungen und Ende des 19. Jahrhunderts war es dann soweit, dass Indigo im großtechnischen Maßstab produziert werden konnte.
Das Küpenfärben
Um beispielsweise Stoffe mithilfe von Indigo färben zu können wird eine spezielle Methode, das Küpenfärben bzw. die Küpenfärberei angewandt.
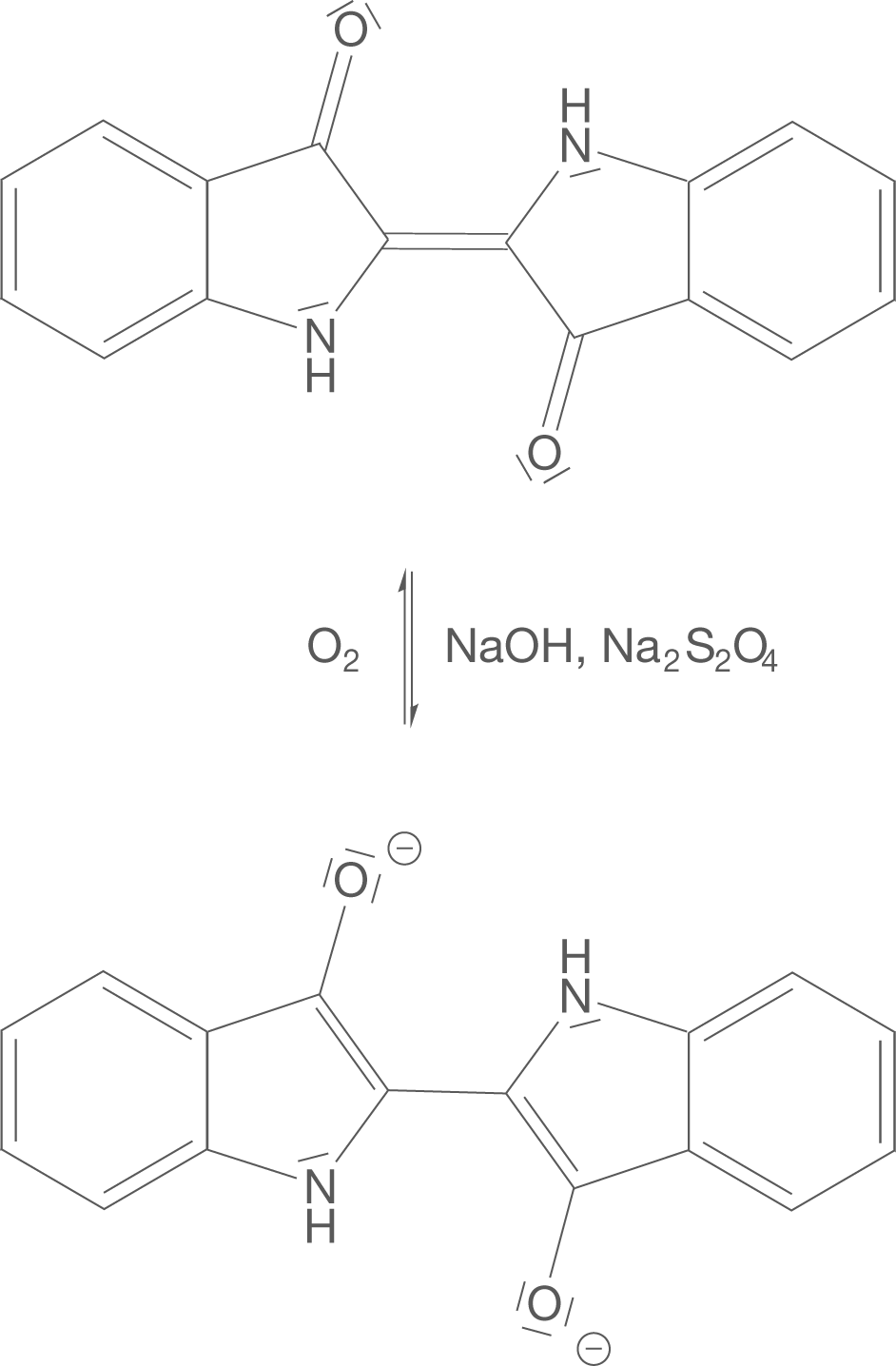
Das Problem bezieht sich darauf, dass es sich bei Indigo um einen blauen Feststoff handelt, der sehr schlecht wasserlöslich ist. Dementsprechend kann er in dieser Form kaum auf die Cellulosefasern von Stoffen aufgebracht werden. Die Lösung kommt in Form des speziellen Färbeverfahrens der Küpenfärberei daher. Das Prinzip gestalltet sich dabei relativ simpel: Zunächst wird Indigo in eine wasserlöslich Verbindung überführt, die sich gut auf die Cellulosefasern aufbringen lässt. Im zweiten Schritt kommt es zur Rückreaktion der wasserlöslichen Verbindung zu Indigo, sodass der Färbevorgang erfolgreich abgeschlossen wird.
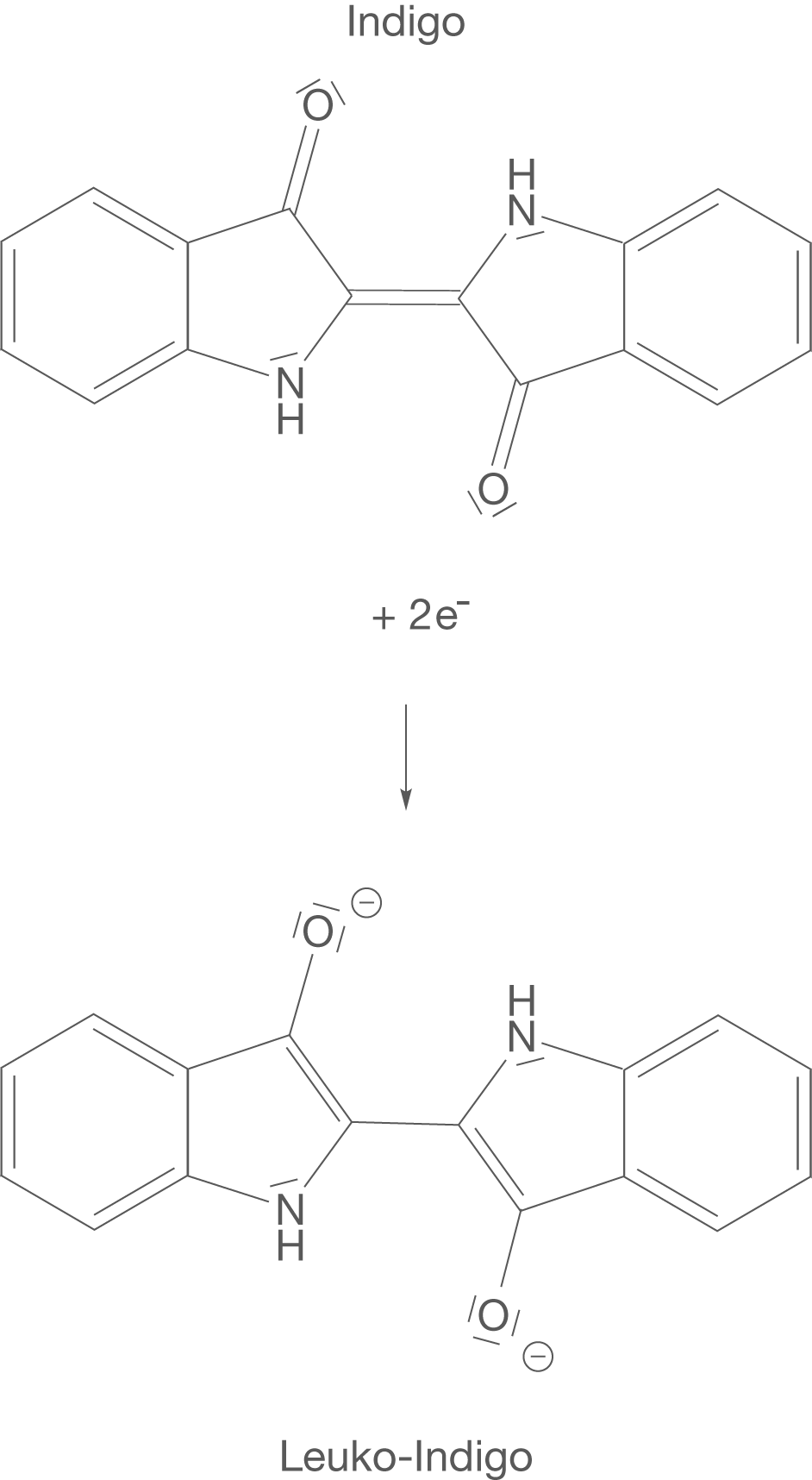
Die Küpenfärberei basiert auf einer Reduktion von Indigo, was zur wasserlöslichen Verbindung Indigoweiß oder Leuko-Indigo führt. Diese wird nach dem Aufbringen auf bspw. Cellulosefasern von Stoffen wieder zu Indigo oxidiert. Diese Reaktion findet im alkalischen Milieu statt und das Reduktionsmittel liegt in Form von Natriumdithionit () vor (vgl. Abb. 4).
Wenn du dir das Leuko-Indigo genauer anschaust, dann kannst du erkennen, dass die beiden Sauerstoffatome der ehemaligen Carbonylgruppe nun je eine negative Ladung tragen. Des Weiteren wurde die Doppelbindung in der Mitte des Moleküls aufgelöst, ist also nicht mehr vorhanden.
Wir schauen uns nun die beiden Teilreaktionen der Redox-Reaktion an.
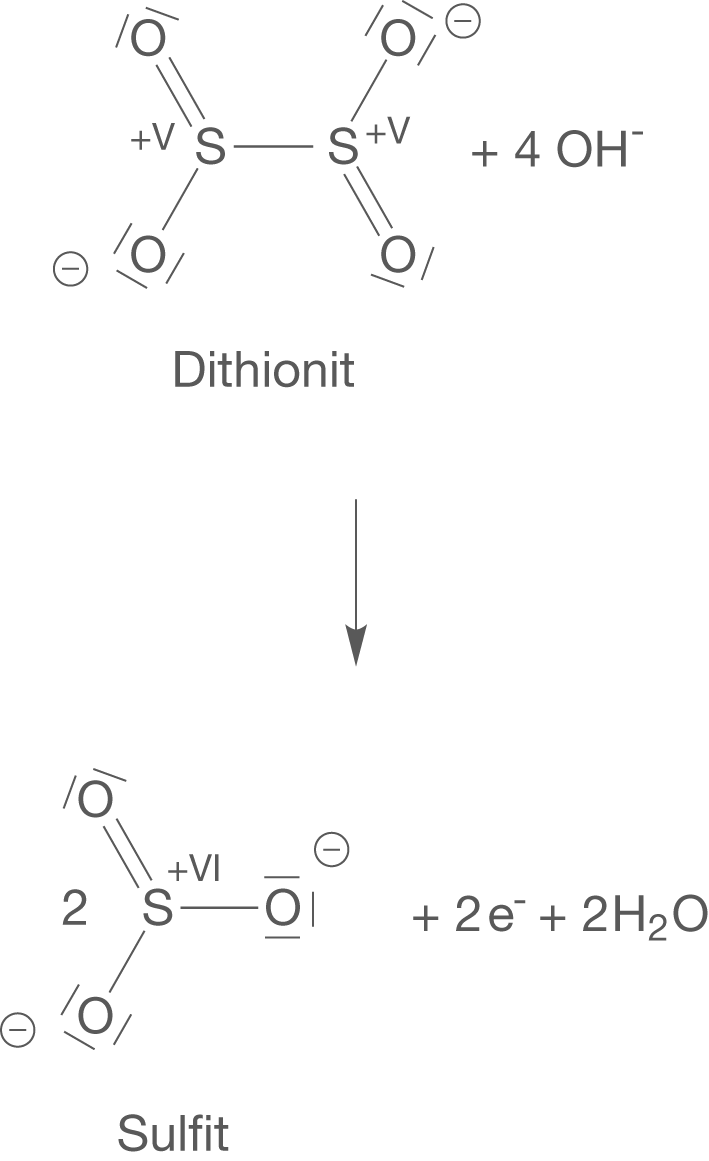
Oxidation von Dithionit
Dithionit wird im alkalischen Milieu zu Sulfit oxidiert (vgl. Abb. 5). Die beiden freien Elektronen entstammen den beiden Schwefelatomen des Dithionitanions, die von nach
oxidiert werden.
Reduktion von Indigo
Diese Elektronen sorgen nun dafür, dass das Indigo Molekül reduziert werden kann, was die Ausbildung des farblosen Leuko-Indigos zur Folge hat (vgl. Abb. 5).
Da das Leuko-Indigo wasserlöslich ist, lässt es sich so auf die zu färbenden Cellulosefasern aufziehen. Interessant wird es nun, wenn wir uns die Rückreaktion dieser Reduktion anschauen (vgl. Abb. 4). Unter Anwesenheit von Sauerstoff wird das farblose Leuko-Indigo wieder zu tiefblauem Indigo oxidiert. Dieser Zusammenhang führt dazu, dass das zu färbende Stück Stoff an der Luft zum Trocknen aufgehängt werden kann. Während dieser Trockenphase kommt es zur Oxidation durch den Luftsauerstoff und die blaue Färbung tritt zu Tage.
Zusammenfassung
- Indigo ist ein tiefblauer Farbstoff.
- Das Indigo Molekül weist ein relativ ausgedehntes System delokalisierter {
-Elektronen} auf. Diese können durch Licht im sichtbaren Bereich des Spektrums angeregt werde, was zur blauen Färbung führt.
- Indigo war im 19. Jahrhundert einer der wichtigsten Farbstoffe der Welt und wurde aus der vor allem in Indien beheimateten Indigopflanze gewonnen.
- Adolf von Baeyer entwickelte um 1880 die erste Möglichkeit Indigo im Labor zu synthetisieren.
- Die von Friedrich Engelhorn gegründetet „Badische Anilin- und Sodafabrik“ sicherte sich die Rechte an dieser Erfindung und trieb die Forschung in Zusammenarbeit mit Karl Neumann dahingehend voran, dass Ende des 19. Jahrhunderts Indigo großtechnisch produziert werden konnte.
- Die Küpenfärberei gliedert sich in zwei Teilschritte: Zunächst wird der Farbstoff in eine wasserlösliche Verbindung überführt, die anschließend auf das Gewebe aufgebracht wird und chemisch wieder in den ursprünglichen Farbstoff rückgeführt wird.
- Indigo wird im alkalischen Milieu zum farblosen und wasserlöslichen Leuko-Indigo reduziert und anschließend durch den Luftsauerstoff wird zum blauen Farbstoff oxidiert. Als Reduktionsmittel wird bspw. Natriumdithionit
verwendet.