Kohlenwasserstoffe
Einführung und Definition
In diesem Skript beschäftigen wir uns mit den Kohlenwasserstoffen. Dabei handelt es sich um Verbindungen, die primär aus Kohlenstoff- und Wasserstoffatomen bestehen.
Bevor wir uns den Kohlenwasserstoffen zuwenden, wollen wir zunächst das ChemieLV-Themengebiet Organische Chemie in das ChemieLV-Basiswissen einordnen. Dieses Vorhaben geschieht vor dem Hintergrund, dass du es im Fall des ChemieLV-Themengebiets Organische Chemie vor allem mit einem unterstützenden Themengebiet zu tun hast, welches die Grundlagen für viele andere Themengebiete liefert (vgl. Abb. 1).
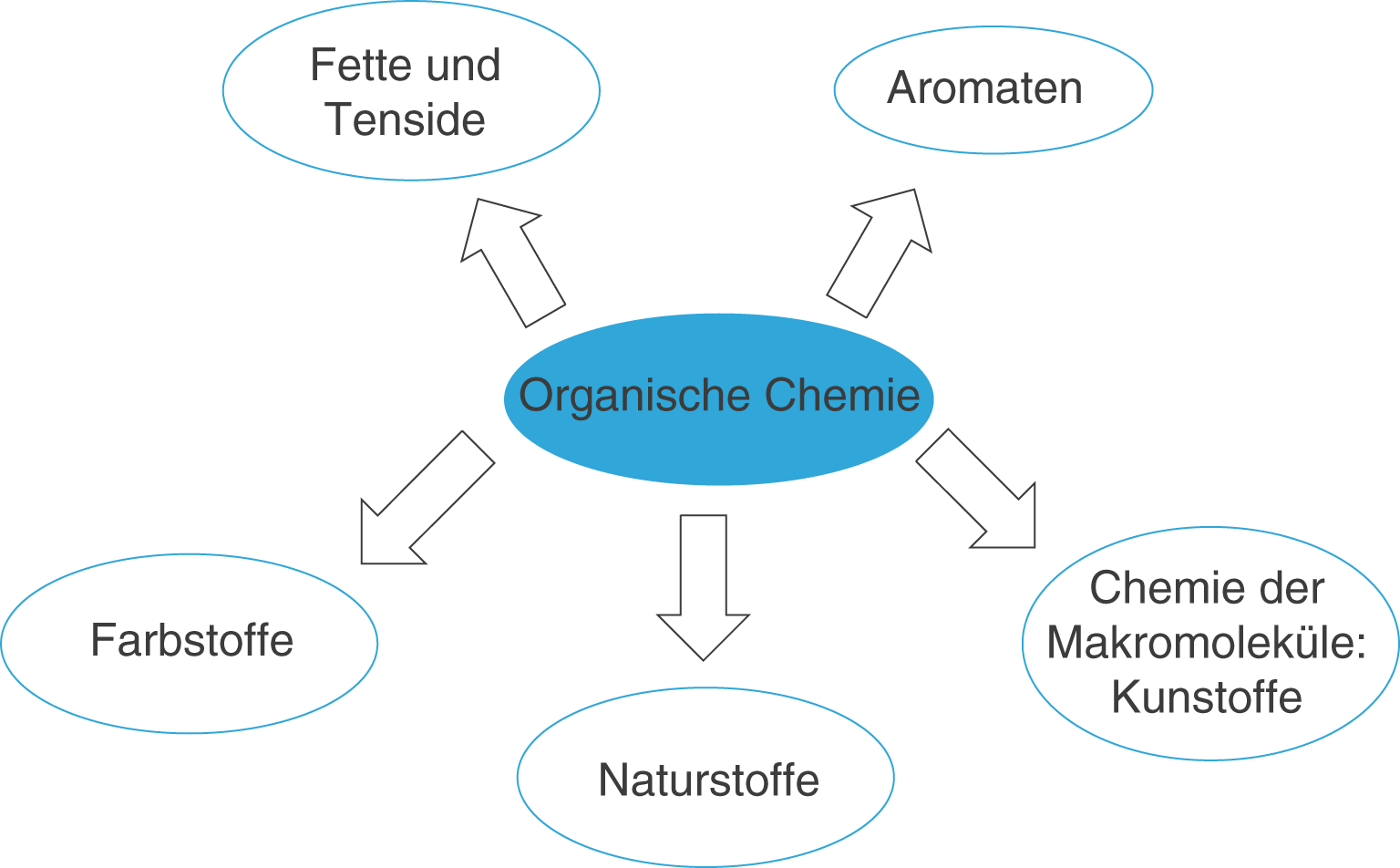
Wir werden uns im Rahmen des Themengebiets Organische Chemie mit folgenden Themen befassen, die auf drei Skript aufgeteilt sind:
- das Skript Kohlenwasserstoffe
- das Skript Sauerstoffverbindungen
- das Skript Stickstoff- und Schwefelverbindungen
Gesättigte Kohlenwasserstoffe
Alkane - Grundlagen
Die einfachsten Kohlenwasserstoffe sind die Alkane. In den Molekülen der Alkane kommen nur C-C-Einfachbindungen vor. Die Alkane werden auch als gesättigte Kohlenwasserstoffe bezeichnet. Dieser Begriff lässt sich so verstehen, dass der Kohlenstoff bzgl. seiner maximalen Bindungsanzahl von vier gesättigt ist; es besteht keine Möglichkeit ein weiteres Atom durch eine weitere Bindung an ein solches C-Atom zu binden. In Kohlenwasserstoffen können im allgemeinen H-Atome durch andere Atome wie bspw. Halogene ersetzt sein.
Methan - Eigenschaften und Bindungsverhältnisse des C-Atoms
Das einfachste Alkan ist Methan mit der Summenformel (vgl. Abb. 2).

Die vier Wasserstoffatome des Methanmoleküls bilden die Ecken eines Tetraeders. Das Kohlenstoffatom sitzt genau in der Mitte dieses Tetraeders. Der Bindungswinkel zwischen zwei Bindungen beträgt
.
Die Struktur von Molekülen und ihre Geometrie stehen im Rahmen der Schul-Chemie nicht unbedingt im Vordergrund. Aus diesem Grund sei hier angemerkt, dass diese Eigenschaften zentral für die Reaktivität von Molekülen sind. Der hier angesprochene Bindungswinkel ist charakteristisch für die Einfachbindung beim Kohlenstoff. Wir werden im Verlauf des Skripts weitere relevanten Bindungswinkel ansprechen.
Die homologe Reihe der Alkane
Nehmen wir Methan als einfachsten Kohlenwasserstoff, dann können wir im nächsten Schritt eines der H-Atome durch ein C-Atom ersetzen (vgl. Abb. 3). Das so entstandene Molekül besitzt die Summenformel und nennt sich Ethan.
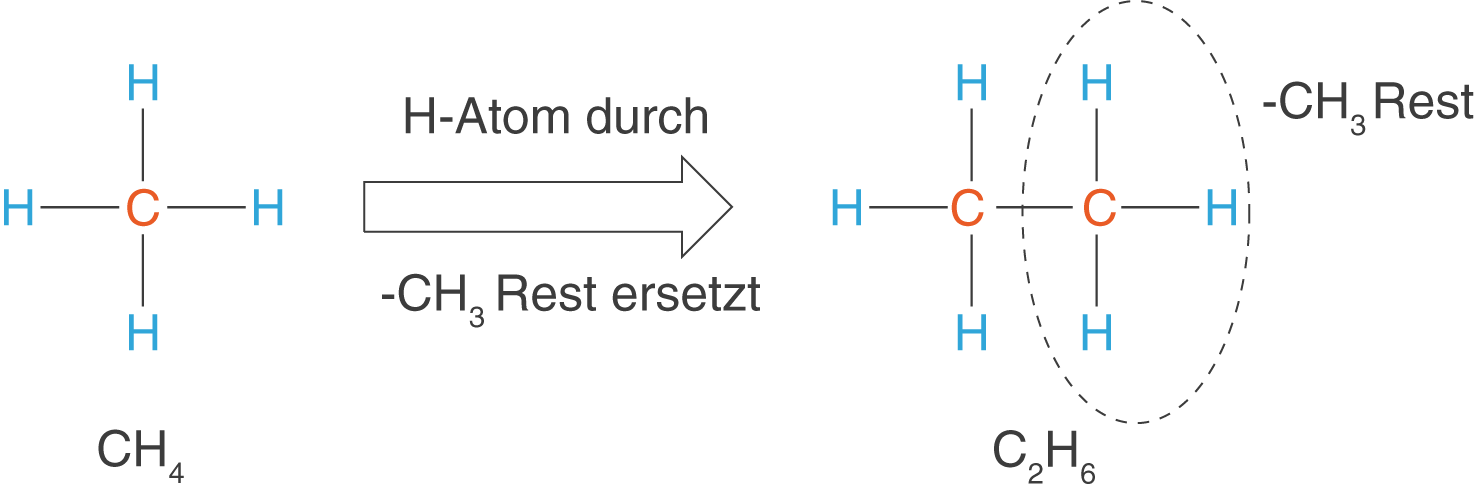
Dieses Prozedere können wir nun weiterführen, um somit eine Kette aus C-Atomen zu erhalten. Die entstehende Gruppe an Molekülen, deren Kettenlänge sich aufsteigend immer um ein zusätzliches -} Glied unterscheidet, nennt man auch die homologe Reihe der Alkane. Die Verbindungen dieser Gruppe weisen die allgemeine Summenformel
auf, wobei
eine natürliche Zahl (
) ist.
Wir wollen diese allgemeine Summenformel an den beiden Beispielen Methan und Ethan testen:
| Methan | Ein C-Atom, also ist |
| Ethan | Zwei C-Atome, also ist |
Wir können so prinzipiell beliebig lange Kohlenstoffketten aufbauen. Im Regelfall reicht es aber sich die ersten zehn Alkane mit ihren Namen und Kettenlängen zu merken. Diese bilden nämlich im weiteren die Grundlage für viele organische Moleküle. In der folgenden Tabelle findest du die besagten ersten zehn Alkane mit ihren Namen und den Summenformeln:
| Name | Summenformel |
|---|---|
| Methan | |
| Ethan | |
| Propan | |
| Butan | |
| Pentan | |
| Hexan | |
| Heptan | |
| Octan | |
| Nonan | |
| Decan |
Alkane - Nomenklatur und Eigenschaften
Isomerie
Bisher haben wir die einfachsten Alkane betrachtet, die in Form kettenförmiger (linearer) Moleküle vorliegen. Wir wissen bereits, dass Alkane nur C-C-Bindungen aufweisen, jedoch haben wir keine Aussage über ihre Struktur getroffen: Alkane sind nicht zwangsweise kettenförmig aufgebaut!
Wir wollen an dieser Stelle den Begriff der Isomerie kennen lernen. Unter Isomerie verstehen wir die Eigenschaft, dass Verbindungen unterschiedliche Strukturen bei konstanter Atomzahl aufweisen können. Anders formuliert sind Isomere Verbindungen mit gleichen Summenformeln und unterschiedlichen Strukturformeln. Wir wollen uns die Isomerie am Beispiel von Pentan () anschauen (vgl. Abb. 4).

In diesem Zusammenhang sprechen wir auch von Konstitutionsisomere, da sich der räumliche Aufbau des Moleküls, seine Konstitution, unterscheidet. An dieser Stelle wäre es nun geschickt die dargestellten Moleküle voneinander unterscheiden zu können, wenn man über sie spricht. Dieses Problem wollen wir nun im Rahmen der Nomenklatur der Alkane klären.
Nomenklatur
Die Nomenklatur beschreibt die systematische Benennung von Verbindungen, wobei wir uns an dieser Stelle auf die Alkane beschränken wollen. Die Grundlagen für die Benennung von Molekülen liefert die International Union of Pure and Applied Chemistry (IUPAC). Dieser Abschnitt soll insbesondere dein bereits Vorhandenes Wissen um die Benennung von Alkanen auffrischen. Ziehen wir wieder die Konstitutionsisomere von Pentan heran (vgl. Abb. 5).
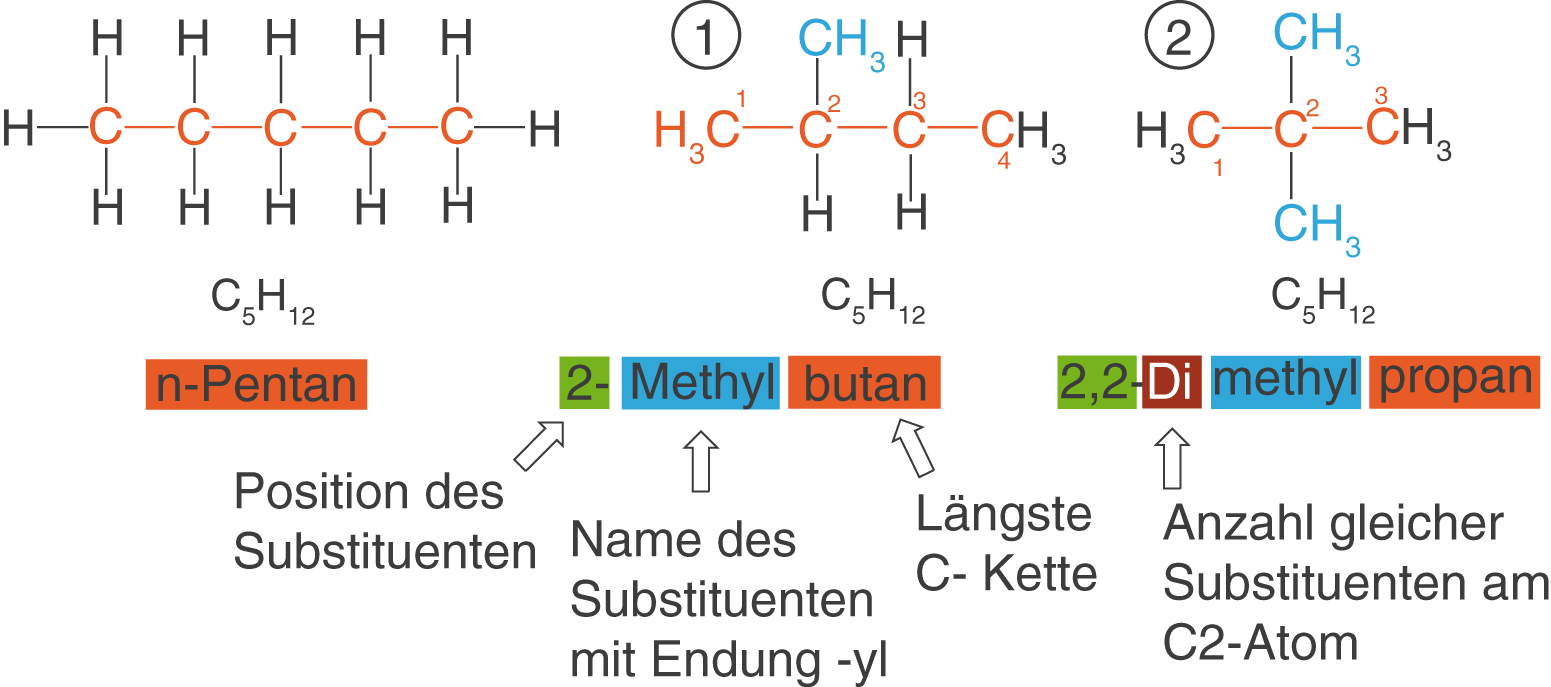
Wir wollen das Vorgehen am Beispiel des zweiten und dritten Moleküls besprechen:
- Die längste C-Kette weist vier C-Atome auf, womit wir als Grundbaustein (orange) Butan erhalten. Am C2-Atom befindet sich eine
-Gruppe, die wir aufgrund ihres verwandten Alkans Methan als Methylrest bezeichnen. Wir ergänzen den Grundbaustein um die Silbe Methyl- (blau) und erhalten Methylbutan. Abschließend ist es natürlich relevant zu wissen, an welchem der vier C-Atom sich der Methylrest befindet. Dementsprechend fügen wir eine 2 (grün) vor dem Namen des Moleküls hinzu und erhalten: 2-Methylbutan. Bedenke, dass du die C-Atome des Grundbausteins so durchnummerierst, dass die Nummer der Position so klein wie möglich bleibt!
- Hier weist die längste C-Kette drei C-Atome auf, womit es sich hierbei um Propan (orange) handelt. Am C2-Atom befinden sich diesmal zwei
-Gruppen, also zwei Methylreste (blau). Um das doppelte Auftreten im Namen zu kennzeichnen, ergänzen wir die Silbe Di- (rotbraun) vor Methyl: Dimethylpropan. Nun ist es aber wiederum wichtig zu wissen, an welchen Positionen, also an welchen C-Atomen sich die Methylgruppen im Molekül befinden. Wir gehen hier analog zum ersten Fall vor, ergänzen nur eine weitere 2 (grün): 2,2-Dimethylpropan.
Im Fall der beiden besprochenen Konstitutionsisomere sprechen wir auch davon, dass es sich um verzweigte Moleküle handelt, während Pentan unverzweigt vorliegt. Das unverzweigte Pentan wird als n-Pentan bezeichnet.
Physikalische Eigenschaften der Alkane
Van-der-Waals-Kräfte
Im Fall der gesättigten Kohlenwasserstoffe haben wir wie bereits gesehen lange Kohlenstoffketten oder aber auch verzweigte Moleküle vorliegen, die primär aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. Dementsprechend ist die Van-der-Waals Wechselwirkung die einzige relevante intermolekulare Wechselwirkung (zwischenmolekular) (vgl. ChemieLV-Skript Bindungsformen und deren Unterschiede). Je länger die Kohlenstoffkette wird bzw. je verzweigter das Molekül, desto stärker sind die wirksamen Anziehungskräfte in Form der Van-der-Waals Wechselwirkung. Diese Tatsache schlägt sich in den physikalischen Eigenschaften der Alkane nieder.
Schmelz- und Siedepunkt
Die kurzkettigen Alkane bis (Methan bis Butan) liegen bei Raumtemperatur gasförmig vor, während die langkettigen Alkane mit Kettenlängen von
als Flüssigkeiten vorliegen. Ab einer Kettenlänge von ungefähr
geht der Aggregatszustand der Alkane in fest über, wobei diese Verbindungen ungefähr die Konsistenz von Wachs aufweisen. Im folgenden Schaubild (vgl. Abb. 6) siehst du die Zunahme der Schmelz- und Siedetemperatur gegen die Kettenlänge der Alkane aufgetragen.

Ungesättigte Kohlenwasserstoffe
Gegensatz zu den gesättigten Kohlenwasserstoffen weisen die ungesättigten Kohlenwasserstoffe nicht nur C-C-Einfachbindungen sondern auch Mehrfachbindungen auf. Hierbei kann es sich um eine Doppelbindung handeln, womit wir von den Alkenen sprechen oder aber es handelt sich um eine Dreifachbindung. Im letzteren Fall betrachten wir dann die Stoffgruppe der Alkine.
Alkene
Bindungsverhältnisse in Alkenen
Wie bereits in der Einleitung dieses Kapitels erwähnt handelt es sich bei den Alkenen um Kohlenwasserstoffe, die mindestens eine Doppelbindung aufweisen. Damit ergibt sich das einfachste Alken zu , da wir mindestens zwei C-Atome benötigen, um eine Doppelbindung knüpfen zu können (vgl. Abb. 7).
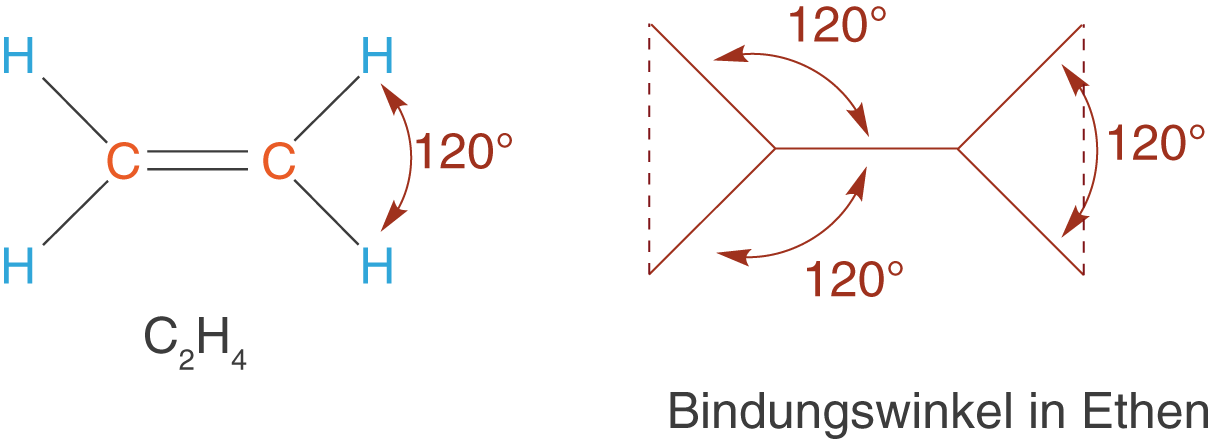
In Abbildung 7 kannst du die schematische Darstellung der Geometrie von Ethen sehen. Hier schließen die Bindungen nun einen Winkel von ein, was charakteristisch für den Bindungswinkel von C-Atomen mit Doppelbindungen ist.
Die homologe Reihe der Alkene
Auch hier können wir eines der H-Atome durch ein weiteres C-Atom ersetzen, um die Kette zu verlängern (vgl. Abb. 8).
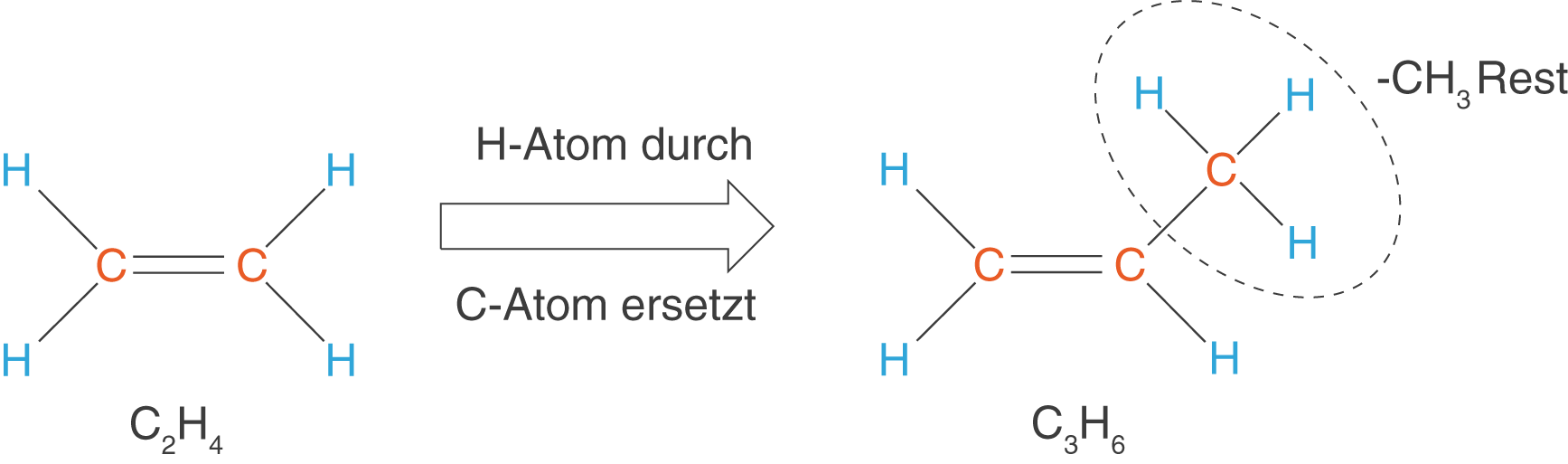
Damit erhalten wir das nächste Alken mit der Summenformel . Führen wir dieses Prozedere fort, dann führt uns das auf eine vergleichbare Reihe von Molekülen, wie wir sie schon bei den Alkanen kennen gelernt haben. Hierbei kommt ebenfalls in jedem Schritt eine weitere -
- Gruppe hinzu. Somit erhalten wir hier die allgemeine Summenformel
, wobei
wiederum eine natürliche Zahl ist (
). Im Folgenden findest du die Reihenfolge der ersten neun Alkene, die wir direkt aus der homologen Reihe der Alkane ableiten können. Bedenke, dass es kein vergleichbares Alken zu Methan gibt!
Der Unterschied ist in der letzten Silbe zu erkennen: Die Alkene enden auf -en während die Alkane auf -an enden.
| Name | Summenformel | |
|---|---|---|
| Ethen | ||
| Propen | ||
| Buten | ||
| Penten | ||
| Hexen | ||
| Hepten | ||
| Octen | ||
| Nonen | ||
| Decen |
Die elektrophile Addition
Eine klassische Reaktion, an welcher Alkene beteiligt sind, ist die elektrophile Addition. Wir wollen uns in diesem Abschnitt diese Reaktion am Beispiel von elementarem Brom () mit Ethen (
) anschauen.
Wir wollen uns in diesem Abschnitt um die Reaktivität der Doppelbindung kümmern. Die hier vorgestellten Konzepte gelten auch für andere entsprechende Beispiele. Das bedeutet, dass es hier nicht darum gehen sollte die dargestellte Reaktion auswendig zu lernen, sondern die Grundlagen zu verinnerlichen, die hinter dieser Reaktion stehen.
Zunächst klären wir die beiden Begriffe Addition und elektrophil.
- Bei einer Additionsreaktion, wie wir sie hier betrachten, kommt es zur Vereinigung von zwei Molekülen. Wir können auch sagen, dass eines der beiden dem anderen hinzugefügt; es wird addiert. Wichtig ist, dass das Produkt alle Atome der beiden Edukte enthält! Es geht keines verloren.
- Elektrophil beschreibt die „elektronenliebende“ Eigenschaft eines Stoffes. Elektrophile Moleküle reagieren dort, wo viele Elektronen vorhanden sind. Moleküle mit den Eigenschaften eines Elektrophils kannst du gut an einer positiven Ladung oder positiven Partialladung erkennen.
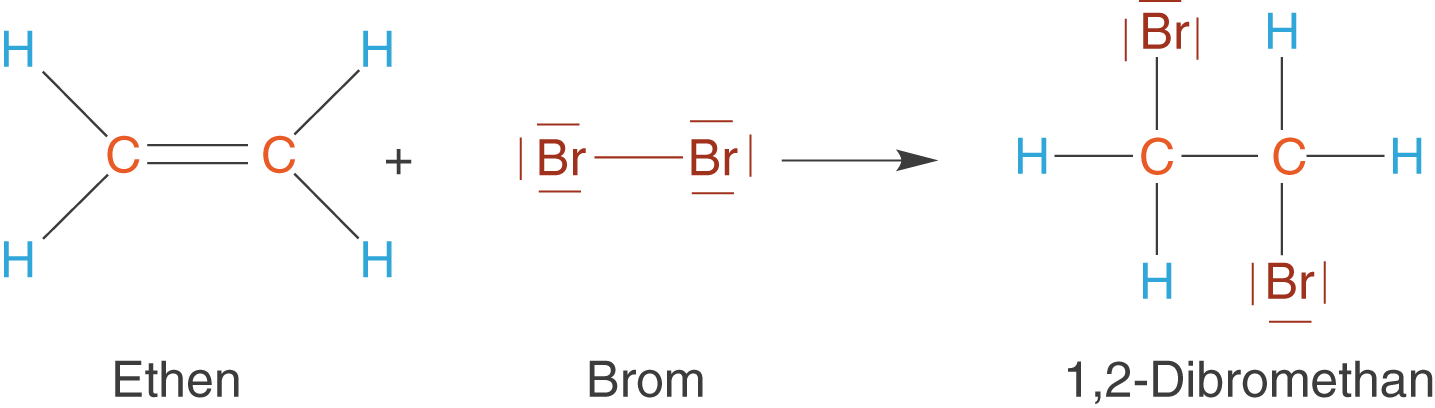
Im Fall von Ethen haben wir bei der Doppelbindung relativ viele Elektronen vorliegen: Hier wird das Elektrophil angreifen. Leider ist es nicht gleich ersichtlich, dass es sich bei Brom um das Elektrophil handelt. Dazu müssen wir uns anschauen, was geschieht, wenn das Brommolekül zufällig in die Nähe der Doppelbindung gelangt (vgl. Abb. 10).
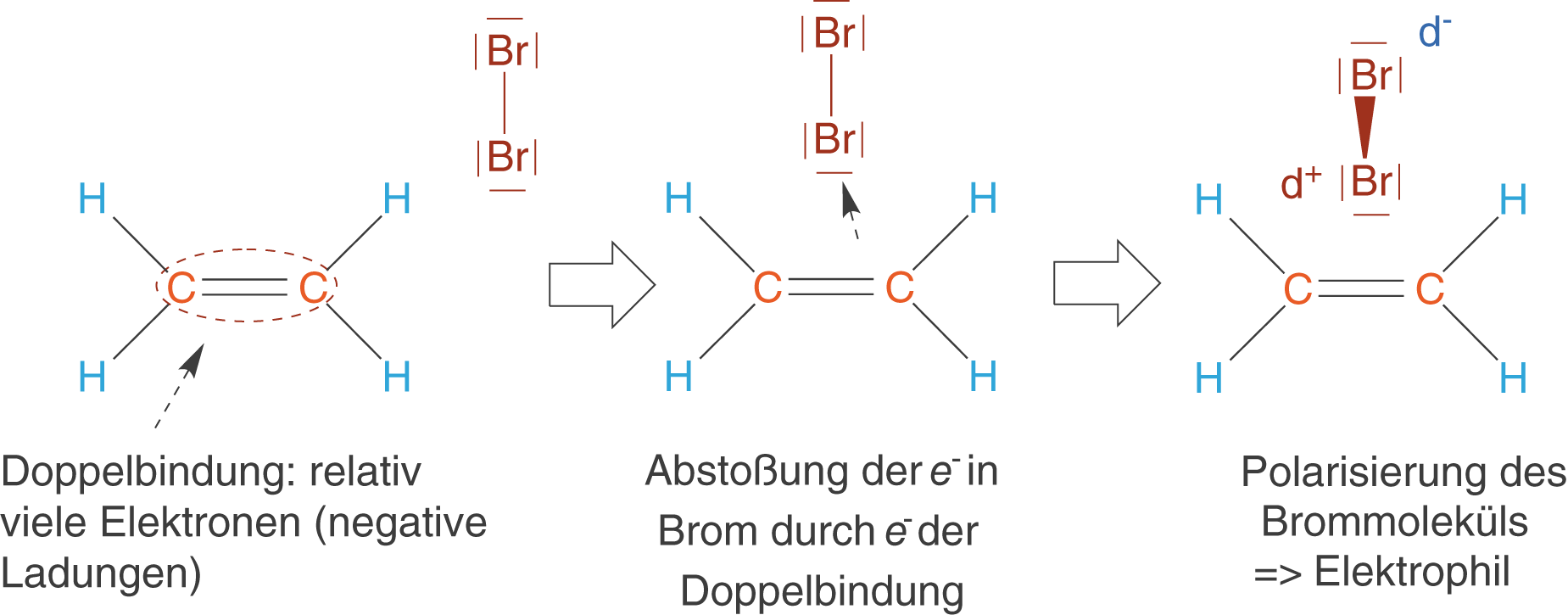
Kommt das Brommolekül der Doppelbindung zu nahe, dann führt die Abstoßung der Elektronen zu einer Verschiebung dieser in Brom. Das Brommolekül wird somit polarisiert, wodurch wir eine positive Partialladung erhalten. Letztere ist nun für den elektrophilen Charakter des Brommoleküls in dieser Reaktion verantwortlich.
Alkine
Bindungsverhältnisse und die homologe Reihe
Die zweite Gruppe der ungesättigten Kohlenwasserstoffe umfasst die Alkine. Diese weisen nun eine C-C-Dreifachbindung auf (vgl. Abb. 11).
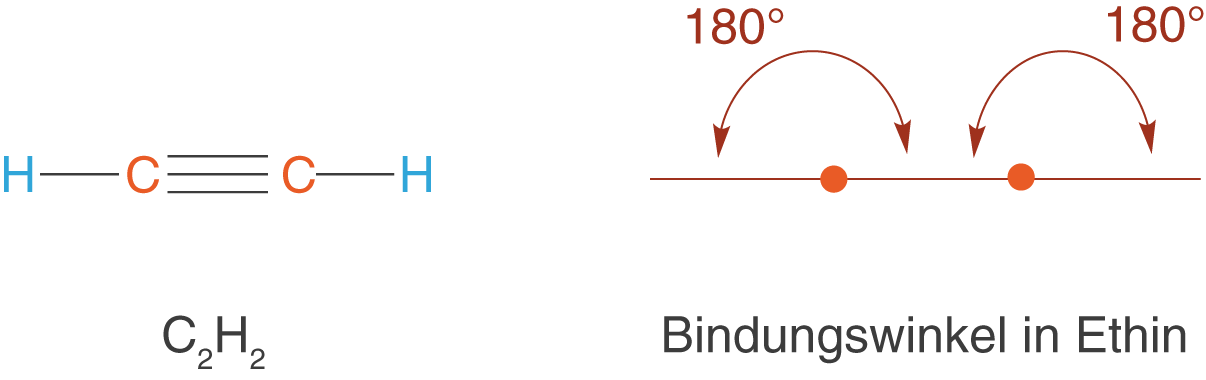
Der Bindungswinkel der Alkine beträgt bezüglich der C-Atome, die an der Dreifachbindung beteiligt sind , was charakteristisch für diese Stoffgruppe ist.
Wir können nun auch in diesem Fall ein H-Atom durch ein C-Atom ersetzen und erhalten so die homologe Reihe der Alkine, die vergleichbar zu den Alkenen aufgebaut ist. Die Endung ergibt sich zu -in und die allgemeine Summenformel lautet wobei
wiederum eine natürliche Zahl ist (
).
| Name | Summenformel |
|---|---|
| Ethin | |
| Propin | |
| Butin | |
| Pentin | |
| Hexin | |
| Heptin | |
| Octin | |
| Nonin | |
| Decin |
Bedenke, dass es auch hier keine analoge Verbindung zu Methan gibt, da eine Dreifachbindung ebenfalls mindestens zwei C-Atome benötigt.
Physikalische Eigenschaften und Reaktivität
Im Folgenden sind einige relevanten Punkte bzgl. der Eigenschaften und der Reaktivität von Alkinen aufgeführt.
- Die Dreifachbindung ist zwar sehr stabil aber durch die hohe Elektronendichte anfällig für die Reaktion mit Elektrophilen, wie wir sie bereits bei den Alkenen kennen gelernt haben.
- Alkine können leicht Polymerisationsreaktionen eingehen (vgl. ChemieLV-Skript Polymersynthese I: Radikalische Polymerisation).
- Ethin reagiert unter Anwesenheit starker Basen sauer, gibt also ein H-Atom in Form eines
-Ions ab. Diese Eigenschaft unterscheidet die Alkine stark von den Alkanen und Alkenen, da diese gar nicht oder nur unter sehr extremen Umständen deprotoniert werden können.
Zusammenfassung
- Alkane sind Kohlenwasserstoffe, die nur C-C-Einfachbindungen aufweisen. Man nennt sie auch gesättigte Kohlenwasserstoffe, weil die C-Atome keine zusätzliche Bindung mehr aufnehmen können.
- Die homologe Reihe der Alkane umfasst alle linearen Alkane in der Reihenfolge aufsteigender Anzahl an C-Atomen. Die allgemeine Summenformel der Alkane lautet
mit
.
- Konstitutionsisomere sind Moleküle mit gleicher Summenformel und unterschiedlicher Strukturformel.
- Van-der-Waals-Kräfte sind die wichtigsten intermolekularen Wechselwirkungen (zwischenmolekularen) bei Alkanen: Je länger die C-Kette, desto stärker die Wechselwirkungen.
- Alkene weisen neben Einfachbindungen auch C-C-Doppelbindungen auf. Alkene zählen zu den ungesättigten Kohlenwasserstoffen.
- Die homologe Reihe der Alkene leitet sich direkt von den Alkanen ab, wobei die allgemeine Summenformel der Alkene
mit
lautet.
- Eine typische Reaktion der Alkene ist die elektrophile Addition.
- Die zweite Gruppe an ungesättigten Kohlenwasserstoffe sind die Alkine. Diese weisen C-C-Dreifachbindungen auf.
- Die homologe Reihe der Alkine leitet sich ebenfalls von den Alkanen ab. Die allgemeine Summenformel der Alkine lautet
mit
.
- Alkine sind sehr reaktiv, da die Elektronendichte an der Dreifachbindung sehr hoch ausfällt.