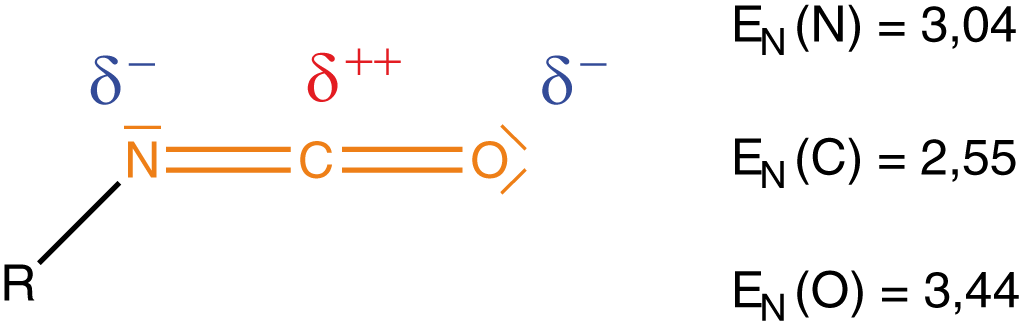Polymersynthese III: Polyaddition
Einführung
Nach der radikalischen Polymerisation (vgl. ChemieLV-Skript Polymersynthese I: Radikalische Polymerisation) und der Polykondensation (vgl. ChemieLV-Skript Polymersynthese II:Polykondensation) steht die Polyaddition an dritter Stelle, wenn es um die Polymersynthese geht. Mit dieser Variante der Polymersynthese wollen wir uns in diesem Skript beschäftigen. Hierbei legen wir unseren Fokus auf die Gruppe der Polyurethane, deren Herstellung und Charakteristika.
Wir beginnen damit, die Polyaddition gegenüber den anderen Varianten der Polymersynthese abzugrenzen. Anschließend werfen wir einen Blick auf die Monomere, aus welchen wir im Verlauf des Skripts das Polymer aufbauen werden. Hier interessieren uns insbesondere die Gruppen der Isocyanate und der Alkohole. Anschließend beschäftigen wir uns mit der Urethangruppe und ihrer Bildung. Über diese werden wir die ausgeählten Monomere mittels Polyaddition zu einem Polymer, dem Polyaddukt, verknüpfen. Wir werden das Skript mit einer Betrachtung der Reaktionsprodukte, den Polyurethanen, und einer besonderen Anwendung in Form geschäumter Polyurethane abschließen.
Stufenreaktionen
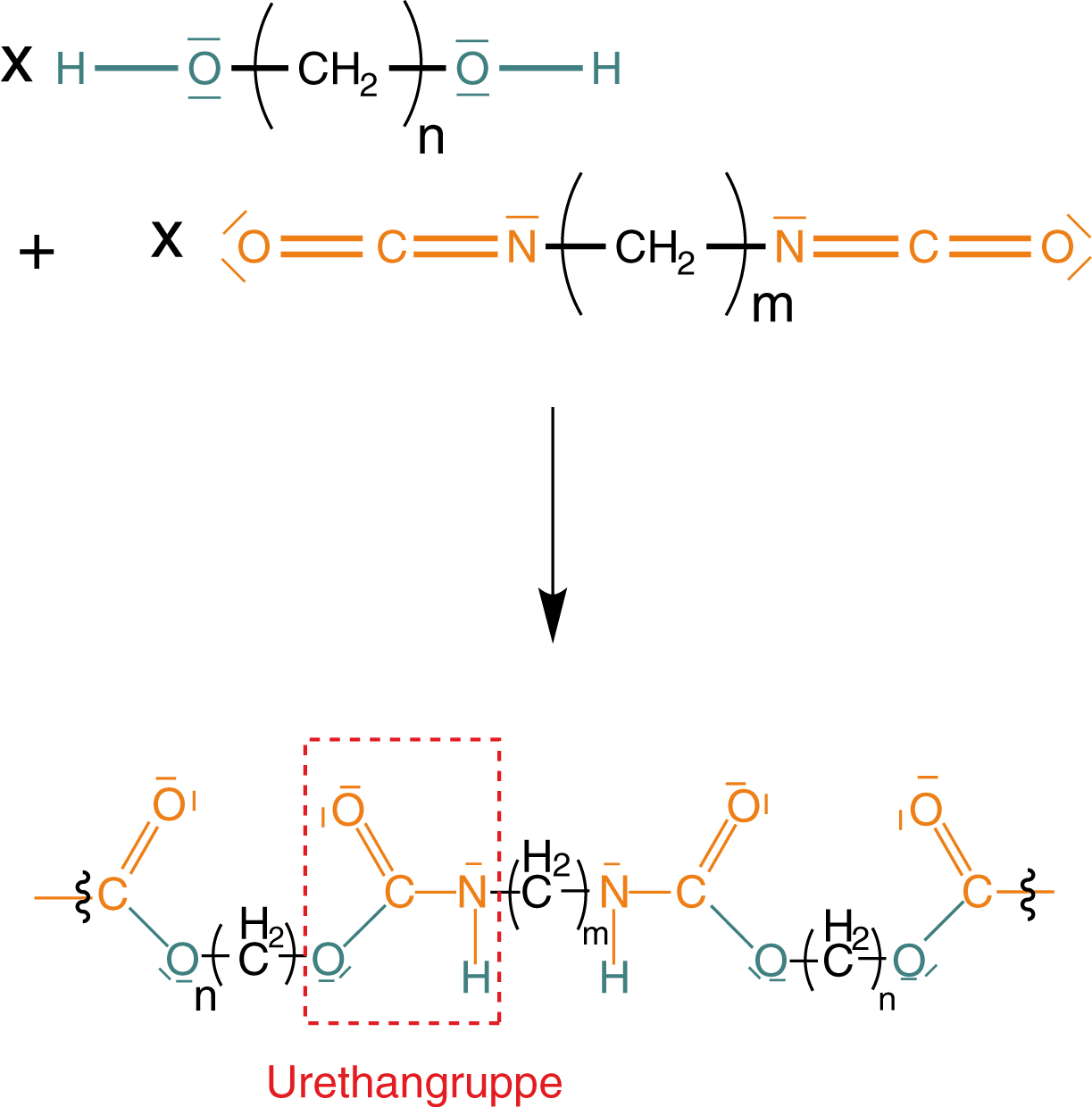
Polymere, welche mittels Polyaddition gebildet werden (sogenannte Polyaddukte), reagieren stufenweise miteinander. Dieser Reaktionstyp wird deshalb auch Stufenreaktion genannt. Während beim Radikalkettenmechanismus eine Polymerkette stetig weiterwächst und die Reaktion durch Rekombination abgebrochen wird, baut sich das Polyaddukt nach und nach durch die Reaktion zweier funktioneller Gruppen auf. Dieser Prozess beruht darauf, dass sowohl die Monomere als auch die Polymere im Verlauf der Reaktion reaktive funktionelle Gruppen an den Kettenenden tragen (vgl. Abb. 1).
Hier können dann auch weitere Reaktionen stattfinden, die so zum Aufbau eines langkettigen Polymers führen. Wichtig ist an dieser Stelle, dass wir nicht auf Monomere mit zwei identischen endständigen funktionellen Gruppen angewiesen sind. Es ist auch möglich, Monomere zu verwenden, die zwei unterschiedliche funktionelle Gruppen aufweisen. In diesem Skript interessieren uns vor allem Diisocyanate mit mehreren endständigen Isocyanatgruppen (R-NCO) sowie mehrwertige Alkohole, wie Diole und Triole. Im Bezug zu der Eigenschaft der Stufenreaktion ist die Polyaddition mit der Polykondensation (vgl. ChemieLV-Skript Polymersynthese II: Polykondensation) verwandt. Der entscheidende Unterschied zwischen diesen beiden Reaktionsytpen liegt darin begründet, dass es bei der Polyaddition keine niedermolekularen Spaltprodukte (kleine Moleküle als Nebenprodukte) gibt. Welche Eigenschaft du heranziehen kannst, um diese Reaktion bzw. ihre Produkte (hier die Polyurethane) zu erkennen, werden wir im Rahmen des Reaktionsmechanismus ansprechen.
Wir fassen kurz zusammen, welche Aspekte für die Polyaddition zentral sind:
- Monomere reagieren in Stufenreaktionen zu Polymeren.
- Bei der Polyaddition gibt es keine niedermolekularen Spaltprodukte.
Im nächsten Schritt wenden wir uns den Monomeren der Polyaddition zu.
Die Monomere - Von Isocyanaten und Alkoholen
Im Rahmen dieses Skripts wollen wir die Polyaddition insbesondere im Zusammenhang mit der Stoffklasse der Polyurethane kennenlernen. Aus diesem Grund schauen wir uns an dieser Stelle auch die Monomere an, die wir über Urethangruppen verknüpfen können.
Anmerkung:
Die Polyaddition umfasst auch die Reaktionen anderer Stoffklassen. Im Rahmen der Schulchemie interessieren uns aber nur die Polyurethane.
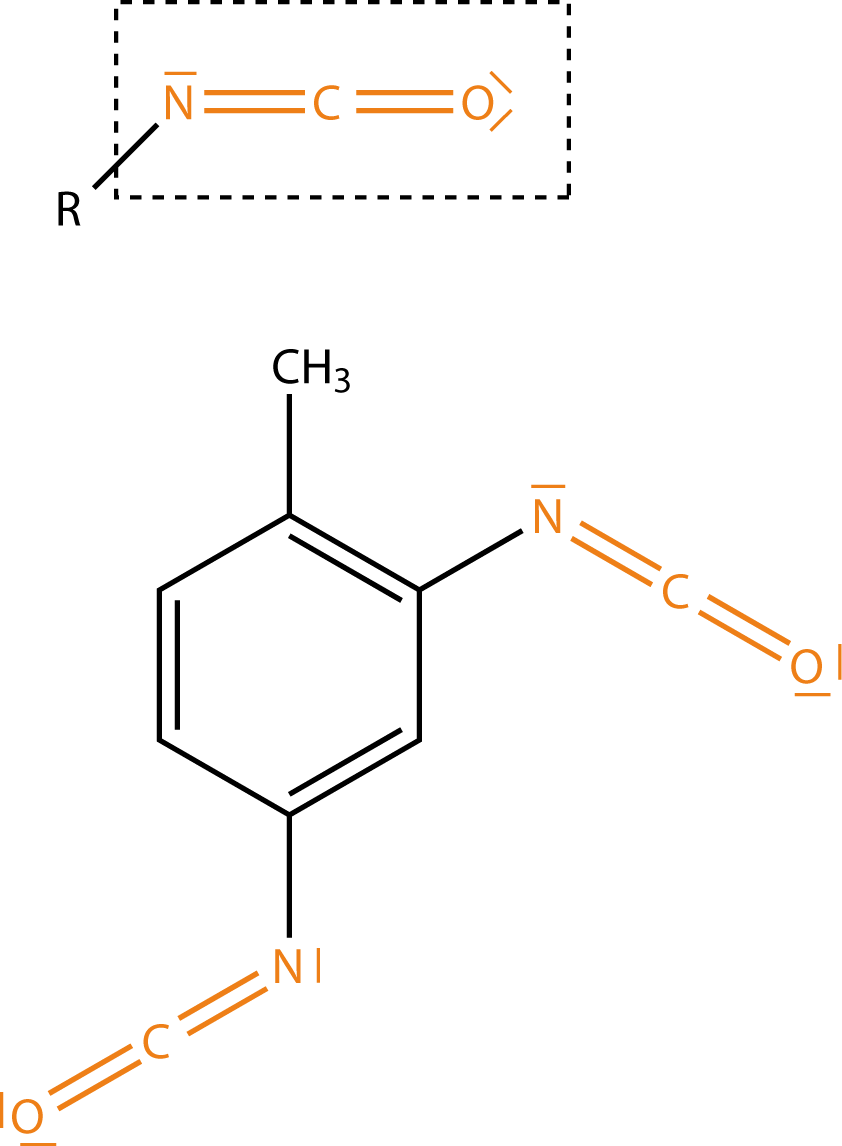
Die Gruppe der Isocyanate (vgl. Abb. 2) umfasst die eine Hälfte der Monomere, die uns hier interessieren.
Die charakteristische funktionelle Gruppe der Isocyanate ist linear mit der Abfolge -NCO. Dabei ist das Kohlenstoffatom mit je einer Doppelbindung an den Stickstoff und den Sauerstoff gebunden. Wir können bereits hier Überlegungen zur Reaktivität von Isocyanaten anstellen, welche im weiteren Verlauf noch wichtig werden. Dazu betrachten wir die Elektronegativitäten von Kohlenstoff, Stickstoff und Sauerstoff (vgl. Abb. 3). Die Elektronegativität
ist ein Maß für das Bestreben eines Elements Elektronen einer Bindung an sich zu ziehen.
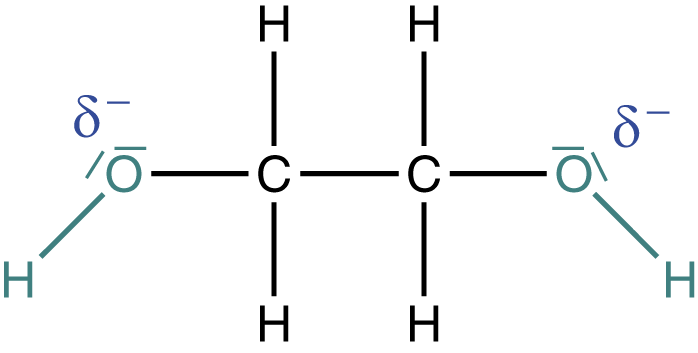
Das C-Atom wird durch die relativ hohe Elektronegativität von Sauerstoff und Stickstoff stark positiv polarisiert. Solche Stellen sind in Molekülen immer prädestiniert für eine Reaktion. Neben den Isocyanaten spielt für uns hier die Stoffklasse der Alkohole eine wichtige Rolle. Alkohole sind an den Hydroxygruppen (OH--Gruppen) erkennbar, die auch für die Reaktivität verantwortlich sind (vgl. Abb. 4).
Was die Alkohole angeht, interessieren uns insbesondere die Hydroxygruppen. Aufgrund einer höheren Elektronegativität liegt hier ein negativ polarisiertes Sauerstoffatom vor, welches zwei freie Elektronenpaare aufweist. Freie Elektronenpaare sind ebenfalls eine Möglichkeit für Moleküle, Reaktionen einzugehen.
Wir wollen nun diese beiden Monomere verwenden, um die Isocyanatgruppe mit der Hydroxygruppe durch eine Additionsreaktion zu einer Urethangruppe zu verknüpfen. Führen wir diese Additionsreaktionen mit vielen Monomeren durch, dann erhalten wir als Ergebnis ein Polymer und sprechen von Polyaddition.
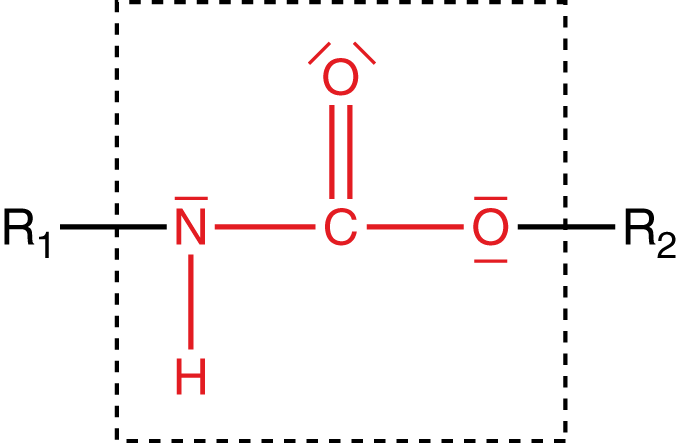
Die Urethangruppe und deren Bildung
Die Urethangruppe (vgl. Abb. 5) ist das Ergebnis einer Additionsreaktion zwischen Isocyanat und Alkohol.
Über diese Gruppe sind die Monomere zu einem Polymer verknüpft. Das bedeutet, dass wir nun ein Isocyanat mit einem Alkohol in einer Additionsreaktion reagieren lassen.
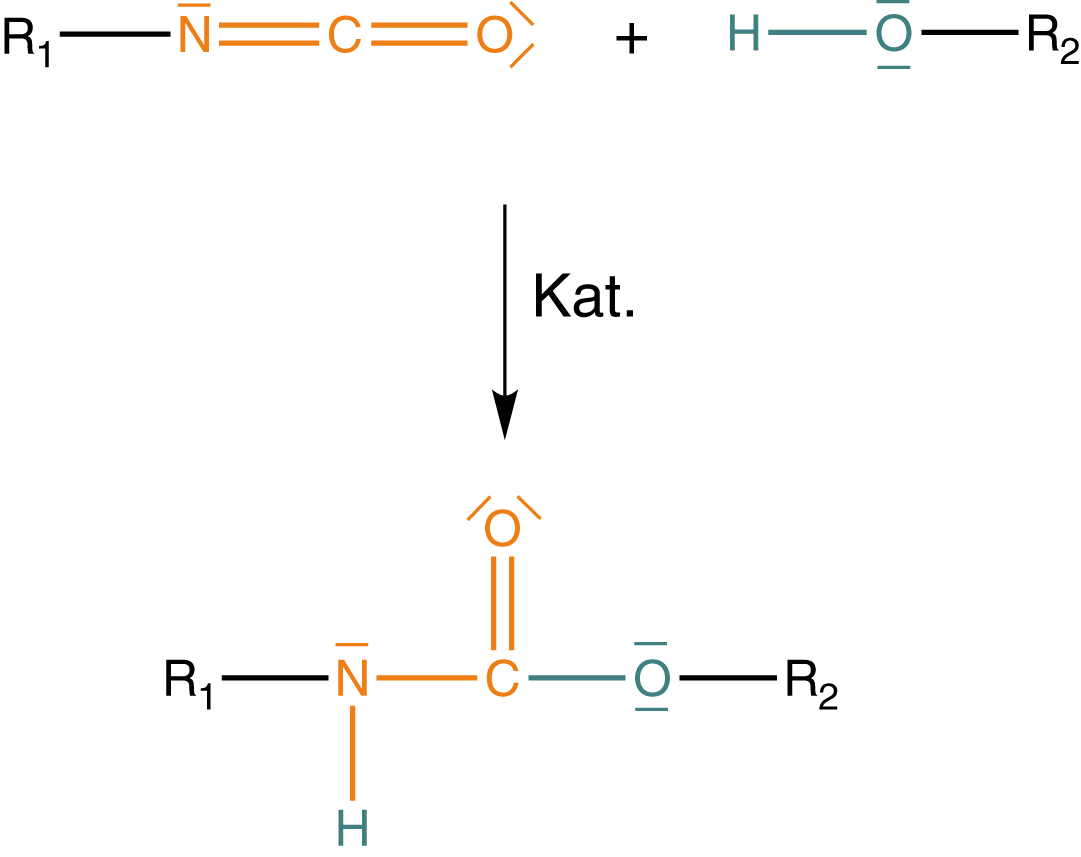
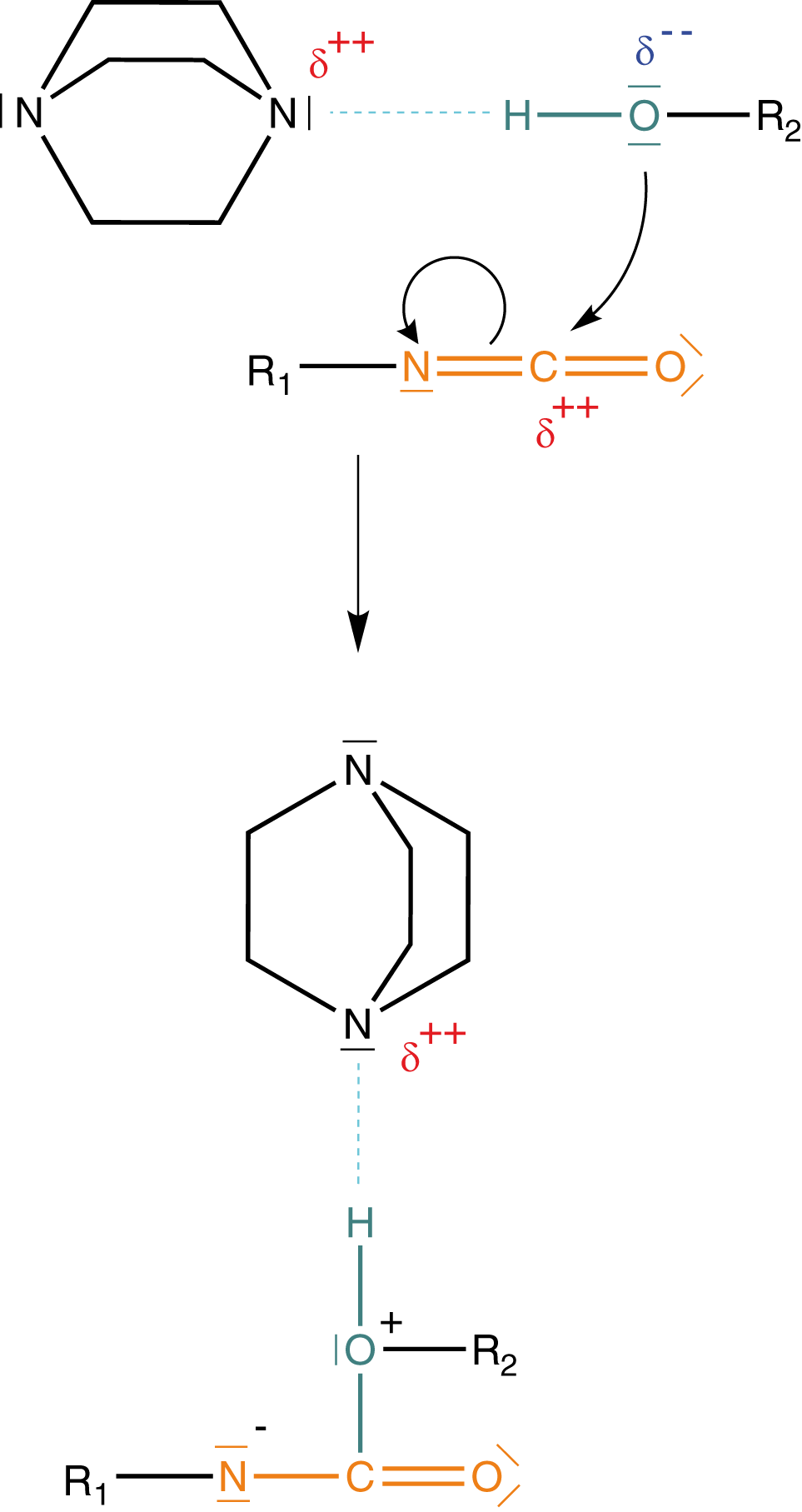
Das Isocyanat und der Alkohol reagieren unter Verwendung eines Katalysator zu einem Urethan. Hierbei kommt es während der Reaktion, zu einer Umlagerung des H-Atoms des Alkohols. Zur besseren Darstellung ist die Hydroxygruppe in Abbildung 6 blau und die Isocyanatgruppe orange eingefärbt. Dabei kannst du sehen, dass das Wasserstoffatom der Hydroxygruppe an das Stickstoffatom der ehemaligen Isocyanatgruppe umgelagert wurde. Dieser Vorgang ist charakteristisch für die Urethanbildung und weist auf eine Additionsreaktion hin.
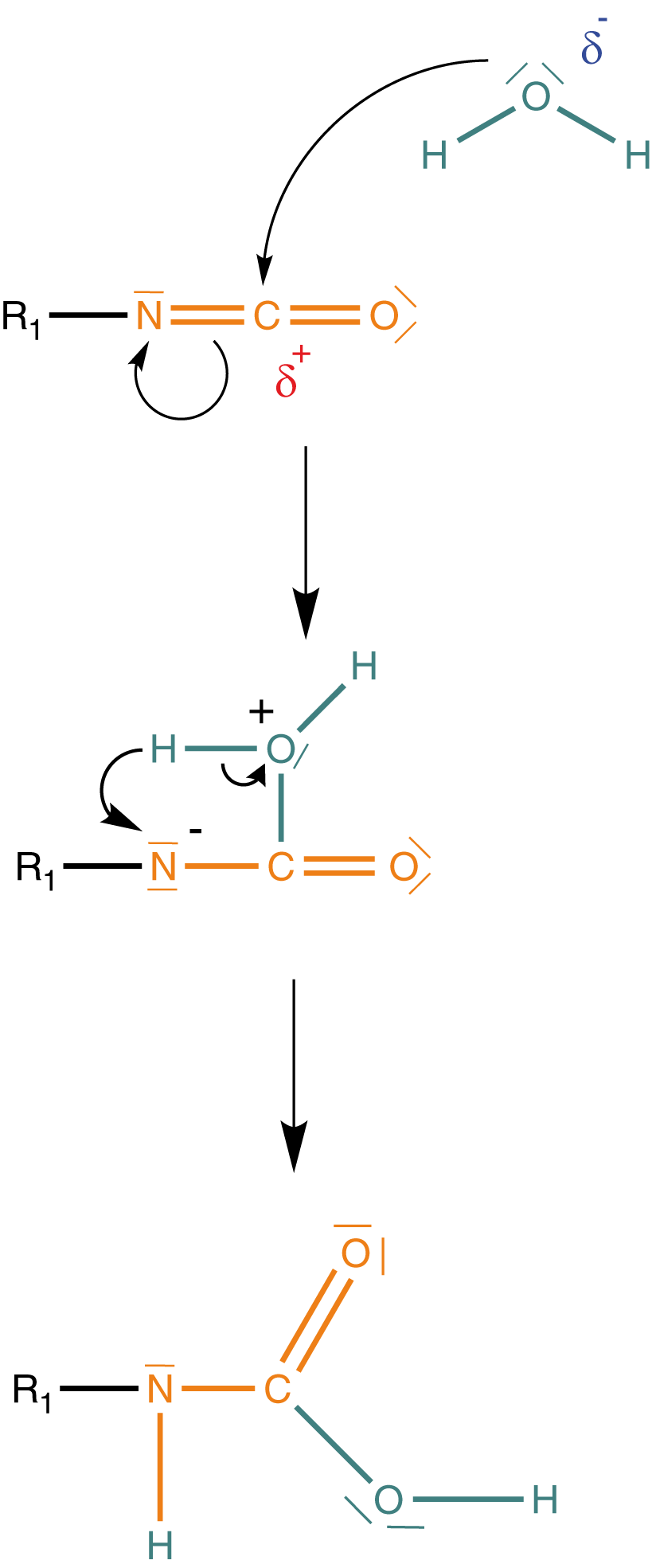
Wir wollen hier ein wenig ins Detail gehen, was die Urethandarstellung angeht. Im Rahmen dessen werden wir uns die Verwendung des Katalysators sowie die Umlagerung des Protons (-Kation) erklären können. Zur besseren Übersichtlichkeit unterteilen wir die Reaktion in Abbildung 6 in drei Schritte.
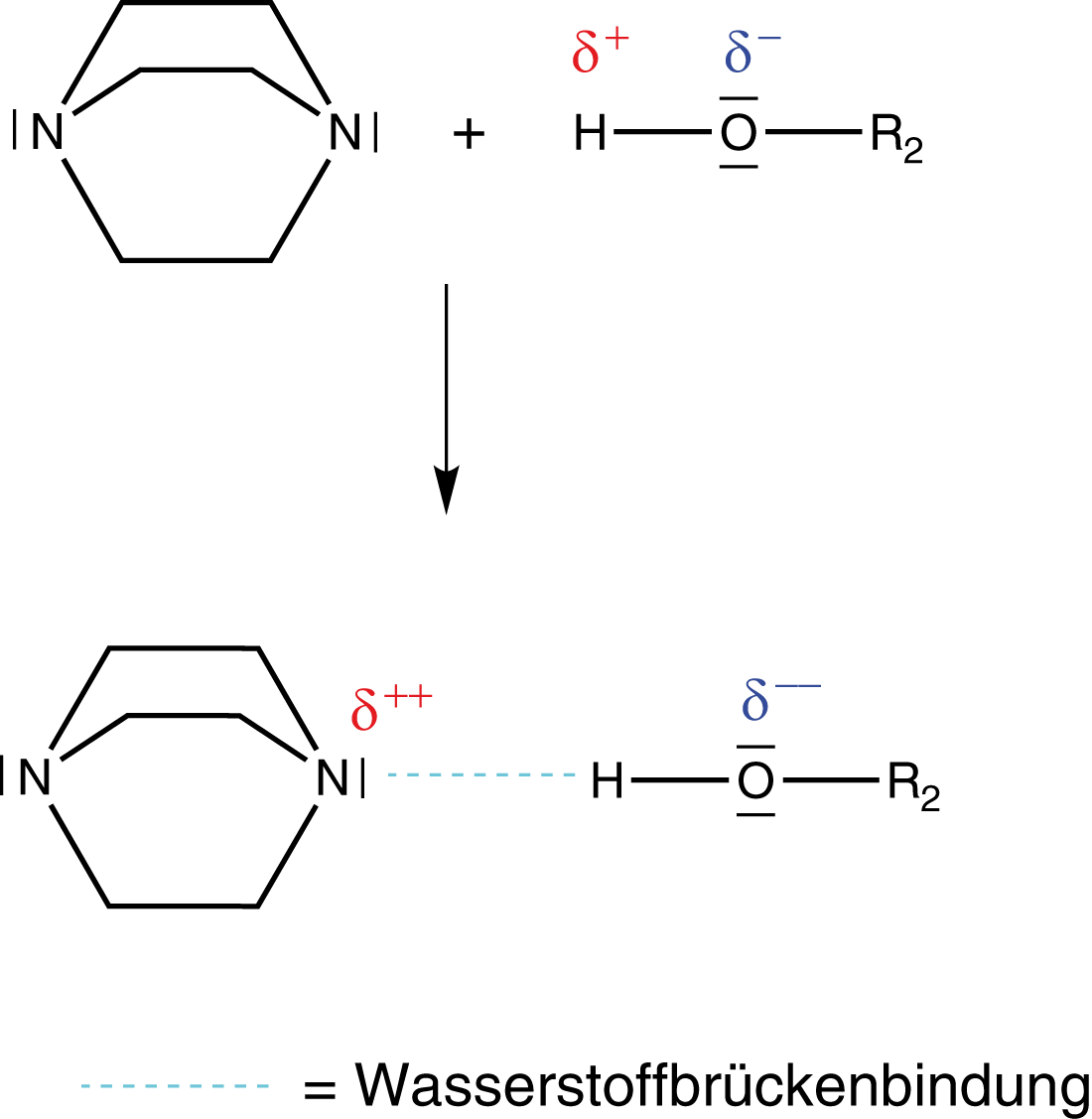
(1) Aktivierung des Alkohols durch den Katalysator
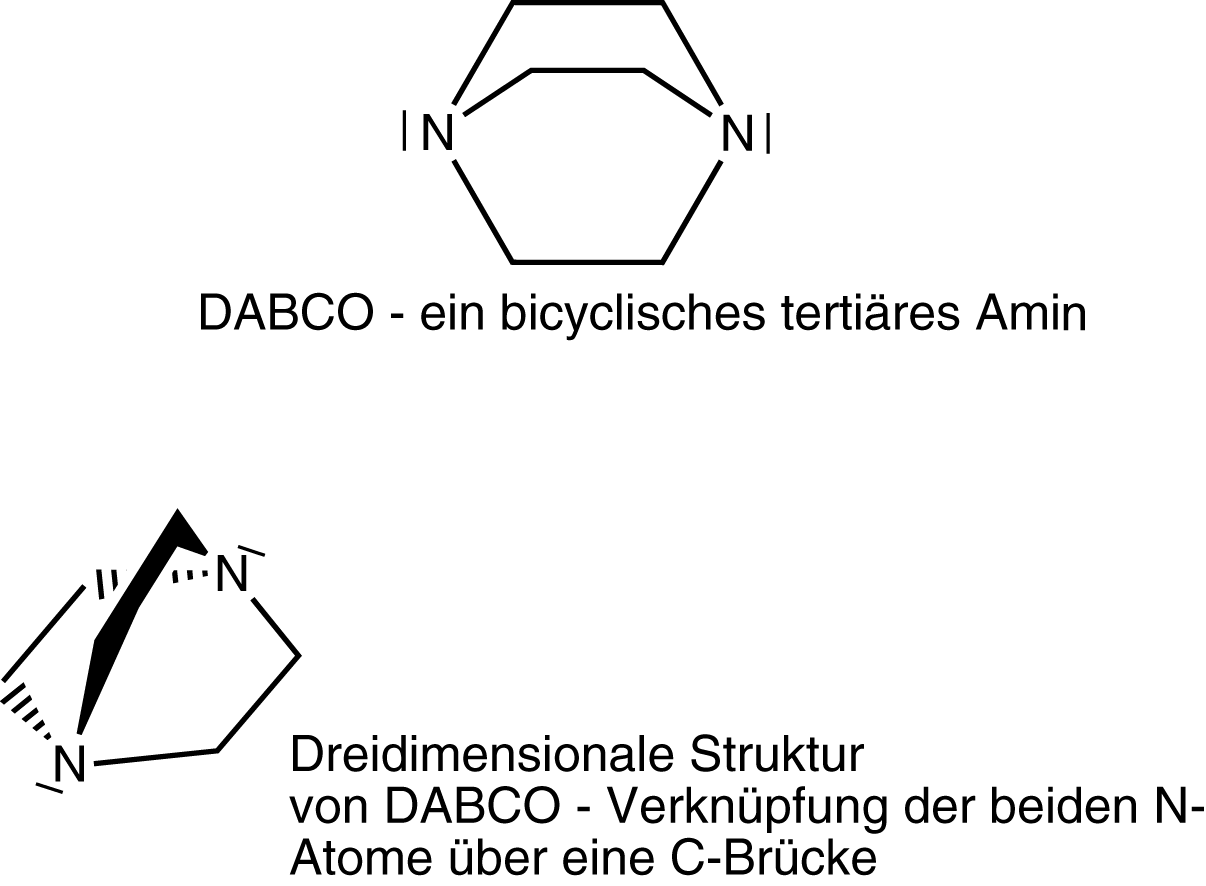
Wir benötigen einen Katalysator, um die Urethansynthese erfolgreich durchführen zu können: DABCO - 1,4-Diazabicyclo[2.2.2]octan (bzgl. der Struktur vgl. Abb. 8).
Der Katalysator aktiviert den Alkohol in der Weise, dass sich zwischen dem freien Elektronenpaar eines Stickstoffs und dem Wasserstoffatom der Hydroxygruppe des Alkohols eine Wasserstoffbrückenbindung ausbildet. Dadurch wird die positive Polarisierung auf das Stickstoffatom übertragen und das Sauerstoffatom deutlich negativer polarisiert als zuvor. Dieser Vorgang wird auch als Aktivierung des Alkohols bezeichnet. Insbesondere das O-Atom wird hier aktiviert, um anschließend in die Reaktion einzugreifen.
(2) Angriff des Alkohols
Wir ziehen hier eine Information heran, die wir bereits kennen: Das C-Atom der Isocyanatgruppe ist aufgrund der Elektronegativität von Stickstoff und Sauerstoff relativ stark positiv polarisiert (vgl. Abb. 3).
Durch die Aktivierung des Alkohols mittels DABCO (Katalysator) erhalten wir dort ein relativ stark negativ polarisiertes Sauerstoffatom. Letzteres wird nun am C-Atom der Isocyanatgruppe aufgrund des dort vorherrschenden Elektronenmangels angreifen können. Der Alkohol wird in diesem Zusammenhang auch als Nukleophil bezeichnet. Nukleophil bedeutet „kernliebend“. An einer solchen Verbindung sind relativ viele Elektronen zu finden, die eine Reaktion mit positiv polarisierten Atomen eingehen können (die positive Polarisierung bedeutet eine verminderte Elektronendichte, das heißt, dass die positive Ladung der Protonen im Kern des Atoms hier dominieren und den Angriff möglich machen).
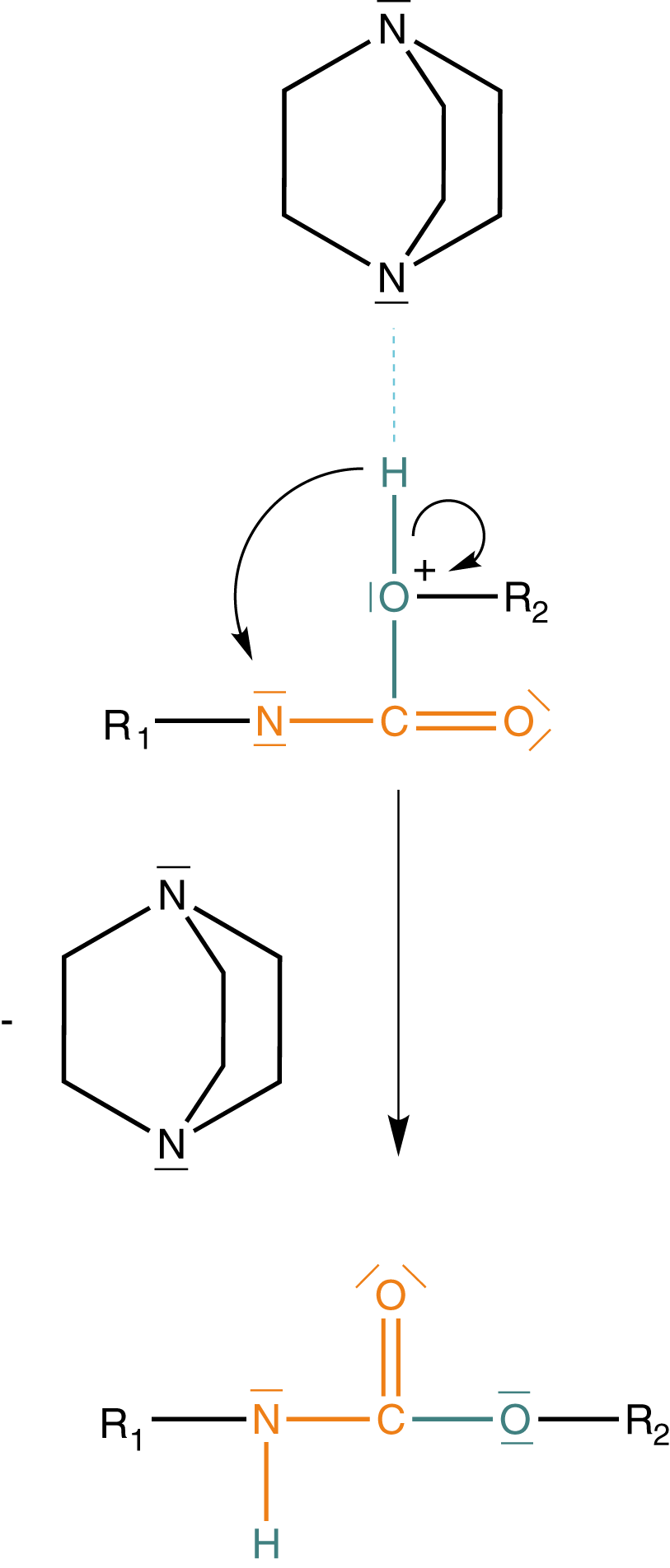
(3) Umlagerung des Protons - Urethanbildung
Im dritten Schritt löst sich die Wasserstoffbrückenbindung zwischen dem Katalysator und dem Wasserstoffatom des ehemaligen Alkohols. Anschließend kommt es zur Umlagerung des H-Atoms an eines der freien Elektronenpaare am Stickstoff der ehemaligen Isocyanatgruppe.
Der Katalysator geht unverändert aus der Reaktion hervor. Wenn wir uns die Fragen vom Anfang vergegenwärtigen, dann wissen wir jetzt, dass der Katalysator die Aktivierung des Alkohols bewerkstelligt und dass das H-Atom über eine Umlagerung an das Stickstoffatom gelangt. Bedenke, dass es sich hierbei um Details handelt, die so nicht im Abitur gefordert sind.
Zusammenfassung der Urethanbildung durch Addition
- Funktionelle Gruppen: Urethangruppen werden unter Beteiligung von Hydroxygruppen und Isocyanaten durch eine Additionsreaktion zu einem Urethan verknüpft.
- Additionsreaktion: Diese Reaktion ist eine Stufenreaktion, bei welcher im Gegensatz zur Kondensationsreaktion keine niedermolekularen Spaltprodukte anfallen.
- Katalysator: Die Additionsreaktion wird durch DABCO katalysiert; DABCO aktiviert hierbei den Alkohol, was im Anschluss die Additionsreaktion ermöglicht.
- Protonenübertragung: Bei der Bildung der Urethangruppe kommt es zur Übertragung des H-Atoms (Proton) vom Alkohol an das N-Atom des ehemaligen Isocyanats.
Wir haben nun die Bildung von Urethangruppen erarbeitet. Auf diesem Weg können wir nun ausgewählte Monomere in einer Polyaddition zu einem Polymer, dem Polyaddukt, reagieren lassen.
Das Produkt der Polyaddition - Polyurethane
Funktionalität der Monomere
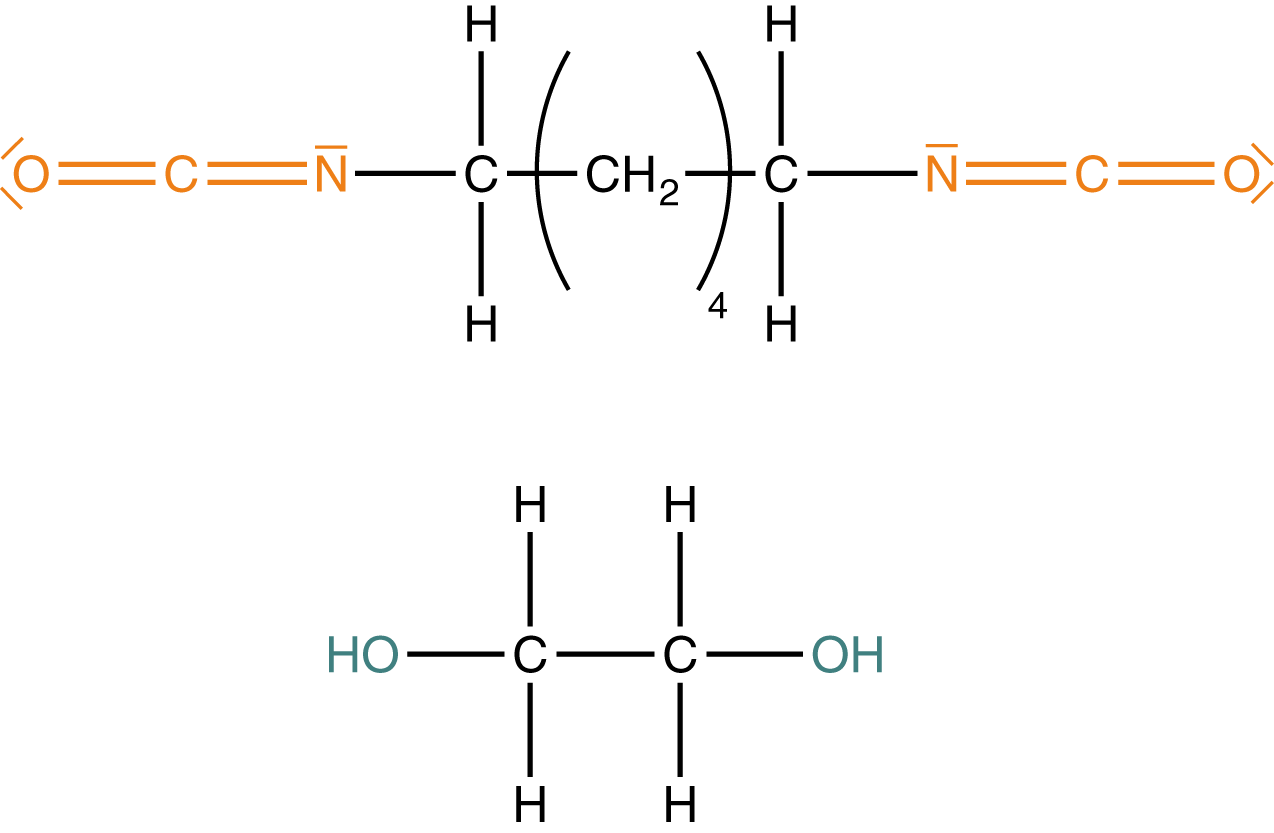
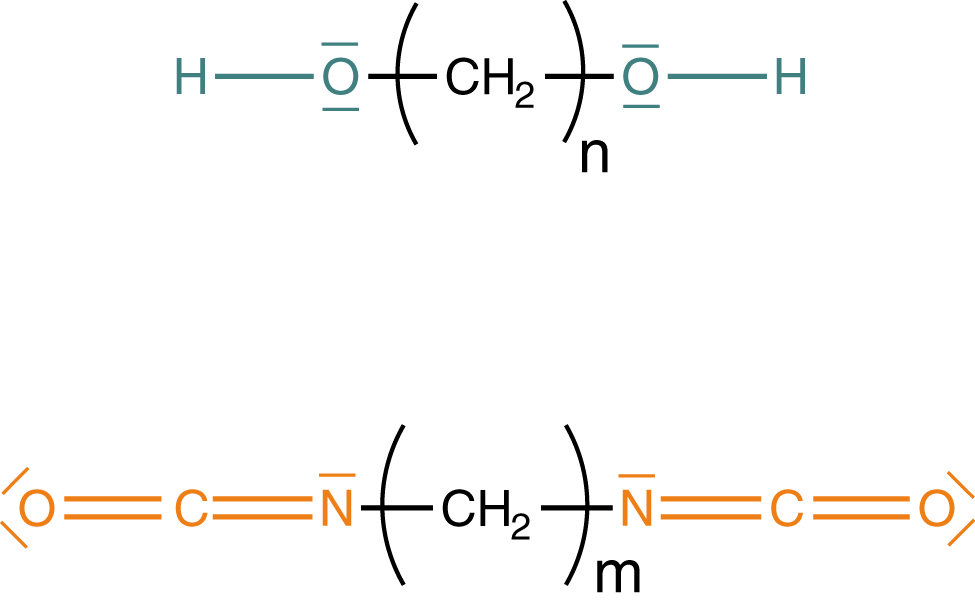
Zunächst werfen wir einen Blick auf die funktionellen Gruppen der Monomere. Wichtig ist, dass wir mindestens bifunktionelle Monomere benötigen. Das sind solche, die zwei funktionelle Gruppen aufweisen (vgl. Abb. 2 und Abb. 4) und somit zu einem kettenförmigen Polymer verknüpft werden können. Die erste Variante besteht hier darin, dass wir Diole und Diisocyanate verwenden (vgl. Abb. 11), welche je zwei identische funktionelle Gruppen aufweisen.
Eine andere Variante ist die Verwendung von bifunktionellen Monomeren, die aber zwei unterschiedliche funktionelle Gruppen aufweisen.
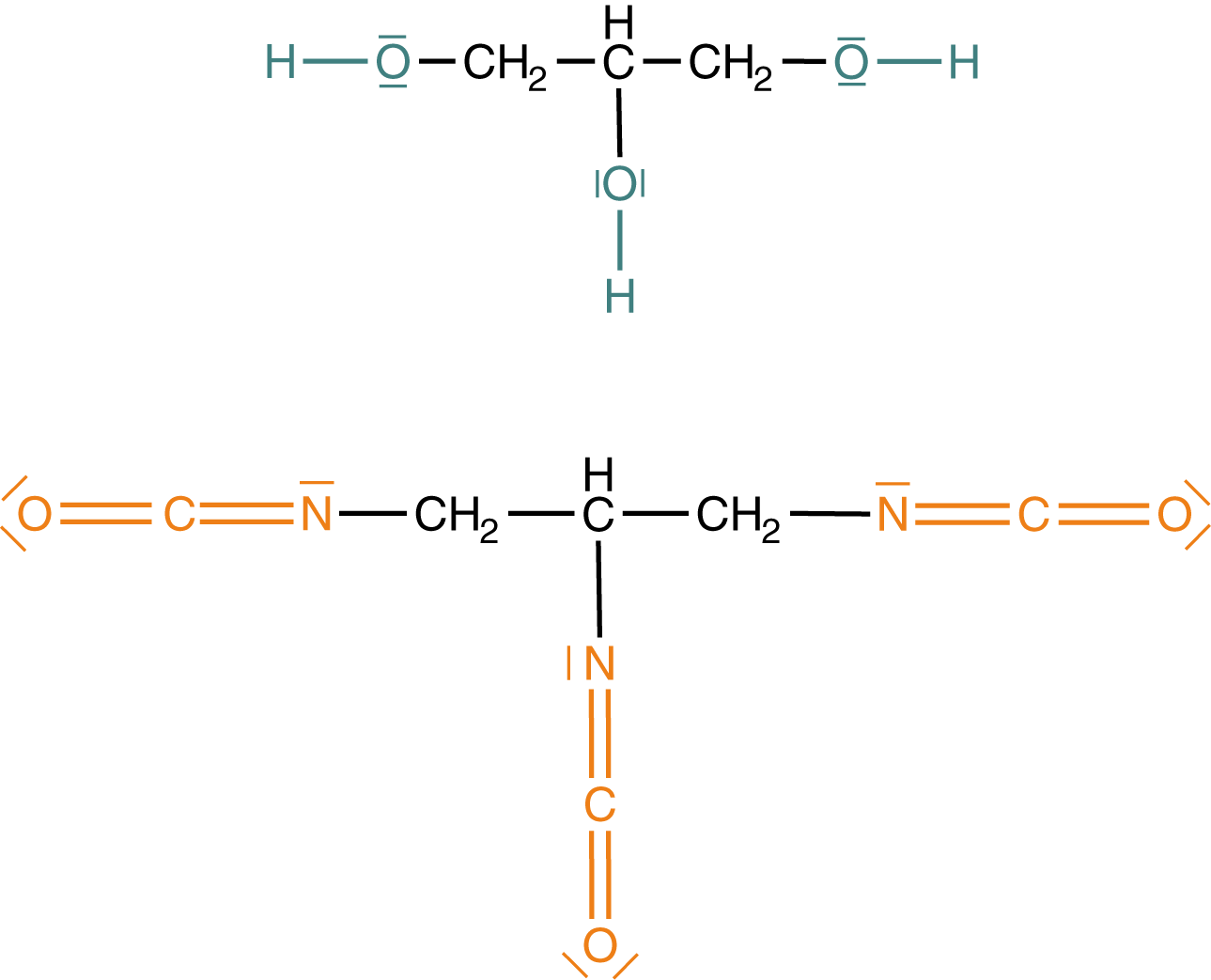
So können wir beispielsweise ein Polymer aus einem einzigen Monomer aufbauen, da wir unterschiedliche endständige funktionelle Gruppen haben. Die letzte Variante besteht in der Verwendung von polyfunktionellen Monomeren, also solchen, die mehr als zwei funktionelle Gruppen aufweisen. Mit deren Hilfe ist es möglich auch vernetzte Polymere durch Polyadditionsreaktionen zu gewinnen.
Wir haben hier beispielsweise ein Triol und ein Triisocyanat vorliegen. An allen drei funktionellen Gruppen können nun Additionsreaktionen mit den passenden Reaktanden ablaufen.
Polyurethane
Nun sind wir soweit, dass wir ein Polyurethan mittels Polyaddition herstellen können. Dazu wählen wir hier beispielhaft zwei unverzweigte Monomere mit identischen funktionellen Gruppen: Ein Diol und ein Diisocyanat. Von diesen beiden Monomeren bringen wir jeweils eine Anzahl zur Reaktion, um ein langkettiges Polyurethan zu erhalten.
Wir erhalten in diesem Fall ein kettenförmiges Polymer. Wenn wir uns hier an die Struktur-Eigenschafts-Beziehungen (vgl. ChemieLV-Skript Markomoleküle: Struktur und Eigenschaft) erinnern, dann kommen wir zu dem Schluss, dass wir durch Variation der Monomere verschiedene Polyaddukte erhalten können. Diese Variation können wir einerseits auf die Art und Anzahl der funktionellen Gruppen beziehen (4.1) oder wir schauen uns die Struktur der Monomere an. Haben wir bspw. aromatische Komponenten (vgl. Abb. 2) vorliegen, dann wirkt sich dieser Umstand direkt auf die Eigenschaften des Kunststoffs aus. In diesem Fall wären dann beispielsweise stärkere Van-der-Waals Kräfte möglich, welche sich positiv auf die Stabilität des Materials auswirken. Kettenförmige Polyaddukte würden hingegen sehr viel schwächere intermolekulare (zwischenmolekulare) Kräfte aufweisen, was sich beispielsweise im thermischen Verhalten widerspiegeln kann.
Geschäumte Polyurethane
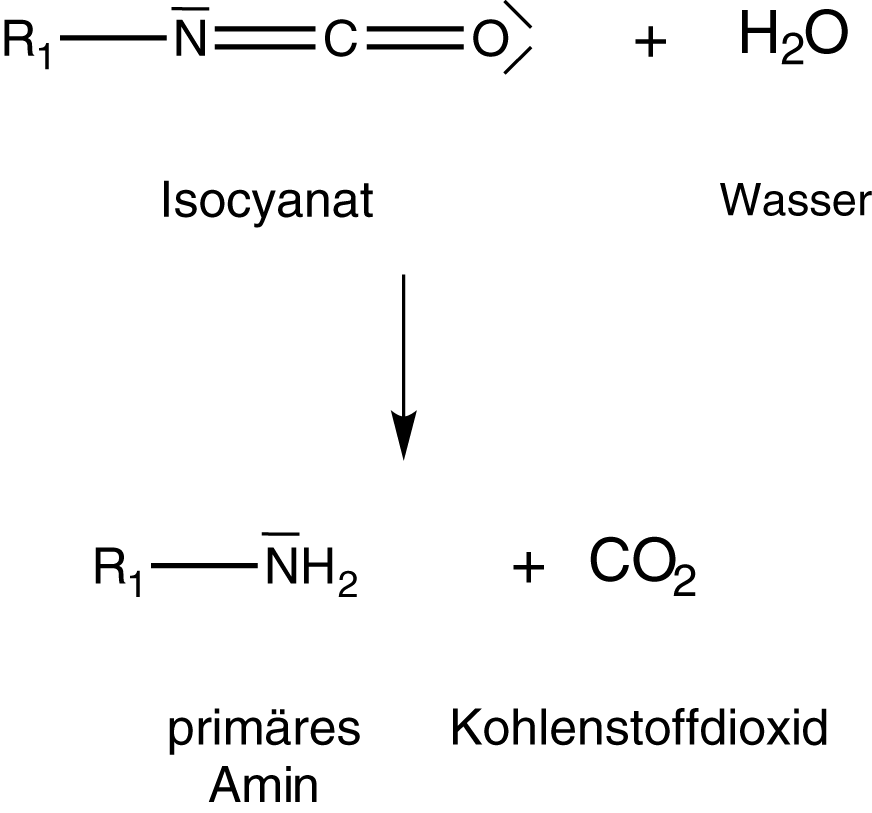
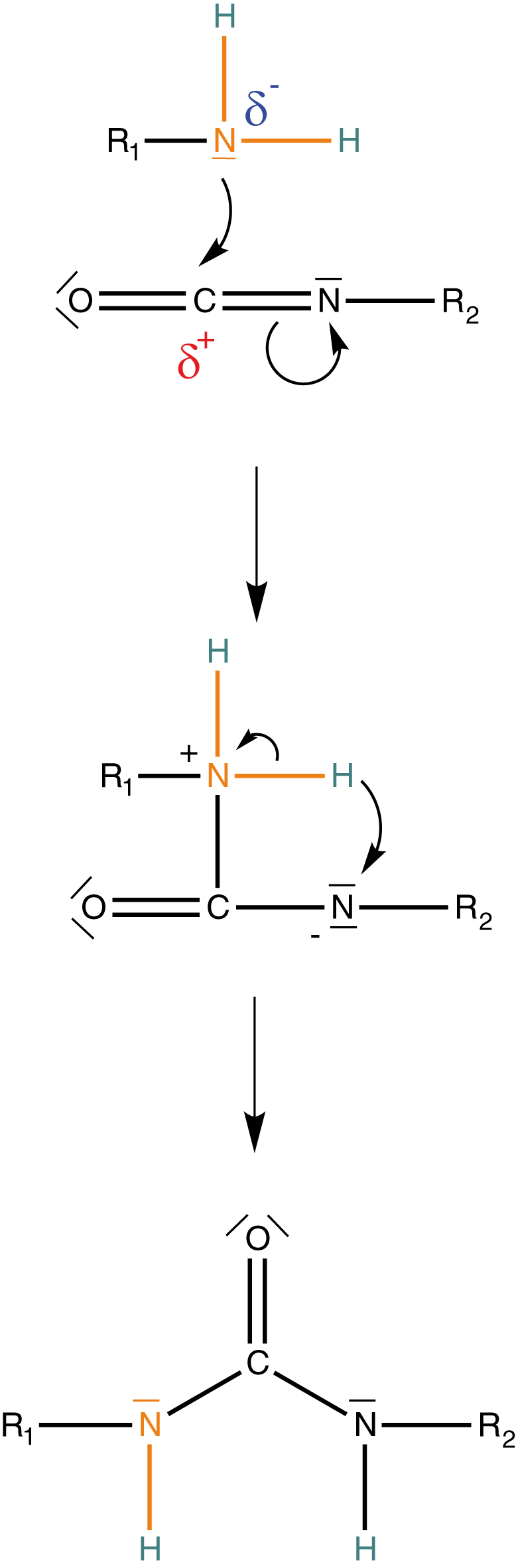
Wenn die Bildung von Urethanen mit einer Gasentwicklung kombiniert wird, dann erhalten wir ein geschäumtes Material. Das kannst du dir so vorstellen, dass das Gas, welches bei der Reaktion frei wird, im Material „gefangen“ bleibt und nicht entweichen kann. Durch die vielen kleinen Gasblasen im Material erhöht sich dessen Volumen. Die Grundlage dieses Prozesses ist die Reaktion von Wasser mit Isocyanat (vgl. Abb. 15).
Betrachten wir das Schäumen von Urethanen detaillierter, dann sehen wir woher das Kohlenstoffdioxid genau kommt. Des Weiteren können wir noch eine weitere Besonderheit erkennen, die sich direkt auf das Produkt auswirkt und hier in Schritt 3 dargstellt ist: Die Bildung von Harnstoff.
(1) Angriff von Wasser an Isocyanat
Hierbei entsteht eine Carbamidsäure. Wichtig ist, dass es sich hierbei um eine endständige funktionelle Gruppe handelt. Diese Verbindung ist nämlich sehr instabil, was wir gleich im Anschluss sehen werden. Die Ester der Carbamidsäure kennen wir bereits: die Urethane.
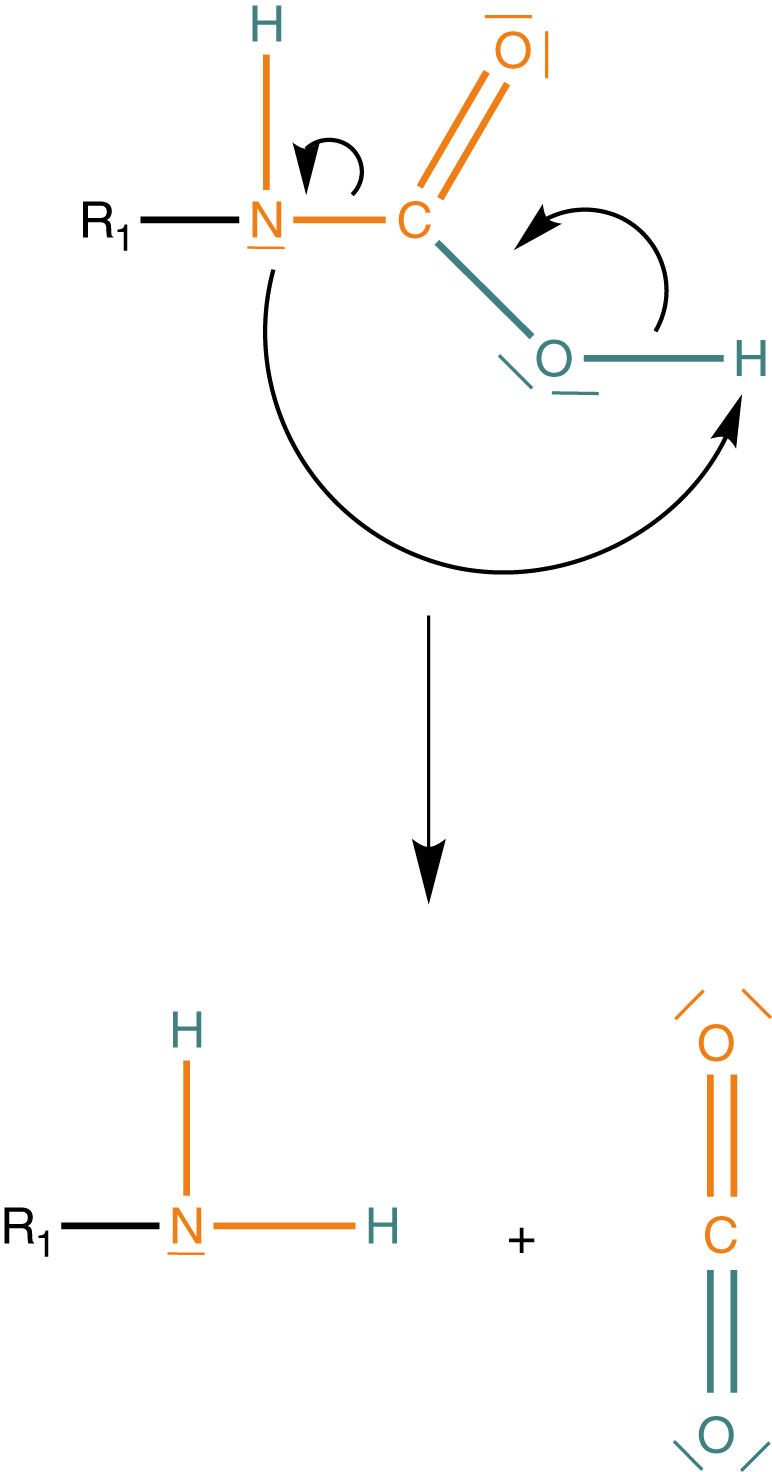
(2) Amidbildung unter Abspaltung von Kohlenstoffdioxid
(3) Bildung von Harnstoffgruppen
Das bedeutet, dass in einem geschäumten Polyurethan einige der Urethangruppen durch Harnstoffgruppen ersetzt sind.