Korrosion
Definition
Unter dem Begriff der Korrosion verstehen wir die Oxidation von Metallen, die zur Beeinträchtigung der Eigenschaften eines metallischen Werkstoffs führen kann. Wir kennen alle die Bilder von verrosteten Fässern oder technischen Bauteilen und verbinden damit den Verfall des Materials.
Wir wollen uns in diesem Skript mit den elektrochemischen Grundlagen der Korrosion beschäftigen. Hierzu werden wir viele der Grundlagen benötigen, die du in den anderen Skripten des ChemieLV-Themengebiets Elektrochemie finden kannst. Bei Bedarf kannst du dein Grundlagenwissen also jederzeit dort auffrischen.
Im ersten Teil dieses Skripts beschäftigen wir uns mit dem Begriff des Lokalelements und lernen die beiden wichtigsten Korrosionsprozesse kennen: die Säure- und die Sauerstoffkorrosion. Der zweite Teil konzentriert sich dann auf den Korrosionsschutz, in dessen Rahmen wir uns den Begriff der Passivierung anschauen und insbesondere einen Blick auf die Opferanode werfen werden.
Lokalelemente
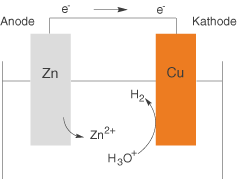
Wenn wir ein Lokalelement theoretisch beschreiben wollen, dann können wir uns ein kurzgeschlossenes galvanisches Element vorstellen (vgl. Abb. 1).
Praktisch gesehen kann ein Lokalelement dann entstehen, wenn ein Metall metallische Verunreinigungen aufweist, wobei es sich bei den Verunreinigungen um edlere Metalle handelt. Wir wollen anhand von Abbildung 1 eine kurze Wiederholung des galvanischen Elements durchführen. Dieses setzt sich hier aus zwei Metallen mit unterschiedlichen Standardpotentialen zusammen, die über einen elektrischen Leiter miteinander verbunden sind. Im Fall des dargestellten galvanischen Elements ist Zink das unedlere und Kupfer das edlere Metall. Die freien Elektronen, die durch die Oxidation von Zink an der Anode entstehen, können ungehindert zur Kathode in Form des Kupferblechs fließen. Dort findet anschließend die Reduktion von
statt.
Wir wollen uns nun die beiden primären Mechanismen der Korrosion im Detail anschauen und verstehen lernen, welche elektrochemischen Prozesse unter welchen Randbedingungen relevant werden. Unter Randbedingung verstehen wir hierbei die vorherrschenden Einflüsse von außen, also ob bspw. Wasser vorhanden ist oder ob wir uns in einer sauerstoffreichen Umgebung aufhalten. Beide Fällen schauen wir uns am bereits gewählte Beispiel der Zink-- und Kupferelektrode an.
Säurekorrosion
Das zentrale Element der Säurekorrosion lässt sich direkt aus dem Begriff an sich ableiten: Die Anwesenheit einer Säure bzw. allgemeiner gesagt die Anwesenheit von Oxonium-Ionen . Betrachten wir zunächst nur ein Zinkblech, dass in Kontakt zu einer Säure steht. Hier geschieht nichts, was bedeutet, dass die Reduktion von
zu
an Zink nicht ablaufen wird. Diese Reaktion ist kinetisch gehemmt, da die auftretende Überspannung zu hoch ist (vgl. ChemieLV-Skript Die Elektrolyse).
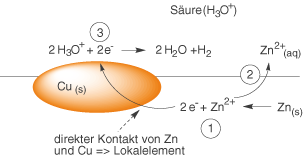
An Kupfer fällt diese Überspannung sehr viel niedriger aus, sodass diese Reaktion dort ungehindert ablaufen könnte. Stellen wir uns vor, dass unser Zinkblech Verunreinigungen von Kupfer aufweist, dann erhalten wir hier viele kleine Lokalelemente (vgl. Abb. 2).
Wir wollen nun schrittweise die drei relevanten Schritte dieser Redox-Reaktion anschauen. Unsere Randbedingungen sind dabei folgende: Wir haben eine saure, wässrige Lösung () sowie festes Kupfer (
) und festes Zink (
) vorliegen.
- Zink wird unter Abgabe von zwei
zu
-Kationen oxidiert.
--Kationen gehen in Lösung:
- Die Elektronen können ungehindert zur Kupferverunreinigung fließen (Lokalelement), an welcher die Reduktion der
, die in Form der Oxonium--Ionen gebunden vorliegen stattfindet. Es bildet sich elementarer Wasserstoff (
).
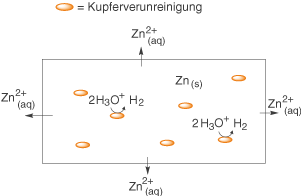
Sieht unser verunreinigtes Zinkblech in etwa so aus wie in Abbildung 3, dann kannst du dir vorstellen, dass diese Redox-Reaktion an vielen Stellen stattfindet und das Zinkblech so effektiv korrodiert wird.
Notieren wir zum Schluss noch die beiden Teilreaktionen und fassen sie dann zur Gesamtreaktion zusammen.
Oxidation
Reduktion
Redox-Reaktion
Zusammenfassend können wir hier folgendes sagen: Die Säurekorrosion findet dann statt, wenn ein Metall mit einem edleren verunreinigt ist bzw. wenn ganz allgemein ein Kontakt zwischen zwei solchen Metallen besteht. Im Bezug auf den letzten Aspekt kannst du dir bspw. Messingschrauben vorstellen, die sich in Kontakt zu einem Eisenblech befinden. Ein anderes Beispiel ist die Beschädigung von beschichteten Bauteilen. Haben wir ein metallisches Bauteil vorliegen, dessen Oberfläche mit einem edleren Metall beschichtet ist und eine Beschädigung, die diese Beschichtung durchschlägt, dann liegt wiederum effektiv ein Lokalelement vor. Bei der Säurekorrosion kommt es zur Auflösung des unedleren Metalls indem es oxidiert wird. Gleichzeitig werden Oxonium-Ionen unter Entwicklung von elementarem Wasserstoff reduziert.
Sauerstoffkorrosion
Die zweite Variante der Korrosion bezieht die Anwesenheit von elementarem Sauerstoff mit ein, weshalb diese auch als Sauerstoffkorrosion bezeichnet wird. Ein entscheidender Aspekt ist hierbei wiederum die Anwesenheit von Wasser. Du könntest jetzt natürlich auch argumentieren, dass dann auch die bereits besprochene Säurekorrosion auftreten könnte. Wenn du dich jedoch an die Begrifflichkeit an sich erinnerst, dann fällt auf, dass bei der Säurekorrosion pH--Werte im sauren Milieu () notwendig sind, damit die Redox--Reaktion effektiv stattfinden kann. Betrachten wir jedoch pH--Werte im neutralen (
) und alkalischen Milieu (
), dann ist die Konzentration der Oxoniumionen}zu gering, als dass sie effektiv zu einer Oxidation des Metalls beitragen wörde. Hier kommt dann der elementare Sauerstoff ins Spiel. Die Sauerstoffkorrosion tritt beispielsweise dann auf, wenn Eisen beginnt zu rosten. Wir schauen uns den Prozess zunächst beispielhaft anhand der Teilreaktionen an:
Oxidation
Elementares Eisen wird unter Abgabe von zwei Elektronen zu Eisen(II)-Kationen oxidiert.
Reduktion
Elementarer Sauerstoff wird unter Anwesenheit von Wasser zu --Anionen reduziert, die in Form von Hydroxid--Anionen (
) vorliegen. Es sei an dieser Stelle bereits erwähnt, dass die Prozesse, die im Rahmen der Sauerstoffkorrosion ablaufen und insbesondere im hier angeführten Prozess des Rostens sehr komplex sind. Dementsprechend wollen wir uns vor allem darauf konzentrieren das Konzept der Sauerstoffkorrosion an sich zu verstehen. Die ablaufenden, komplexen Prozesse werden wir nur andeuten, aber nicht vertiefend besprechen.
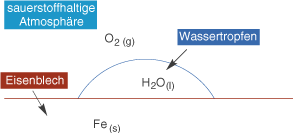
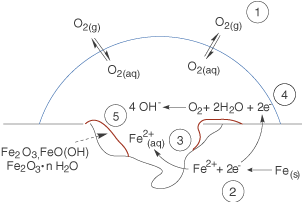
Stellen wir uns ein Eisenblech vor, welches eine Weile im Regen stand. Dort haben wir einen direkten Kontakt von Eisen und Wasser sowie elementarem Sauerstoff, welcher sich in der Atmosphäre wiederfindet (vgl. Abb. 4).
Nun wenden wir uns den chemischen Prozessen zu. In Abbildung 5 sind die wichtigsten Stellen durch Nummern hervorgehoben, die wir weiter unten besprechen. Hierbei betrachten wir zwei räumliche Bereiche eines Tropfens auf dem Eisenblech:
- Den Tropfenrand, an dem Sauerstoff (
) aus der Atmosphäre vorhanden ist.
- Das Tropfeninnere, in welchem der Sauerstoff durch die ablaufenden Redox--Prozesse bereits aufgebraucht ist.
Wir wollen nun die verschiedenen chemischen Prozesse ansprechen, die hier ablaufen. Um das doch relativ komplex anmutende Schaubild zu entwirren, gehen wir schrittweise vor.
- Elementarer Sauerstoff (
) aus der Atmosphäre löst sich im Wasser des Tropfens.
- Elementares Eisen (
) wird unter Abgabe von zwei Elektronen zu
--Kationen oxidiert.
--Kationen gehen in Lösung und befinden sich nun im Tropfen.
- Die beiden Elektronen, die in Schritt 2 formal frei wurden, führen am Rand des Tropfens zusammen mit Wasser (
) zur Reduktion von elementarem Sauerstoff. Es werden Hydroxid--Anionen (
) gebildet, die sich ebenfalls in Lösung befinden.
- Freie Eisenkationen und Hydroxid--Anionen reagieren in Lösung miteinander, was zur Ausbildung einer Vielzahl so genannter Eisenoxohydroxide führt. Hierbei kann das Eisen auch von
zu
oxidiert werden, so dass Verbindungen wie
und
entstehen können.
Insbesondere der erste Schritt, der dafür sorgt, dass Sauerstoff vorhanden ist, ist zentral für die Sauerstoffkorrosion. Ohne Sauerstoff ist diese Redox--Reaktion nicht möglich. Wir können nun die beiden Reaktionsgleichungen der Reduktion und Oxidation zur Gesamtgleichung für die Redox--Reaktion zusammenfassen. Hierbei gilt es zu beachten, dass wir vier Elektronen für die Reduktion des Sauerstoffs benötigen. Somit multiplizieren wir die Reaktionsgleichung der Oxidation von Eisen noch mit einem Faktor zwei.
Redox-Reaktion
Korrosionsschutz
Korrosion führt dazu, dass metallische Werkstoffe meist irreparabel geschädigt werden. Es ist naheliegend, dass eine solche Schädigung nicht erwünscht ist. Mit einem verrosteten Fahrrad lässt es sich eben nicht gut fahren. Aus diesem Grund sind verschiedene Methoden müglich, um metallische Werkstoff gegen Korrosion zu schützen. Wir sprechen in diesem Zusammenhang dann auch von Korrosionsschutz.
Passivierung
Die Passivierung zielt darauf ab die Metalloberfläche so zu verändern, dass sie besonders reaktionsträge ist. Somit können die negativen elektrochemischen Prozesse nicht zur Entfaltung kommen. Die Oberflächen der Metall bestehen dann meist aus Oxiden oder Hydroxiden, welche sehr viel weniger reaktiv sind als das elementare Metall. In diesem Zusammenhang fällt auch der Begriff der Passivität des Metalls. Ein Beispiel für ein passiviertes Metall ist Aluminium. Aluminium geht sehr gerne Reaktionen mit Sauerstoff ein, was dazu führt, dass es eine sehr beständige und widerstandsfähige „Schutzschicht“ aufweist. Diese macht Aluminium zu einem sehr witterungs-- und korrosionsbeständigen Werkstoff. Die Passivierung wird auch in technischem Maßstab durchgeführt, um die werkstoffbezogenen Eigenschaften von Aluminium zu verbessern.
Korrosionsschutz - Die Opferanode
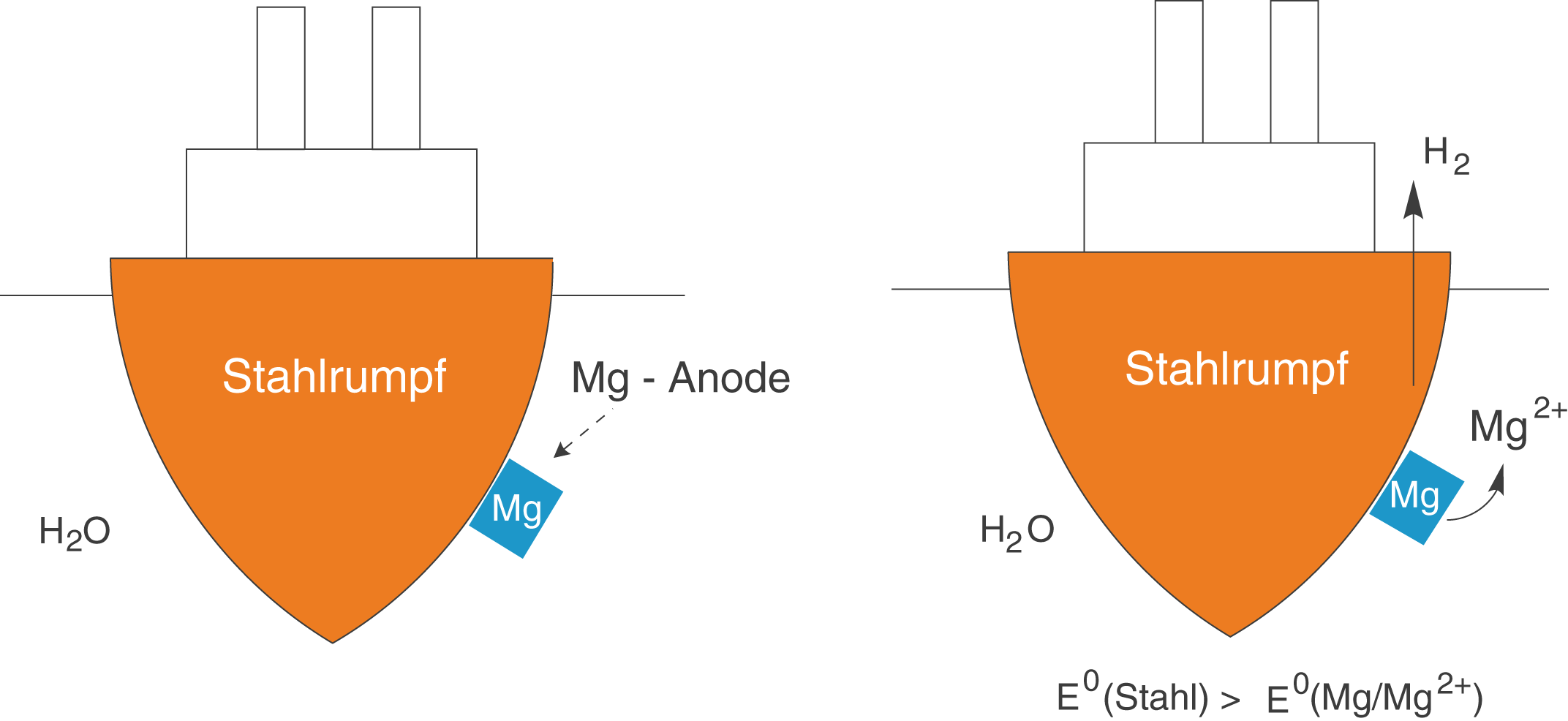
Eine weitere, sehr raffinierte Methode die Auswirkungen der Korrosion zu vermeiden bzw. zu umgehen, basiert auf der Verwendung einer sogenannten Opferanode. Dabei geht es wirklich konkret um eine Anode, die aus einem ausgewählten Element besteht und die der Korrosion zum „Opfer fallen“ darf. Wir wollen uns dieses Konzept am Beispiel eines Schiffsrumpfes aus Stahl und einer Magnesiumanode anschauen. Unser Ziel ist es die Korrosion des Stahls des Schiffsrumpfes zu verhindern, damit das Schiff seine Überfahrt nicht verfrüht beenden muss (vgl. Abb. 6).
Um dieses Vorhaben erfolgreich umzusetzen, verwenden wir ein unedleres Material als Stahl. Dieses Material stellt unsere Opferanode dar. In diesem Fall verwenden wir Magnesium. Das Standardredoxpotential von Stahl ist hier größer als das von Magnesium (
): Magnesium ist das unedlere Metall. Die Reaktionen, die hier ablaufen haben wir schon im Rahmen der Säurekorrosion kennen gelernt. Den wichtigsten Bestandteil liefert das Wasser selbst. In Wasser befinden sich immer Oxonium--Ionen
erinnere dich hier an die Autoprotolyse des Wassers). Damit können wir nun die beiden Teilreaktionen sowie die Redox--Reaktion formulieren.
Wir wissen, dass Magnesium in Lösung gehen wird. Demnach handelt es sich hier um die Oxidation. Da die Oxidation immer an der Anode abläuft, sprechen wir deshalb auch von der Opferanode.
Oxidation
Elementares Magnesium wird unter Abgabe von zwei Elektronen zu --Kationen oxidiert.
Reduktion
in
wird zu elementarem Wasserstoff reduziert. Diese Reaktion läuft am Schiffsrumpf ab. Die Gesamtreaktionsgleichung der Redox--Reaktion ergibt sich zu:
Redox-Reaktion
Somit können wir folgendes festhalten:
- Magnesium ist bzgl. des Standardredoxpotentials das unedlere Metall im Vergleich zu Stahl.
- Es läuft praktisch der Prozess der Säurekorrosion ab, welcher zur Auflösung der Opferanode führt, während der Stahlrumpf des Schiffs geschützt ist.
Zusammenfassung
- Unter dem Begriff der Korrosion verstehen wir die Oxidation von Metallen, die zur Beeinträchtigung der Eigenschaften eines metallischen Werkstoffs führen kann.
- Ein Lokalelement entspricht einem kurzgeschlossenen galvanischen Element. Die Elektronen können somit ungehindert von der Anode (dem unedleren Metall) zur Kathode (dem edleren Metall) fließen.
- Es werden zwei Korrosionstypen unterschieden: die Säurekorrosion und die Sauerstoffkorrosion.
- Im Rahmen der Säurekorrosion werden
zu
reduziert. Gleichzeitig wird der Hauptwerkstoff oxidiert und geht in Form von Kationen in Lösung. Diese Reaktion läuft an Verunreinigungen in Metallen ab, wobei die metallischen Verunreinigungen edler sind, als der Hauptwerkstoff.
- Die Sauerstoffkorrosion basiert auf der Reduktion von Sauerstoff unter Anwesenheit von Wasser.
- Sauerstoff wird reduziert, während der metallische Werkstoff (bspw. Eisen) oxidiert wird.
- Die Sauerstoffkorrosion ist verantwortlich für den Prozess, den wir aus dem Alltag unter dem Begriff des Rostens kennen.
- Um Korrosion zu verhindern wird insbesondere in technischen Bereichen der Korrosionsschutz betrieben.
- Im Falle der Passivierung schützt eine unreaktive Schicht an der Oberfläche des Metalls gegen die Korrosionsprozesse. Hierbei kann es sich beispielsweise um eine Oxidschicht handeln, wie es bei Aluminium der Fall ist.
- Opferanoden nutzen das Prinzip der Korrosion aus, um einen edleren Werkstoff zu schützen. Dabei löst sich die Opferanode auf Grundlage der Säurekorrosion auf, womit die Korrosion vom Werkstoff, wie bspw. Stahl, abgewendet wird.