Stickstoff-und Schwefelverbindungen
Einführung und Definition
Dieses Skript stellt das letzte des ChemieLV-Themengebiets Organische Chemie dar. Wir werfen hier einen Blick auf ausgewählte organische Stickstoff- und Schwefelverbindungen, die im Rahmen des ChemieLV-Basiswissen zur Sprache kommen. Das bedeutet, dass wir uns insbesondere auf zwei relevante funktionelle Gruppen bzw. Verbindungen konzentrieren wollen:
- Die Aminogruppe und ihre Basizität sowie die Peptidgruppe.
- Thiole im Kontext der Aminosäuren und die Disulfidbrücken.
Es handelt sich hier um einen minimalen Ausschnitt dessen, was wir tatsächlich in der organischen Chemie an Stickstoff-- und Schwefelverbindungen finden können. Dir sollte also bewusst sein, dass sich dieses Skript im Rahmen des ChemieLV-Basiswissen bewegt und nicht darüber hinausgeht; du wirst alle hier genannten Verbindungen und deren Eigenschaften auch in den entsprechenden Skripten der jeweiligen Themengebiete finden.
Stickstoffverbindungen in der organischen Chemie
Amine und die Aminogruppe
Die relevanteste funktionelle Gruppe in der organischen Chemie, die ein Stickstoffatom enthält und im ChemieLV-Basiswissen auftaucht, ist die Aminogruppe. Diese finden wir an zwei Stellen:
- Im ChemieLV-Skript Polymersynthese II: Polykondensation, wo wir sie im Rahmen der Polyamidbildung als Reaktand kennen gelernt haben.
- Im ChemieLV-Skript Aminosäuren, wo die Aminogruppe zusammen mit der Carboxygruppe den Grundaufbau von Aminosäuren definiert.
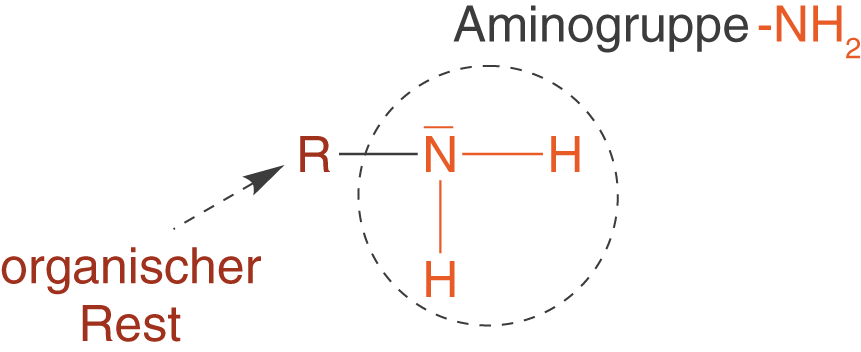
Die Verbindung leitet sich strukturell von Ammoniak (
) ab, wobei wir eines der H-Atome durch einen organischen Rest R ersetzt haben. Da es sich bei der Aminogruppe um eine endständige funktionelle Gruppe handelt, sprechen wir bei
auch von einem primären Amin. Im ChemieLV-Skript Polymersynthese II: Polykondensation setzen wir solche primären Amine ein, um diese im Rahmen einer Kondensationsreaktion mit Carbonsäuren zu Polymeren vom Typ der Polyamide umzusetzen.
Basische Eigenschaften der Aminogruppe
Grundlegendes zur Aminogruppe
Wir kennen Ammoniak als schwache Base mit einem -Wert von ca. 4,75. Die Basizität kommt in dem Fall vom freien Elektronenpaar des Stickstoffatoms, da hier ein freies Proton
aufgenommen werden kann (Protonenakzeptor). Die Aminogruppe leitet sich strukturell wie bereits erwähnt von Ammoniak ab, was dazu führt, dass hier ebenfalls ein freie Elektronenpaar am Stickstoffatom vorhanden ist: Die Aminogruppe reagiert ebenfalls basisch (vgl. Abb. 2).
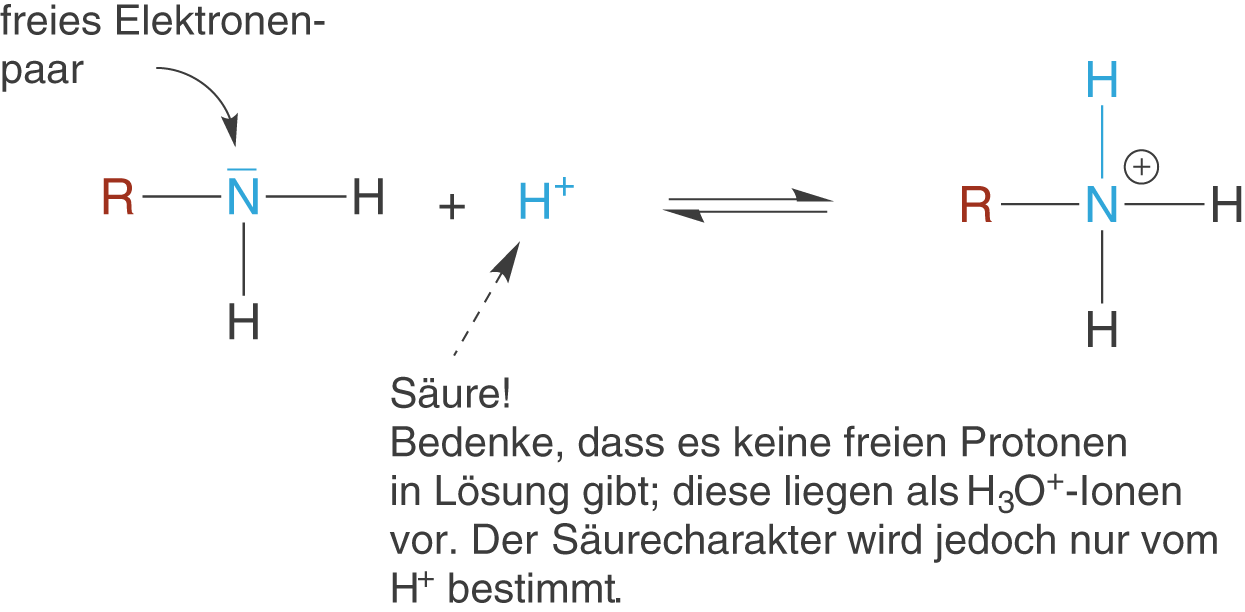
Diese Eigenschaft ist ganz zentral im Fall der Aminosäuren. Dort haben wir innerhalb eines Moleküls neben der Aminogruppe auch eine Carboxygruppe () vorliegen, wobei letztere sauer reagiert. Hier kommt es zu einer Protolysereaktion innerhalb des Moleküls; es bildet sich das sogenannte Zwitterion aus, dass sowohl eine negative als auch eine positive Ladung trägt. Die Auswirkungen dieses Umstands bzgl. der Chemie von Aminosäuren besprechen wir ausführlich im ChemieLV-Skript Aminosäuren.
Einfluss der Substituenten auf die Basizität
Bisher haben wir uns ganz allgemein mit den basischen Eigenschaften der Aminogruppe auseinandergesetzt und uns nicht um den organischen Rest R gekümmert. Wir wollen uns diesen nun genauer anschauen und den Einfluss auf die basischen Eigenschaften der Aminogruppe am Beispiel von Anilin kennen lernen. Anilin ist ein Aromat, was bedeutet, dass es sich bei dem Rest um einen Phenylrest handelt (vgl. ChemieLVSkript Aromaten). Betrachten wir nun Anilin und als Vergleich Methylamin, wobei der Rest bei letzterem Molekül ein Methylrest ist (vgl. Abb. 3).
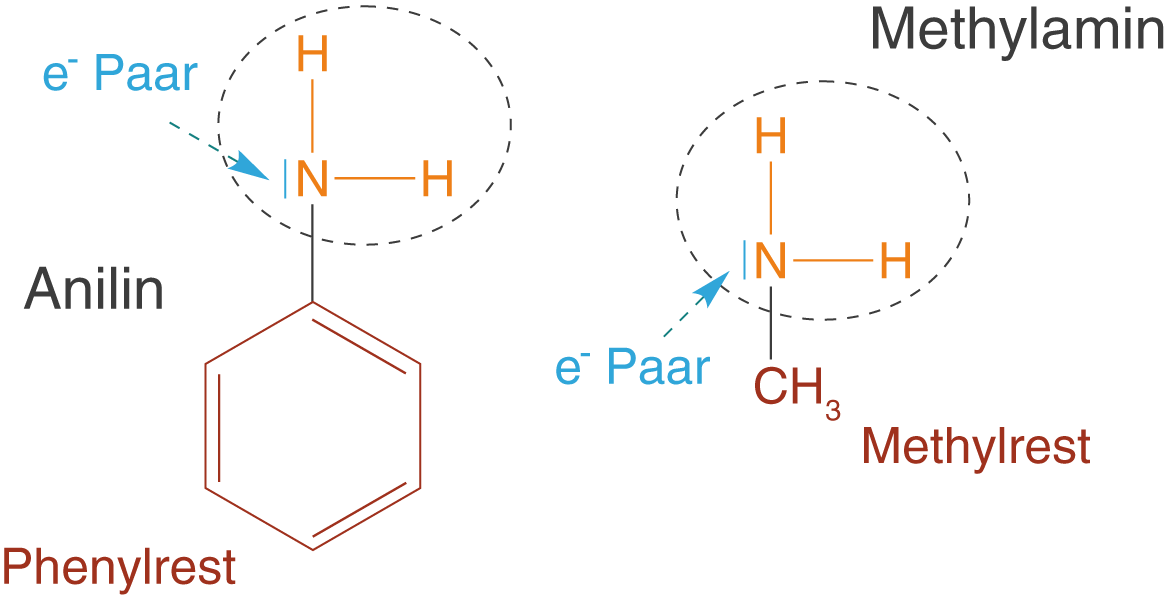
Der Einfluss des Rests wird dann deutlich, wenn wir uns zunächst die Stabilität der Moleküle vor dem Hintergrund der Mesomeriestabilisierung anschauen. In Abbildung 4 kannst du sehen, dass wir für Anilin vier mesomere Grenzformeln formulieren können, während wir bei Methylamin überhaupt keine Mesomeriestabilisierung beobachten können.
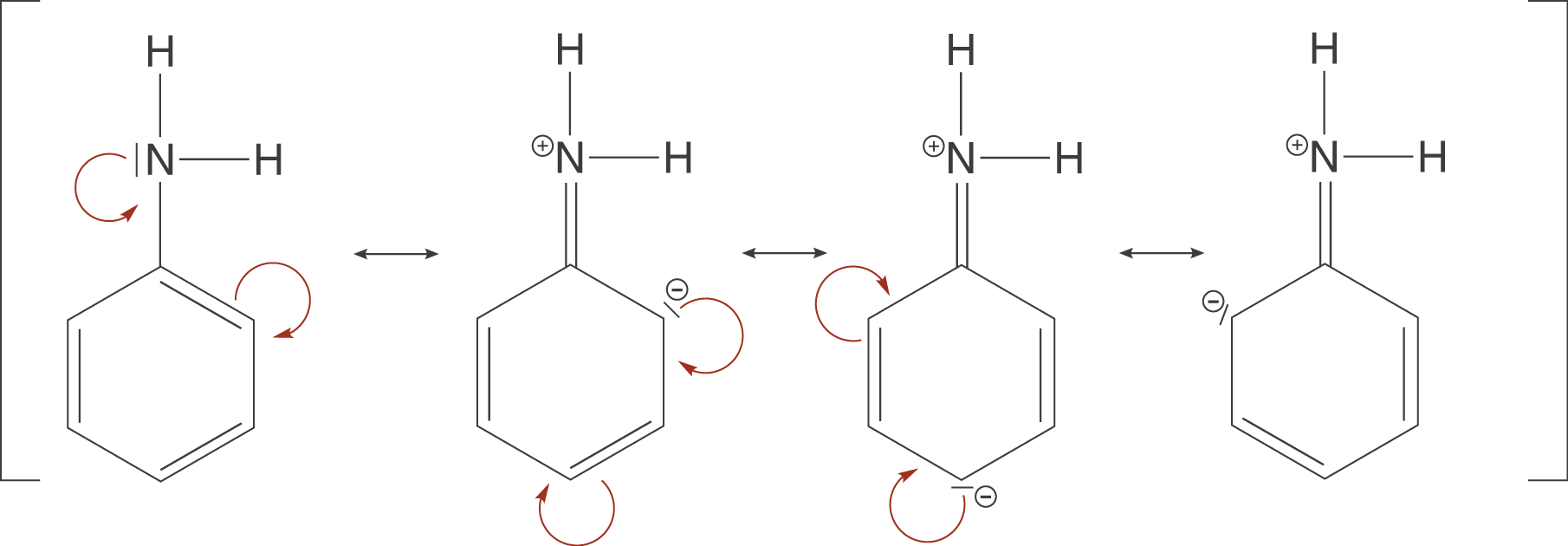
Nun lassen wir Anilin und Methylamin jeweils in einer Protolysereaktion mit einer Säure reagieren (vgl. Abb. 5) und schauen uns anschließend noch einmal die Mesomeriestabilisierung der beiden Moleküle an.
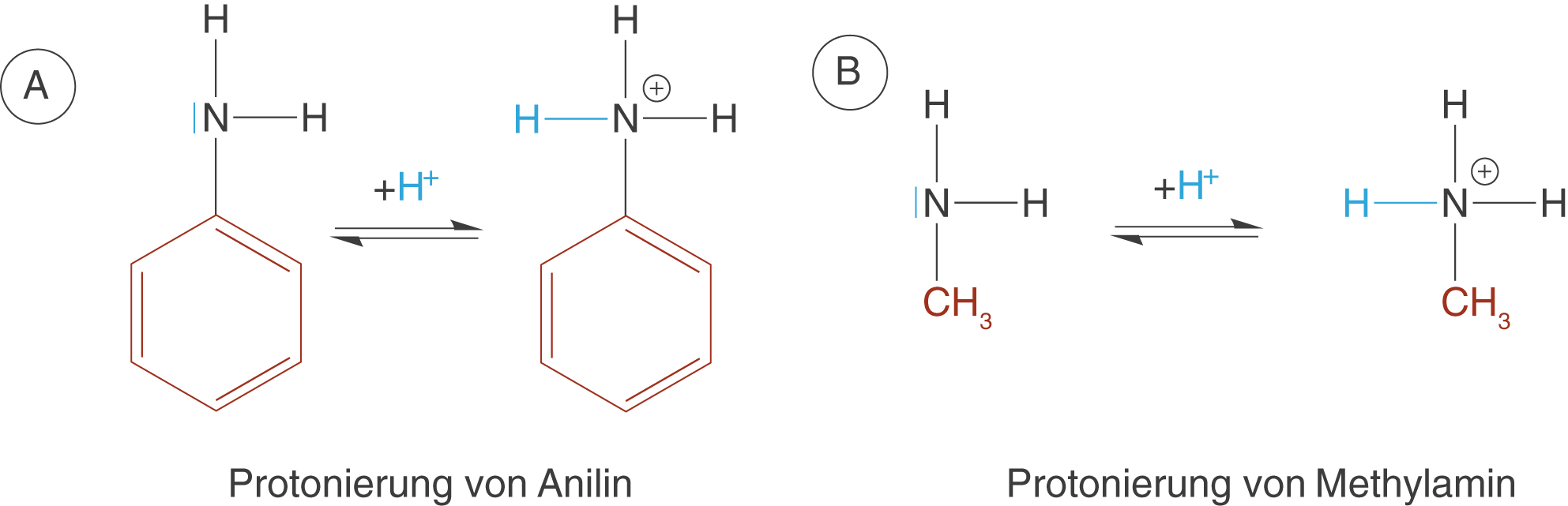
Interessanterweise ist es uns jetzt ebenfalls nicht mehr möglich für Anilin mesomere Grenzformeln zu formulieren; Anilin verliert die Mesomeriestabilisierung durch die Protolysereaktion. Das bedeutet, dass es im unprotonierten Fall stabiler ist. Gleichzeitig bedeutet dies aber auch, dass die Basenstärke sinkt, da das Bestreben in einen energetisch ungünstigeren Zustand überzugehen nicht sehr hoch ist. Dieser ungünstige Zustand entspricht hier der protonierten Form.
Wir fassen folgendermaßen zusammen:
- Anilin ist auf Grund des Phenylrests in unprotonierter Form mesomeriestabilisiert, was bei Methylamin nicht der Fall ist.
- Wird Anilin protoniert, dann geht die Mesomeriestabilisierung verloren, während bei der protonierten Form von Methylamin kein nennenswerter Unterschied bzgl. der Stabilität vor und nach der Reaktion zu verzeichnen wäre.
- Die protonierte Form von Anilin ist energetisch gesehen ungünstiger, da im unprotonierten Fall die Mesomeriestabilisierung greift. Diese ist die Ursache des Phenylrests, der somit direkt auf die Baseneigenschaften der Aminogruppe Einfluss nimmt. Diese ist aufgrund des Phenylrests reduziert.
Die Peptidbindung
Eine der wichtigsten funktionellen Gruppen im ChemieLV-Basiswissen ist die Peptidgruppe, über welche einzelne Aminosäuren zu Peptiden verknüpft werden (vgl. ChemieLV-Skript Peptide und Proteine). Die Bildung der Peptidgruppe verläuft über die Kondensationsreaktion einer Aminogruppe und einer Carboxygruppe (vgl. Abb. 6).
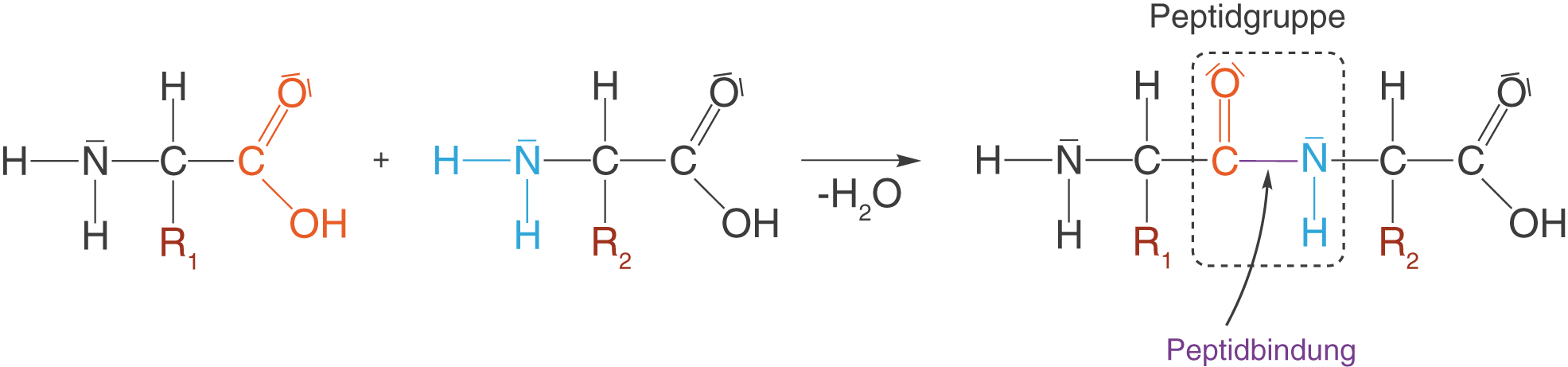
Ausführliche Informationen zur Bildung, zur räumlichen Struktur und zur Relevanz für Polypeptide findest du im oben angeführten ChemieLV-Skript zu Polypeptiden und Proteinen.
Schwefelverbindungen in der organischen Chemie
Organische Schwefelverbindungen sind im ChemieLV-Basiswissen selten anzutreffen. Um präzise zu sein, beschäftigen wir uns eigentlich nur ein einziges Mal mit solchen Verbindungen. Diese sind aber in dem Fall so wichtig, dass es sich lohnt auch an dieser Stelle noch einmal einen Blick darauf zu werfen.
Thiole am Beispiel von Cystein
Das einzige Mal, dass Schwefel in einer organischen Verbindung im ChemieLV-Basiswissen effektiv vorkommt, ist im Fall der Aminosäure Cystein (vgl. Abb. 7).
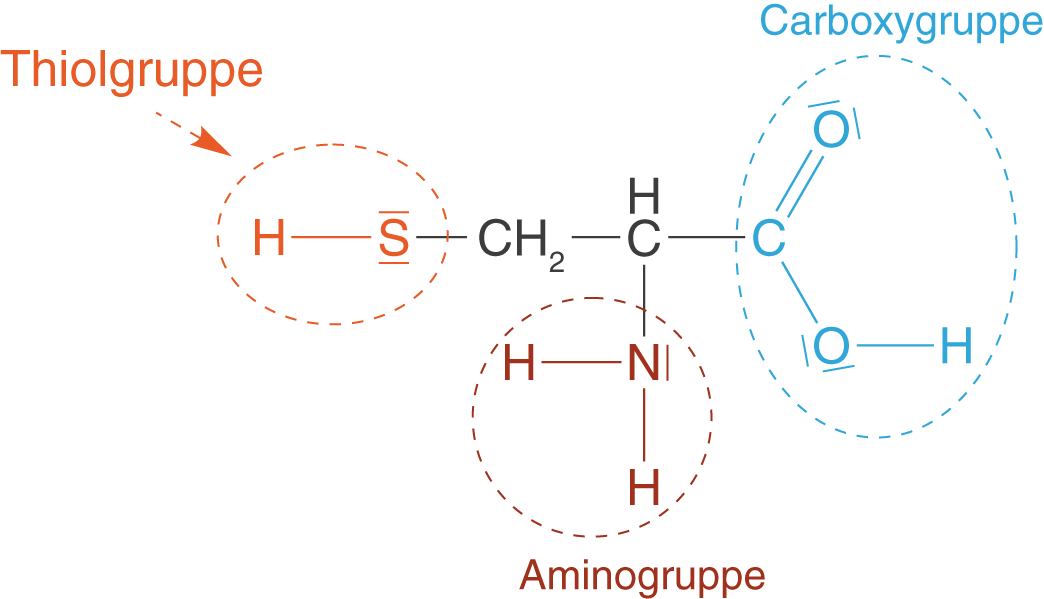
Im Fall von Cystein finden wir Schwefel als Bestandteil einer endständigen Thiolgruppe (). Diese ist mit der Hydroxygruppe (
Gruppe) der Alkohole verwand und unterscheidet sich dadurch, dass das Sauerstoffatom durch ein Schwefelatom ersetzt ist. Das Auftreten dieser Gruppe sprechen wir ausführlich im ChemieLV-Skript Peptide und Proteine an. Wir wollen an dieser Stelle nun kurz einen Blick auf den Zusammenhang zwischen der Thiolgruppe und den Disulfidbrücken der Peptide werfen.
Disulfidbrücken
Ein Sulfid setzt sich so zusammen, dass zwei Alkylreste R und R‘ über ein Schwefelatom miteinander verbunden sind, also }. Im Fall eines Disulfids befinden sich zwei Schwefelatome zwischen den Alkylresten, also
.
Die Thiolgruppen zweier Cystein-Moleküle können nun in einer Redox-Reaktion zu einer sogenannten Disulfidbrücke reagieren (vgl. Abb. 8).
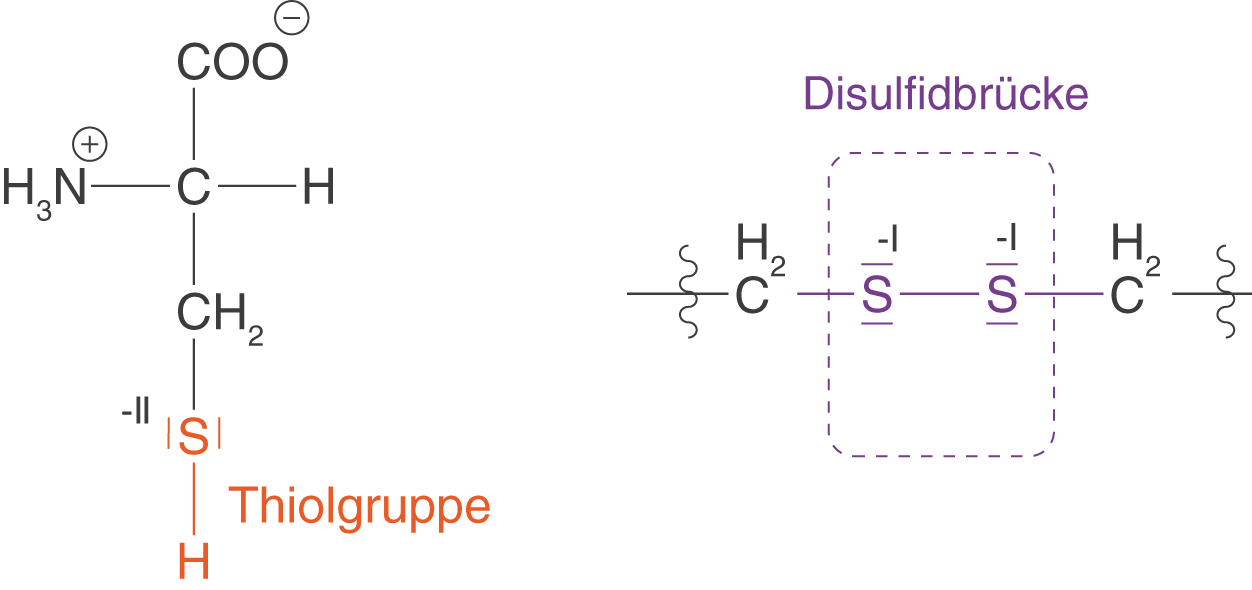
Diese Disulfidbrücken spielen bei der Stabilität der Tertiärstruktur von Proteinen eine große Rolle. Hierbei werden die Bereiche der Proteine stabilisiert, die stark verknäult und gefaltet vorliegen. Dabei reagieren endständige Thiolgruppen von Cysteinmolekülen innerhalb eines Polypeptids zu Disulfidbrücken, was dazu führt, dass die angesprochenen Bereiche effektiv durch chemische Bindung verknüpft werden und nicht durch zwischenmolekulare Kräfte. Damit fällt die Stabilisierung deutlich höher aus, als es bspw. im Fall von Wasserstoffbrückenbindungen möglich wäre. Eine ausführliche Darstellung dieses Themas und die Rolle der Disulfidbrücken im Kontext der Dauerwelle findest du im ChemieLV-Skript Peptide und Proteine.
Zusammenfassung
- Die Aminogruppe
findet sich in Aminen wieder, den Derivaten des Ammoniaks. Dabei handelt es sich im Fall der Verbindung
um ein primäres Amin.
- Die Aminogruppe weist aufgrund des freien Elektronenpaars am Stickstoff einen basischen Charakter auf. Diese Eigenschaft spielt insbesondere auch im Kontext der Chemie der Aminosäuren eine zentrale Rolle.
- Der organische Substituent R hat deutlichen Einfluss auf die Basizität der Aminogruppe: Anilin ist eine schlechte Base, da die unprotonierte Form aufgrund des Phenylrests mesomeriestabilisiert ist und somit nicht bestrebt ist ein Proton aufzunehmen.
- Durch die Kondensationsreaktion einer Aminogruppe und einer Carboxygruppe erhalten wir die Peptidbindung, die für den Aufbau von Peptiden zuständig ist, die wiederum die Grundstruktur der Proteine bilden.
- Im ChemieLV-Basiswissen ist Cystein die relevanteste organische Schwefelverbindung. Die proteinogene Aminosäure Cystein weist dabei eine endständige Thiolgruppe auf:
.
- Durch eine Redox-Reaktion zweier endständiger Thiolgruppen verschiedener Cysteinmoleküle entstehen Disulfidbrücken
(Reste R und R‘).
- Disulfidbrücken sind für die Stabilität der Tertiärstruktur von Proteinen verantwortlich und machen die Dauerwelle erst möglich.