Atommodelle
Atommodelle - Was sind Atome?
Jedes Element im Periodensystem der Elemente (PSE) lässt sich auf einen Baustein zurückführen, der nicht mehr weiter zerteilt werden kann, ohne dass die Eigenschaften des Elements verloren gehen würden. Diese Bausteine nennen wir Atome von griech. atomos unteilbar.Wir wollen uns in diesem Skript mit dem Begriff des Atoms auseinandersetzen und zwar insbesondere mit der Entwicklung der Atommodelle und den verschiedenen Modellvorstellungen, die uns ermöglichen Atome zu beschreiben. Dazu teilen wir dieses Skript in zwei Teile:
Zunächst beschäftigen wir uns mit drei grundlegenden Atommodellen von Dalton, Thomson und Rutherford, die ihren Ursprung im 19. und frühen 20. Jahrhundert haben. In diesem Rahmen lernen wir etwas über den Aufbau von Atomen im Allgemeinen und konzentrieren uns insbesondere auf den Aufbau des Atomkerns.
Im zweiten Teil dieses Skripts betrachten wir verstärkt das Elektron und die Elektronenhülle. Zu Beginn gehen wir auf das Elektron an sich und den Begriff der Elektronenhülle ein. Anschließend wollen wir uns das Bohrsche Atommodell anschauen und die fundamentalen Neuerungen dieses Modells im Gegensatz zu den vorherigen ansprechen. Daraufhin werfen wir einen Blick auf die moderne Beschreibung der Elektronenstruktur von Atomen in Form des Orbitalmodells. Hinweis zu den Inhalten dieses Skripts Die ChemieLV-Skripte des Themengebiets Atommodelle unterscheiden sich ein wenig von den anderen dieses Basiswissens. Wir beschäftigen uns hier nicht mit chemischen Reaktionen sondern mit den für uns relevanten Bausteinen der Materie, den Atomen, ihrem Aufbau und dem Atommodell. Physik Grundlagen und die geschichtliche Entwicklung sind dabei auch von großer Bedeutung. Des Weiteren gilt es einige Aspekte im Hinterkopf zu behalten, die sich auf den Umgang mit dem Modellbegriff beziehen:
- Modelle sind das Resultat menschlicher Überlegungen, die nicht die Gesamtheit eines Objekts beschreiben können, sondern immer nur gewisse Aspekte. In diesem Zusammenhang ist vor allem der Rahmen des Modells, also sein Gültigkeitsbereich, sehr wichtig.
- Im Hinblick auf den ersten Punkt wird deutlich, dass Modelle Grenzen haben, die ihren Gültigkeitsbereich von dem Bereich trennen, in welchem sie scheitern. Diese Grenzen interessieren uns hier ganz besonders, da sie die Entwicklung von besseren Modellen motivieren.
- Im Lauf der Geschichte haben sich verschiedene Leute Gedanken zu Atommodellen gemacht. Die Entwicklung dieser Modelle ist darauf zurückzuführen, dass man insbesondere die Grenzen ausgelotet hat und das Modell anhand neuer Erkenntnisse weiterentwickelte. Beachte, dass alle Atommodelle immer nur gewisse Aspekte eines Atoms beschreiben können.
- Das moderne Atommodell in Form des Orbitalmodells hat sehr außergewöhnliche Grundlagen, die den Erfahrungen des Menschen widersprechen. Ein paar dieser Aspekte können wir bereits am Bohrschen Atommodell erklären, jedoch nicht alle. In diesem Zusammenhang macht es für uns vor allem Sinn, sich die Fakten zu merken, da wir uns die Grundlagen mit dem Schulwissen nicht erklären können.
Wie ist ein Atom aufgebaut? – Atommodelle im Vergleich
John Dalton – Atommodell (1809)
Anfang des 19. Jahrhunderts, um genau zu sein um 1809, formulierte der englische Naturforscher John Dalton (vgl. Abb. 1) eine Atomhypothese, die auf dem damaligen Stand der Wissenschaft beruhte. Dabei nahm er an, dass Atome die kleinsten Bausteine der Elemente seien, die sich je nach Element durch ihre Masse voneinander unterscheiden würden.
Abb. 1: Portrait von John Dalton und eine schematische Darstellung seines Atommodells.
- John Dalton die Atome als kleinste Bausteine der Elemente ansah, die sich von Element zu Element voneinander unterscheiden.
- Keine Aussagen über den Aufbau eines Atoms getroffen wurden.
Grenzen beim Atommodell nach Dalton – Einflüsse von Joseph J. Thomson Atommodell (1897)
Gegen Ende des 19. Jahrhunderts arbeitete der britische Physiker Joseph John Thompson an der Untersuchung der sogenannten Kathodenstrahlung. Hierbei gelang ihm der experimentelle Nachweis, dass sich diese Strahlung aus Teilchen zusammensetzt, die negativ geladen sind. Er ging dabei davon aus, dass diese Teilchen aus dem Material seiner Strahlungsquelle (Kathodenstrahlröhre) stammen müssten. Interessanterweise stellte sich heraus, dass diese Teilchen viel kleiner und leichter als Atome waren. Im Zusammenhang mit seiner Annahme bzgl. der Quelle dieser Teilchen hatte Thomson das erste subatomare Teilchen in Form des Elektrons entdeckt und wurde dafür 1906 mit dem Nobelpreis für Physik ausgezeichnet.Im Bezug auf die Daltonsche Atomhypothese fallen uns drei Sachen auf, die sich als deutliche Neuerungen herausstellen:
- Es existieren Teilchen, die kleiner und leichter als Atome sind. Ein solches Teilchen ist das Elektron.
- Atome sind nicht die kleinsten Bausteine, sondern sie bestehen aus negativ geladenen Elektronen.
- Da Atome elektrisch neutral sind, muss die negative Ladung der Elektronen im Atom von positiven Ladungen ausgeglichen werden. Thomson ging davon aus, dass diese positiven Ladungen gleichmäßig über das Atom verteilt wäre, während die negativ geladenen Elektronen in dieser positiven Ladung eingebettet wären. Daher kommt der Name des Rosinenkuchen-Modells (vgl. Abb. 2).

Abb. 2: Portrait von Joseph John Thomson und eine schematische Darstellung seines Atommodells.
- Die Quelle der positiven Ladung sowie deren Verteilung im Atom.
- Die Verteilung der Elektronen im Atom.
Ernest Rutherford (1911)
Ernest Rutherford war ein neuseeländischer Physiker, der bedeutende experimentelle Beiträge zur Physik lieferte. Für uns sind an dieser Stelle folgende Informationen wichtig:
- Rutherford fand heraus, dass die Strahlung, die von Uran ausgeht, aus verschiedenen Teilchenarten besteht. Diese Strahlung war um 1896 vom französischen Physiker Antoine Henri Becquerel entdeckt worden.
- Daraus schloss er, dass beim radioaktiven Zerfall Atom in andere Atome zerfallen.
- Die sogenannte
-Strahlung besteht aus Helium-Kernen, also
-Kationen. Bei seinem berühmten Streuexperiment nutzte Rutherford eben diese Strahlung.

Abb. 3: Portrait von Ernest Rutherford
Das Streuexperiment
Um 1910 arbeitete Rutherford an der Streuung von- Ein radioaktives Präparat sendet
-Strahlung in Form von Helium-Kernen (
-Kationen) aus.
- Die
-Strahlung trifft auf eine sehr dünne Goldfolie und wird gestreut.
- Der Großteil der
-Strahlung passiert die Folie ohne große Ablenkungen.
- Ein gewisser Anteil der
-Strahlung wird stark abgelenkt und teilweise sogar in Richtung der Strahlenquelle zurückgeworfen.
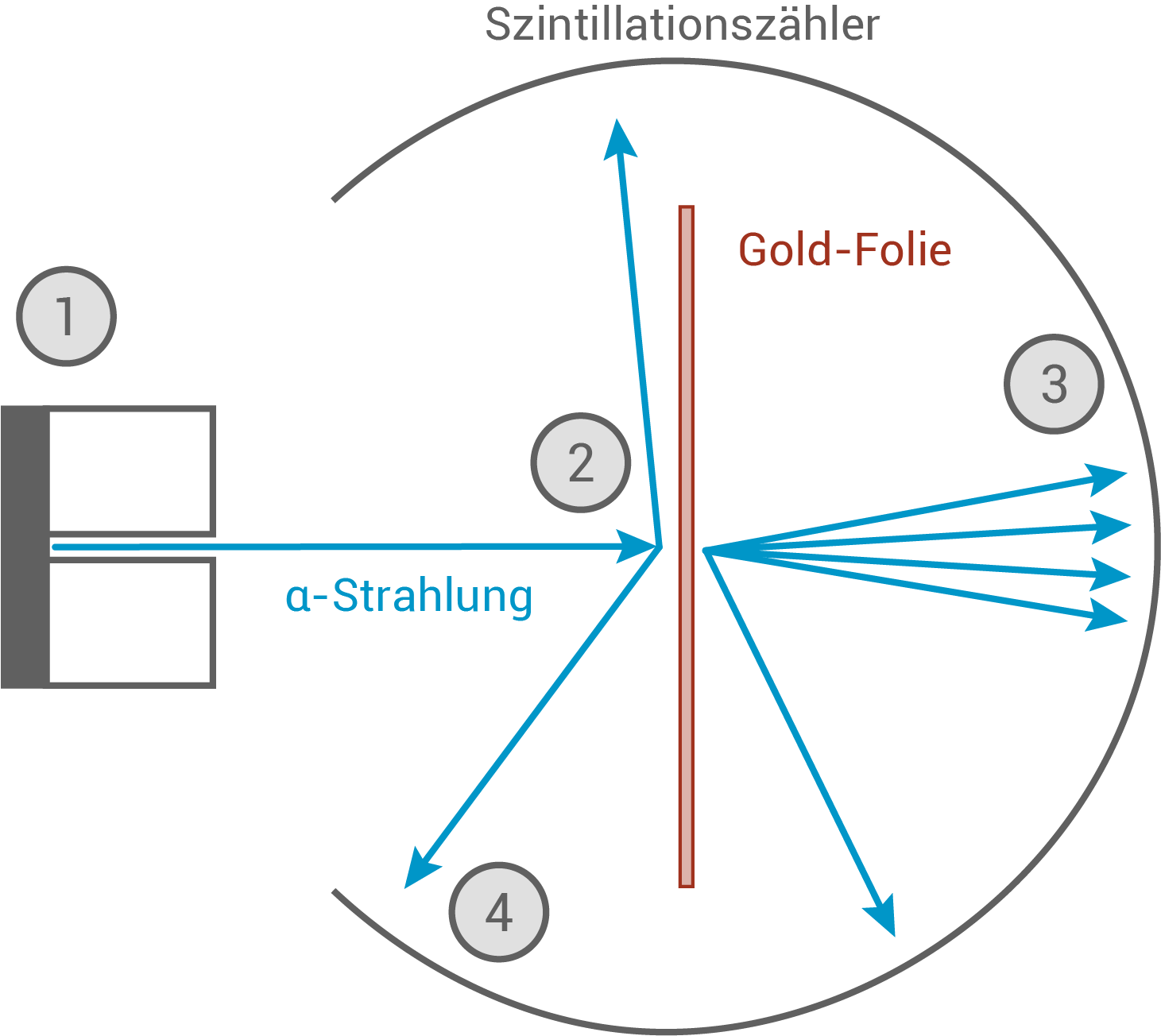
Abb. 4: Experimenteller Aufbau des Streuexperiments von Ernest Rutherford.
Wir wollen uns nun mit den Konsequenzen des Streuexperiments beschäftigen und uns das Atommodell nach Rutherford anschauen. Anschließend fassen wir das bis hierhin Erarbeitete zusammen und besprechen den Aufbau des Atoms, wie er heute noch gilt.
Rutherfordsches Atommodell und seine Grenzen
Die Streuprozesse, die Rutherford in seinem Experiment untersuchte, sind in Abbildung 5 dargestellt.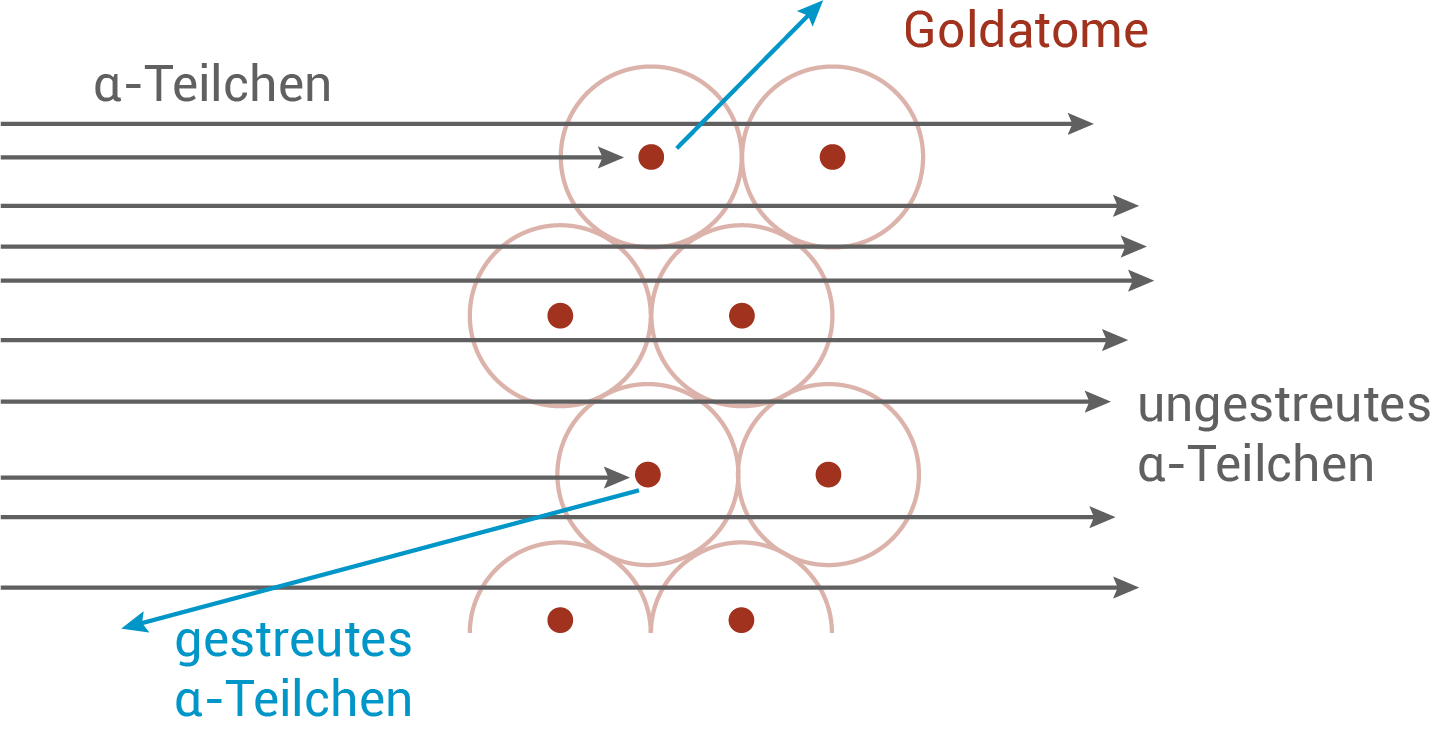
Abb. 5: Streuprozesse von  -Teilchen an Gold-Atomen.
-Teilchen an Gold-Atomen.
- Atome bestehen zum Großteil aus einer leeren Hülle.
- Im Zentrum sitzt konzentriert die positive Ladung des Atoms, woran die
-Teilchen gestreut werden.
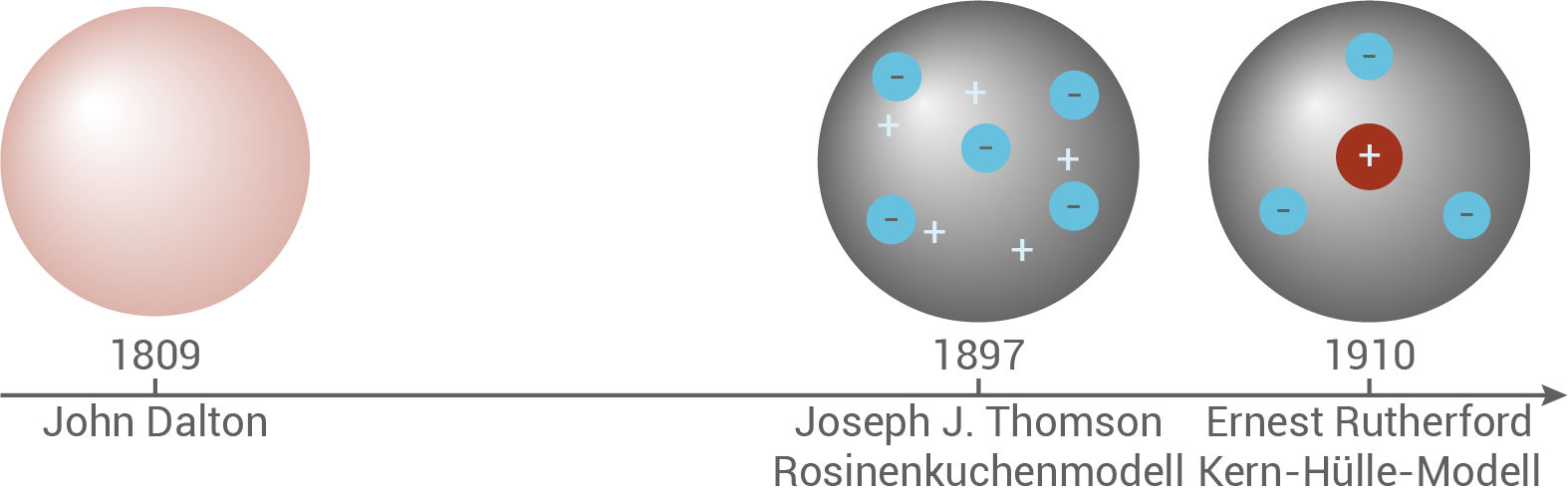
Abb. 6: Zeitliche Entwicklung des Atommodells im 19. Jahrhundert.
Woraus besteht ein Atom? – Das Kern-Hülle-Modell
Der Kern – Protonen und Neutronen
Im Laufe des 19. Jahrhunderts bzw. zu Beginn des 20. Jahrhunderts konnte die grundlegende Struktur der Atome geklärt werden. Atome setzen sich aus einem Atomkern und der Elektronenhülle zusammen. Ernest Rutherford zeigte experimentell, dass die positive Ladung von Atomen im Kern konzentriert ist und nicht wie von Thomson angenommen gleichmäßig über das Atom verteilt. Das Proton an sich wurde erst in den 20er Jahren des 20. Jahrhunderts experimentell nachgewiesen. Das Proton ist der Träger einer positiven Elementarladung und stellt einen Bestandteil des Atomkerns dar. Es wird oft alsDer zweite Bestandteil des Atomkerns sind die Neutronen. Diese wurden ebenfalls im frühen 20. Jahrhundert experimentell nachgewiesen. Neutronen wiegen in etwas genau so viel wie Protonen, tragen jedoch keine Ladung - sie sind elektrisch neutral (vgl. Abb. 7). Da Protonen und Neutronen die Kernbausteine darstellen, fasst man in diesem Zusammenhang die beiden Teilchen auch unter dem Begriff der Nukleonen (Kernbausteine) zusammen. Der Kern wird analog als Nuklid bezeichnet.
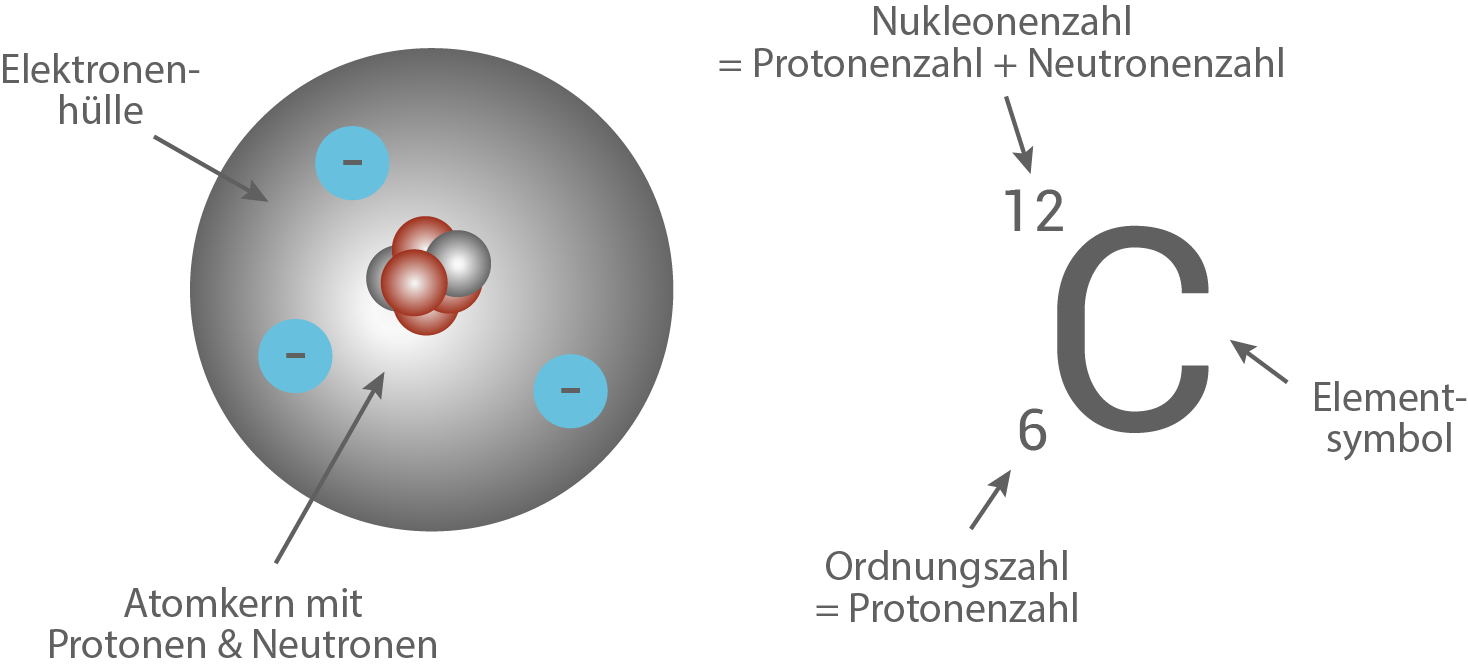
Abb. 7: Das Kern-Hülle-Modell mit entsprechender Notation am Beispiel von Kohlenstoff.
Isotope
Wasserstoffatome haben genau ein Proton und ein Elektron. Nach der in Abbildung 7 eingeführten Notation, die uns Informationen über die Anzahl der Kernbausteine liefert, schreiben wir dafürWenn wir das Wasserstoffatom wiegen würden, dann würden wir auch herausfinden, dass der Kern nur aus einem Proton besteht. Das Elektron ist sehr viel leichter, sodass es nur einen sehr geringen Anteil zum Gesamtgewicht beiträgt.
Interessanterweise existieren jedoch weitere Atome, die wie Wasserstoff exakt ein Proton und ein Elektron aufweisen, jedoch doppelt bzw. dreimal so schwer sind. An dieser Stelle kommen die Neutronen ins Spiel. Elemente werden durch ihre Protonenzahl bestimmt, während die Neutronenzahl variieren kann. Wir sprechen in diesem Zusammenhang von den Isotopen des Wasserstoffs. Isotope sind Nuklide mit gleicher Protonenzahl, aber unterschiedlicher Neutronenzahl (vgl. Abb. 8).
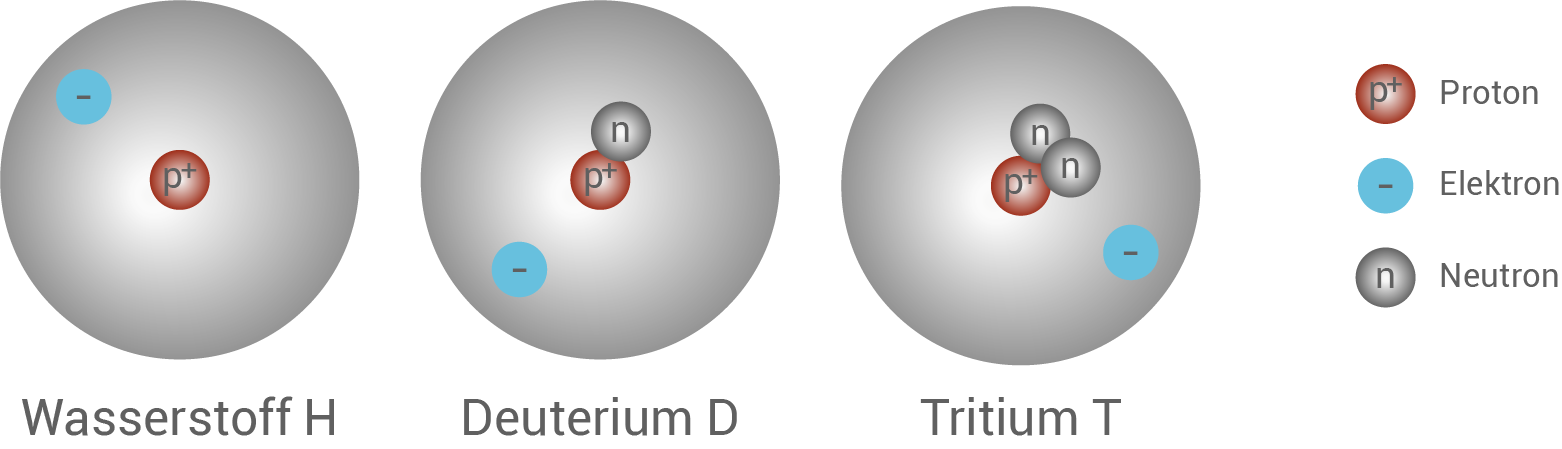
Abb. 8: Wasserstoff und seine Isotope Deuterium und Tritium.
Die Elektronenstruktur von Atomen
Das Elektron und die Elektronenhülle
Wir interessieren uns an dieser Stelle für das Elektron und die Elektronenhülle. Dazu ziehen wir noch einmal einen Ausschnitt aus Abbildung 7 heran (vgl. Abb. 9), um uns einen Überblick zu verschaffen. Bei der Betrachtung von Abbildung 9 lassen sich folgende, für uns relevante, Fragen stellen:- Was sind Elektronen?
- Was ist die Elektronenhülle?
- Wo befinden sich die Elektronen in der Elektronenhülle?
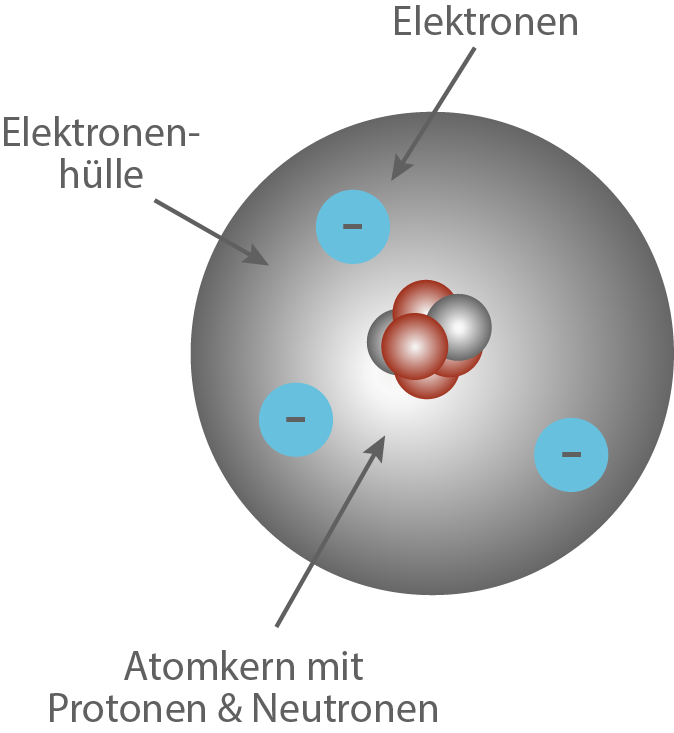
Abb.9 : Die Elektronenhülle als Teil des Kern-Hülle-Modells.
| Wichtig: | Wir betrachten nun das Bohrsche Atommodell. Dieses erlaubt uns gewisse Eigenschaften der Elektronen in der Elektronenhülle zu beschreiben. Diese Eigenschaften der Atome und Elektronen waren mit allen vorherigen Modellen nicht zu fassen. Es ist sehr wichtig, dass du im nächsten Abschnitt immer den Modellcharakter im Hinterkopf behältst und dementsprechend vor allem auch die Rahmenbedingungen. Tatsächlich ist dieses Modell heutzutage überholt und kann nur sehr wenige Tatsachen vernünftig erklären. Stelle dir Atome also bitte nicht so vor, wie sie das Bohrsche Atommodell darstellt, sondern betrachte das Modell, als das, was es ist: ein Modell. |
Nils Bohr (1913) – Bohrsches Atommodell
Das Versagen früher Atommodelle
Wie wir wissen, nahm Rutherford an, dass sich die Elektronen um den Kern bewegen würden. Wenn wir davon ausgehen, dass sie das wie Planeten tun, die um die Sonne kreisen, dann ergeben sich einige Probleme mit der klassischen Physik.- Das bewegte Elektron würde auf seiner Bahn fortwährend Strahlung abgeben, was bedeutet, dass es effektiv energieärmer werden würde.
- Das Resultat wäre, dass das Elektron nicht stabil auf einer Bahn um den Kern kreisen könnte, sondern in diesen stürzen würde (vgl. Abb. 10).
- Damit wären Atome nicht stabil, was aber gegen die Erfahrungen und Beobachtungen spricht.
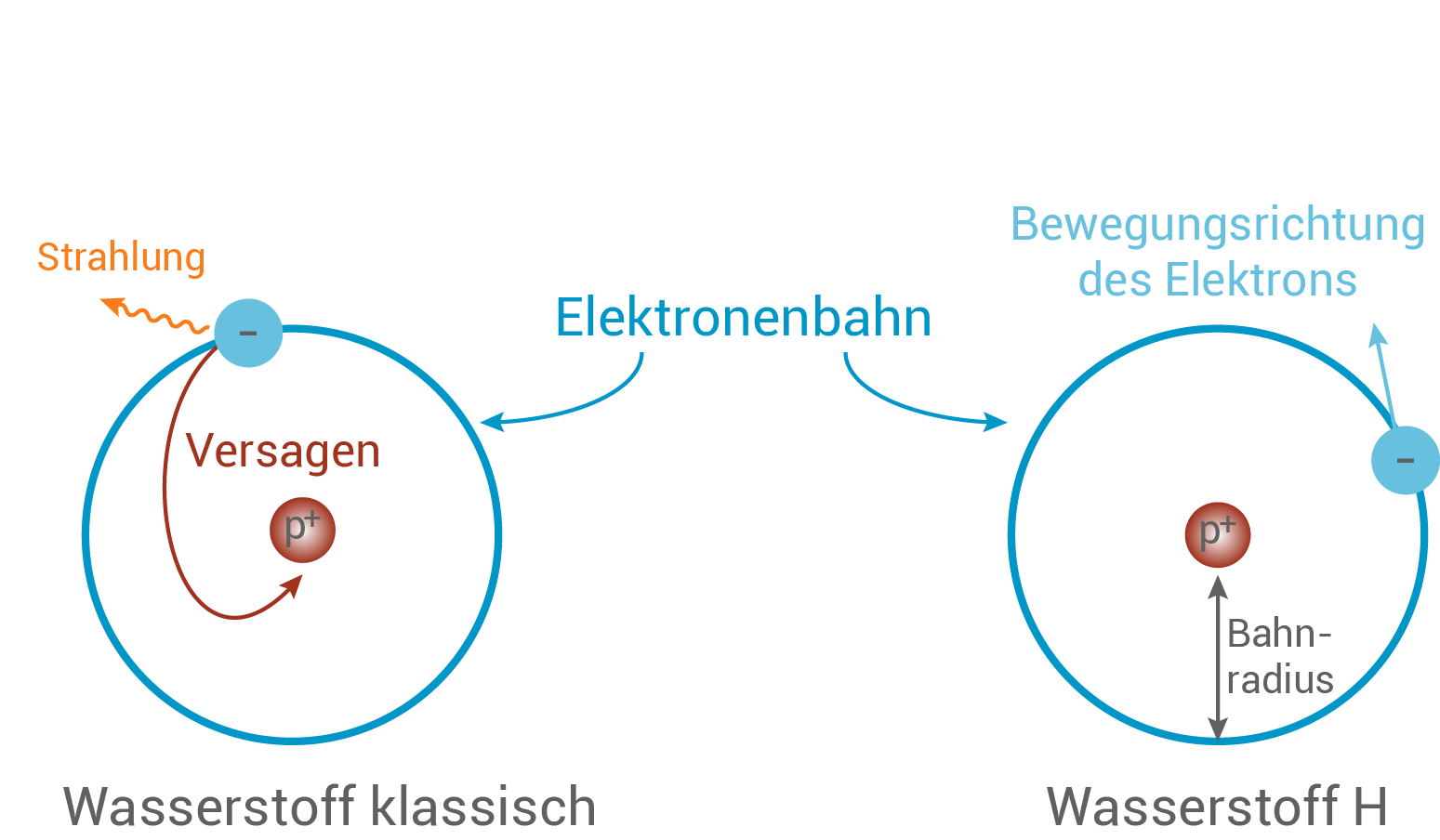
Abb. 10: Versagen der klassischen Theorien.
Das Atommodell Bohr – Von Elektronen auf Bahnen
1913 postulierte der dänische Physiker Nils Bohr auf Grundlage vom Atommodell Rutherford ein vollkommen neues Atommodell für das Wasserstoffatom, das die zu dieser Zeit aufkeimende Idee der Quantisierung von Größen in der atomaren Welt mit einbezog. Wir wollen uns zunächst Bohrs Postulate anschauen und im Anschluss den Begriff der Quantisierung klären.
Bohrs Postulate zu seinem Atommodell:
- Elektronen bewegen sich auf festen Bahnen um den Atomkern (vgl. Abb. 11). Die Gesamtenergie eines Elektrons auf solch einer Bahn ist ein ganzzahliges Vielfaches des planckschen Wirkungsquantums
.
- Die Änderung der Gesamtenergie eines Elektrons kann nur auf die Weise stattfinden, dass es sich am Ende wieder auf einer nach Punkt 1 erlaubten Bahn befindet.
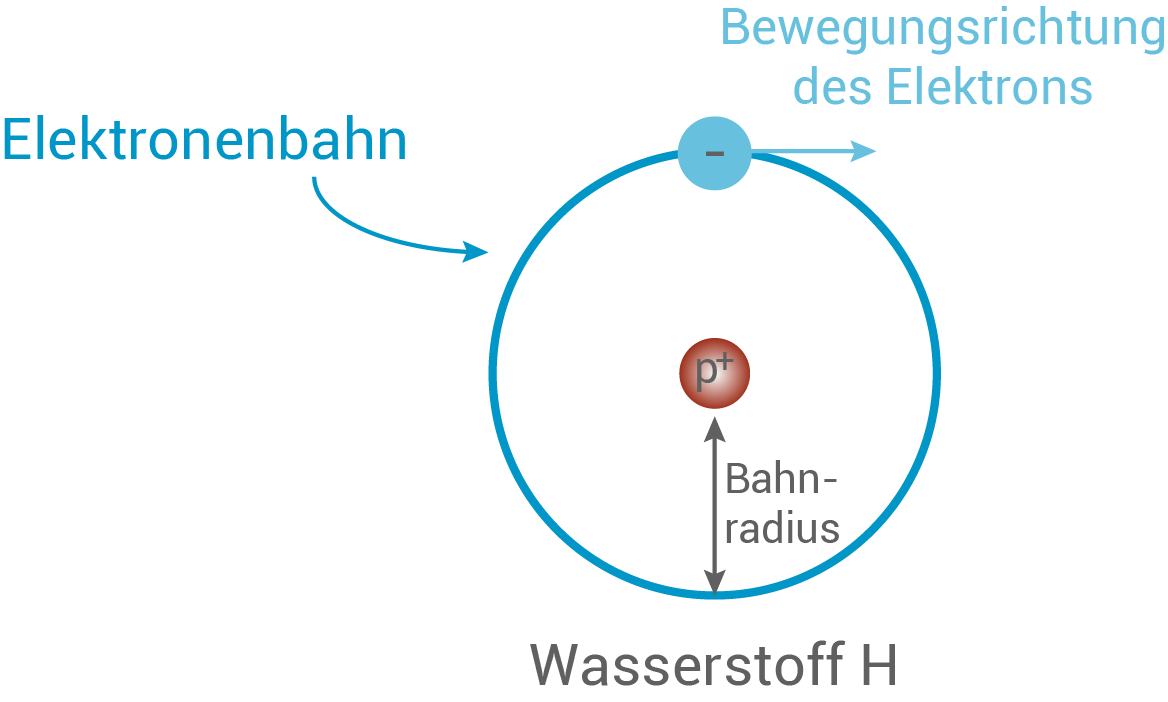
Abb. 11: Das Bohrsche Atommodell.
Quantisierung
Nach den klassischen Modellen könnte sich ein Elektron auf irgendwelchen Bahnen um den Kern aufhalten. Es wäre jede Bahn möglich, die existiert. So war man es aus der klassischen Physik gewöhnt. Größen waren nicht auf bestimmte Werte festgelegt, was man in diesem Zusammenhang als Kontinuum bezeichnet: Die Zahlenwerte physikalischer Größen folgen kontinuierlich aufeinander, ohne dass eine Lücke existieren würde.Nils Bohr revolutionierte dieses Bild mit seinem Atommodell. Er nahm an, dass es Bahnen geben müsste, auf denen sich ein Elektron bewegen könnte, ohne Strahlung abzugeben (zu emittieren). Das Elektron auf einer solchen Bahn wäre stabil, würde also nicht in den Kern stürzen. Des Weiteren ging er davon aus, dass die Energie eines Elektrons auf solch einer Bahn, nur ganz bestimmte Werte annehmen sollte. Diese Werte waren alle ein Vielfaches des planckschen Wirkungsquantums
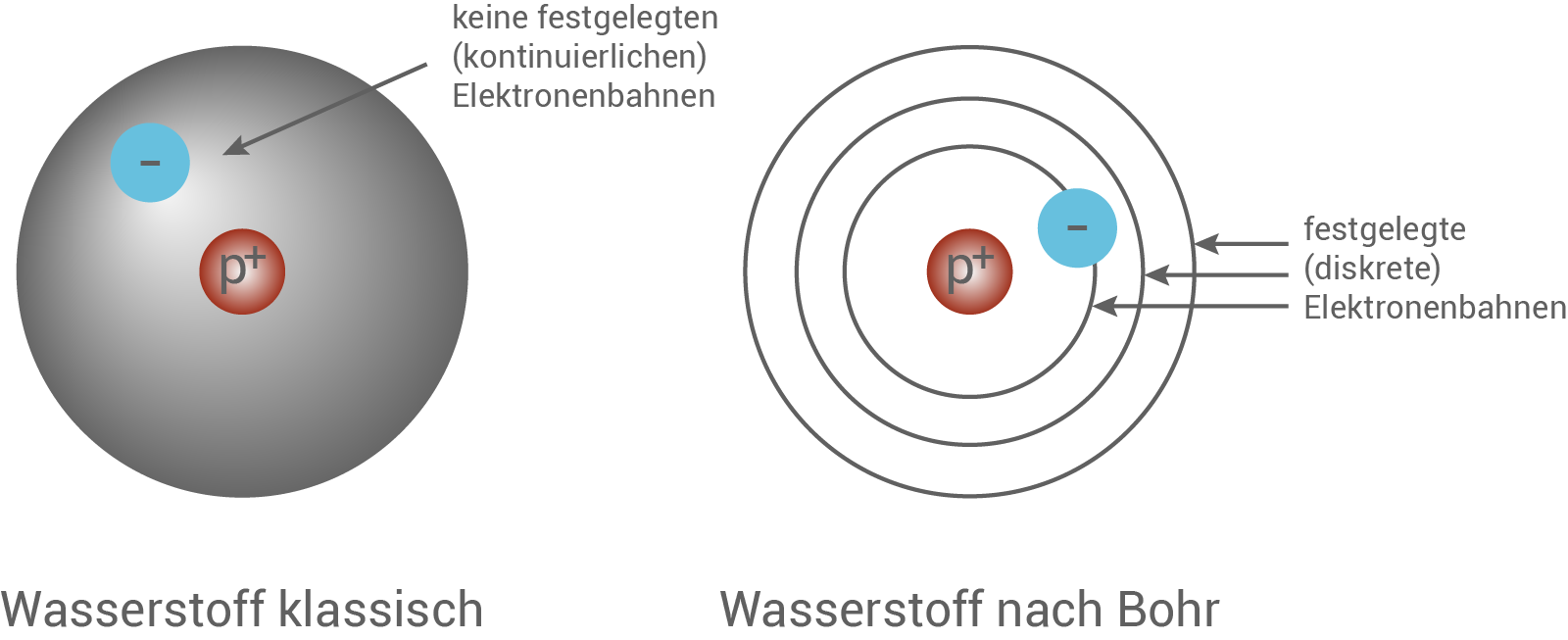
Abb. 12: Die durch Bohr angenommene Quantisierung der Energie der Elektronen in Atome.
- Das Bohrsche Atommodell gilt nur für das Wasserstoffatom.
- Elektronen bewegen sich auf festgelegten (diskreten) Bahnen.
- Die Energie eines Elektrons auf solche einer Bahn ist ein Vielfaches des planckschen Wirkungsquantums - Elektronen haben folglich festgelegte (diskrete) Energieniveaus.
Korrekte Vorhersagen – Das Spektrum des Wasserstoffatoms
Anregung von Elektronen Wir wissen bereits, dass Bohr festgelegte Bahnen für die Elektronen im Wasserstoffatom annahm. Wir man sich ein solches Modell vorstellen kann, siehst du in Abbildung 12. Im nächsten Schritt wollen wir ein Elektron von einer Bahn auf eine andere anheben. In diesem Zusammenhang erinnern wir uns an Bohrs zweites Postulat: Die Energie von Elektronen entspricht einem ganzzahligen Vielfachen des planckschen Wirkungsquantums. Das bedeutet, dass wir ein Elektron genau dann auf eine andere Bahn anheben können, wenn wir im exakt die Energiemenge zukommen lassen, die die beiden Bahnen voneinander unterscheidet. Wir wollen uns das in Abbildung 13 veranschaulichen.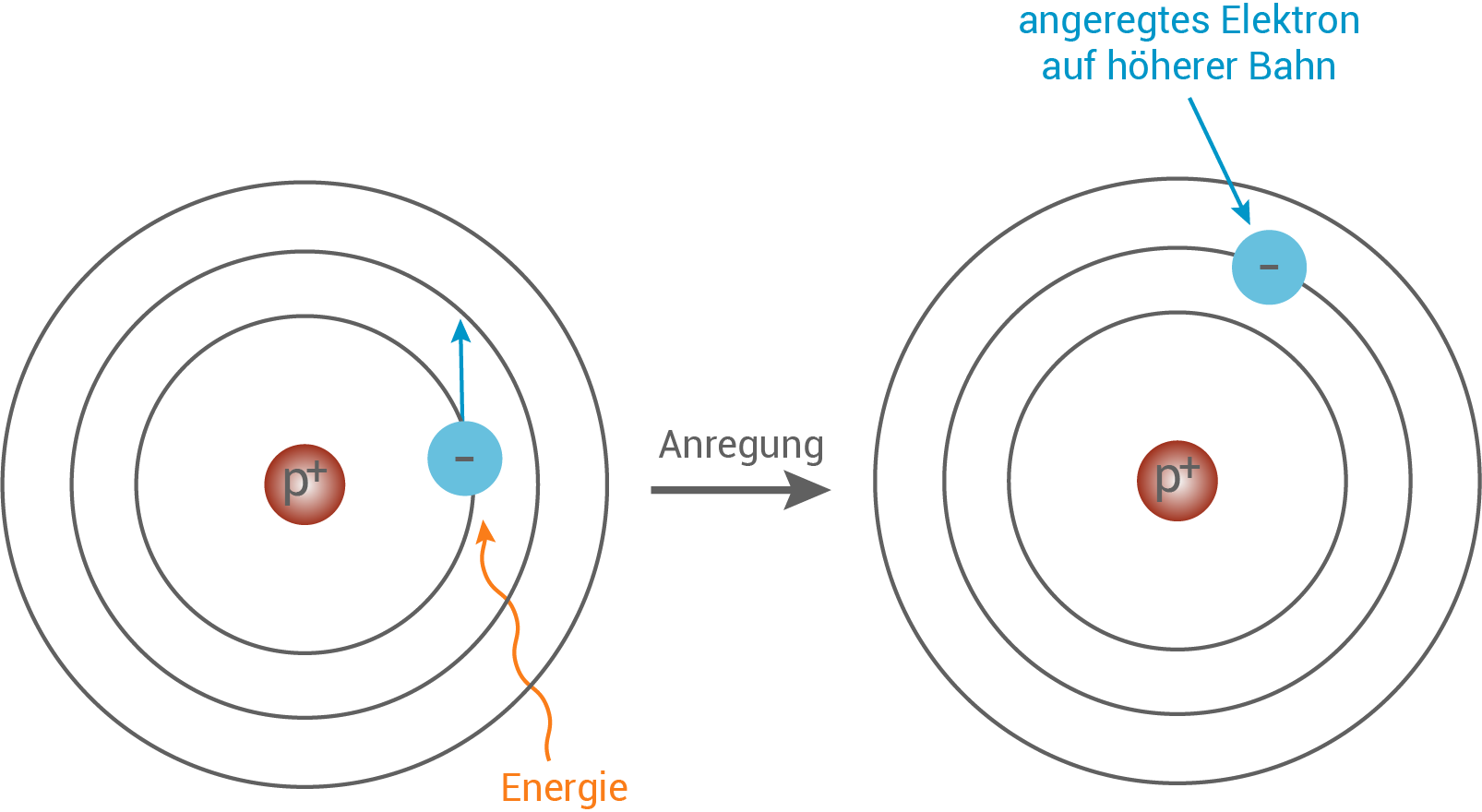
Abb. 13: Die Anregung von Elektronen.
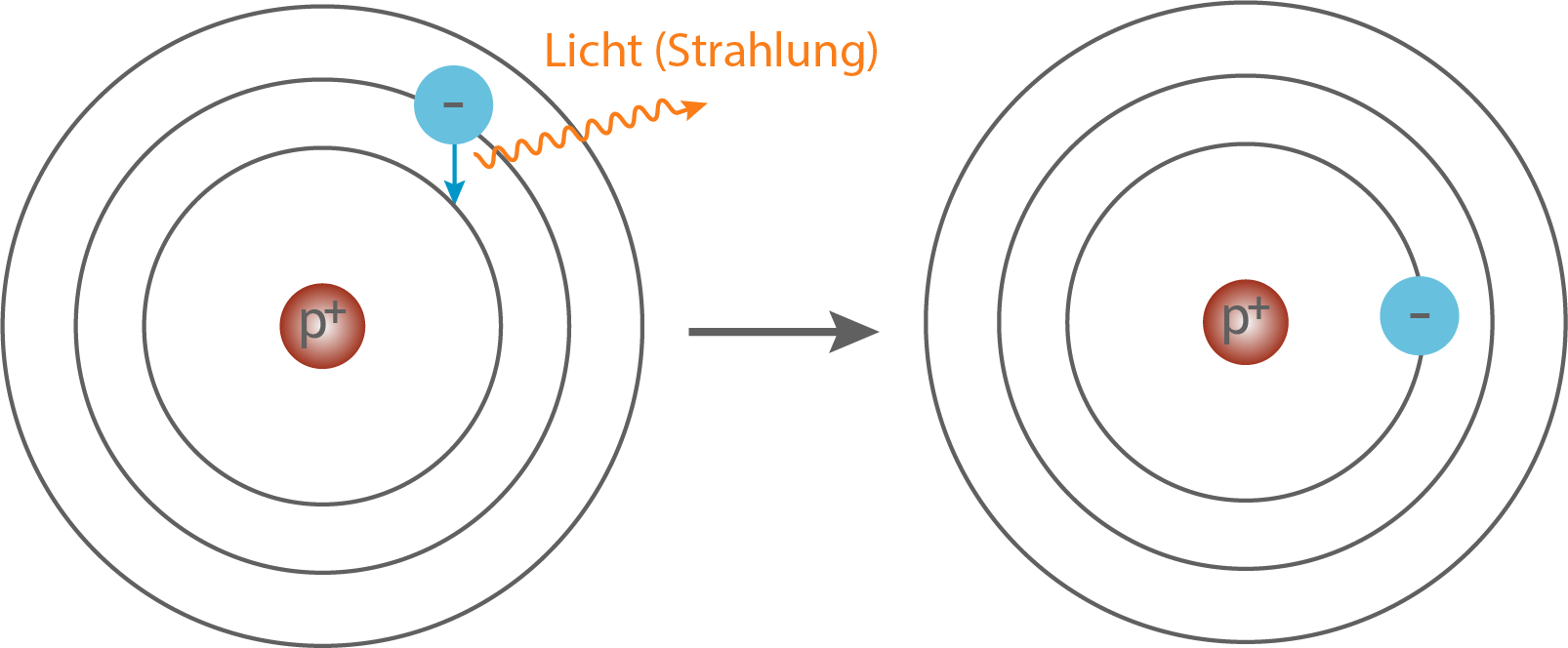
Abb. 14: Rückkehr des Elektrons auf die erste Bahn unter Abgabe (Emission) von Licht (Strahlung).
Das Spektrum des Wasserstoffs
Diesen Prozess können wir nun aber auch so durchführen, dass wir das Elektron nicht nur auf die zweite, sondern auch auf die dritte oder höhere Bahnen anregen. Damit erhalten wir aber wiederum ein anderes Licht, wenn das Elektron zurückfällt, da wir hierfür mehr Energie aufwenden müssen. Nehmen wir nun alle Möglichkeiten der Anregung her und beobachten die unterschiedlichen Arten des Lichts, die dabei auftreten, so nennt man die Gesamtheit aller auftretenden Arten des Lichts Spektrum. Nils Bohr konnte das Spektrum des Wasserstoffs auf Grundlage seines Atommodells theoretisch erklären.Grenzen des Bohrschen Atommodells
Obwohl Bohr mit seinem Atommodell das Spektrum von Wasserstoff theoretisch beschreiben konnte, gab es dennoch einige Aspekte, die das Bohrsche Atommodell nicht beschreiben konnte bzw. in deren Zusammenhang die getroffenen Annahmen versagten. Im Folgenden findest du eine relevante Auswahl:- Wenn sich ein Elektron auf einer Bahn bewegt, dann könnten wir seine Position und seine Geschwindigkeit exakt bestimmen, und zwar gleichzeitig. Nach der Heisenberg'schen Unschärferelation ist es jedoch unmöglich, diese beiden Größen in Bezug auf das Elektron zum selben Zeitpunkt zu kennen. Wir können immer nur eine der beiden kennen und je besser wir über diese eine Bescheid wissen, desto weniger wissen wir über die andere Größe. Das widerspricht den Annahmen in diesem Atommodell.
- Das Bohrsche Atommodell kann nur Atome mit einem Elektron erklären. Mehrelektronenatome (zu denen so ziemliches jedes Element außer Wasserstoff zählt) sind nicht fassbar.
- Die chemische Bindung ist auf Grundlage des Bohrschen Atommodells nicht beschreibbar, geschweige denn erklärbar.
Das Orbitalmodell (1927) – Ein Ausblick
Die Physik erfuhr in den 20er und 30er Jahren des 20. Jahrhunderts eine rasante Entwicklung. Die Quantenmechanik wurde theoretisch ausgearbeitet und die Beschreibung atomarer Vorgänge so möglich. Diese neue Theorie entsprach in keinster Weise den Alltagserfahrungen, sollte sich aber dennoch zu einer der besten Theorien entwickeln, die die Physik jemals hervorgebracht hat. Die Quantenmechanik erlaubte es nun auch, die Struktur von Atomen und insbesondere auch die der Elektronenhülle auf eine neue Art und Weise zu beschreiben, die sehr viel effektiver und korrekter als die der Vorgängermodelle war. Orbitale Nils Bohr hatte in seinem Atommodell bereits die Idee der gequantelten Größen aufgegriffen und die diskreten Energieniveaus des Wasserstoffatoms sehr gut beschreiben können. An Stelle der von Bohr postulierten Bahnen traten nun aber die sogenannten Orbitale. Elektronen sollten sich nicht auf festgelegten Bahnen bewegen, sondern sie sollten sich mit einer gewissen Wahrscheinlichkeit in bestimmten räumlichen Bereichen um den Atomkern aufhalten. Folgende Aspekte sind zentral:- Die Position von Elektronen kann nur mit einer gewissen Wahrscheinlichkeit festgelegt werden.
- Die räumlichen Bereiche, in denen es sehr wahrscheinlich ist ein Elektron anzutreffen, werden Orbitale genannt.
- Die Struktur bzw. Form des Orbitals ändert sich je nach Energieniveau.
Beschreibung der Orbitale durch Quantenzahlen
Im Rahmen der Quantenmechanik werden die Orbitale durch vier sogenannte Quantenzahlen beschrieben, die das Ergebnis dieser Theorie sind. Sie beschreiben das jeweilige Orbital eindeutig. Es gibt folgende Quantenzahlen:| Hauptquantenzahl |
Nebenquantenzahl |
|---|---|
| magnetische Quantenzahl |
Spin-Quantenzahl |
|---|---|
| sobald mehr als ein Elektron vorhanden ist, kommt die Spin-Quantenzahl ins Spiel |
- Die Hauptquantenzahl beschreibt die Größe eines Orbitals.
- Die Nebenquantenzahl beschreibt die Form eines Orbitals.
- Die magnetische Quantenzahl beschreibt die Orientierung eines Orbitals im Raum.
Zusammenfassung
- Das Atommodell Dalton (1809): Atome als kleinste unteilbaren Bausteine der Materie.
- Das Atommodell Thomson (1897): Experimenteller Nachweis des Elektrons, Grenzen von Daltons Atommodell
Atome bestehen aus noch kleineren Bausteinen.
- Das Atommodell Thomson: Negativ geladenen Elektronen sind in ein ansonsten gleichmäßig positiv geladenes Atom eingebettet. Diese Annahme verlieh dem Modell den Namen des Rosinenkuchen-Modells.
- Ernest Rutherford (1910) fand in seinem berühmten Experiment heraus, dass die Atome offensichtlich aus einer ziemlich leeren Hülle und einem kleinen, positiven Kern (Nuklid) bestehen sollten. Damit war Thomsons Atommodell überholt.
- Die Ergebnisse Rutherfords lieferten den ersten Ansatz eines Kern-Hülle-Modells, wie wir es heute kennen.
- Atome setzen sich aus einem Atomkern und der Elektronenhülle zusammen. Letztere enthält die Elektronen.
- Der Kern (Nuklid) ist aus positiv geladenen Protonen und neutralen Neutronen aufgebaut. Protonen und Neutronen nennt man aus diesem Grund auch Nukleonen (Kernbausteine).
- Elemente werden durch ihre Protonenzahl bestimmt, während die Neutronenzahl variabel ist.
- Isotope sind Nuklide mit gleicher Protonenzahl, aber unterschiedlicher Neutronenzahl.
- Das Elektron ist ein Elementarteilchen, also einer der kleinsten Bausteine der Materie.
- Als Elementarteilchen trägt das Elektron die kleinste negative Ladung, die Elementarladung.
- Im Rahmen klassischer Atommodelle waren Atome nicht stabil.
- Nils Bohr veröffentlichte 1913 sein Atommodell, in dem er annahm, dass Elektronen den Atomkern auf ganz bestimmten (diskrete) Bahnen umkreisen würden und somit auch nur ganz bestimmte Energien annehmen können.
- Das Bohrsche Atommodell verwendete die Idee der Quantisierung von Größen, die im starken Kontrast zu den Vorstellungen der klassischen Physik stand.
- Bohr war in der Lage mit seinem Modell das Spektrum des Wasserstoffatoms theoretisch zu erklären. Sein Modell scheiterte an den neuen Ergebnissen der Quantenmechanik.
- Das aktuelle Atommodell ist das Resultat der Quantenmechanik und wird als Orbitalmodell bezeichnet.
- Orbitale sind Raumbereiche, in denen sich Elektronen mit einer gewissen Wahrscheinlichkeit aufhalten. Diese Orbitale ersetzen die Bahnen des Bohrschen Atommodells.
- Orbitale werden von den vier Quantenzahlen beschrieben, die ein Ergebnis der Quantenmechanik sind.