Einführung
An dieser Stelle werden wir im Basiswissen das Konzept des chemischen Gleichgewichts diskutieren. Dazu werden wir uns zunächst die Fragen stellen, was ein chemisches Gleichgewicht ganz grundsätzlich darstellt, wodurch es charakterisiert ist und was der Begriff des Gleichgewichts im Kanon der Chemie für eine Bedeutung hat.
Des Weiteren werden wir bereits hier einen Blick in die Zukunft werfen, indem wir verschiedene Bereiche der Chemie kurz ansprechen und die Relevanz der dort vorherrschenden chemischen Gleichgewichte verdeutlichen. Dies soll dir als Motivation dienen, damit du bereits von Anfang verstehen wirst, warum es so wichtig erscheint dieses Konzept ausführlich zu erarbeiten.
Dann wollen wir in die Theorie des chemischen Gleichgewichts einsteigen. Du wirst den Unterschied zwischen Gleichgewichts- und Nichtgleichgewichtsreaktionen sowie typische Gleichgewichtsreaktionen kennen und verstehen lernen.
Nach Betrachtung der praktischen und experimentellen Seite dieser Klasse chemischer Reaktionen, gehen wir dazu über das Massenwirkungsgesetz für Gleichgewichtsreaktionen zu formulieren. Mithilfe dieser Gleichung werden wir in der Lage sein das chemische Gleichgewicht quantitativ zu beschreiben.
Nach der Erarbeitung des Begriffs des chemischen Gleichgewichts werden wir dazu übergehen Gleichgewichte zu beeinflussen. Hierbei spielt das Prinzip von Le Chatelier die zentrale Rolle.
Einführung
Was ist ein chemisches Gleichgewicht bzw. was ist überhaupt ein Gleichgewicht im Zusammenhang mit der Chemie?
Generell klassifiziert das chemische Gleichgewicht den Zustand einer spezielle Klasse von chemischen Reaktionen. In diesem Zustand läuft die Reaktion in zwei Richtungen ab, weist also quasi zwei Reaktionspfade auf:
- Reaktion von Edukten zu Produkten
- Rückreaktion von Produkten zu Edukten
Eine solche Gleichgewichtsreaktion erkennst du am Reaktionspfeil in Form des Gleichgewichtspfeils. Dieser weist beide Reaktionspfade (Hin- und Rückreaktion) aus.
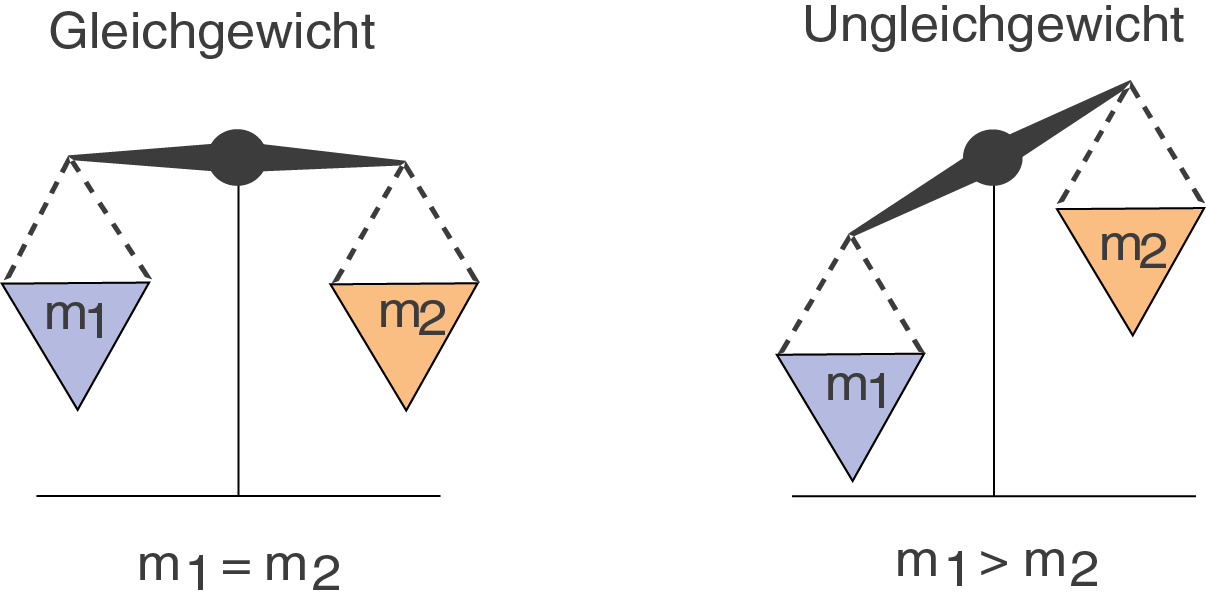
Nun zum Begriff des Gleichgewichts: aus dem Alltag kennst du diesen Begriff in der Form, dass sich zwei identische Massen auf einer Küchenwaage im Gleichgewicht befinden und sich die Waage halten.
Abb. 1: Gleichgewicht und Ungleichgewicht
Diese Vorstellung kann jedoch zu Verständnisschwierigkeiten führen, wenn du dir das chemische Gleichgewicht so bildlich vorzustellen versuchst.
Im chemischen Gleichgewicht geht es nicht darum, dass sich in etwa die Massen oder Stoffmengen der beteiligten Edukte und Produkte die Waage halten, sonder darum, dass die Stoffmenge, bzw. Konzentration an hin- und rückreagierenden Reaktanden im Gleichgewicht steht. Die Konzentrationen der Reaktanden ändert sich dabei nicht. Dies beruht darauf, dass die Reaktionsraten für Hin- und Rückreaktion, also quasi die Reaktionsgeschwindigkeiten, ebenfalls konstant sind. Unter einer Reaktionsgeschwindigkeit kannst du dir eine Konzentrationsänderung pro Zeiteinheit vorstellen. Auf diese Aspekte werden wir jedoch später wieder zurückkommen.
Motivation
Nachdem du nun einen kleinen Einblick bekommen hast, wodurch das chemische Gleichgewicht charakterisiert wird, wollen wir an dieser Stelle mit wenigen Beispielen zeigen, wie fundamental dieses Konzept für die gesamte Chemie ist. Dabei werden auch einige Aspekte angesprochen, die du als Zusatzinformation sehen darfst und nicht im Rahmen des Abiturs zu lernen sind.
Säuren und Basen - Das Kalk-Kohlensäure-Gleichgewicht
Ein weiteres der wichtigsten Grundkonzepte der Chemie baut auf der Theorie des chemischen Gleichgewichts auf, nämlich die Theorie der Säuren und Basen nach Brönstedt.
Im Zuge dessen sind wir in der Lage, Gleichgewichtssysteme wie das Kalk-Kohlensäure-Gleichgewicht zu verstehen. Dieses stellt eines der wichtigsten Puffersysteme der Erde dar und sorgt nicht nur dafür, dass unsere Böden nicht versauern, sondern auch das unser Blut auf einem konstanten pH-Wert gehalten wird.
Löslichkeit - Warum lebt der Fisch in seinem Aquarium?
Die Theorie des chemischen Gleichgewichts erlaubt es uns weiterhin, Löslichkeitsprozesse mithilfe des Löslichkeitsprodukts zu verstehen, welches aus dem Massenwirkunsgesetz abgeleitet wird. Dazu gehört beispielsweise die Löslichkeit von Salzen oder aber auch von Gasen wie Sauerstoff in Wasser.
Abb. 2: Gaslöslichkeit im Aquarium
Beispiel - Großindustrielle Ammoniaksynthese nach Haber und Bosch
Das Wissen um das chemische Gleichgewicht erlaubt es uns, die Chemie nach unseren Vorstellungen und Bedürfnissen zu betreiben.
Eines der prominentesten Beispiele, welches wir auch noch einmal im Kapitel Anwendungen ausführlich besprechen werden, ist das Haber-Bosch-Verfahren. Den deutschen Chemikern Fritz Haber und Walter Bosch war es zu Beginn des 20. Jahrhunderts gelungen im großtechnischen Maßstab Ammoniak (NH3) aus den elementaren Bausteinen H2 und N2 zu synthetisieren. Ein fundamentaler Bestandteil dieser wegweisenden Leistung war das Wissen um die Theorie des chemischen Gleichgewichts und darauf aufbauend die Beeinflussung dessen.
Ausblick
Nach dieser Einführung gehen wir jetzt dazu über, das chemische Gleichgewicht in seine Aspekte zu zerlegen, um die Theorie dahinter systematisch zu erarbeiten.
Wir werden das Massenwirkungsgesetz formulieren und schauen uns dieses im Zusammenhang mit verschiedenen Gleichgewichtslagen an. Daraufhin sind wir in der Lage auf Grundlage der Theorie von Le Chatelier das Gleichgewicht von außen zu beeinflussen und diese Einflüsse über das Massenwirkungsgesetz zu verstehen.
Danach werden wir die Thematik noch anhand der fortgeschrittenen Themen Reaktionsgeschwindigkeit (Kinetik) und Katalysatoren vertiefen. Abschließend besprechen wir prominente Anwendungen detaillierter, womit dieses Kapitel dann auch abschließen wird.