Fette
Definition
In diesem Skript beschäftigen wir uns mit den Fetten und den fetten Ölen sowie deren Aufbau aus Glycerin und gesättigten bzw. ungesättigten Fettsäuren.

Gesättigte und ungesättigte Fettsäuren
Die entscheidenden Bausteine der Fette sind die Fettsäuren. Fettsäuren sind langkettige, aliphatische (nicht aromatische) Carbonsäuren, die eine endständige Carboxygruppe(R-COOH) tragen.
Wir unterscheiden dabei gesättigte und ungesättigte Fettsäuren. Die Kohlenstoffatome der gesättigten Fettsäuren weisen alle vier Einfachbindungen auf, binden also jeweils neben ihren C-Bindungspartnern der Kette auch zwei H-Atome. In gesättigten Fettsäuren treten somit C-C-Einfachbindungen auf. Im Gegensatz dazu weisen ungesättigte Fettsäuren eine oder mehrere Doppelbindungen innerhalb der C-Kette auf. Diese Eigenschaft wirkt sich direkt auf die Struktur des Fettsäuremoleküls aus (vgl. Abb. 2).
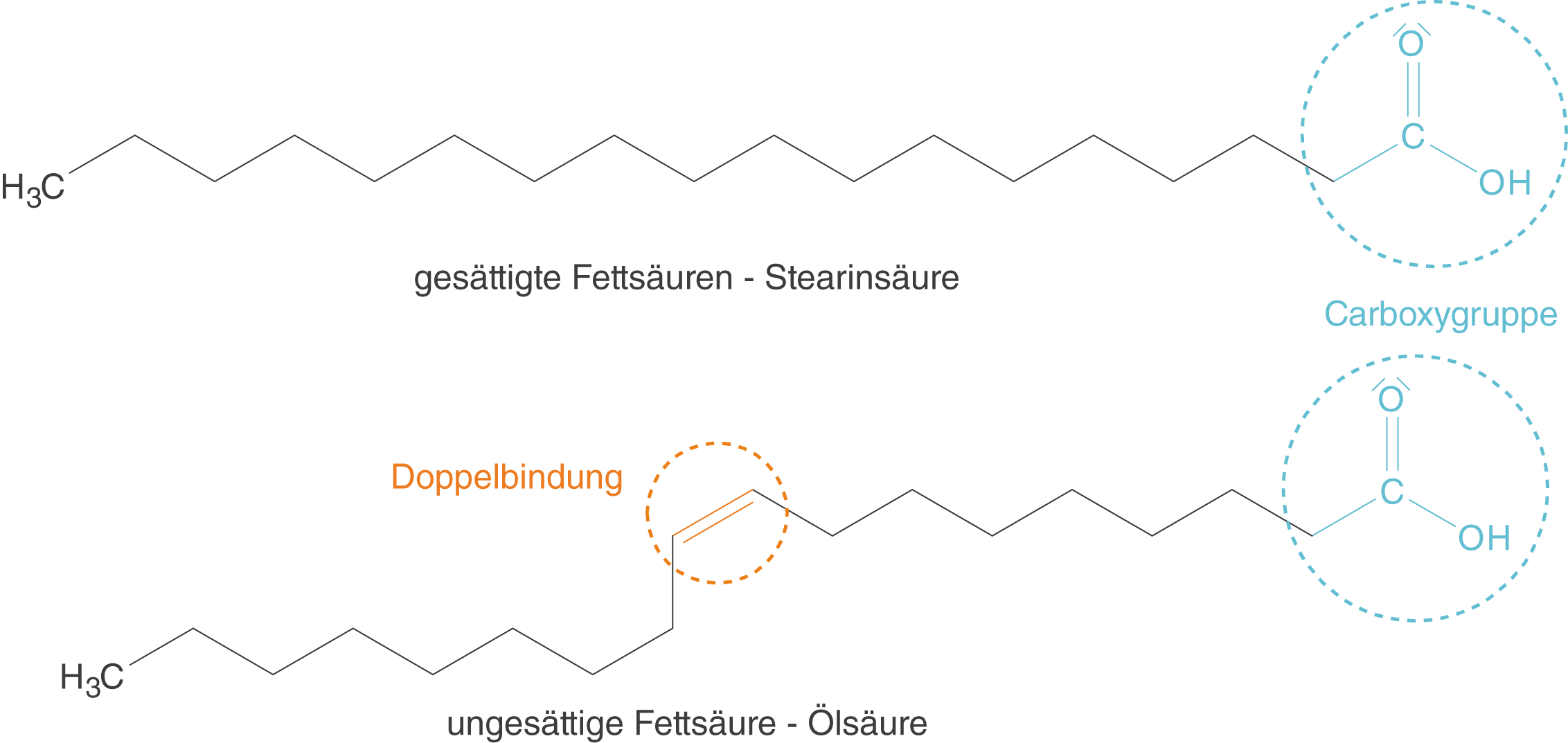
Abb. 2: Beispiele für eine gesättigte (oben) und eine ungesättigte Fettsäure (unten)
Zunächst ein Hinweis zur Darstellung der Fettsäuren. Du kannst sehen, dass die Kohlenstoffatome der Kette und die H-Atome nicht dargestellt sind; an jeder Ecke sitzt ein C-Atom, das im Fall der gesättigten Fettsäure noch zwei H-Atome bindet. Ein C-Atom, das im Fall einer ungesättigten Fettsäure an einer Doppelbindung beteiligt ist, weist dahingegen jedoch nur ein H-Atom auf, so wie es uns auch bekannt ist. Bedenke immer, dass diese Atome vorhanden sind, obwohl sie nicht eingezeichnet sind! Dahingehend ist es auch wichtig, dass am Ende der C-Kette ein Methyl-Rest (CH3-Rest) hängt.
Wenn du dir die ungesättigte Fettsäure anschaust, dann kannst du einen Knick in der Kohlenstoffkette sehen, der durch die Doppelbindung hervorgerufen wird. Hier siehst du folglich den Struktureinfluss der Bindungen innerhalb der Kette.
Fette und fette Öle - Struktur und Eigenschaften
Molekulare Struktur von Fetten und fetten Ölen
Fette sind Ester des dreiwertigen Alkohols Glycerin und diverser Fettsäuren (vgl. Abb. 3).
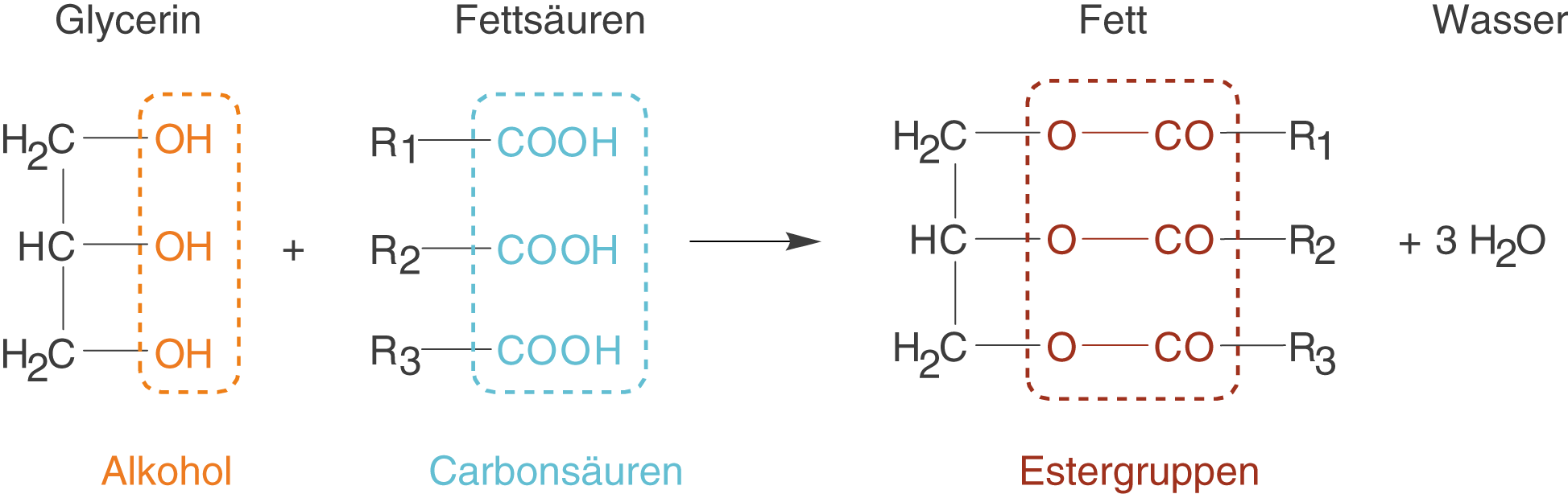
Abb. 3: Ein Fettmolekül als Produkt von Glycerin und drei Fettsäuren
Fette entstehen durch die Veresterungdes Glycerins mit Fettsäuren. Hierbei handelt es sich um eine Kondensationsreaktion bei der Wasser abgespalten wird. Die Reste der Fettsäuren R1, R2 und R3 können sich unterscheiden. Du kannst dir die Struktur eines solchen Fettes auch so merken, dass sie dem Großbuchstaben E ähnelt (vgl. Abb. 4).

Abb. 4: Struktur eines Fettmoleküls bzgl. des Buchstaben E
Öle, oder um genauer zu sein fette Öle unterscheiden sich dahingehend von Fetten, dass sie beim Raumtemperatur flüssig sind, also einen sehr niedrigen Schmelzbereich haben. Fette Öle sind vor allem aus ungesättigten Fettsäuren aufgebaut sind, die sich auf die zwischenmolekularen Kräfte auswirken. Die Unterscheidung in fette Öle ist deshalb wichtig, weil der Begriff des Öls nicht nur eine bestimmte Stoffklasse umfasst, sondern relativ viele (fette Öle, Mineralöle, ätherische Öle bspw.). Diese sind bzgl. ihrer molekularen Struktur jedoch nicht alle gleich aufgebaut.
Eigenschaften von Fetten und fetten Ölen
Wasserlöslichkeit
Fette und Öle sind aufgrund ihrer langen unpolaren Kohlenstoffreste stark hydrophob (wasserabweisend) und lassen sich nicht in Wasser oder anderen polaren Lösungsmitteln lösen. Gleichzeitig verleihen ihnen eben diese Kohlenstoffreste die Eigenschaft lipophil (fettliebend) zu sein, was bedeutet, dass sie sich sehr gut in unpolaren Lösungsmitteln lösen lassen.
Zwischenmolekulare Kräfte und der Schmelzbereich
Fette können aus ganz unterschiedlichen Fettsäuren aufgebaut sein, wie wir weiter oben gesehen haben. Des Weiteren bestehen Fette im Allgemeinen immer aus einer Vielzahl verschiedener Fettmoleküle, die jedoch alle aus spezifischen Fettsäuren zusammengesetzt sind.
Schauen wir uns zunächst die Unterschiede an, die bei der räumlichen Orientierung der Moleküle auftreten, wenn wir gesättigte oder ungesättigte Fettsäuren vorliegen haben (vgl. Abb. 5). Dazu erinnern wir uns, dass gesättigte Fettsäuren lineare Moleküle sind und ungesättigte Fettsäuren einen oder mehrere Knicke durch die auftretenden Doppelbindungen aufweisen. Strukturell gesehen können die Fettmoleküle auch von der Form des E abweichen.
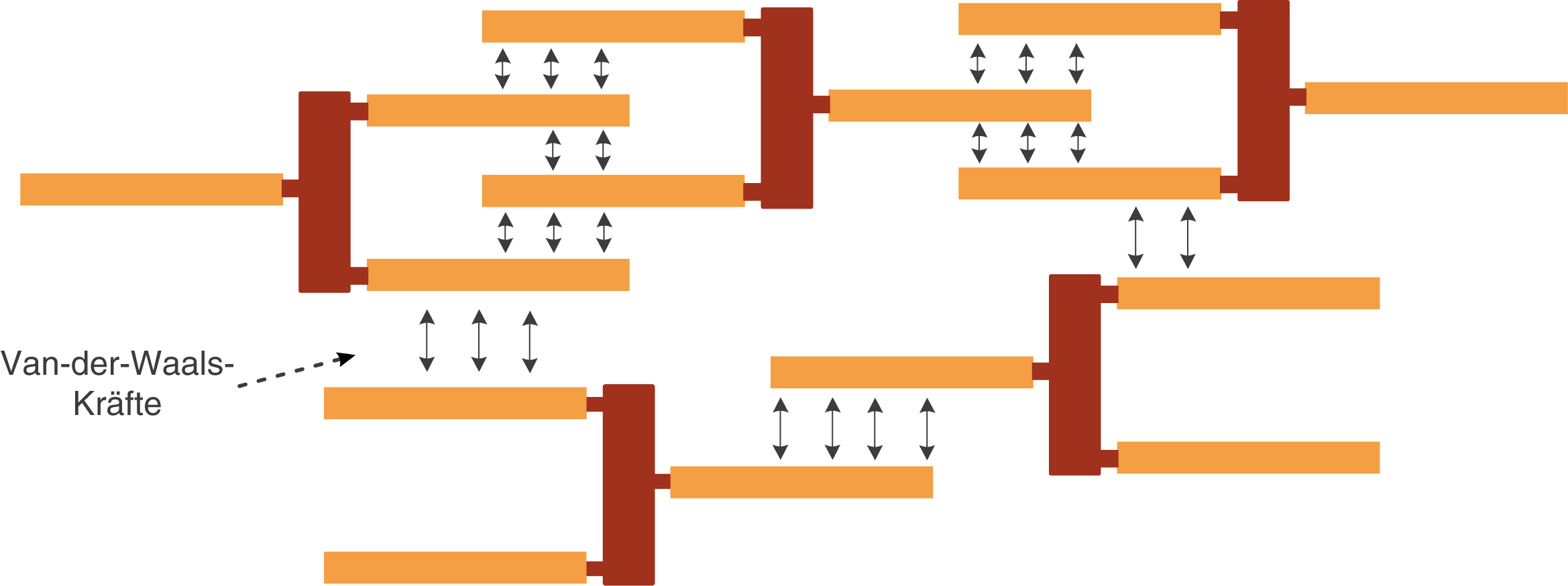
Abb. 5: Van-der-Waals-Kräfte zwischen Fetten mit gesättigten Fettsäuren
Die Moleküle können sich relativ nah zueinander anordnen, sodass die van-der-Waals Kräfte zwischen den langen unpolaren Fettsäureresten gut zur Wirkung kommen können.
Werfen wir nun einen Blick auf die Anordnung der Moleküle, die ungesättigte Fettsäuren aufweisen (vgl. Abb. 6).
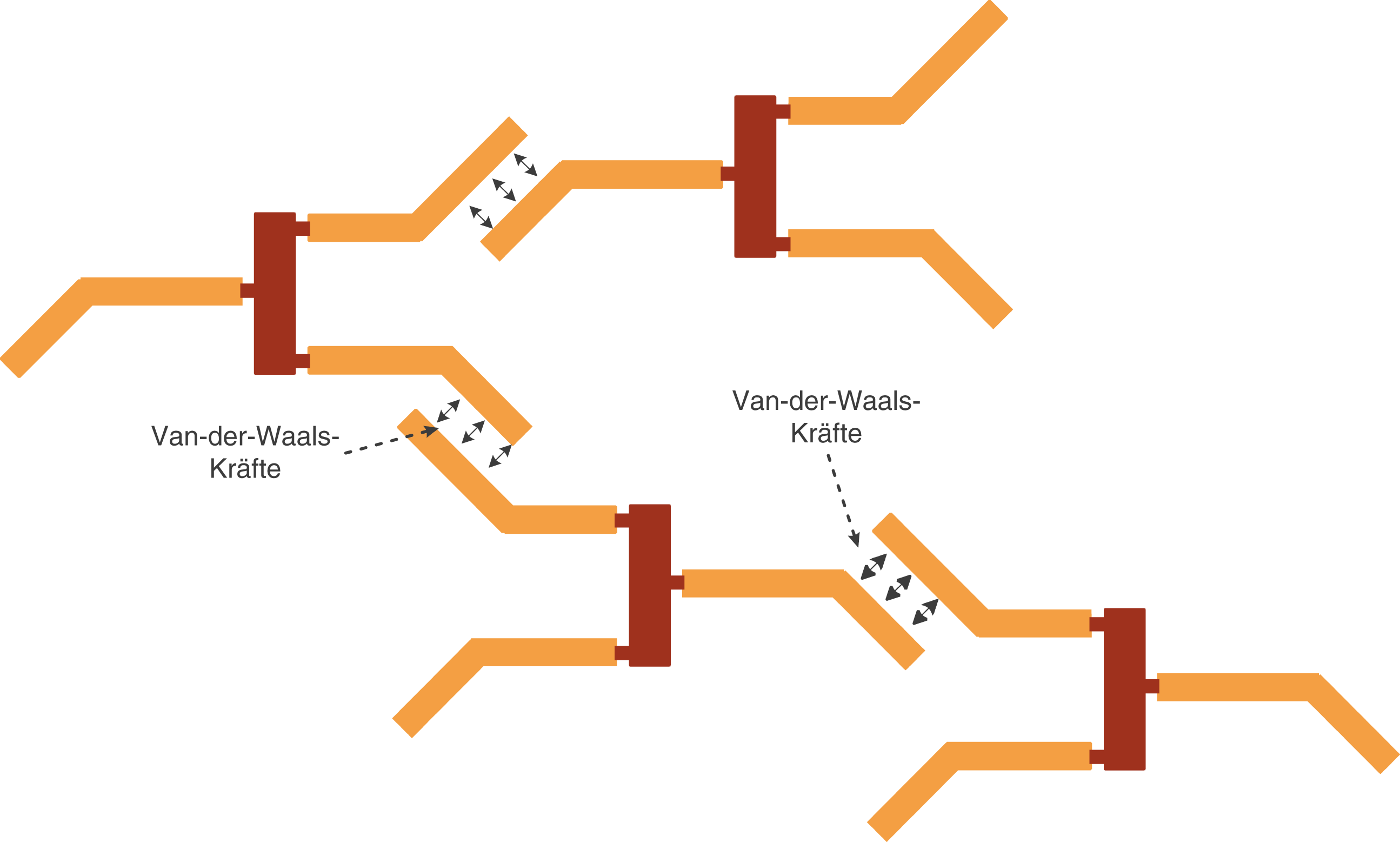
Abb. 6: Van-der-Waals-Kräfte zwischen Fetten mit ungesättigten Fettsäuren
Es fällt auf, dass die Struktur der Fettmoleküle dazu führt, dass diese sich nicht so eng zusammen lagern können, wie im Fall gesättigter Fettsäuren. Dementsprechend sind die Bereiche in denen die van-der-Waals Kräfte effektiv wirksam sind in sehr viel geringerer Zahl vorhanden.
Zusammengefasst bedeutet das, dass wir im Fall von Fetten mit vielen gesättigten Fettsäuren relativ starke zwischenmolekulare Wechselwirkungen vorfinden, was sich direkt auf ihren Schmelzbereich auswirkt. Dieser ist bzgl. der Temperatur relativ hoch im Vergleich zu Fetten mit vielen ungesättigten Fettsäuren. Bei letzteren handelt es sich dann um Verbindungen, die auch schon bei Raumtemperatur flüssig vorliegen, die sogenannten fetten Öle. Hier kannst du die strukturellen Auswirkungen der Fettsäuren auf die physikalischen Eigenschaften von Fetten erkennen.
Seifen als Salze der Fettsäuren
Die Verseifung
Wenn wir heutzutage von Seifen reden, dann beziehen wir uns eigentlich nicht auf die Salze der Fettsäuren sondern auf Tenside. Letzteren wollen wir ein eigenes Skript widmen, weshalb wir hier nun tatsächlich auf die Seifen als Salze der Fettsäuren zu sprechen kommen wollen.
Wir beginnen mit dem Prozess der Verseifung, der eine Esterhydrolyse im alkalischen Milieu darstellt. Die Estergruppen der Fette werden unter Anwesenheit von Hydroxid-Ionen gespalten.
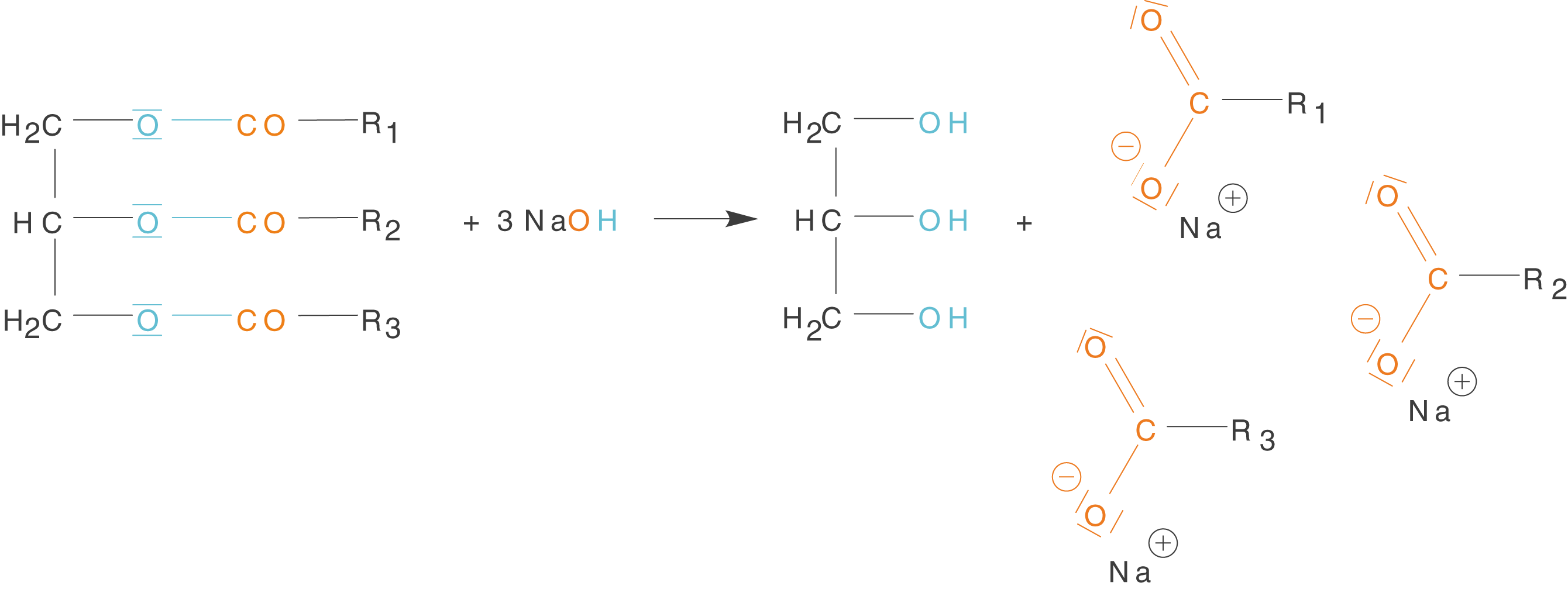
Abb. 7: Verseifung als Esterhydrolyse im alkalischen Milieu
Die Estergruppen des Fettmoleküls werden durch Hydroxid-Ionen, die bspw. von NaOH stammen, gespalten. Anschließend werden die entstehenden Carboxygruppen deprotoniert, was zur Ausbildung von Carboxylat-Anionen führt. Der letzte Schritt ist sehr wichtig, da dieser erst zur Entstehung der Seifen führt. Den reinigenden Effekt der Seifen werden wir im Kontext zu den Tensiden im ChemieLV-Skript Tenside besprechen.
Vergleich: Säure- und basenkatalysierte Hydrolyse
An dieser Stelle bietet es sich an einen etwas genaueren Blick auf die Hydrolyse zu werfen. Diese Reaktion ist ein hervorragendes Beispiel, an welchem du schon in der Schule die Relevanz eines Reaktionsmechanismus erkennen kannst. Unter dem Begriff des Reaktionsmechanismus verstehen wir die Zerlegung einer Reaktion in sogenannte Elementarreaktionen, also solche, die wir nicht weiter unterteilen können.
Im ChemieLV-Skript Polymersynthese II: Polykondensation haben wir die Hydrolyse bereits kennen gelernt, jedoch mit einem großen Unterschied: Die dort beschriebene Reaktion war säurekatalysiert (H+) und nicht basenkatalysiert (OH-) wie im Fall der Verseifung. Wir spalten zwar in beiden Fällen einen Carbonsäureester, nur liefern die Rahmenbedingungen zwei unterschiedliche Ergebnisse.
Wiederholung der säurekatalysierten Hydrolyse
Zunächst schauen wir uns kurz die säurekatalysierte Hydrolyse eines Carbonsäureesters an, damit wir den Vergleich direkt vor Augen haben (vgl. Abb. 8).
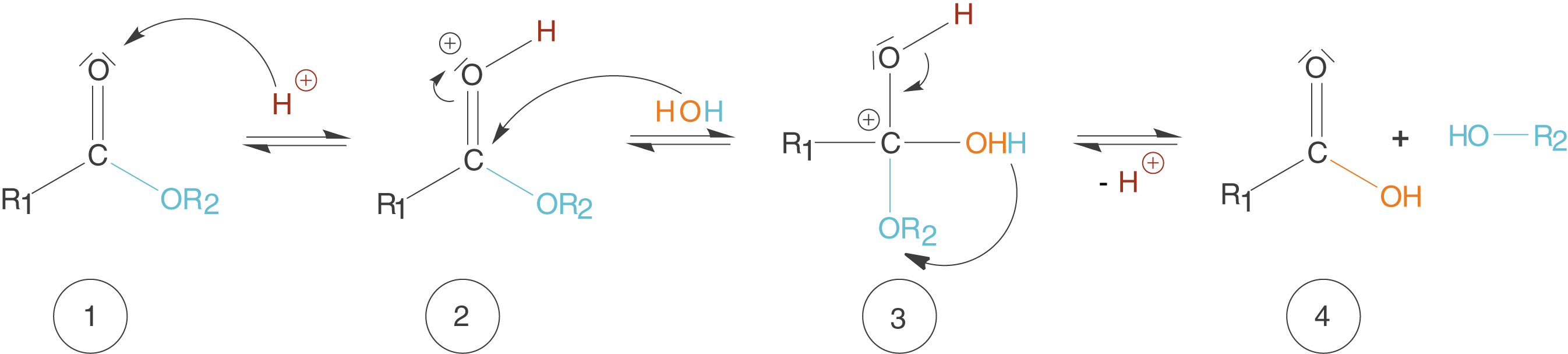
Abb. 8: Säurekatalysierte Hydrolyse eines Carbonsäureesters
- Die Aktivierung der Carbonylgruppe erfolgt durch die Protonierung (rotes H+) des Sauerstoffatoms.
- Wasser weist freie Elektronenpaare auf, kann also am durch Schritt 1 positiv polarisierten C-Atom angreifen (nukleophiler Angriff).
- Es kommt zur Abspaltung des Katalysators in Form des Protons (H+); dieser geht unverbraucht aus der Reaktion hervor. Nach der Wanderung eines weiteren Protons (blau) wird auch der Alkohol (blau) abgespalten.
- Die Produkte liegen in Form einer Carbonsäure (R1-COOH) und eines Alkohols (R2-OH) vor.
Mechanismus der basenkatalysierten Hydrolyse
Nun werfen wir einen detaillierteren Blick auf die basenkatalysierte Hydrolyse eines Carbonsäureesters. Dieser Mechanismus bildet die Grundlage für die Reaktion in Abbildung 7. Wenn man es genau nimmt, dann laufen dort drei basenkatalysierte Hydrolysen ab: Für jede Estergruppe eine. Deshalb reicht es, wenn wir uns hier nur eine der drei anschauen (vgl. Abb. 9).
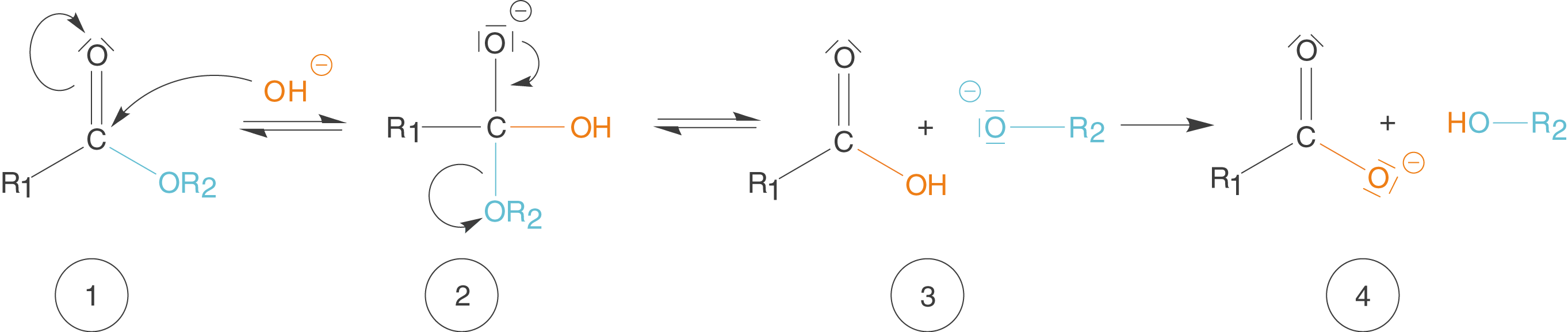
Abb. 9: Basenkatalysierte Hydrolyse eines Carbonsäureesters
- Das Hydroxid-Ion greift am positiv polarisierten C-Atom der Carbonylgruppe an.
- Es wird ein Alkoholat-Anion (R2-O-) abgespalten.
- Neben der Carbonsäure liegt nun auch das Alkoholat-Anion vor. Letzteres ist eine sehr starke Base und deprotoniert die Carbonsäure.
- Die Produkte liegen in Form eines mesomeriestabilisierten Carboxylat-Anions (Salz der Carbonsäure) und eines Alkohols vor.
Vergleich der Mechanismen
Wir wollen uns nun die einzelnen Schritte der beiden Mechanismen vergleichend anschauen, die Unterschiede erarbeiten und letztendlich die Konsequenzen verstehen. Die einzelnen Reaktionsschritte wollen wir hier mit S1 bis S4 für die säurekatalysierte Reaktion und mit B1 bis B4 für die basenkatalysierte Reaktion abkürzen.
Angriff des Nukleophils
Beide Reaktionen beginnen im Prinzip damit, dass ein nukleophiler (kernliebender) Reaktand am positiv polarisierten C-Atom der Carbonylgruppe angreift (S1 + S2 und B1). Hier können wir den unterschiedlichen Charakter des Wassers und des Hydroxid-Anions erkennen. Das Hydroxid-Anion ist bereits negativ geladen, ist also relativ gesehen das stärkere Nukleophil und kann direkt am positiv polarisierten C-Atom der Carbonylgruppe angreifen (B1). Das Wassermolekül kann erst dann angreifen (S2), wenn die Carbonylgruppe durch das Proton (H+) aktiviert wurde (S1): Die positive Polarisierung des C-Atoms wird dadurch erhöht, sodass das schwächere Nukleophil Wasser ebenfalls reagiert.
Ausbildung der Carbonsäure
Nach dem Angriff des Nukleophils kommt es in beiden Fällen zur Abspaltung der Carbonsäure (S3 und B2). Hier tritt der durch die unterschiedlichen Ausgangssituationen hervorgerufene Effekt bereits ans Licht: Im Fall der säurekatalysierten Hydrolyse erhalten wir neben der protonierten Carbonsäure auch einen Alkohol (S4), während wir bei der basenkatalysierten Hydrolyse neben der Carbonsäure ein Alkoholat-Anion, einen deprotonierten Alkohol, erhalten (B3). Wir haben im zweiten Fall effektiv ein Proton zu wenig vorliegen.
Carboxylat-Anion vs. Carbonsäure
Das Alkoholat-Anion ist eine starke Base, da Alkohole im Normalfall schwache Säuren darstellen. Folglich wird die Carbonsäure deprotoniert und wir erhalten ein mesomeriestabilisiertes Carboxylat-Anion und einen Alkohol (B4). Im Fall der säurekatalysierten Hydrolyse erhalten wir dahingegen eine Carbonsäure und einen Alkohol (S4).
Zusammengefasst konnten wir hier folgendes sehen:
- Es macht einen großen Unterschied, ob wir eine säure- oder eine basenkatalysierte Hydrolyse durchführen.
- Seifen erhalten wir nur durch die basenkatalysierte Hydrolyse. Seifen sind die Salze der Fettsäuren und wir benötigen das Alkoholat-Anion, dass es zur Deprotonierung der Fettsäuren kommt.
- Obwohl wir in beiden Fällen ungefähr die gleiche Abfolge an Reaktionsschritten hatten (bis auf die Aktivierung bei S1 und die Protolyse bei B4), bestimmen die eingesetzten Reaktanden und damit der Reaktionsmechanismus das Ergebnis ganz entscheidend!
Zusammenfassung
- Fettsäuren sind langkettige, aliphatische (nicht aromatische) Carbonsäure, die eine endständige Carboxygruppe (R-COOH) tragen.
- Wir unterscheiden gesättigte Fettsäuren, die nur C-C-Einfachbindungen aufweisen und ungesättigte Fettsäuren, die auch C-C-Doppelbindungen aufweisen.
- Die C-C-Doppelbindungen führen zu geknickten Fettsäuren, was direkte Auswirkungen auf die Eigenschaften der Fette hat.
- Fette sind aus einem Glycerinbaustein (Propan-1,2,3-triol) und drei Fettsäuren aufgebaut, die über Estergruppen miteinander verbunden sind.
- Fette bestehen hauptsächlich aus gesättigten Fettsäuren, während fette Öle insbesondere aus ungesättigten Fettsäuren aufgebaut sind.
- Gesättigte Fettsäuren sind linear, wohingegen ungesättigte Fettsäuren geknickt sind. Damit sind die van-der-Waals-Kräfte zwischen gesättigten Fettsäuren höher.
- Fette und fette Öle sind hydrophobe und lipophile Substanzen, die sich gut in unpolaren Lösungsmitteln lösen.
- Fette und fette Öle haben einen Schmelzbereich, da sie aus verschiedenen Fettmolekülen mit verschiedenen Fettsäuren aufgebaut sind.
- Seifen sind die Salze der Fettsäuren.
- Unter Verseifung verstehen wir die basenkatalysierte Hydrolyse von Fetten unter Gewinnung von Glycerin und Carboxylat-Anionen der entsprechenden Fettsäuren.