Systeme
Der Systembegriff
Systeme
Wir wollen den Begriff des Systems an dieser Stelle als eine abgegrenzte abstrakte Menge von Komponenten und deren Interaktionen beschreiben. Was bedeutet das konkret: im Falle einer chemischen Reaktion beispielsweise besteht das System aus den Reaktanden, welche die stofflichen Komponenten des Systems darstellen. Die Interaktionen zwischen diesen Reaktanden liegen beispielsweise in Form von Stößen vor, die letztendlich zur Reaktion führen. Diese Reaktion wäre in unserer Betrachtung beispielsweise von der Umwelt abgegrenzt. Insbesondere diesen letzten Aspekt, also das System und die Beziehung zur Umgebung, werden wir im Verlauf dieses Skripts noch eingehender beleuchten.
Ganz allgemein gibt es zwei Möglichkeiten ein System zu betrachten, die damit zusammenhängt, dass der menschliche Geist nur ein gewisses Maß an Komplexität verarbeiten kann. Jeder wird an den Punkt gelangen, an dem es ihm oder ihr einfach nicht mehr möglich ist, alle Einzelheiten und Interaktionen gedanklich erfassen zu können. Folgende Betrachtungen sind möglich:
- Holistische Systeme:in diesem Fall wird das Systeminnere nicht betrachtet; die dort ablaufenden Prozesse sind zu komplex und nicht fassbar. Die Funktionsweise wird einzig und allein über die Antworten des Systems auf äußere Einflüsse versucht zu entschlüsseln. Weil du quasi nicht in diese Systeme „hineinschauen“ kannst, werden diese auch als „Black-Box-Systeme“ bezeichnet. Hier beschäftigen wir uns nicht mit diesem Systemtyp.
- Reduktionistische Systeme: bei diesem Systemtyp wird davon ausgegangen, dass sich ein System aus vielen Untereinheiten zusammensetzt, welche der Mensch benennen und erfassen kann. Diese Betrachtungsweise, dass sich alles aus kleineren Einzelteilen zusammensetzt, wird Reduktionismus genannt. Wichtig ist, dass das System als ganzes, mehr als die Summe seiner Einzelteile ist. Die Interaktionen der Komponenten rufen neue Eigenschaften hervor. Dieser Systemtyp findet in diesem Kapitel seine Anwendung.
Es ist sehr wichtig zu wissen, dass der Systembegriff dem Menschen als Hilfsmittel dient komplexe Wirkungsgefüge auf ein relativ verständliches Maß zu reduzieren. Systeme sind menschliche Konstruktionen, die von Natur aus so nicht vorliegen. Die Grenzen sind mehr oder weniger willkürlich durch den Menschen gezogen und dienen der Förderung des Verständnisses. Aus diesem Grund ist es auch so wichtig, dass wir uns mit dem System und seiner Beziehung zur Umwelt beschäftigen.
Energetische Charakterisierung von Systemen
Systeme werden durch verschiedene Größen charakterisiert. Diese Größen wollen wir in diesem Abschnitt genauer betrachten.
Zustandsgrößen (intensiv und extensiv)
Zustandsgrößen beschreiben im Allgemeinen ein System in einem bestimmten Zustand. Im energetischen (thermodynamischen) Gleichgewicht, also in unserem Fall im chemischen Gleichgewicht, sind diese Zustandsgrößen konstant. Ein weiterer wichtiger Aspekt ist, dass Zustandsgrößen den Zustand eines Systems beschreiben und nicht davon abhängen wie dieser Zustand erreicht wurde.
Zustandsgrößen sind bspw.:
- Innere Energie:
- Enthalpie:
- Temperatur:
- Druck:
- Volumen:
Wir wollen an folgendem Beispiel kurz die Wegunabhängigkeit dieser Größen erörtern: Stelle dir einen Topf voller Wasser vor, den du zum Sieden bringen willst. Du könntest ihn auf eine Herdplatte stellen, auf erhitzen und das Wasser siedet. Andererseits könntest du das Wasser aber auch auf
erhitzen, auf
abkühlen und anschließend bei
zum Sieden bringen. Der Weg unterscheidet sich deutlich, nur der Endzustand nicht. Beide Male hat das Wasser eine Temperatur von
wenn es den Endzustand erreicht hat. Die Zustandsgröße Temperatur hängt nicht von Weg ab, auf dem dieser Zustand erreicht wurde.
Zustandsgrößen werden weiter in intensive und extensive Zustandsgrößen unterteilt.
- intensive Zustandsgrößen: bspw.
,
: Zustandsgrößen, die nicht von der Stoffmenge abhängen.
- extensive Zustandsgrößen: bspw.
: Zustandsgrößen, die linear mit der Stoffmenge zusammenhängen. Bei einer Zunahme der Stoffmenge in einem System wird auch das Volumen größer und analog gilt das auch für die Verringerung der Stoffmenge.
Prozessgrößen
Im Gegensatz zu Zustandsgrößen hängen Prozessgrößen vom Weg ab, auf dem der Zustand erreicht wurde. Diese treten auch nur dann auf, wenn sich der Zustand des Systems ändert. Beispiele für Prozessgrößen sind die Gröen der Arbeit und der Wärmeenergie
. Auf diese gehen wir im Skript Energie näher ein.
Stoffliche Charakterisierung von Systemen
Ein weitere wichtige Charakterisierung, die wir durchführen können, bezieht sich auf die Aggregatszustände der Komponenten des Systems. An dieser Stelle ist es nur wichtig zu wissen, dass es diesen Unterschied gibt. Das Problem dabei ist, dass sich die Behandlung von homogenen und heterogenen Systemen in der Theorie unterscheidet. Heterogene Systeme sind wesentlich komplexer und damit ändert sich auch die Theorie, die zur Beschreibung herangezogen wird. Doch das soll uns hier im Detail nicht interessieren.
Homogene Systeme
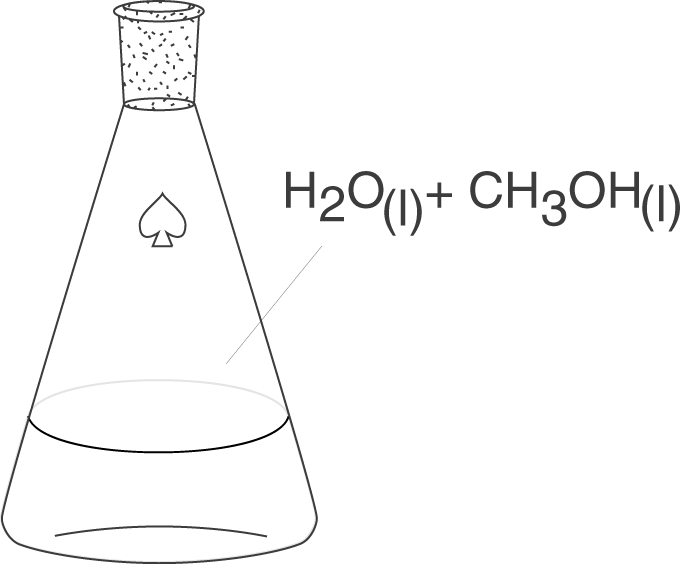
Ein homogenes System liegt vor, wenn alle Komponenten des Systems den gleichen Aggregatszustand besitzen. Beispielsweise reden wir von einem homogenen System, wenn wir Methanol in Wasser lösen.
Heterogene Systeme
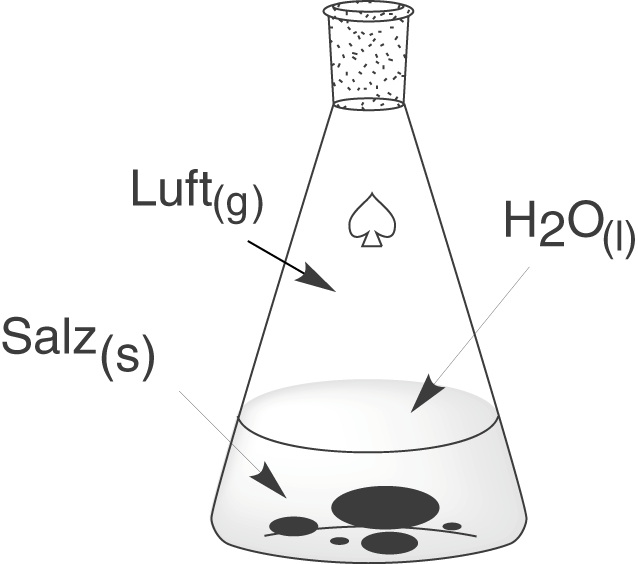
Heterogene Systeme bestehen aus Komponenten mit unterschiedlichen Aggregatszuständen. Wenn wir beispielsweise eine gesättigte Salzlösung betrachten, liegt neben der gesättigten Lösung auch ein Bodensatz an ausgefallenem Feststoff vor. Wenn wir dann auch noch die Luft über der Lösung zu unserem System zählen, dann haben wir sogar ein Drei-Phasen-System vorliegen: eine flüssige (Lösung), eine feste (Salz) und eine gasförmige Phase (Luft).
Systeme und ihre Umgebung
Im Zusammenhang mit der chemischen Energetik und weiter gegriffen der chemischen Thermodynamik, ist es nicht nur notwendig sich mit dem Systembegriff an sich auseinander zu setzen, sondern insbesondere auch mit der Beziehung von Systemen zur ihrer Umwelt. Jedes System ist zwar eine abstrakte Menge von Komponenten und deren Interaktionen, dennoch ist diese in einem gewissen Umfeld eingebettet. Was uns an dieser Stelle genauer interessiert ist die Verbindung zwischen dem System und seiner Umgebung.
Auf der Basis dieses Wissen werden wir im weiteren Verlauf des Kapitels das Verhalten von Systemen in gewissen Situationen erklären können, was ohne diese Grenzen nicht ohne weiteres möglich wäre.
Offene Systeme
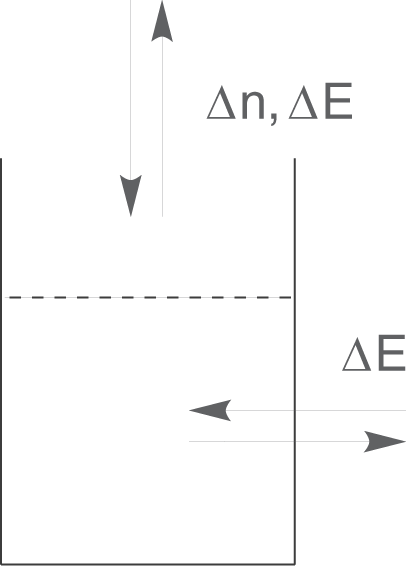
Offene Systeme sind dadurch charakterisiert, dass ein Stoffaustausch und ein Energieaustausch
mit der Umwelt möglich ist.
Ein solches System könnte beispielsweise ein offenes Gefäß sein, in dem Wasser erhitzt wird. Das Wasser kann bei steigender Temperatur verdampfen und die Wärme des Wassers wird über die Gefäßwand an die Umgebung abgegeben.
Geschlossene Systeme
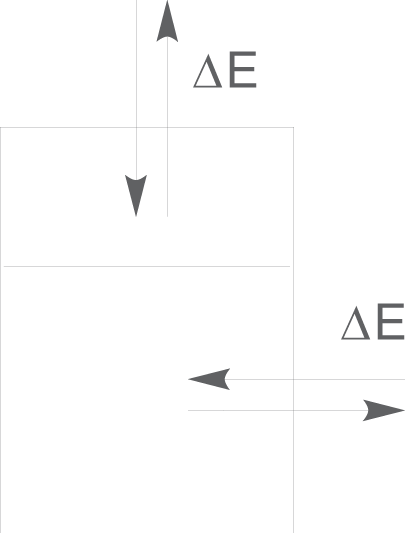
Zwischen geschlossenen Systemen und ihrer Umwelt besteht kein Stoffaustausch , sondern nur ein Energieaustausch
. Das bedeutet, dass sich die Masse in diesem System nicht ändert.
Wenn wir das Beispiel von oben heranziehen, können wir das Gefäß beispielsweise mit einem Deckel verschließen. Damit kann kein Wasserdampf mehr austreten und die Masse an Wasser im System bleibt konstant. Andererseits kann die Wärme immer noch über die Gefäßwand an die Umgebung abgegeben werden.
Isolierte Systeme
Im Falle von isolierten Systemen liegt weder ein Stoffaustausch noch ein Energieaustausch
mit der Umwelt vor. Sowohl die Masse als auch die Energie sind innerhalb der Systemgrenzen erhalten.
Um auch hier das gegebene Beispiel zu verwenden, stellen wir uns vor, dass wir das Gefäß isolieren. Dann kann auch keine Wärmeenergie mehr über die Gefäßwände (hier die Systemgrenze) abgegeben werden.
Diese Definitionen erlauben es uns bei der Beschreibung von Systemen gewisse Annahmen zu treffen, dazu gehören hier insbesondere die Tatsachen der Massen- und Energieerhaltung bei isolierten Systemen, die uns das Rechnen sehr erleichtern. Aus diesem Grund werden wir im weiteren Verlauf dieses ChemieLV-Basiswissens immer von isolierten Systemen reden. Sollte dies an einer Stelle einmal nicht so sein, dann ist dies explizit angegeben.