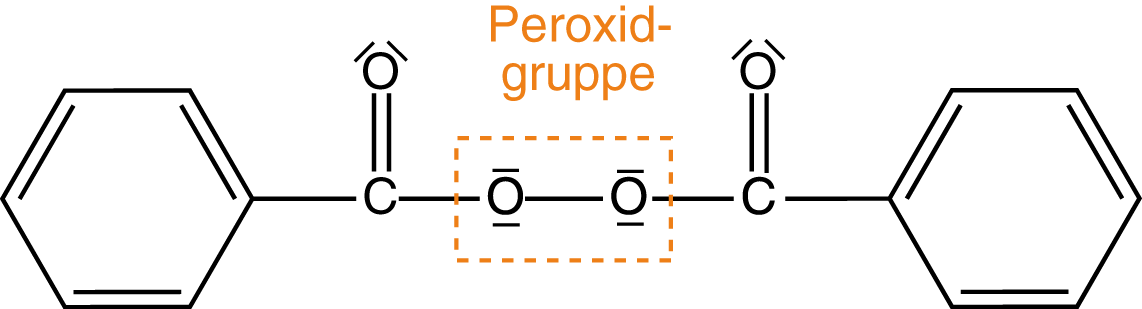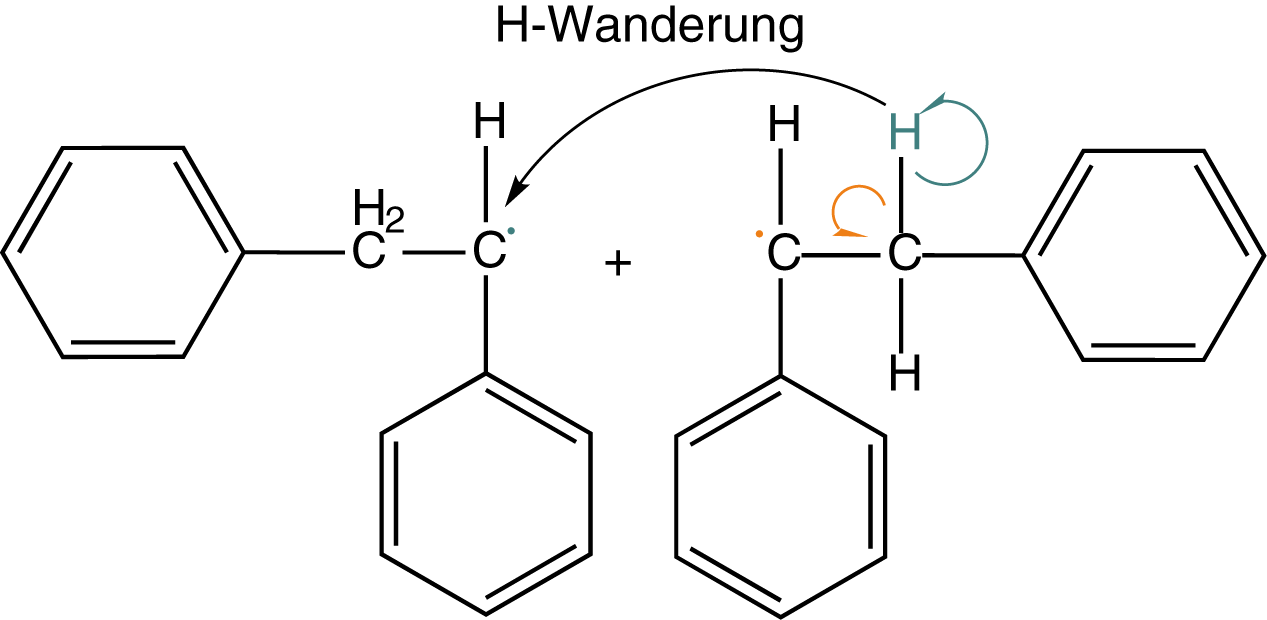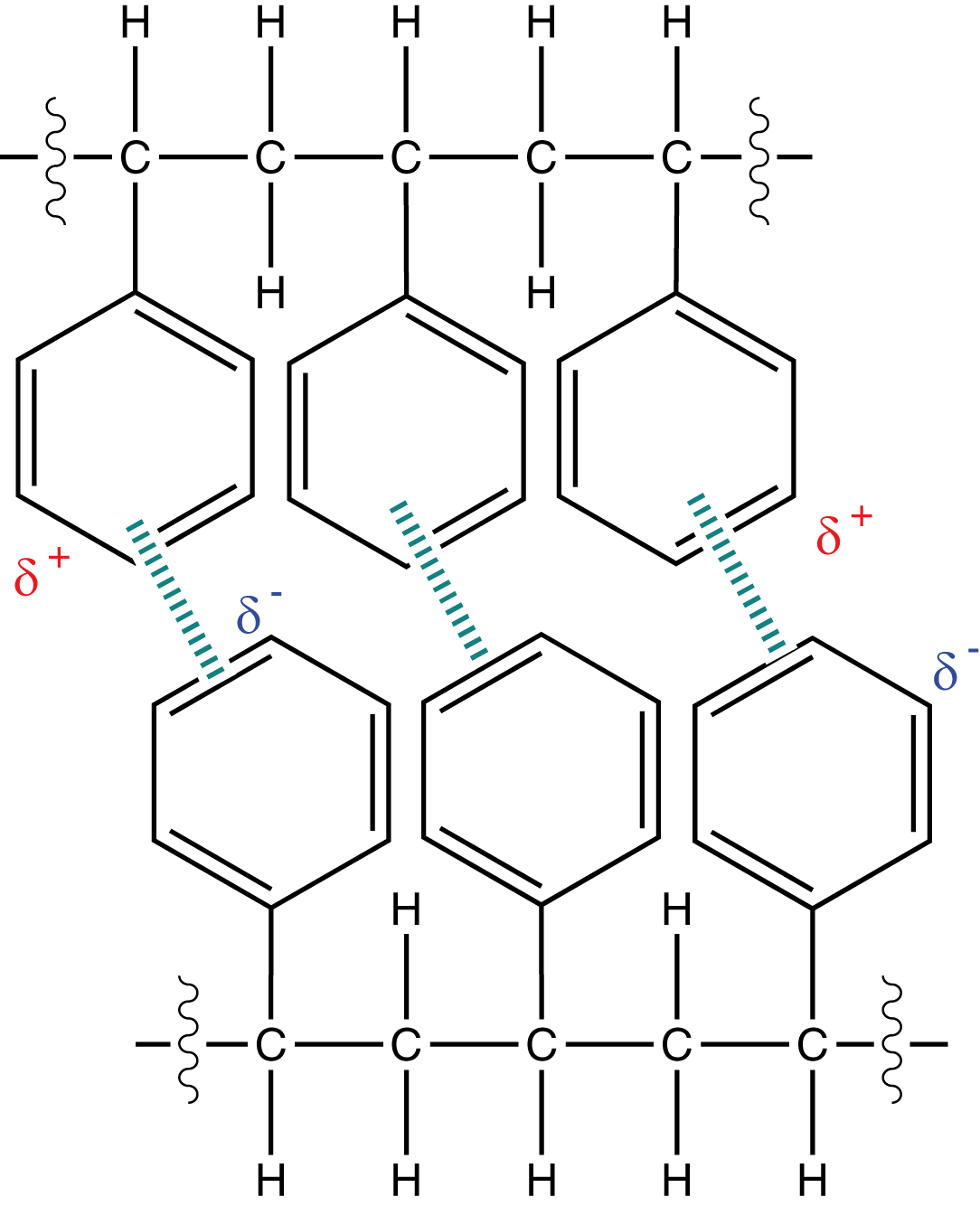Polymersynthese I: Radikalische Polymerisation
Polymerisation
In diesem Skript werden wir uns mit einer der drei wichtigsten Synthesevarianten zur Herstellung von Polymeren beschäftigen. Im Zusammenhang mit den Grundlagen des Themengebiets Makromolekulare Chemie und insbesondere mit den Kunststoffen haben wir wichtige Konzepte zur Struktur und den Eigenschaften dieser Feststoffe kennen gelernt (vgl. ChemieLV-Skript Makromoleküle - Struktur und Eigenschaft). Diese Struktur-Eigenschafts-Beziehungen basieren auf dem räumlichen Bau des Polymers. Wir wollen hier dazu übergehen, das Polymer aus seinen Monomeren zusammenzusetzen. Dieser Prozess ist an unterschiedliche Reaktionsmechanismen gebunden. Solche werden im Allgemeinen durch den Begriff der Polymerisation beschrieben. Bei einer Polymerisation oder auch Kettenpolymerisation handelt es sich um eine Reaktion, bei welcher ein Polymer durch sogenannte aktiven Spezies gebildet wird. Diese aktiven Spezies sind die Monomere des zu bildenden Polymers, die auf eine spezifische Art und Weise aktiviert wurden. Wie diese Aktivierung funktioniert, werden wir in diesem Skript detailiert besprechen.
Zunächst kümmern wir uns um den Mechanismus der radikalischen Polymerisation, welche wir am Beispiel von Styrol erarbeiten wollen. Hier betrachten wir die einzelnen Reaktionsschritte, was dabei passiert und welche die maßgeblichen Reaktionsteilnehmer sind. Wir beginnen mit der Erzeugung von Radikalen, welche den Kettenstart ermöglichen. Anschließend reagieren die aktivierten Monomere und bauen das Polymer nach und nach auf. Abbruchreaktionen führen, wie der Begriff bereits erwarten lässt, zum Abbruch der Polymerisationsreaktion. Abschließend schauen wir uns neben Polystyrol (PS) zwei weitere prominente Polymere, deren Eigenschaften sowie deren Verwendung im Alltag an. Hier werden die Struktur-Eigenschafts-Beziehungen der Polymere relevant (vgl. ChemieLV-Skript Makromoleküle - Struktur und Eigenschaft).
Anmerkung:
In der organischen Chemie ist es notwendig, sich die Reaktion im Detail anzuschauen. Es gibt eine Vielzahl charakteristischer Reaktionen, die nach einem bestimmten Schema ablaufen. Das „Wie“, also die Gesamtheit der einzelnen Reaktionsschritte, bezeichnen wir als Mechanismus. Das bedeutet, dass die Einzelschritte einer Reaktion zusammengefasst einen Reaktionsmechanismus darstellen, so auch die Radikalische Polymerisation.
Radikalische Polymerisation am Beispiel von Styrol
Durch die radikalische Polymerisation werden viele Monomere zu einem Polymer aufgebaut. Ganz prinzipiell läuft die Reaktion so ab, dass ein Monomer am Anfang steht und nach und nach werden andere Monomere mit diesem verknüpft, sodass eine Kette von Monomeren entsteht: das Polymer.
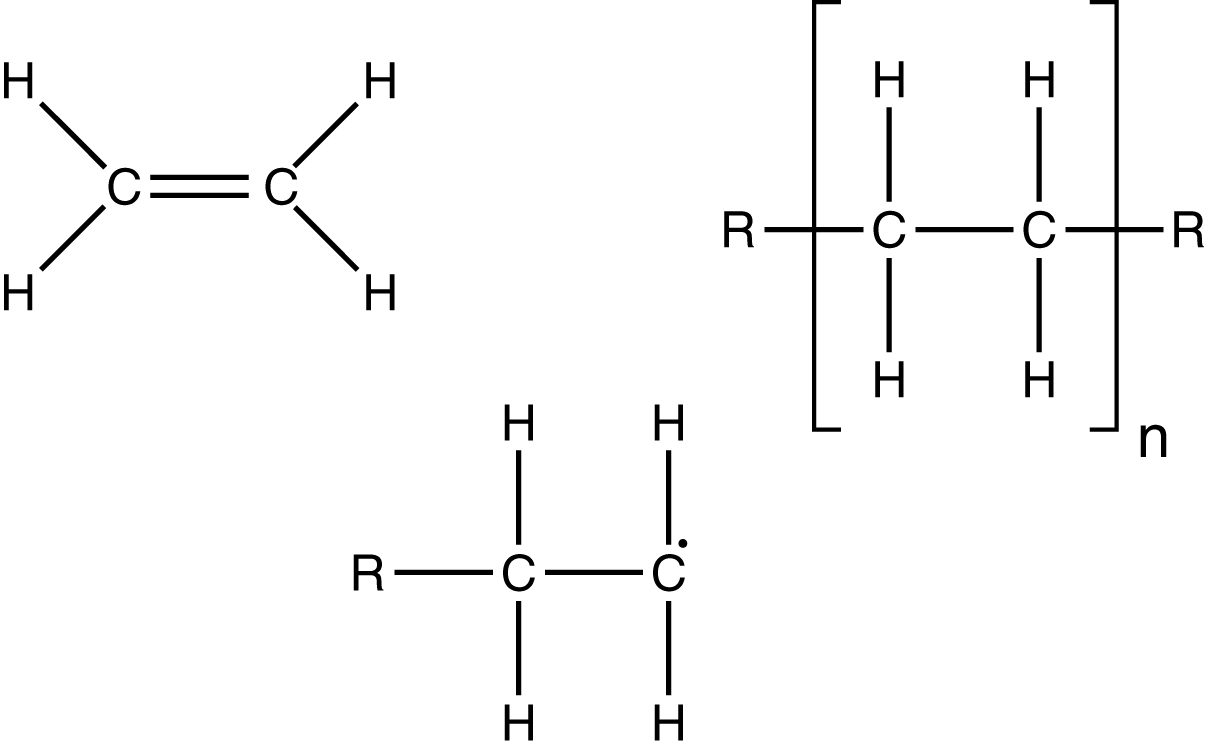
Wir wollen uns den Mechanismus der radikalischen Polymerisation, welcher auch als Radikalkettenmechanismus bekannt ist, am Beispiel des Monomers Styrol schauen. In Abbildung 1 kannst du die Strukturformel von Styrol sehen. Es handelt sich hierbei um eine aromatische Verbindung, die auch unter dem Namen Phenylethen bekannt ist. Die funktionelle Gruppe des Moleküls, die Doppelbindung, ist hier orange eingefärbt. Die Elektronen dieser Doppelbindung spielen die zentrale Rolle während der radikalischen Polymerisation. Wir wenden uns nun dem Radikalbegriff zu und klären, wie Radikale entstehen und was sie von anderen Verbindungen unterscheidet.

Radikalstarter - Erzeugung von Radikalen
Radikale sind Atome oder Molek&uumL,le, die ungepaarte Elektronen aufweisen. In der Strukturformel wird das freie Elektron dabei durch einen Punkt am jeweiligen Atom dargestellt. Ein sehr wichtiger Aspekt betrifft den Unterschied zu Ionen (Anionen und Kationen): Ein Radikal ist ungeladen! Während Ionen ihre Elektronenkonfiguration so „ergänzt“ haben, dass diese neue Konfiguration stabiler ist als die alte, beispielsweise indem die Oktettregel erfüllt wurde, ist dies bei Radikalen nicht der Fall. Dieser Unterschied hilft uns nun, das Radikal zu verstehen. Das ungepaarte Elektron führt nämlich dazu, dass Radikale hoch reaktiv sind (wir können uns den Radikalbegriff also sehr realistisch vorstellen - das Teilchen ist wirklich „radikal“ in seinem Verhalten). Wenn wir Verbindungen mit mehr als einem ungepaarten Elektron finden, dann sprechen wir von Diradikalen (zwei ungepaarte Elektronen) oder Triradikalen (drei ungepaarte Elektronen).
Um unsere Reaktion in Gang zu bringen, benötigen wir Radikale. Es gibt nun Verbindungen, die sich aufgrund ihrer Struktur ganz besonders dazu eignen, Radikale auszubilden. Diese werden im Zusammenhang zur radikalischen Polymerisation Initiatoren genannt, weil sie die Reaktion in Gang bringen. Wir werden beispielhaft Dibenzoylperoxid (DBP) als Radikalstarter betrachten (vgl. Abb. 1).
Anmerkung:
Unter Strahlung verstehen wir elektromagnetische Wellen. Es gibt viele verschiedene elektromagnetische Wellen, die sich in ihren Energien voneinander unterscheiden (Röntgen, UV, sichtbar, Infrarot etc.). In ihrer Gesamtheit stellen sie das elektromagnetische Spektrum dar. Der bekannteste Bereich dieses Spektrums umfasst das sichtbare Licht. Der Regenbogen ist ein Phänomen, bei welchem du alle Farben dieses Teilbereichs des elektromagnetischen Spektrums sehen kannst. Energiereichere Strahlung wird als UV-Strahlung (Ultraviolett) bezeichnet. Vor dieser schützen wir uns beispielsweise durch Sonnencreme. Sie ist energiereicher und somit für uns schädlicher. Diese Energie können wir hier nutzen, um Radikale zu erzeugen, indem wir Peroxid-Gruppen spalten.
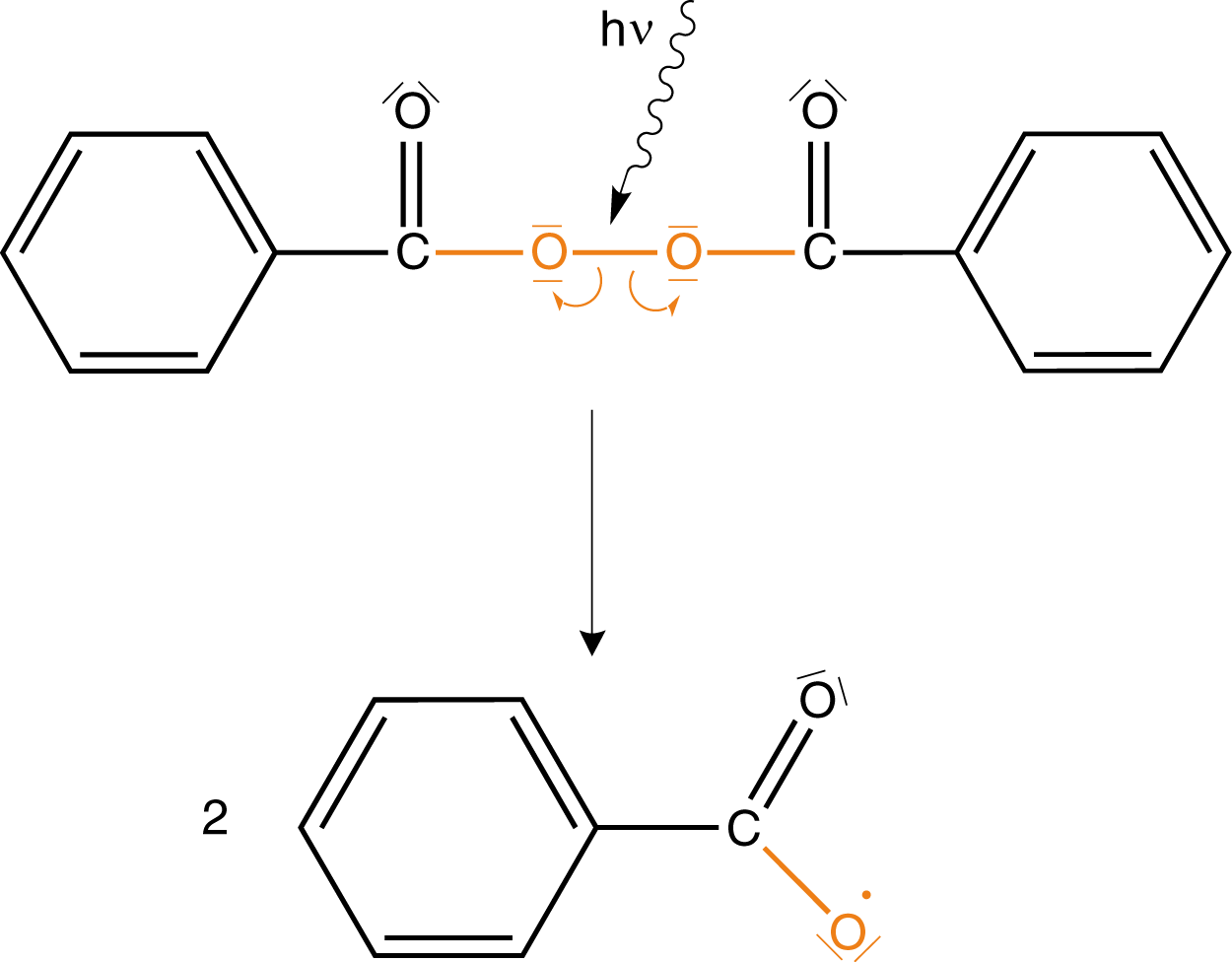
Wir werden uns hier der zweiten Variante bedienen: Wir spalten die Peroxidbindung mithilfe energiereicher Strahlung () homolytisch (vgl. Abb. 2). Unter einer homolytischen Spaltung verstehen wir die Spaltung einer kovalenten Bindung, bei welcher je ein Elektron am ehemaligen Bindungspartner verbleibt: Die Elektronen werden gleichsam geteilt. Unter einer kovalenten Bindung verstehen wir diejenige, die von zwei Elektronen aufgebaut wird (vgl. ChemieLV-Skript Bindungsformen und deren Unterschiede). Die Strahlung stellen wir mithilfe eines gewellten Pfeils dar.
Wir erhalten als Produkt zwei Benzoyloxy-Radikale. Je ein Elektron der ehemaligen O-O-Bindung verleiht dieser Verbindung ihren radikalischen Charakter. Die Umverteilung der Elektronen wird durch die Verwendung von Pfeilen dargestellt. Eine halbe Pfeilspitze steht dabei für ein Elektron und eine ganze für zwei Elektronen.
Anmerkung:
Bei der Spaltung von kovalenten Bindungen können wir zwei Typen unterscheiden: die homolytische Spaltung und die heterolytische Spaltung. Während bei der homolytischen Spaltung die Elektronen der aufgebrochenen Bindung gleichmäßig unter den beiden Produkten aufgeteilt werden, verbleiben die Elektronen bei der heterolytischen Spaltung an einem Spaltprodukt. Die Folge ist, dass homolytisch gespaltene Bindung zur Ausbildung von Radikalen führen, welche ungeladen vorliegen. Heterolytisch gespaltene Bindungen ziehen die Entstehung von Ionen nach sich, da die Elektronen ungleichmäßig aufgeteilt werden. Bedenke: Radikale sind nicht geladen, sondern weisen ungepaarte Elektronen auf. Ganz im Gegensatz dazu stehen Ionen!
Das Benzoyloxy-Radikal könnte die Polymerisation nun schon in Gang setzen. Eine andere Möglichkeit besteht darin, dass es unter Abspaltung von ein Phenyl-Radikal ausbildet, wie in Abbildung 3 dargestellt.
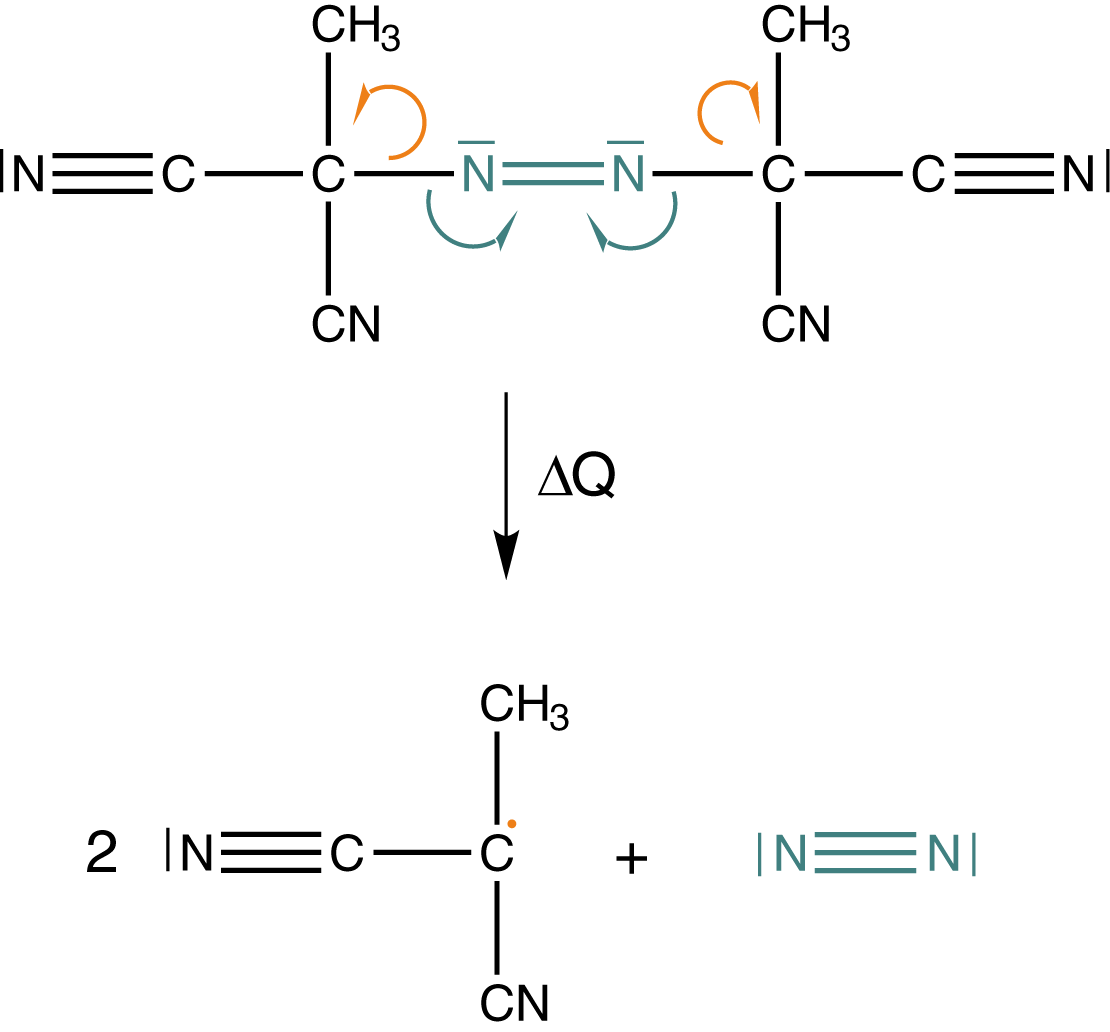
Damit haben wir zwei freie Radikale erhalten, die unsere Reaktion in Gang bringen können. Im Falle industrieller Prozesse werden diese Initiatoren insbesondere thermisch gespalten, um Radikale zu erhalten und nicht durch energiereiche Strahlung wie hier. Ein weiterer Radikalstarter, den wir hier der Vollständigkeit halber aufführen wollen, ist AIBN: N,N-Azobisisobutyronitril.
Dieser bietet eine bessere Kontrolle bei Polymerisationsreaktionen und bildet das entsprechende Radikal unter Abspaltung von elementarem Stickstoff. Die homolytische Spaltung der Bindung können wir durch die Zufuhr von Wärme () erreichen.
Bisher haben wir gesehen, dass wir eine Verbindung benötigen, welche leicht Radikale bildet, wie beispielsweise DBP oder AIBN. Diese stellt den Radikalstarter bzw. Initiator dar. Technisch gesehen können wir Radikale nicht einfach zur Reaktionsmischung hinzugeben. Diese bilden sich aus den Initiatormolekülen durch Spaltung schwacher Bindungen (Peroxid bspw.) im Reaktionsgemisch aus. Die zur Spaltung benötigte Energie können wir in thermischer Form oder in Form von elektromagnetischer Strahlung (bspw. UV) bereitstellen. Wichtig ist, dass du diesen Schritt als ersten im gesamten Verlauf des Radikalkettenmechanismus im Hinterkopf behalten. Dieser Schritt ist essentiell, andernfalls bekommen wir keine Radikale.
Polymerradikale - Kettenstart und Kettenwachstum
An dieser Stelle betrachten wir Styrol als Monomer. Das Monomer stellt den kleinsten Baustein des Polymers dar (vgl. ChemieLV-Skript Makromoleküle - Einführung und Definition). Als wir Styrol am Anfang dieses Skripts kennen gelernt haben, haben wir insbesondere auch einen Blick auf die funktionelle Gruppe in Form der Doppelbindung geworfen. Diese wird nun relevant.
(i) Kettenstart
Wir verwenden nun die Phenyl-Radikale, die wir durch die Spaltung von DBP erhalten haben, um den Kettenstart durchzuführen. Unter Kettenstart verstehen wir die Reaktion eines Initiatorradikals mit einem Monomer. Letzteres stellt in unserem Fall das Styrol dar.
Das Produkt dieser Reaktion stellt wieder ein Radikal dar. In diesem Schritt wurde ein Monomer durch eines der Initiatorradikale aktiviert. Das bedeutet, dass es nun ebenfalls einen radikalischen Charakter aufweist. Dementsprechend ist es nun möglich, dass auch dieses neue Radikal aufgrund seiner hohen Reaktivität an einem weiteren Monomer angreifen kann. Somit wird es möglich, dass ein Polymer aufgebaut werden kann. Dieses Kettenwachstum wollen wir uns im nächsten Schritt anschauen.
Anmerkung
Die Chemie von Styrol hält Überraschungen bereit, die auf die Reaktivität dieser Verbindungen zurückzuführen sind. Im Falle dieses Moleküls ist eine Polymerisation auch ohne Radikalstarter zu beobachten und nur an eine erhöhte Temperatur gekoppelt. Dieses Phänomen hat mit dem Begriff der Selbstinitiation zu tun: Durch eine Reaktion mehrerer Styrolmoleküle ist es möglich, dass sich hier bereits Radikale bilden, ohne dass ein Radikalstarter nötig ist. Dieser Effekt soll uns hier aber nicht im Detail interessieren.
(ii) Kettenwachstum
Wir haben während des Kettenstarts durch die Reaktion eines Initiatorradikals mit einem Monomer, in unserem Fall Styrol, ein aktiviertes Monomer erhalten, welches wiederum einen radikalischen Charakter besitzt. Dieses wird nun an einem weiteren Styrol-Monomer angreifen.
Die Abkürzung „Ph“ steht für Phenyl und stellt den aromatischen Rest dar. Wieder greift das Radikal an der Doppelbindung von Styrol an. Dadurch verlängert sich die Kette um ein weiteres Monomer und behält ihren radikalischen Charakter. Dieser Vorgang wird auch als Addition von Monomeren an bezeichnet. In jedem Schritt wird ein weiteres Monomer an die bestehende Kette addiert. Allgemein können wir das Kettenwachstum auch durch die folgende Reaktionsgleichung beschreiben, wobei das R einem Rest und das M einem Monomer entspricht:
In einem Reaktionsschritt wird ein Monomer an das bereits bestehende Polymer mit Kettengliedern addiert. Wir erhalten dann eine Kette mit
Kettengliedern. Betrachten wir diese allgemeine Reaktionsgleichung für das Beispiel für Styrol unter Verwendung von Strukturformeln, dann sieht das so aus:
Wir erhalten folglich ein Polymer mit Kettengliedern. Beachte, dass das letzte in diesem Fall wiederum einen radikalischen Charakter aufweist. Aus diesem Grund hat die Kette auch nur eine Länge von
Gliedern. Eines der
Monomere bildet das „radikalische“ Ende.
Abbruchreaktionen
Am Ende des Radikalkettenmechanismus stehen die Abbruchreaktionen. Diese beruhen auf der Tatsache, dass ohne freie Radikale auch keine Reaktion mehr ablaufen kann. Haben alle Radikale, die an der Reaktion beteiligt sind, in irgendeiner Art und Weise reagiert, dann stoppt das Kettenwachstum und die Polymerisation. Wir wollen uns nun die Typen dieser Abbruchsreaktionen anschauen.
(iii a) Abbruch durch Kombination
Reagieren zwei Radikale miteinander, dann kommt es unter Kombination der beiden Radikale zur Bindungsbildung. Es werden zwei ungepaarte Elektronen zur Verfügung gestellt, die zusammen eine Einfachbindung ergeben. Das hat zur Folge, dass nun keine ungepaarten Elektronen mehr im Molekül vorliegen und somit auch kein radikalischer Charakter. Wir schauen uns das beispielhaft einmal in Abbildung 9 an:
Nehmen wir zwei allgemeine Polymerradikale mit einer Kettenlänge von und
Monomeren, dann können wir diese Abbruchsreaktion auch allgemein schreiben:
Wir erhalten demnach ein Polymer, das die kombinierte Anzahl an Monomeren der beiden Polymerradikale besitzt. Die Kettenlängen addieren sich. Gleichzeitig bedeutet das auch, dass du viele verschiedene Möglichkeiten der Kombination hast.
(iii b) Abbruch durch Disproportionierung
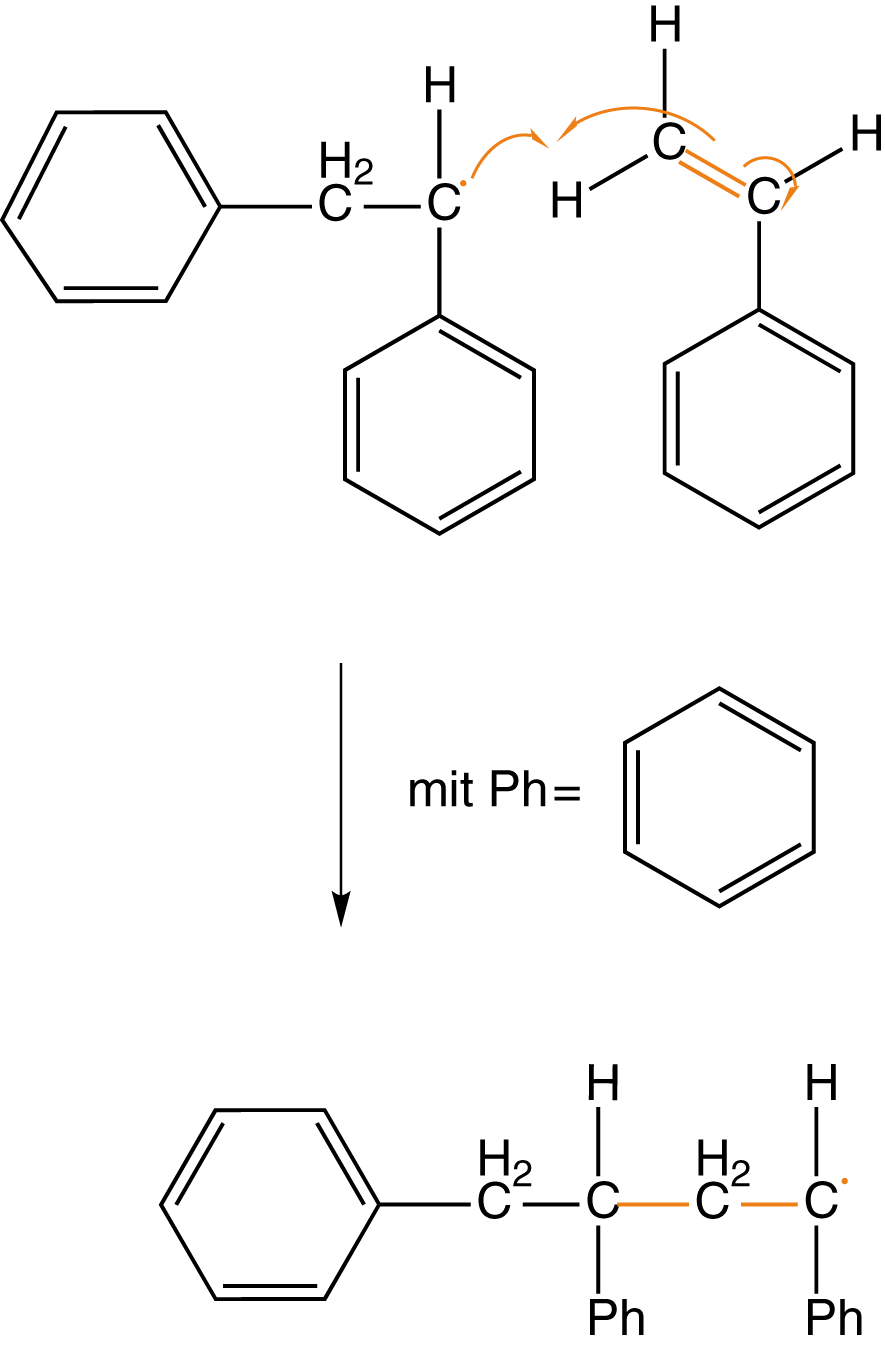
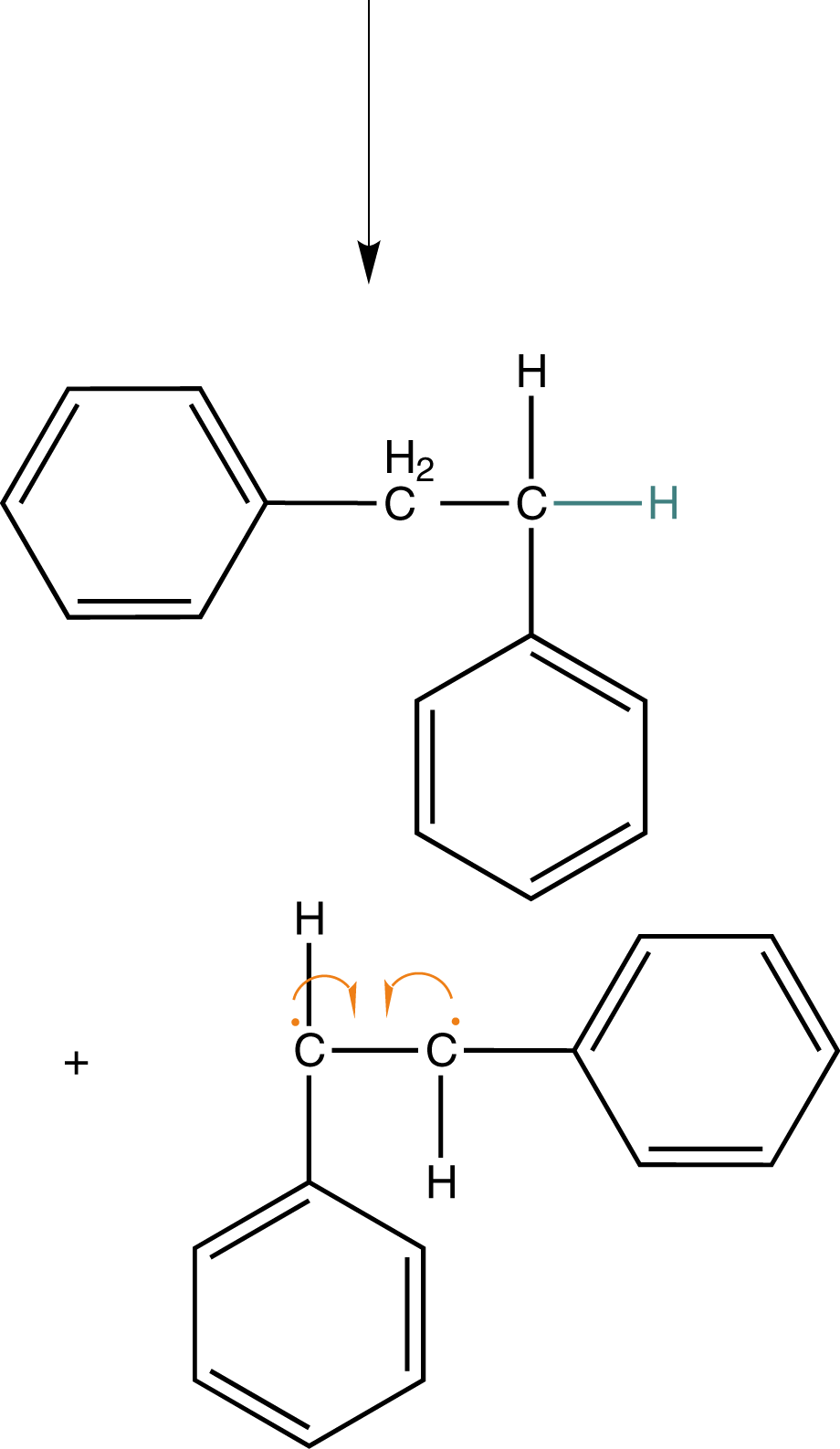
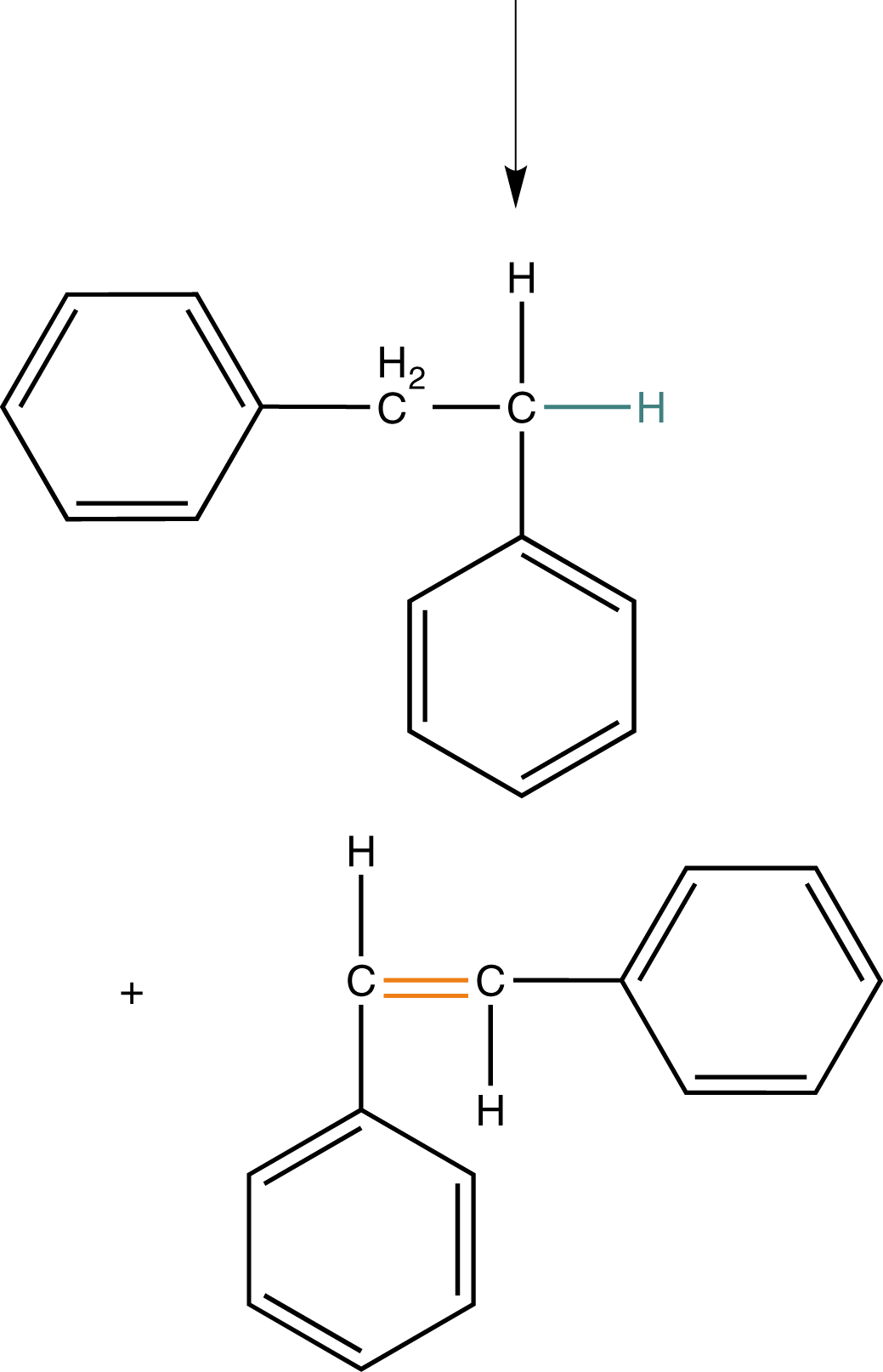
Wenn wir noch einmal das Beispiel aus Abbildung 9 heranziehen, dann können wir hier auch eine andere Art der Abbruchsreaktion beobachten: die Disproportionierung. Unter diesem Begriff verstehen wir Absättigung eines Radikals, indem dieses sich ein H-Atom eines anderen Radikals schnappt (vgl. Abb. 10).
In Folge dessen ist bereits ein Radikal „unwirksam“ geworden. An demjenigen, welches das H-Atom verloren hat, verbleibt ein ungepaartes Elektron an dem C-Atom, welches ehemals die Bindung zum verlorenen H-Atom aufwies. Nun haben wir zwei ungepaarte Elektronen in direkter Nachbarschaft, was zur Ausbildung einer kovalenten Bindung führt: Eine Doppelbindung entsteht.
Am Ende stehen die beiden Produkte:
Produkte der Radikalischen Polymerisation
Bis hier haben wir uns insbesondere mit der Theorie der Polymerisation beschäftigt, genauer gesagt dem Radikalkettenmechanismus. Wir wollen uns nun mit den Produkten dieser Reaktion beschäftigen. Das bedeutet, dass wir unser Augenmerk hier auf drei wichtige Kunststoffe legen werden, die das Produkt radikalischer Polymerisation darstellen: Polystyrol (PS), Polyethylen (PE) und Polyvinylchlorid (PVC). Diese Beispiele wollen wir unter der Berücksichtigung von drei Aspekten betrachten. Zunächst schauen wir uns die Strukturformel des Monomers, des aktivierten Monomers (also des Radikals) und natürlich des Produkts an. An zweiter Stelle stehen die Struktur-Eigenschafts-Beziehungen. Wir fragen nach den Auswirkungen der Struktur und der Zusammensetzung des Polymers auf seine Eigenschaften. Hierbei spielen zwischenmolekulare Kräfte (intermolekular) und die Geometrie des Polymers (Ketten oder vernetzt) eine Rolle. Mithilfe der so gewonnenen Informationen können wir dann zum Abschluss die Relevanz der Polymere ansprechen und ihre Verwendung im Alltag kennen lernen.
PS - Polystyrol
Radikal und Produkte
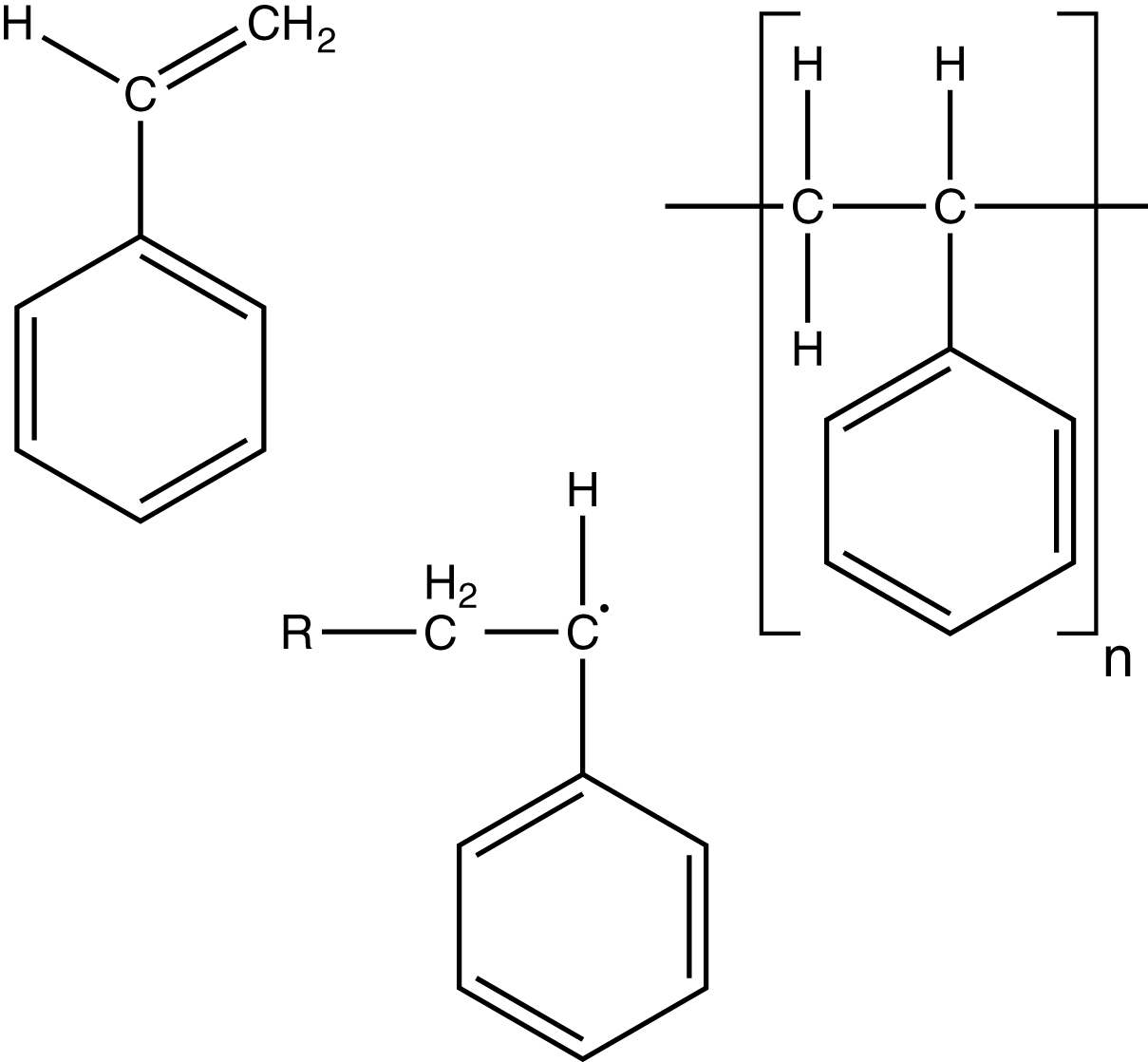
Die Doppelbindung der Ethenylgruppe von Styrol macht den Angriff eines Initiatorradikals und die Ausbildung eines neuen möglich. Das Produkt der radikalischen Polymerisation von Styrol ist ein kettenförmiges Molekül mit Gliedern: Polystyrol. Das R bezeichnet einen Rest, der beispielsweise das Initiatorradikal sein kann.
Struktur und Eigenschaften
Polystyrol ist ein kettenförmiges, thermoplastisches Polymer (vgl. ChemieLV-Skript Makromoleküle - Struktur und Eigenschaft). Eine wichtige Komponente sind die großen aromatischen Phenylreste, welche viele Elektronen in das System bringen. Diese Elektronen führen zu ausgeprägten Van-der-Waals Kräften zwischen den Polymerketten (vgl. Abb. 14), was sich auf die Resistenz des Kunststoffes auswirkt.
Van-der-Waals Kräfte sind die Folge von Elektronenbewegungen innerhalb des Moleküls (vgl. ChemieLV-Skript Grundlagen: Atommodell - Kräfte und Wechselwirkungen). Aufgrund dieser Bewegung kann es kurzzeitig zu einem lokalen Elektronenüberschuss in einem Teilbereich des Polymers kommen. Wir erhalten hier räumlich getrennte Partialladungen ( und
) innerhalb des Moleküls. Letzteres kann nun mit anderen Molekülen wechselwirken, welche ebenfalls solche Partialladungen aufweisen. Diese Eigenschaft führt dazu, dass Polystyrol ein harter, spröder Kunststoff ist. Die Struktur ist entweder amorph oder teilkristallin.
Verwendung
Polystyrol ist ein weit verbreiteter Werkstoff, der von Verpackungsmaterial bis hin zu CD-Hüllen Verwendung findet. In geschäumter Form wird dieses Material auch als Styropor oder Styrodur vermarktet. Geschäumtes Polystyrol findet beispielsweise als Wärme- und/oder Schalldämmung im Hausbau Verwendung.
Anmerkung:
Das Schäumen ist eine Verarbeitungsvariante von Kunststoffen, bei denen sogenannte Schaumstoffe entstehen. Diese zeichnen sich dadurch aus, dass sie im Gegensatz zu ungeschäumten Kunststoffen kompressibel sind, das heißt, dass du sie zusammendrücken kannst Der Prozess des Schäumens wird bei Polystyrol durch die Verwendung von Pentan bewerkstelligt. Das Pentan befindet sich in Polystyrolkügelchen, die erhitzt werden. Dabei verdampft das Pentan und vergrößert das Volumen der Kügelchen, die bei den erhöhten Temperaturen erweichen, um ein Vielfaches.
PE - Polyethylen
Radikal und Produkte
Polyethylen ist ein Polymer, welches auch Ethenmonomeren aufgebaut ist. Ethen, das einfachste Alken, ist aufgrund seiner Doppelbindung in der Lage durch einen Radikalstarter aktiviert zu werden. So erhalten wir die Möglichkeit weitere Monomere über den Radikalkettenmechanismus an das Radikal zu addieren: Das Polymer wächst. Bei Polyethylen handelt es sich um einen gesättigten Kohlenwasserstoff, das heißt, dass wir hier nur Einfachbindungen zwischen den C-Atomen haben. Wichtig ist, dass wir hier strukturell gesehen ein Alkan vorliegen haben.
Es kann problematisch sein, den Reaktionsmechanismus hinter diesem Polymer zu sehen, wenn du zunächst nur die Strukturformel siehst. Der zentrale Aspekt liegt hier auf dem Fehlen offensichtlicher funktioneller Gruppen. Das ist ungewöhnlich, aber hier liegt das Augenmerk auf den Einfachbindungen. Wenn du dich mit Kunststoffen beschäftigst, dann musst du dir in diesem Zusammenhang überlegen, welche Möglichkeit es gibt, Einfachbindungen zwischen C-Atomen zu knüpfen. Hier kommt der Radikalkettenmechanismus ins Spiel - Merke: Einfachbindungen zwischen C-Atomen werden in diesem Zusammenhang über Radikale geknüpft! Ein weiterer wichtiger Hinweis betrifft die Anzahl der C-Atome im Polymer. Diese muss im Fall von Polyethylen nämlich ein Vielfaches von zwei sein, da wir in jedem Schritt ein weiteres Ethenmolekül addieren.
Struktur und Eigenschaften
Polyethylen ist ein Thermoplast, der aus langen Kohlenstoffketten aufgebaut ist, welche teilweise Seitenketten besitzen. Die Bildung der Seitenketten gehen auf die Reaktionsbedingungen zurück.
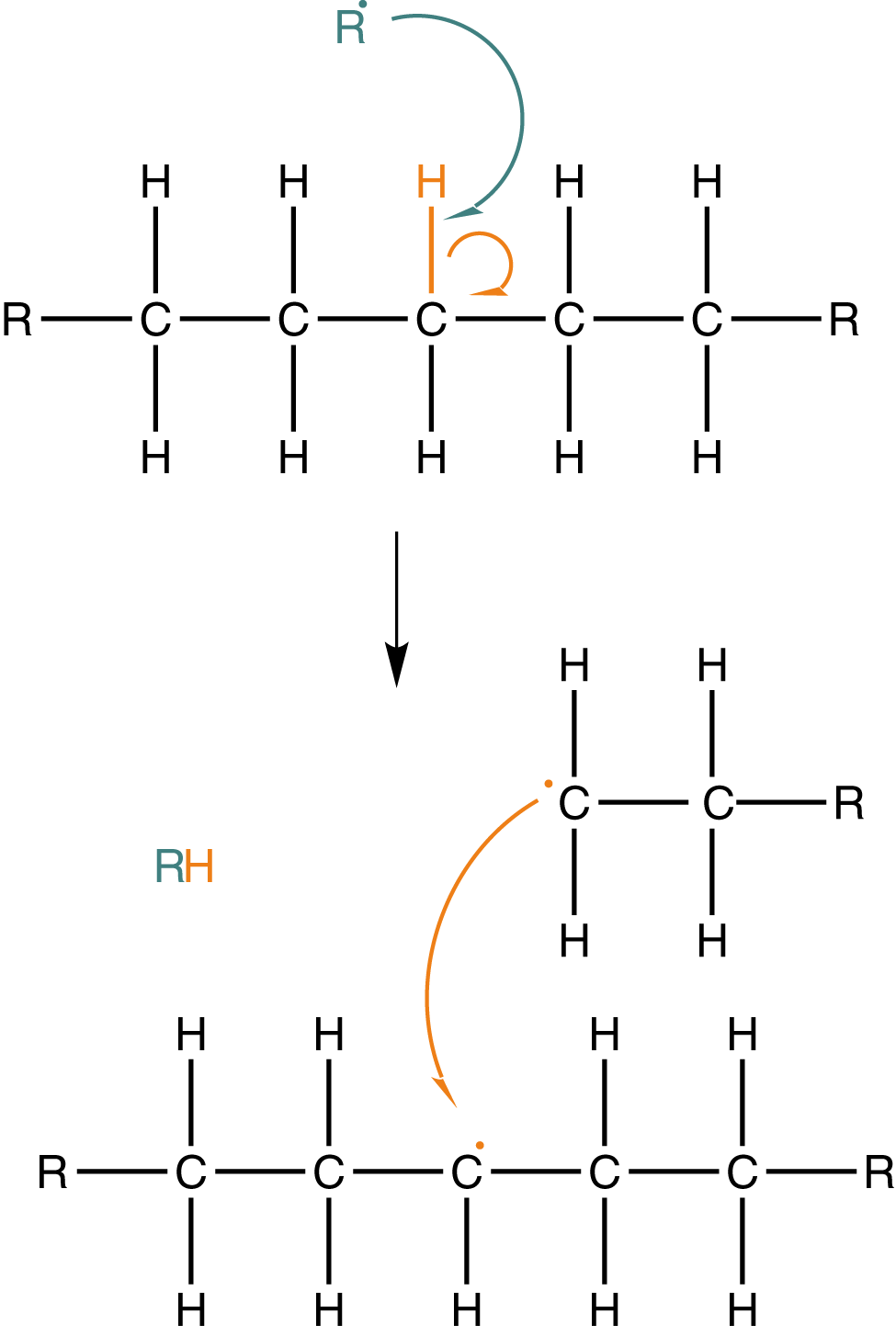
Hierbei kommt es nämlich teilweise zur Spaltung von C-H-Bindungen durch Radikale, was ein C-Atom mit einem ungepaarten Elektron zurücklässt, welches sich im Kettengefüge befindet und nicht endständig ist. In Abbildung 17 sehen wir die homolytische Spaltung einer C-H-Bindung durch ein Radikal () in der Kettenmitte. Im Anschluss bildet sich hier ein C-Atom mit radikalischem Charakter aus. Entweder kann dieses nun an einem anderen Monomer angreifen oder es kommt zur Kombination mit anderen freien Polymerradikalen, wie hier dargestellt. In beiden Fällen bildet sich eine Seitenkette aus. Polyethylen wird nun anhand dieser Seitenketten im Bezug auf deren Längen unterschieden. Je kürzer diese Ketten, desto enger können die Polymermoleküle zusammenliegen, was sich direkt in den Eigenschaften widerspiegelt. Das Resultat ist eine relativ große Dichte dieses Materials. Des Weiteren nimmt der kristalline Charakter des Polymers zu. Hierbei sind die Polymerketten dann in bestimmten Bereichen des Polyethylen parallel angeordnet. In diesen Bereichen sind die zwischenmolekularen Kräfte dann auch stärker als in amorphen (unregeläßigen) Bereichen. Mit zunehmender Länge der Seitenketten behindern sich die Polymermoleküle gegenseitig. Dies führt zur Knäuelbildung.
Verwendung
Polyethylen wird in Massen produziert und findet ein breites Anwendungsfeld. Je nach Struktur werden daraus Rohrleitung, Verpackungen oder Folien hergestellt.
PVC - Polyvinylchlorid
Radikal und Produkte
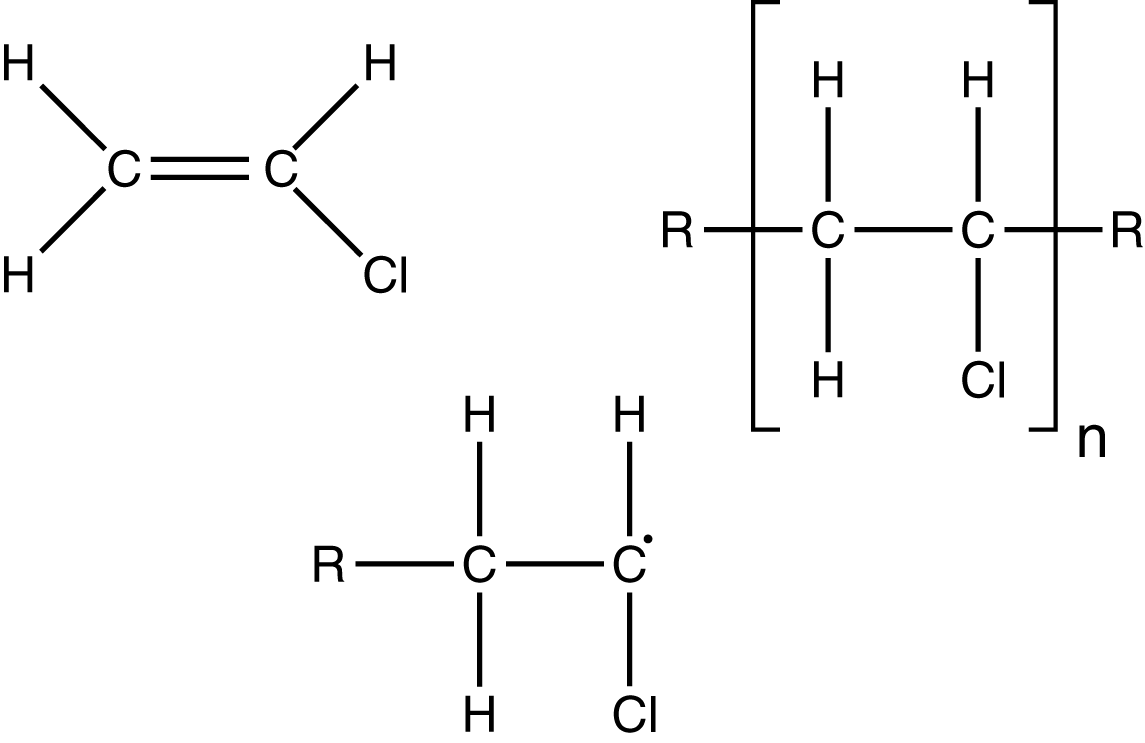
Abb. 19: Von links nach rechts: Vinylchlorid (Monomer), Radikal, Strukturformelausschnitt des PVC-Polymers
Das Monomer von Polyvinylchlorid ist ein Derivat von Ethen und weist ein Chloratom in seiner Struktur auf. Derivate sind Verbindungen, die von einer bestimmten Grundstruktur abgeleitet werden können. Diese Stammverbindung weist dann teilweise andere Komponenten auf, wie beispielweise eine spezielle funktionelle Gruppe.
Struktur und Eigenschaften
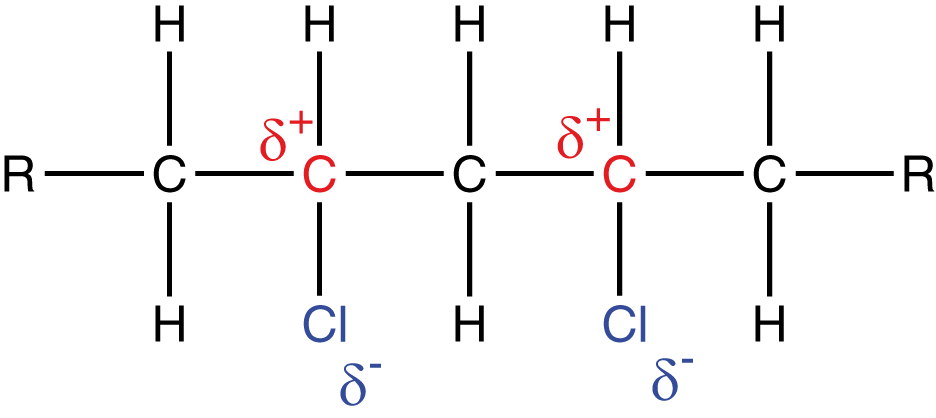
Die Struktur von Polyvinylchlorid wird durch das Chloratom bestimmt. Dieses hat zwei wichtigen Eigenschaften. Zunächst ist das Atom sehr groß und sperrig, was dazu führt, dass sich die Polymerketten nicht sehr effektiv zusammenlagern können. Dies führt zu einer verminderten Ordnung, was sich im amorphen Charakter von PVC widerspiegelt. An zweiter Stelle steht die relativ hohe Elektronegativität von Chlor. Die C-Cl-Bindung ist im Vergleich zu einer C-H-Bindung stärker polarisiert.
iese Ausbildung von Formalladungen spiegelt sich in den zwischenmolekularen Kräften wider. Diese sind nämlich zusätzlich zu den Van-der-Waals Kräften der C-Kette aktiv. PVC ist von sich aus hart und spröde und zählt zu den Thermoplasten. Erst durch die Zugabe von Weichmachern wird PVC formbar und somit für diverse technische Anwendungen zugänglich.
Verwendung
Polyvinylchlorid findet Anwendung als Bodenbelag (PVC), in Form von Rohren oder auch als Schallplatten. Letztere haben deshalb auch die umgangssprachliche Bezeichnung Vinyl.
https://goo.gl/5ns0xU - Envase de yogur, Hispalois CC-BY-SA 3.0