PSE-Gruppen und -Tendenzen
Definition
Die Anordnung der Elemente im PSE ist nicht zufällig, wie wir im ersten Skript dieses Themengebiets sehen konnten (vgl. ChemieLV-Skript Periodensystem der Elemente - Einführung und Grundlagen). Dimitri Mendelejew war es gegen Ende der 1860er Jahre sogar möglich auf der Grundlage des damaligen PSE erfolgreiche Vorhersagen über fehlende Elemente zu treffen. Diese Tatsache geht darauf zurück, dass die Elemente der Hauptgruppen vergleichbare Eigenschaften haben. Wir wollen in diesem Skript zunächst den Begriff der Stabilität auf Grundlage der Oktettregel diskutieren, die uns erlauben wird viele der daraufhin folgenden Eigenschaften zu bewerten. Im ChemieLV-Skript Atommodell - Bindungsformen und deren Unterschiede findest du ebenfalls Informationen zur Oktettregel. Da diese aber in diesem Skript sehr hilfreich ist, besprechen wir sie hier ebenfalls. Im dritten Kapitel widmen wir uns zunächst verschiedenen Eigenschaften der Elemente und ihr Verhalten im Verlauf einer Periode bzw. einer Hauptgruppe. In diesem Zusammenhang sprechen wir dann von Tendenzen. Hier werden wir die zu Beginn eingeführte Oktettregel anwenden und in diesem Zusammenhang auch die Entwicklung der Eigenschaften verstehen können. Den Abschluss dieses Skripts bildet ein Blick auf die Reaktivität ausgewählter Hauptgruppen. Dabei legen wir unser Augenmerk insbesondere auf die Alkalimetalle, die Halogene sowie die Edelgase. Hier werden uns die Eigenschaften und Tendenzen aus Kapitel 3.1 beim Verständnis weiterhelfen. Dieses letzte Kapitel stellt dann auch die Überleitung zum letzten Skript dieses Themengebiets, Steckbriefe ausgewählter Elemente, dar. Dort kommen wir dann konkret auf einzelne, wichtige Elemente zu sprechen, während wir uns hier eher im Allgemeinen um die Reaktivität der angesprochenen Hauptgruppenelemente kümmern wollen.
Hauptgruppen und Stabilität - die Oktettregel
Wir interessieren uns für den Stabilitätsbegriff im Bezug auf die Hauptgruppen. Die Nebengruppenelemente werden uns in diesem Skript nicht weiter interessieren.
| Anmerkung: | Uns geht es in diesem Kapitel um die Außenelektronen der Hauptgruppenelemente. Wenn wir uns die Elektronenkonfiguration der Nebengruppenelemente anschauen wollten, dann würden wir zusätzliche Informationen benötigen, die im Rahmen der Schul-Chemie aber nicht weiter relevant sind und den Schulstoff deutlich übersteigen würden. Es ist also wichtig, dass die nachfolgende Betrachtung primär für die Hauptgruppenelemente gilt und nicht für die Nebengruppenelemente. |
Edelgase und die Edelgaskonfiguration
Die Edelgase stehen in der 8. Hauptgruppe des PSE. Jedes Edelgas besitzt genau 8 Valenzelektronen und ist aus diesem Grund eher unreaktiv und träge. In Zusammenhang mit dieser voll besetzen Valenzschale spricht man aus diesem Grund auch von der Edelgaskonfiguration. Damit ist folglich die spezielle Elektronenkonfiguration der Edelgase gemeint. Diese Edelgaskonfiguration ist ein Kriterium für die Stabilität eines Elements. Ist es einem Element in irgendeiner Form möglich Valenzelektronen aufzunehmen oder abzugeben, um die Edelgaskonfiguration zu erreichen, dann wird es dazu tendieren genau das zu tun. Diesen Aspekt werden wir in Kapitel 3.1 ausführlich verwenden.
Die Oktettregel
Den Rahmen für das Kriterium der Edelgaskonfiguration bildet die Oktettregel:
- Elektronenkonfigurationen vollbesetzter Valenzschalen sind energetisch günstig.
- Edelgase weisen von Natur aus vollbesetzte Valenzschalen auf, was sie zu unreaktiven und trägen Elementen macht. Dementsprechend wird diese Elektronenkonfiguration als Edelgaskonfiguration bezeichnet.
- Elemente streben danach die Edelgaskonfiguration zu erreichen, da diese energetisch günstig ist.
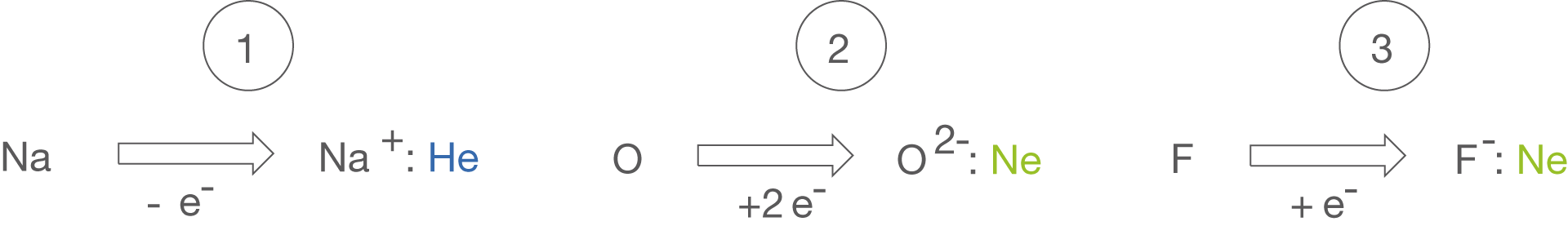
Auch wenn die Oktettregel für uns ein Stabilitätskriterium darstellt, können bestimmte Edelgase Reaktionen eingehen, was du immer im Hinterkopf behalten solltest. In Abbildung 1 sind einige Elemente mit ihren Edelgaskonfigurationen dargestellt.
- Natrium (Na) gibt als Element der 1. Hauptgruppeein Elektron ab, was zum
- Kation führt, welches die Elektronenkonfiguration von Helium (He) aufweist.
- Sauerstoff (O) nimmt als Element der 6. Hauptgruppe zwei Elektronen auf, sodass ein
- Anion entsteht, welches die Elektronenkonfiguration von Neon (Ne) aufweist.
- Fluor (F) nimmt als Element der 7. Hauptgruppe ein Elektron auf, sodass ein
- Anion entsteht, welches ebenfalls die Elektronenkonfiguration von Neon (Ne) aufweist.
Tendenzen und Reaktivität
Eigenschaften der Elemente
Der Atomradius
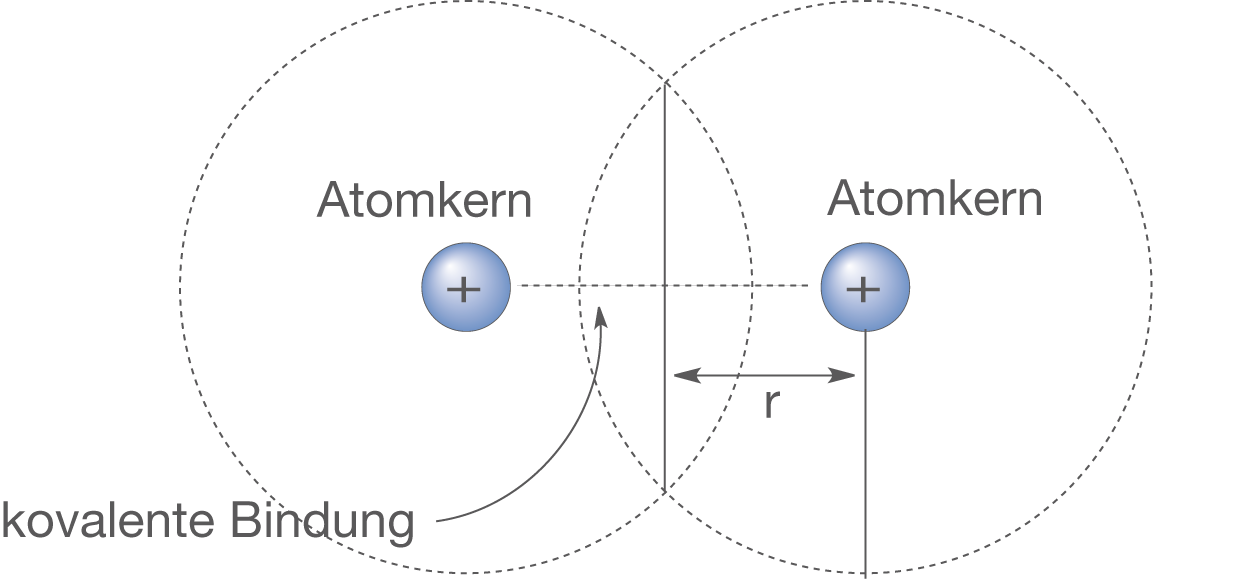
Zunächst soll darauf hingewiesen werden, dass es sich bei Atomen nicht um starre Kugeln handelt. Dies können wir anhand von Ernest Rutherfords Streuversuch nachvollziehen (vgl. ChemieLV-Skript Atommodell - Atommodelle und die Elektronenstruktur von Atomen). Dementsprechend können wir den Atomradius nicht allgemein für ein einzelnes Atom definieren; es gibt einfach keinen Abstand, bei dem wir sagen könnten, dass das Atom dort gleichsam „zu Ende“ wäre. Was wir hingegen tun können, ist die Betrachtung von Atomen in Bindungen und des Abstands der Atomkerne zweier gebundener Atome (vgl. Abb. 2). Damit erhalten wir zwei hier relevante Möglichkeiten: kovalente Atomradien und metallische Atomradien.
Wir werfen zunächst einen Blick auf die Tendenzen des Atomradius in einer Hauptgruppe. Dazu ist wichtig zu wissen, dass wir mit jeder Periode eine neue Schale erhalten, die von Elektronen besetzt wird. Das bedeutet, dass der Atomradius innerhalb einer Hauptgruppe mit steigender Ordnungszahl zunehmen muss, da jedes mal eine weitere Schale hinzukommt. Ein wenig ungewöhnlich scheint die Tendenz innerhalb einer Periode. Hier nimmt der Atomradius} mit steigender Ordnungszahl ab. Dieses Phänomen können wir uns erklären, wenn wir die zunehmende Kernladung beachten. Die steigende Ordnungszahl entspricht einem Anstieg der Protonenzahl im Kern, was bei höheren Ordnungszahlen eine höhere positive Kernladung bedeutet. Dementsprechend sind auch die elektrostatischen Kräfte auf die Elektronenhülle stärker ausgeprägt. Da sich ungleichnamige Ladungen anziehen, wird die Elektronenhülle durch die zusätzlichen positiven Ladungen kleiner, da die Elektronen näher an den Kern gezogen werden. Wir fassen also wie folgt zusammen:
- Innerhalb einer Hauptgruppe nimmt der Atomradius aufgrund zusätzlicher besetzter Schalen der Elektronenhülle zu.
- Innerhalb einer Periode nimmt der Atomradius ab. Dies geschieht aufgrund stärkerer anziehender elektrostatischer Kräfte, die auf die zusätzlichen Protonen im Kern zurückzuführen sind.
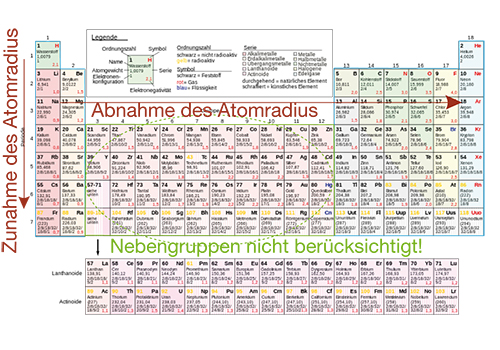 Abb. 3: Tendenz des Atomradius in Hauptgruppen und Perioden
Abb. 3: Tendenz des Atomradius in Hauptgruppen und Perioden
Die Ionisierungsenergie
Wir können Elektronen aus der Elektronenhülle von Atomen entfernen. Die Frage, die wir uns hier stellen wollen, bezieht sich auf den Aufwand, der für ein solches Vorhaben notwendig wird. Interessieren wir uns dafür ein solches Elektron aus der Elektronenhülle zu entfernen, dann ionisieren wird das betreffende Element. Wir können diesen Ionisierungsprozess eines Elements A folgendermaßen notieren:
Das bedeutet, dass wir die Ionisierungsenergie
- Wir ziehen die Oktettregel heran: Je weiter wir in einer Periode von links nach rechts vorrücken, desto ungeschickter wird es für eine Element Elektronen abzugeben, um die angestrebte Edelgaskonfiguration zu erreichen. Irgendwann ist es sogar energetisch günstiger Elektronen aufzunehmen. Dementsprechend nimmt die Ionisierungsenergie innerhalb einer Periode deutlich zu, bis sie ihr Maximum im Fall der Edelgase erreicht hat. Das Minimum befindet sich in der 1. Hauptgruppe.
- Mit zunehmender Ordnungszahl steigt auch die Kernladung an. Dementsprechend werden die Elektronen einer Schale im Fall hoher Ordnungszahlen stärker gebunden. Dieser Umstand macht eine Ionisierung sehr energieaufwendig.
Betrachten wir nun die Tendenz der Ionisierungsenergie innerhalb einer Hauptgruppe, dann nimmt diese mit steigenden Ordnungszahlen ab. Durch die zusätzlichen Schalen sind die jeweiligen Elektronen weiter vom Kern entfernt und somit auch schwächer gebunden. Damit können sie leichter aus der Elektronenhülle entfernt werden. In Abbildung 2 siehst du beiden Tendenzen eingezeichnet.
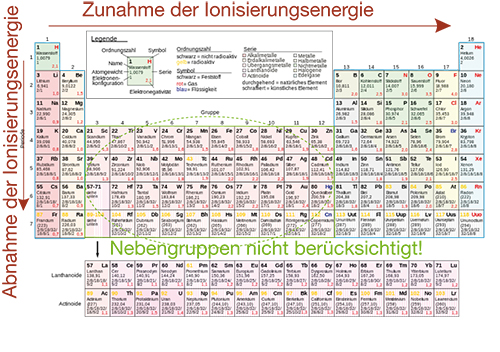 Abb. 4: Tendenz der Ionisierungsenergie in Hauptgruppen und Perioden
Abb. 4: Tendenz der Ionisierungsenergie in Hauptgruppen und Perioden
Die Elektronenaffinität
Wir können uns analog zur Ionisierungsenergie fragen, welchen Energiegewinn oder -verlust die Aufnahme eines zusätzlichen Elektrons mit sich bringt. Die Energie, die frei wird oder aufgewendet werden muss, um dieses Vorhaben umzusetzen wird als Elektronenaffinität bezeichnet. Wir können folgende allgemeine Reaktionsgleichung notieren:
Die Elektronenaffinität kann hiebei verschiedene Vorzeichen annehmen:
: Energie muss aufgewendet werden, um zusätzliches Elektron in Elektronenhülle einzubringen.
: Energie wird frei; durch die Aufnahme des Elektrons ist ein Energiegewinn zu verzeichnen.
Die negativsten Werte bzgl. der Elektronenaffinität, also den größten Energiegewinn, finden wir bei den Elementen der 7. Hauptgruppe, den Halogenen. Ziehen wir die Oktettregel zu Rate, dann wird uns klar, dass hier genau ein Elektron fehlt, um die Edelgaskonfiguration zu erreichen. Damit entspricht auch hier die Vorraussage der Regel den Tendenzen im PSE. Gleichzeitig zeigen die Erdalkalimetalle und die Edelgase die höchsten Werte, was sich damit begründen lässt, dass die Aufnahme eines zusätzlichen Elektrons energetisch ungünstig ist. Wir halten Folgendes fest:
- Das Minimum (Energiegewinn) der Elektronenaffinität befindet sich bei den Halogenen.
- Die Maxima (Energieaufwand) der Elektronenaffinität befinden sich bei den Erdalkalimetallen und den Edelgasen.
- Allgemeine Tendenzen sind nur schwer festzulegen, da hier die Elektronenkonfiguration auf der Grundlage des Oribtalmodells eine entscheidende Rolle spielt, die wir hier aber nicht behandeln können. Auf dieser Grundlage finden wir auch das zweite Maximum bei den Erdalkalimetallen.
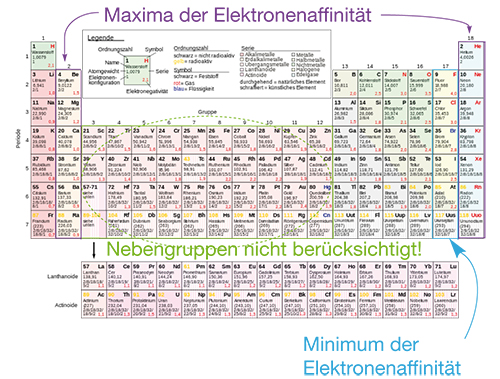 Abb. 5: Minimum und Maxima der Elektronenaffinität im PSE
Abb. 5: Minimum und Maxima der Elektronenaffinität im PSE
| Achtung: | Das Minimum der Elektronenaffinität entspricht hier einem Energiegewinn, während die Maxima dem zusätzlichen Aufwand von Energie entsprechen. Das Minimum entspricht dem energetisch günstigen Zustand. Verwechsle die Begrifflichkeiten nicht mit den denen der Ionisierungsenergie, bei der die Grundlage eine andere war. |
Die Elektronegativität
Die Elektronegativität ist ein Maß dafür, wie stark ein gebundenes Atom die Elektronen der Bindung an sich ziehe kann. Im ChemieLV-Skript Bindungsformen und ihre Unterschiede haben wir gesehen, dass die chemische Bindung im Allgemeinen nicht einem reinen Bindungstyp entspricht. Die Elektronegativität veranschaulicht uns das gemeinsame Auftreten ionischer und kovalenter Bindungsanteile. Der Bezug der Elektronegativität nach Pauling ist Fluor. Alle anderen Werte können hieraus berechnet werden.
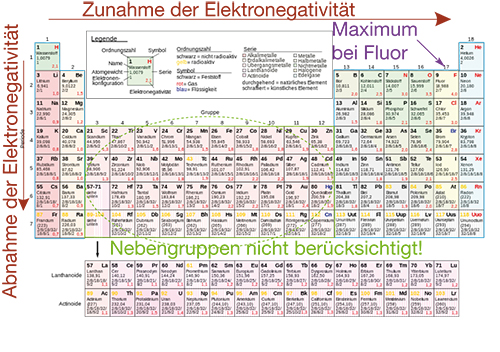 Abb. 6: Tendenz der Elektronegativität nach Pauling
Abb. 6: Tendenz der Elektronegativität nach Pauling
Reaktivität ausgewählter Hauptgruppen
Die 1. Hauptgruppe umfasst die Alkalimetalle, welche sich dem Namen nach den Metallen zuordnen lassen.
- Alle Alkalimetalle lassen sich leicht ionisieren, weisen demnach eine niedrige Ionisierungsenergie auf. Somit erreichen sie die entsprechend stabile Edelgaskonfiguration.
- Alkalimetalle sind sehr starke Reduktionsmittel, da sie danach streben das einzige Valenzelektron abzugeben.
- Alle Alkalimetalle reagieren in elementarer Form stark exotherm mit Wasser wobei elementarer Wasserstoff gebildet wird. Dabei nimmt die Reaktivität mit steigender Periodenzahl zu, sodass Caesium (Cs) ein explosionsartiges Verhalten bei Kontakt mit Wasser zeigt.
- Alkalimetalle haben die ungewohnte Eigenschaft, dass sie sich als Metalle mit einem Messer schneiden lassen.
- Natrium (Na) und Kalium (K) spielen zentrale Rollen in der Biochemie.
Die Elemente der 7. Hauptgruppe werden wie bereits bekannt als Halogene bzw. als Salzbildner bezeichnet. Im Rahmen der erarbeiteten Grundlagen können wir folgende Informationen zusammenfassen:
- Bei den Halogenen findet sich das Minimum der Elektronenaffinität, welches mit dem höchsten Energiegewinn durch die Aufnahme eines Elektrons verbunden ist.
- Fluor ist das reaktionsfähigste Element des PSE.
- Die Oxidationszahlen der Halogene liegen im allgemeinen bei -1, was durch das Auffüllen der Valenzschale zustande kommt.
- Elementar liegen die Halogene immer als zweiatomiges Molekül vor, was wir wiederum mit der Konfiguration der Valenzelektronen erklären können: die Oktettregel wird so erfüllt.
- In der Natur kommen die Halogene nicht elementar vor, was sich durch ihre hohe Reaktivität erklären lässt. Einige wichtige Verbindungen sind
(Flussspat),
(Steinsalz) und
(Apatit).
Die Edelgase sind durch die 8. Hauptgruppe im PSE vertreten. Sie bilden mit ihren Eigenschaften die Grundlage für die Oktettregel, die wir in diesem Skript angesprochen haben. Es lassen sich folgende Informationen zusammenfassen:
- Die Valenzschale der Edelgase ist voll besetzt. Damit sind sie die stabilsten, unreaktivsten Elemente im PSE.
- Die Konfiguration der Valenzelektronen der Edelgase bezeichnet man als Edelgaskonfiguration. Diese liefert das Stabilitätskriterium der Oktettregel: Das Auffüllen der Valenzschale ist energetisch günstig.
- Hier findet sich ein Maximum der Elektronenaffinität. Das Hinzufügen eines weiteren Elektrons ist mit erheblichem Energieaufwand verbunden, was auf Grundlage der bestehenden hohen Stabilität einsichtig ist: Das Edelgas ist bereits „glücklich“.
- Es gibt tatsächlich ein Edelgas, welches diverse Verbindungen eingeht: Xenon.
- Edelgase sind in der Natur Bestandteil der Atmosphäre.
Zusammenfassung
- Die Konfiguration der Valenzelektronen von Edelgasen nennt man Edelgaskonfiguration. Diese stellt die stabilste Elektronenkonfigratuion dar.
- Die Oktettregel besagt, dass Elemente bezüglich ihrer Valenzelektronen nach der Edelgaskonfiguration streben, da diese energetisch günstig ist.
- Als Atomradius kann man den halben Abstand zweier kovalent gebundener Atome auffassen.
- Innerhalb der Hauptgruppen nimmt der Atomradius der Elemente mit steigender Ordnungszahl durch zusätzliche Schalen zu.
- Innerhalb einer Periode nimmt der Atomradius mit steigender Ordnungszahl ab. Durch eine erhöhte Protonenzahl innerhalb des Kerns werden die Valenzelektronen näher an den Kern gezogen. Damit wird der Atomradius reduziert.
- Die Ionisierungsenergie beschreibt den Energiebetrag, der notwendig ist, um ein Elektron komplett aus der Elektronenhülle eines Atoms zu entfernen.
- Die Ionisierungsenergie nimmt innerhalb einer Periode mit steigender Ordnungszahl zu. Durch die erhöhte Protonenzahl im Kern sind die Elektronen stärker gebunden, was ein Entfernen effektiv schwerer macht.
- Innerhalb einer Hauptgruppe nimmt die Ionisierungsenergie ab, da die Elektronen immer weiter vom Kern entfernt sind und somit auch immer schwächer gebunden werden.
- Die Elektronenaffinität beschreibt den Energiebetrag, der bei der bevorzugten Aufnahme eines Elektrons frei wird oder der bei einer unerwünschten Aufnahme aufgewendet werden muss.
- Das Minimum der Elektronenaffinität, was dem höchsten Energiegewinn entspricht, liegt bei den Halogenen.
- Die Elektronenaffinität hat zwei Maxima: Bei den Edelgasen und den Erdalkalimetallen.
- Die Elektronegativität beschreibt das Potential eines Elements die Elektronen einer Bindung an sich zu ziehen.
- Innerhalb einer Periode nimmt die Elektronegativität zu. Ihr Maximum liegt bei Fluor.
- Innerhalb einer Hauptgruppe nimmt die Elektronegativität ab.