Aufgabe 1 – Hydroxycarbonsäuren
In der Natur kommen Säuren verbreitet in Form von Hydroxycarbonsäuren vor. Neben vielen Fruchtsäuren gehören auch Milchsäure und Salicylsäure zu den Hydroxycarbonsäuren.
1
Carl Wilhelm Scheele isolierte 1780 Milchsäure (2-Hydroxypropansäure) aus saurer Milch. Die Strukturaufklärung gelang erst gegen Ende des 19. Jahrhunderts.
1.1
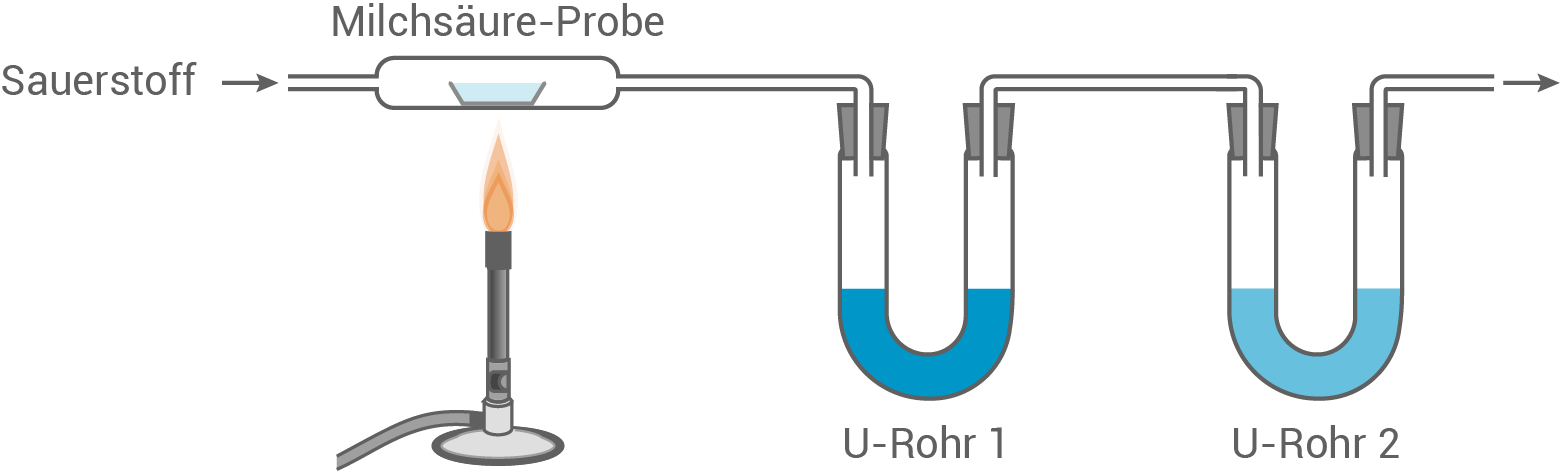
In einem Schulversuch wird zur quantitativen Analyse der Milchsäure eine historische Versuchsapparatur vereinfacht nachgestellt (Abb. 1). In einem Reaktionsrohr wird eine Milchsäure-Probe vollständig verbrannt. Dabei entstehen zwei Reaktionsprodukte.
Das bei der Verbrennung entstehende Wasser wird im U-Rohr 1 von Calciumchlorid gebunden.
Das zweite Reaktionsprodukt reagiert im U-Rohr 2 mit Natriumhydroxid zu Natriumcarbonat und einem weiteren Reaktionsprodukt.
und einem weiteren Reaktionsprodukt.
Die Massenzunahme im U-Rohr 2 lässt auf die Entstehung von Natriumcarbonat schließen.
Natriumcarbonat schließen.
Das bei der Verbrennung entstehende Wasser wird im U-Rohr 1 von Calciumchlorid gebunden.
Das zweite Reaktionsprodukt reagiert im U-Rohr 2 mit Natriumhydroxid zu Natriumcarbonat
Die Massenzunahme im U-Rohr 2 lässt auf die Entstehung von

Abbildung 1: Schematische Darstellung der Versuchsapparatur zur quantitativen Analyse der Milchsäure
- Stelle eine Reaktionsgleichung für die Verbrennung von Milchsäure auf.
- Stelle eine Reaktionsgleichung für die im U-Rohr 2 ablaufende Reaktion auf.
- Berechne die Masse der eingesetzten Milchsäure-Probe.
(5 VP)
1.2
In einem Liter Milchsäure-Lösung sind  Milchsäure enthalten. Der pH-Wert dieser Lösung ist
Milchsäure enthalten. Der pH-Wert dieser Lösung ist 
- Stelle für die Reaktion von Milchsäure mit Wasser eine Reaktionsgleichung auf.
Verwende hierbei Strukturformeln mit allen bindenden und nichtbindenden Elektronenpaaren. - Beschreibe die Säure-Base-Theorie von BRØNSTED und wende diese auf deine Reaktionsgleichung an.
- Begründe, unter Verwendung der genannten Daten, dass nicht alle Milchsäure-Moleküle deprotoniert vorliegen.
(6 VP)
1.3
Mischt man Milchsäure und ihr Natriumsalz in gleichen Stoffmengenverhältnissen, bildet sich ein Puffersystem, das bei Zugabe geringer Mengen einer sauren bzw. alkalischen Lösung den pH-Wert annähernd konstant hält.
- Erkläre mithilfe von Reaktionsgleichungen die Pufferwirkung dieses Systems.
(2 VP)
2
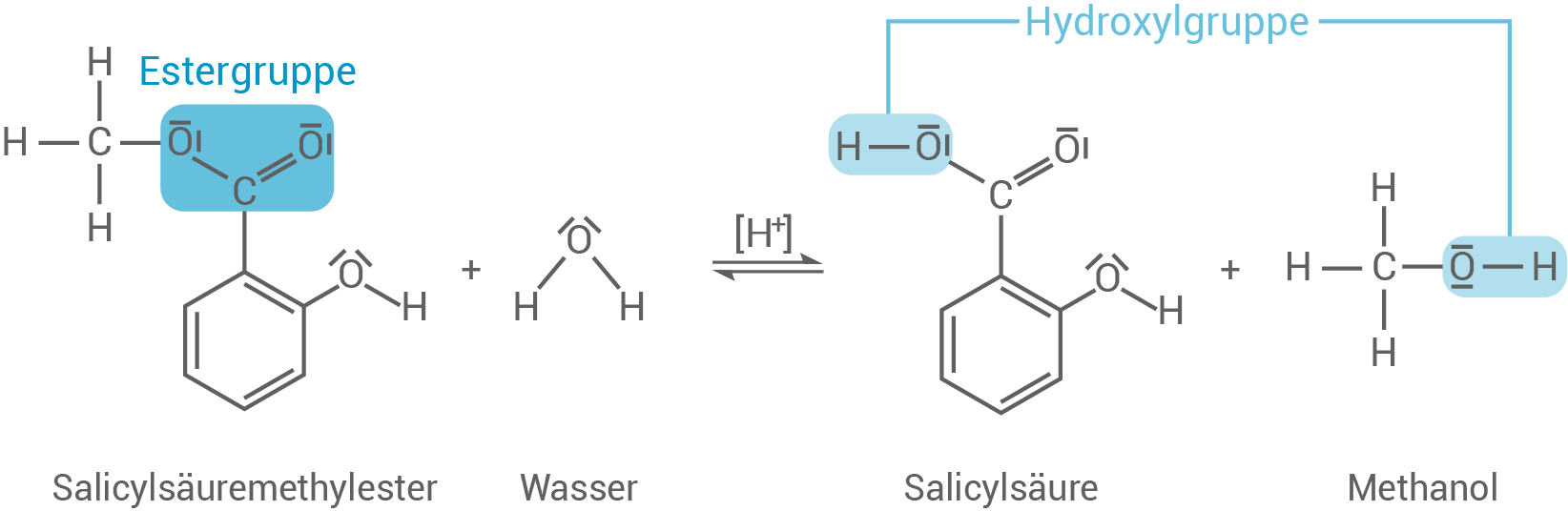
In Pflanzen kann Salicylsäure in Form des Derivats Salicylsäuremethylester (Abb. 2) vorkommen. Dieser Ester kann hydrolytisch gespalten werden.
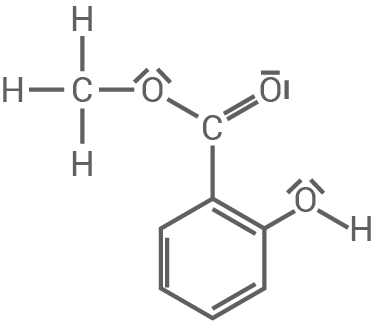

Abbildung 2: Strukturformel eines Salicylsäuremethylester-Moleküls
- Stelle für die Hydrolyse des Salicylsäuremethylesters eine Reaktionsgleichung mithilfe von Strukturformeln auf.
- Kennzeichne und benenne die funktionellen Gruppen im Salicylsäuremethylester-Molekül innerhalb der aufgestellten Reaktionsgleichung.
- Beschreibe den Einfluss einer Änderung der Esterkonzentration sowie der Verwendung eines Katalysators auf den Zahlenwert der Gleichgewichtskonstante
bei konstanter Temperatur.
- Beurteile die Darstellung der Bindungsverhältnisse innerhalb des aromatischen Ringsystems anhand der Strukturformel in Abb. 2.
(7 VP)
(20 VP)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Reaktionsgleichung für die Verbrennung von Milchsäure


 Reaktionsgleichung für die im U-Rohr 2 ablaufende Reaktion
Reaktionsgleichung für die im U-Rohr 2 ablaufende Reaktion


 Berechnung der Masse der eingesetzten Milchsäure-Probe
Mit der gegebenen Masse und molaren Masse von Natriumcarbonat lässt sich zunächst die Stoffmenge berechnen:
Berechnung der Masse der eingesetzten Milchsäure-Probe
Mit der gegebenen Masse und molaren Masse von Natriumcarbonat lässt sich zunächst die Stoffmenge berechnen:
![\(\begin{array}[t]{rll}
n_{Na_2CO_3}&=& \dfrac{m}{M} \\[5pt]
&=& \dfrac{1,32\,\text{g}}{105,96\,\text{g}\cdot\text{mol}^{-1}} &\quad \scriptsize \\[5pt]
&=& 0,0125\,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/29ae2453c91726ab4a1643d07491fe9a08f78294f4be2e94bd639212ed65d946_light.svg) Mit der zweiten Reaktionsgleichung gilt:
Mit der zweiten Reaktionsgleichung gilt:
 Außerdem zeigt die erste Reaktionsgleichung:
Außerdem zeigt die erste Reaktionsgleichung:
 Demnach muss gelten:
Demnach muss gelten:
![\(\begin{array}[t]{rll}
n_{C_3H_6O_3} &=& \dfrac{n_{Na_2CO_3}}{3} \\[5pt]
&=& \dfrac{0,0125\,\text{mol}}{3} &\quad \scriptsize \; \\[5pt]
&=& 4,15 \cdot 10^{-3}\,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/49363c3f16dd6aaeb0df4cc5e3501412f4d4f8bf7e6e99d3f361b41665b461a8_light.svg) Durch Umformen der Gleichung
Durch Umformen der Gleichung
 nach
nach  und mit
und mit  ergibt sich die gesuchte Masse:
ergibt sich die gesuchte Masse:
![\(\begin{array}[t]{rll}
m&=& n \cdot M &\quad \scriptsize \; \\[5pt]
&=& 4,15 \cdot 10^{-3}\,\text{mol} \cdot 90,06\,\text{g}\cdot\text{mol}^{-1} \\[5pt]
&=& 0,374\,\text{g}
\end{array}\)](https://www.schullv.de/resources/formulas/586a27d167b6d31474b66148c358d2505f3bd59c56f5bcbb47f23a3eb76cadf5_light.svg)
1.2
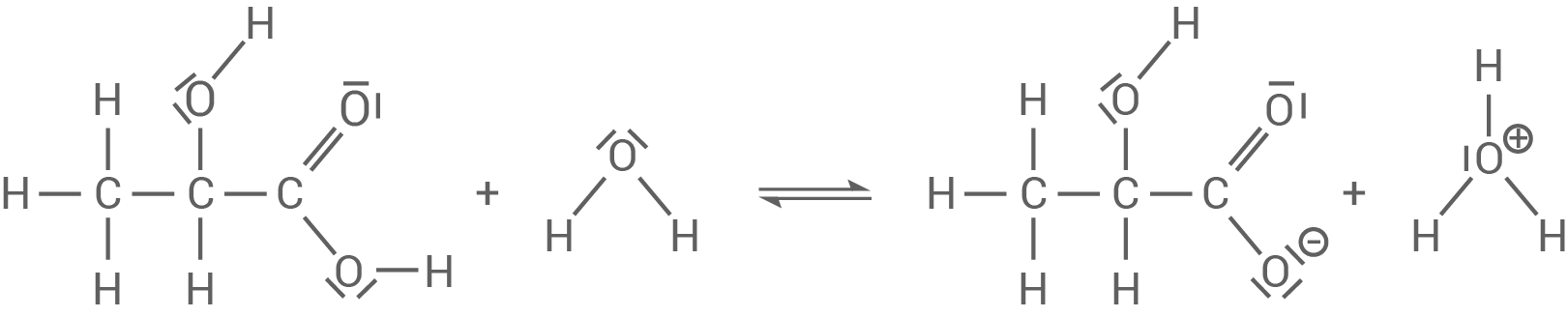
Reaktionsgleichung für die Reaktion von Milchsäure mit Wasser
 Beschreibung der Säure-Base-Theorie nach BRØNSTED
Bei der Säure-Base-Theorie nach BRØNSTED, geht es um die theoretische Beschreibung von Säuren und Basen, die sich auf sogenannte Protonenaustauschreaktionen beschränkt.
Beschreibung der Säure-Base-Theorie nach BRØNSTED
Bei der Säure-Base-Theorie nach BRØNSTED, geht es um die theoretische Beschreibung von Säuren und Basen, die sich auf sogenannte Protonenaustauschreaktionen beschränkt.
Es gilt: ein Proton auf
ein Proton auf 
 und
und  gibt ein Proton ab
gibt ein Proton ab 
 . Milchsäure fungiert hier als Säure (Protonendonator) und Wasser als Base (Protonenakzeptor).
Begründung, dass nicht alle Milchsäure-Moleküle deprotoniert vorliegen
Die Begründung erfolgt über die Berechnung der Anfangskonzentration:
Mit
. Milchsäure fungiert hier als Säure (Protonendonator) und Wasser als Base (Protonenakzeptor).
Begründung, dass nicht alle Milchsäure-Moleküle deprotoniert vorliegen
Die Begründung erfolgt über die Berechnung der Anfangskonzentration:
Mit
 ,
,

 und
und
 gilt:
gilt:
![\(\begin{array}[t]{rll}
c_0&=& \dfrac{m}{V \cdot M} \\[5pt]
&=& \dfrac{14,4\,\text{g}}{1\,\text{L} \cdot 90,06\,\text{g}\cdot\text{mol}^{-1} } &\quad \scriptsize \; \\[5pt]
&=& 0,16\,\text{mol}\cdot\text{L}^{-1}
\end{array}\)](https://www.schullv.de/resources/formulas/92d26133a5da52ca45e98fea09a101401c7ffdbae5d78de366cf4d575f2393d9_light.svg) Gegeben ist
Gegeben ist  Damit lässt sich
Damit lässt sich  berechnen:
berechnen:
![\(\begin{array}[t]{rll}
c_{H_3O^+}&=& 10^{-pH}&\quad \scriptsize \\[5pt]
&=& 10^{-2,31} \\[5pt]
&=& 0,0049\,\text{mol}\cdot\text{L}^{-1} \\[5pt]
\end{array}\)](https://www.schullv.de/resources/formulas/a8a70197f9c4244a7822234588f7af2f4f4db71a8ee000c05310b622abfa07fa_light.svg) Die Rechnung zeigt eine viel geringere
Die Rechnung zeigt eine viel geringere  -Konzentration und belegt damit, dass nicht alle Milchsäure-Moleküle deprotoniert vorliegen.
-Konzentration und belegt damit, dass nicht alle Milchsäure-Moleküle deprotoniert vorliegen.

Es gilt:
- Säuren sind Stoffe, welche Protonen abgeben. Sie werden als Protonendonatoren bezeichnet.
- Basen sind Stoffe, welche Protonen aufnehmen. Sie werden als Protonenakzeptoren bezeichnet.
1.3
Pufferwirkung des Systems
Puffersysteme bestehen aus wässrigen Lösungen, welche eine schwache Säure und ihre korrespondierende Base enthalten. In diesem Fall fungiert die Milchsäure  als schwache Säure und als korrespondierende Base ihr Natriumsalz, das Natriumlactat
als schwache Säure und als korrespondierende Base ihr Natriumsalz, das Natriumlactat  .
Säurezugabe:
.
Säurezugabe:
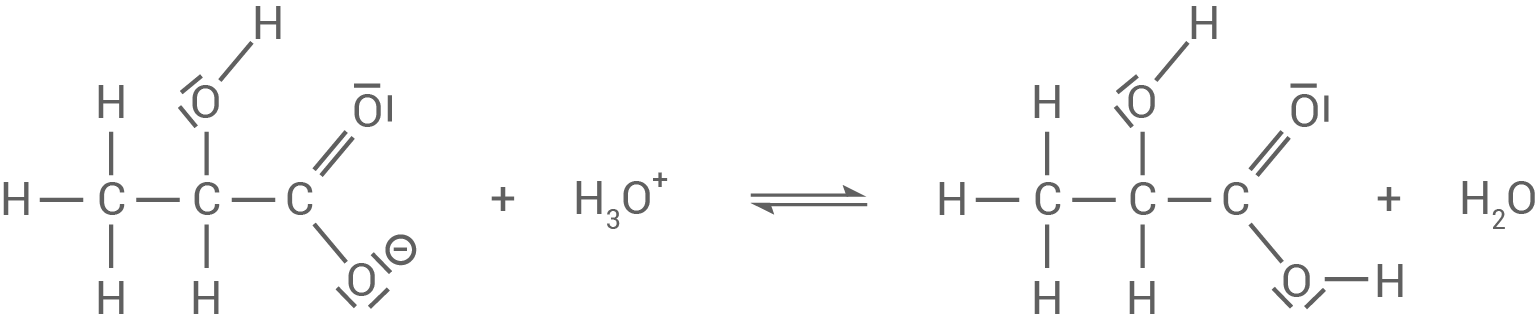 Bei der Zugabe einer sauren Lösung fängt das Lactat
Bei der Zugabe einer sauren Lösung fängt das Lactat  weitere
weitere  -Ionen ab, wodurch das Gleichgewicht dem Zwang ausweicht.
Basenzugabe:
-Ionen ab, wodurch das Gleichgewicht dem Zwang ausweicht.
Basenzugabe:
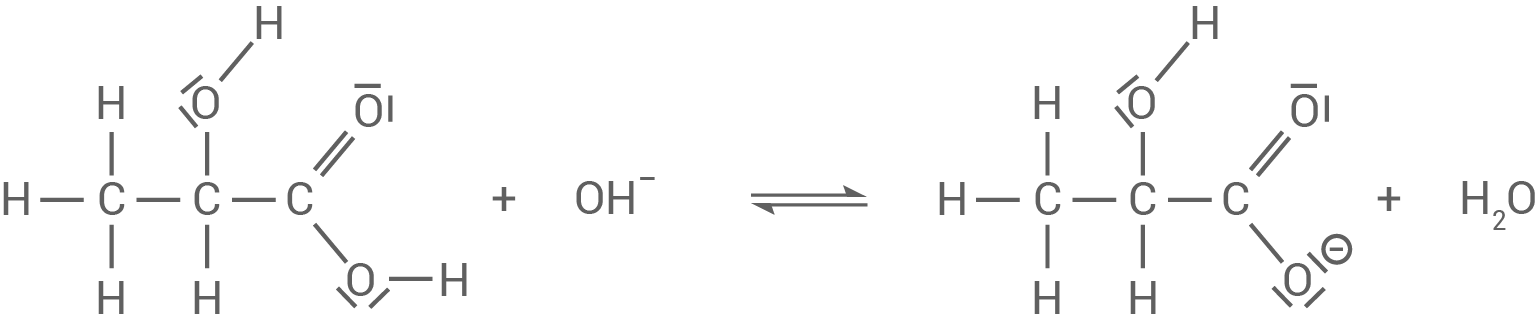 Wird eine alkalische Lösung hinzugegeben, werden die
Wird eine alkalische Lösung hinzugegeben, werden die  -Ionen von der Milchsäure neutralisiert.
-Ionen von der Milchsäure neutralisiert.
 Der pH-Wert bleibt in beiden Fällen annähernd konstant.
Der pH-Wert bleibt in beiden Fällen annähernd konstant.


2
Reaktionsgleichung der Hydrolyse und Kennzeichnung der funktionellen Gruppen
 Einfluss einer Esterkonzentrationsänderung und eines Katalysators auf
Einfluss einer Esterkonzentrationsänderung und eines Katalysators auf  Bei der Hydrolyse eines Salicylsäuremethylesters handelt es sich um eine Gleichgewichtsreaktion. Demnach stellt sich nach einiger Zeit ein chemisches Gleichgewicht ein, welches durch
Bei der Hydrolyse eines Salicylsäuremethylesters handelt es sich um eine Gleichgewichtsreaktion. Demnach stellt sich nach einiger Zeit ein chemisches Gleichgewicht ein, welches durch  beschrieben wird:
beschrieben wird:
 Wird die Konzentratioon des Esters erhöht bzw. erniedrigt, hat dies keinen Einfluss auf
Wird die Konzentratioon des Esters erhöht bzw. erniedrigt, hat dies keinen Einfluss auf  Wird ein Katalysator eingesetzt bewirkt es nur eine schnellere Einstellung des Gleichgewichts, da die Aktivierungsenergie herabgesetzt wird. Der Katalysator geht unverändert aus der Reaktion hervor und hat deshalb auch keinen Einfluss auf
Wird ein Katalysator eingesetzt bewirkt es nur eine schnellere Einstellung des Gleichgewichts, da die Aktivierungsenergie herabgesetzt wird. Der Katalysator geht unverändert aus der Reaktion hervor und hat deshalb auch keinen Einfluss auf  Beurteilung der Darstellung
In Abb. 2 ist eine Strukturformel des Salicylmethylesters zu sehen und damit nur eine mesomere Grenzformel abgebildet. Aus der Darstellung ist nicht ersichtlich, wie die Elektronen delokalisiert sind. Das Ringsystem ist damit ungenau dargestellt.
Beurteilung der Darstellung
In Abb. 2 ist eine Strukturformel des Salicylmethylesters zu sehen und damit nur eine mesomere Grenzformel abgebildet. Aus der Darstellung ist nicht ersichtlich, wie die Elektronen delokalisiert sind. Das Ringsystem ist damit ungenau dargestellt.
