Aufgabe 1 – Zusatzstoffe in der Lebensmitteltechnologie
In der Lebensmitteltechnologie werden verschiedene Zusatzstoffe verwendet, um Lebensmitteln bestimmte Eigenschaften, wie zum Beispiel eine lange Haltbarkeit oder einen besonderen Geschmack zu geben.
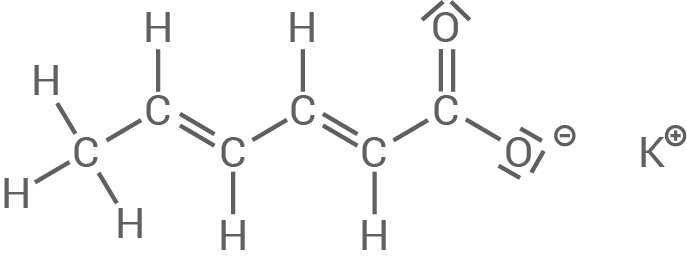
Abbildung 1: Strukturformel Kaliumsorbat
1
Zur Konservierung von Lebensmitteln wird häufig Sorbinsäure eingesetzt. Auch die wesentlich besser wasserlöslichen Salze der Sorbinsäure, wie zum Beispiel Kaliumsorbat (siehe Abb.1), zeigen eine antibakterielle Wirkung. Zur einfacheren Handhabung kommen auch Lösungen dieser Stoffe in den Handel.
1.1
Eine Sorbinsäure-Lösung wird im Labor hergestellt und untersucht. Der pH-Wert dieser Lösung ist 
- Stelle für die Reaktion von Sorbinsäure mit Wasser eine Reaktionsgleichung auf.
- Berechne näherungsweise die Stoffmengenkonzentration
der Sorbinsäure in der Lösung.
- Beschreibe ein mögliches Vorgehen zur Herstellung von reinem Kaliumsorbat aus einer Sorbinsäure-Lösung.
- Begründe die unterschiedlichen Wasserlöslichkeiten von Kaliumsorbat und Sorbinsäure.
(7 VP)
1.2
Laut Etikett einer handelsüblichen Kaliumsorbat-Lösung sind in  der Lösung
der Lösung  Kaliumsorbat. Dabei werden
Kaliumsorbat. Dabei werden  der Lösung mit Salzsäure der Konzentration
der Lösung mit Salzsäure der Konzentration  titriert. Nach Zugabe von
titriert. Nach Zugabe von  Salzsäure ist der Äquivalenzpunkt erreicht.
Salzsäure ist der Äquivalenzpunkt erreicht.
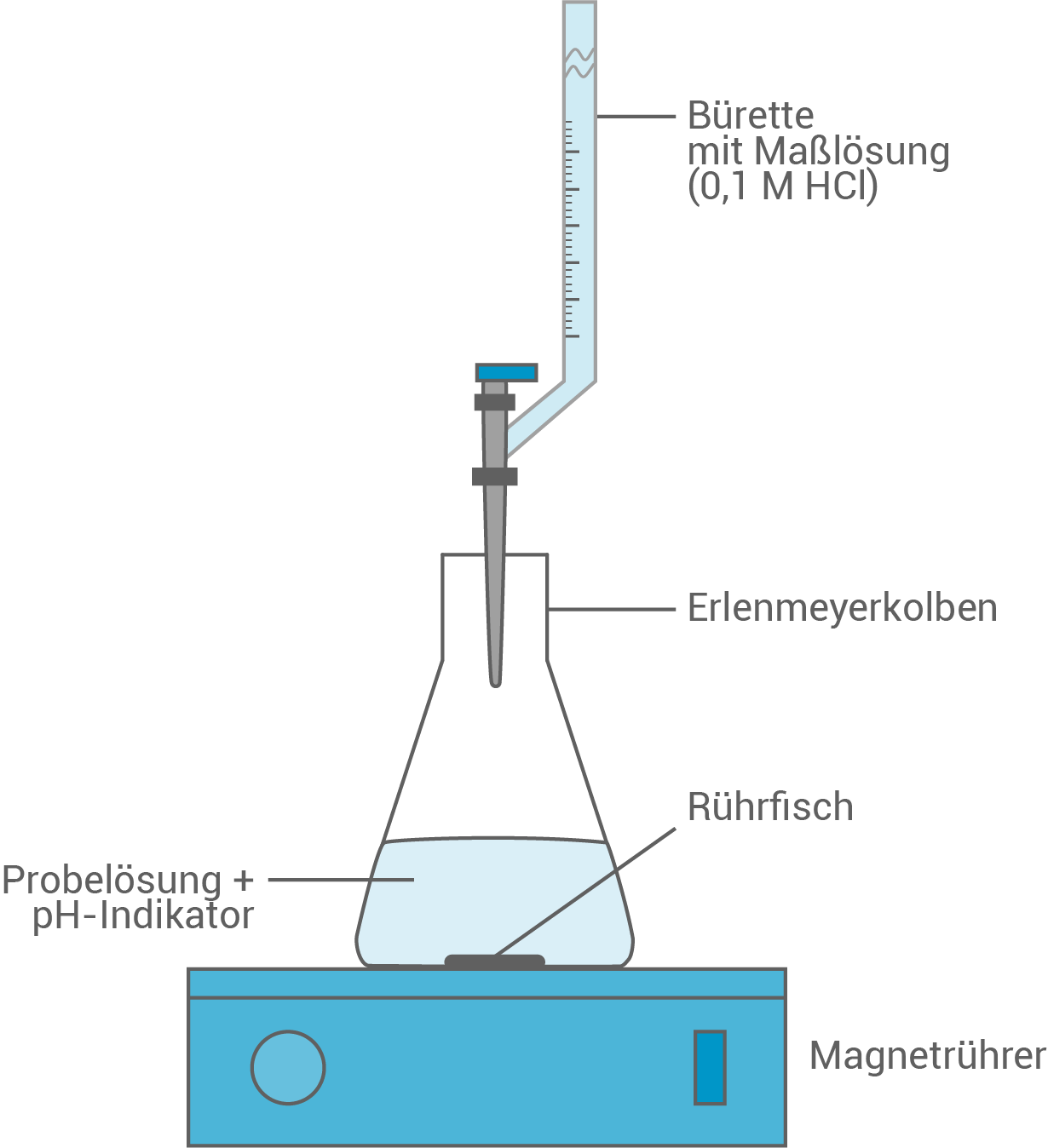
- Beschreibe die Durchführung der Titration mit Hilfe einer beschrifteten Skizze.
- Überprüfe, ob die untersuchte Lösung den Angaben des Herstellers entspricht.
(5 VP)
2
Im Aroma von Früchten findet sich eine große Anzahl verschiedener Verbindungen. Das typische Aroma der Ananas kann in Lebensmitteln durch den Zusatz des künstlichen Aromastoffs 2-Methylbutansäureethylester imitiert werden.
2.1
Dieser Ester kann im Labor synthetisiert werden.
- Stelle für die Herstellung von 2-Methylbutansäureethylester eine Reaktionsgleichung mit Strukturformeln unter Angabe aller bindenden und nichtbindenden Elektronenpaare auf.
- Stelle für diese Reaktion das Massenwirkungsgesetz auf.
- Begründe eine Maßnahme, um die Stoffmenge an Ester im Gleichgewicht zu steigern.
(4 VP)
2.2
Die Synthese von 2-Methylbutansäureethylester soll untersucht werden. Zu Beginn sind die Stoffmengenkonzentrationen beider Edukte gleich. Die Stoffmenge der organischen Säure wird in Abhängigkeit von der Zeit bestimmt und in einem Diagramm dargestellt (siehe Abb.2).

- Erkläre anhand des Diagramms, dass sich ein Gleichgewichtszustand einstellt.
- Begründe die Lage des Gleichgewichts ausgehend von den Daten des Diagramms.
- Gib die Stoffmengen der beteiligten Stoffe im Gleichgewicht an.

(4 VP)
(20 VP)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Sorbinsäure-Lösung
Reaktionsgleichung:
Näherungsweise Berechnung der Stoffmengenkonzentration
Sorbinsäure ist eine schwache Säure  weswegen sie kaum dissoziiert vorliegt. In einer wässrigen Lösung entspricht die Konzentration undissoziierter Säuremoleküle ungefähr der ursprünglich eingesetzten Sorbinsäure-Konzentration. Daraus folgt:
weswegen sie kaum dissoziiert vorliegt. In einer wässrigen Lösung entspricht die Konzentration undissoziierter Säuremoleküle ungefähr der ursprünglich eingesetzten Sorbinsäure-Konzentration. Daraus folgt:
 Weiterhin gilt mit der Elektroneutralitätsbedingung:
Weiterhin gilt mit der Elektroneutralitätsbedingung:
 Damit ist:
Damit ist:
 Konzentration der H3O+-Ionen:
Konzentration der H3O+-Ionen:
 Daraus ergibt sich:
Daraus ergibt sich:
![\(\begin{array}[t]{rlll}
{c_\text{0, Sorbinsäure}} &=& \dfrac{10^{-2pH}}{K_S} &\; \\[5pt]
&=& \dfrac{10^{-2 \cdot 3,38}}{1,74 \cdot 10^{-5}} &\; \\[5pt]
&≈& 0,01 \: \text{mol} \cdot \text{L}^{-1} &\; \\[5pt]
\end{array}\)](https://www.schullv.de/resources/formulas/cafcc9337d97d8a4efaf8378c5da0a9a78bec808b0daf3d2dfc54c6a97da182e_light.svg) Mögliches Vorgehen für die Herstellung von Kaliumsorbat
Eine passende Stoffmenge von beispielsweise Kaliumhydroxid wird zu einer Portion Sorbinsäure-Lösung hinzugegeben. Anschließend wird die enstandene Kaliumsorbat-Lösung eingedampft, woraufhin reines Kaliumsorbat als Feststoff übrig bleibt.
Unterschiedliche Wasserlöslichkeit
Um die unterschiedlichen Wasserlöslichkeiten zu begründen, müssen die unterschiedlich starken Wechselwirkungen mit Wasser-Molekülen betrachtet werden, die aus den unterschiedlichen Ladungen resultieren. Kaliumsorbat löst sich besser als Sorbinsäure in Wasser, da stärkere Wasserstoffbrückenbindungen ausgebildet werden. Sorbinsäure hingegen löst sich besser in unpolaren Lösungsmitteln.
Mögliches Vorgehen für die Herstellung von Kaliumsorbat
Eine passende Stoffmenge von beispielsweise Kaliumhydroxid wird zu einer Portion Sorbinsäure-Lösung hinzugegeben. Anschließend wird die enstandene Kaliumsorbat-Lösung eingedampft, woraufhin reines Kaliumsorbat als Feststoff übrig bleibt.
Unterschiedliche Wasserlöslichkeit
Um die unterschiedlichen Wasserlöslichkeiten zu begründen, müssen die unterschiedlich starken Wechselwirkungen mit Wasser-Molekülen betrachtet werden, die aus den unterschiedlichen Ladungen resultieren. Kaliumsorbat löst sich besser als Sorbinsäure in Wasser, da stärkere Wasserstoffbrückenbindungen ausgebildet werden. Sorbinsäure hingegen löst sich besser in unpolaren Lösungsmitteln.
1.2
Durchführung der Titration
 Sorbatgehalt der Probe und Überprüfung der Herstellerangaben:
Reaktionsgleichung:
Sorbatgehalt der Probe und Überprüfung der Herstellerangaben:
Reaktionsgleichung:


 Es gilt:
Es gilt:
![\(\begin{array}[t]{rll}
n_{HCl} &=& n_{\,\text{Sorbat}}& \\[5pt]
c_{HCl} \cdot V_{HCl}&=& c_{\,\text{Sorbat}} \cdot V_{\,\text{Sorbat}}
\end{array}\)](https://www.schullv.de/resources/formulas/67d831e8ff5a45c8601fc6c730d039358beb5a677fd086cf5cefc208b7610655_light.svg) Daraus folgt:
Daraus folgt:
![\(\begin{array}[t]{rll}
c_{\,\text{Sorbat}} &=& \dfrac{c_{HCl} \cdot V_{HCl}}{V_{\,\text{Sorbat}}} & \\[5pt]
&=& \dfrac{19,2 \,\text{mL} \cdot 0,1 \,\text{mol}}{1,5\,\text{mL}} & \\[5pt]
&=& 1,28 \,\text{mol} \cdot \,\text{L}^{-1}
\end{array}\)](https://www.schullv.de/resources/formulas/ec6e66d961010161ab65cfa2d57337da025c5d23ccf215d528c1fb3d3643cf41_light.svg) Mit
Mit  ergibt sich:
ergibt sich:
![\(\begin{array}[t]{rll}
n_{\,\text{Sorbat}} &=& c_{\,\text{Sorbat}} \cdot V_0 & \\[5pt]
&=& 1,28 \,\text{mol} \cdot \,\text{L}^{-1} \cdot 0,1 \,\text{L} & \\[5pt]
&=& 0,128 \,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/34106b074b903e3691782f3c4361c430ef530bb20a366675e6d0c21b2a5cb596_light.svg)
![\(\begin{array}[t]{rll}
m_{\,\text{Sorbat}}&=& n_{\,\text{Sorbat}} \cdot M_{\,\text{Sorbat}} & \\[5pt]
&=& 0,128 \,\text{mol} \cdot 150 \,\text{g} \cdot \,\text{mol} ^{-1} & \\[5pt]
&=& 19,2 \,\text{g}
\end{array}\)](https://www.schullv.de/resources/formulas/1e163ac585016ed45fe7984ebc2dbe3714dbae29538013504a589791b2fec5a3_light.svg) Mit
Mit  Abweichung werden die Herstellerangaben von
Abweichung werden die Herstellerangaben von  werden nur näherungsweise erfüllt.
werden nur näherungsweise erfüllt.

- Die Probelösung wird mit genau abgemessenem Volumen in einen Erlenmeyerkolben vorgelegt.
Gegebenenfalls wird diese noch mit destilliertem Wasser verdünnt. - Anschließend wird die zu untersuchende Lösung mit einigen Tropfen eines geeigneten pH-Indikators versetzt (z.B. Methylorange).
- Nun wird die Maßlösung unter ständigem Rühren tropfenweise zur Probelösung hinzugegeben bis ein Farbumschlag stattfindet (bei Methylorange von gelborange zu rot).
- Dieser kennzeichnet den Äquivalenzpunkt. An dieser Stelle muss das Volumen der verbrauchten Maßlösung an der Bürettenskala abgelesen werden.
2.1
Synthese von 2-Methylbutansäureethylester
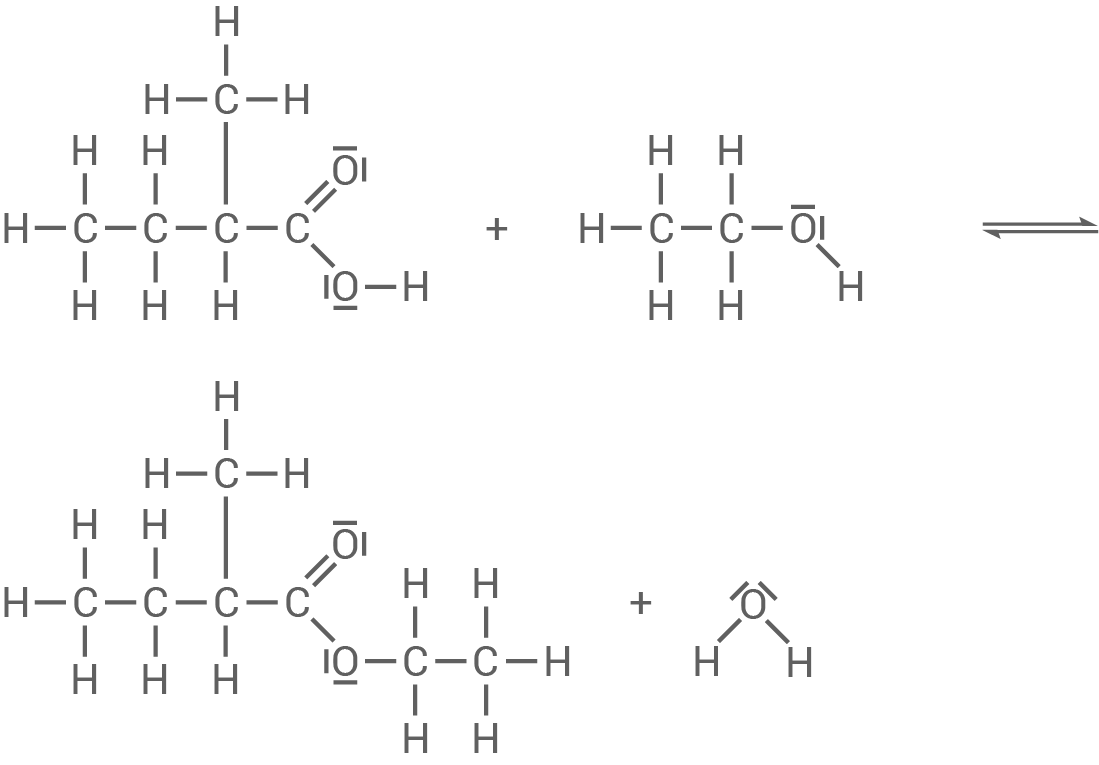 Massenwirkungsgesetz
Massenwirkungsgesetz
 Stoffmenge an Ester im Gleichgewicht steigern
Nach dem Prinzip von LE CHATELIER kann die Ausbeute an Ester durch eine Erhöhung der Stoffmengenkonzentration eines Edukts (Ethanol oder 2-Methylnutansäure) gesteigert werden. Durch diese Erhöhung wird auf die sich im Gleichgewicht befindliche Reaktion ein Zwang ausgeübt, wodurch sich das Gleichgewicht auf die Seite der Produkte verschiebt.
Stoffmenge an Ester im Gleichgewicht steigern
Nach dem Prinzip von LE CHATELIER kann die Ausbeute an Ester durch eine Erhöhung der Stoffmengenkonzentration eines Edukts (Ethanol oder 2-Methylnutansäure) gesteigert werden. Durch diese Erhöhung wird auf die sich im Gleichgewicht befindliche Reaktion ein Zwang ausgeübt, wodurch sich das Gleichgewicht auf die Seite der Produkte verschiebt.

2.2
Zeitliche Abhängigkeit der Stoffmenge  der organischen Säure
der organischen Säure
- Gegen Ende des Experiments ist im Verlauf der Estersynthese keine Änderung der Säuremenge mehr zu erkennen. Die Reaktionsgeschwindigkeit konvergiert gegen null und zeigt die Gleichgewichtseinstellung
also:
- Das Diagramm zeigt, dass die Stoffmenge der organischen Säure im Gleichgewicht deutlich kleiner ist als die Hälfte ihrer Ausgangsstoffmenge. Somit lässt sich die Lage des Gleichgewichts ableiten, welches auf der Seite der Produkte liegt.
- Stoffmengen im Gleichgewichtszustand:
Die Stoffmengenverhältnisse der beteiligten Stoffe sind jeweils 1:1, daraus folgt: