Aufgabe 5 – Emission von Kohlenstoffdioxid
Die Emission von Kohlenstoffdioxid ist nach Stand der Wissenschaft ein entscheidender Faktor für den Klimawandel. Vor diesem Hintergrund sind fossile Brennstoffe in den letzten Jahren in die Kritik geraten, denn bei ihrer Verbrennung entsteht Kohlenstoffdioxid.
1
Erdgas und Benzin sind typische fossile Brennstoffe.
1.1
Hauptbestandteil von Erdgas ist Methan. In einem Schulversuch sollen die Verbrennungsprodukte von Methan nachgewiesen werden. Dazu wird die in Abbildung 1 gezeigte Apparatur aufgebaut und in Betrieb genommen.
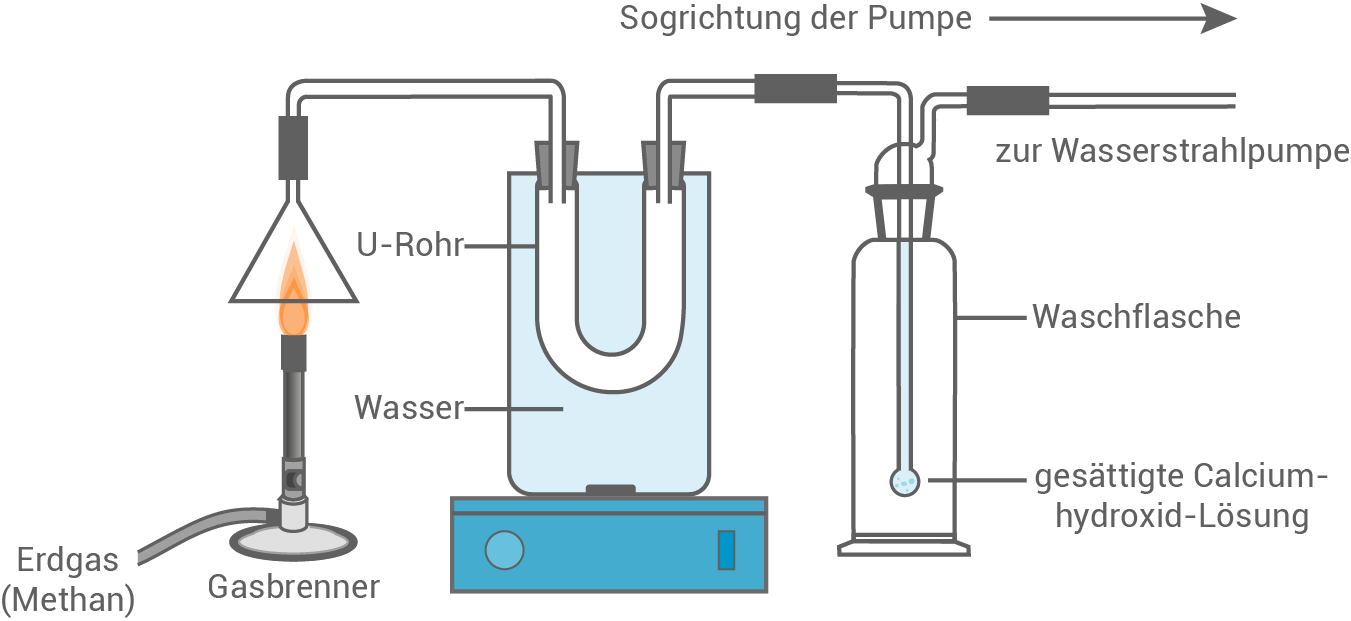 In dem Becherglas befinden sich
In dem Becherglas befinden sich  kaltes Wasser. Während des Experiments nimmt die Wassertemperatur von
kaltes Wasser. Während des Experiments nimmt die Wassertemperatur von  auf
auf  zu. Die spezifische Wärmekapazität von Wasser ist
zu. Die spezifische Wärmekapazität von Wasser ist  . Die molare Verbrennungsenthalpie von Methan beträgt
. Die molare Verbrennungsenthalpie von Methan beträgt  .
.

Abbildung 1: Versuchsapparatur für den Nachweis der Verbrennungsprodukte von Methan
- Stelle für die Verbrennung von Methan eine Reaktionsgleichung auf.
- Beschreibe die Nachweise der Verbrennungsprodukte.
- Berechne die Wärmemenge
, die während des Experiments von dem Wasser im Becherglas aufgenommen wird.
- Berechne die Masse an Kohlenstoffdioxid, die bei diesem Experiment mindestens entsteht.
(5 VP)
1.2
Eine wichtige Größe zur Beurteilung der Klimaschädlichkeit eines Brennstoffes ist der Emissionsfaktor. Er gibt an, welche Masse an Kohlenstoffdioxid bei der Verbrennung entsteht, wenn dabei eine Energiemenge von  freigesetzt wird. Der Emissionsfaktor von Erdgas beträgt
freigesetzt wird. Der Emissionsfaktor von Erdgas beträgt  pro
pro  Zur näherungsweisen Berechnung des Emissionsfaktors von Benzin kann vereinfacht von Octan ausgegangen werden. Octan reagiert mit Sauerstoff nach der folgenden Reaktionsgleichung:
Zur näherungsweisen Berechnung des Emissionsfaktors von Benzin kann vereinfacht von Octan ausgegangen werden. Octan reagiert mit Sauerstoff nach der folgenden Reaktionsgleichung:
- Berechne ausgehend von der gegebenen Reaktionsgleichung die Reaktionsenthalpie für die Verbrennung von Octan.
- Ermittle damit näherungsweise den Emissionsfaktor von Benzin und vergleiche diesen mit dem Emissionsfaktor von Erdgas.
- Nenne ein weiteres Kriterium, das zur Beurteilung der Klimaschädlichkeit eines Brennstoffes herangezogen werden kann.
(6 VP)
2
Im Zusammenhang mit der Klimadiskussion der letzten Jahre ist Wasserstoff als Energieträger verstärkt in den Fokus der Forschung gerückt, da die energetische Verwertung z.B. in Brennstoffzellen ganz ohne Emission von Kohlenstoffdioxid geschieht.
2.1
In einem Experiment soll die Verbrennungsenthalpie von Wasserstoff bestimmt werden. Dazu stehen drei unterschiedliche Kalorimeter zur Auswahl (siehe Abb. 2).
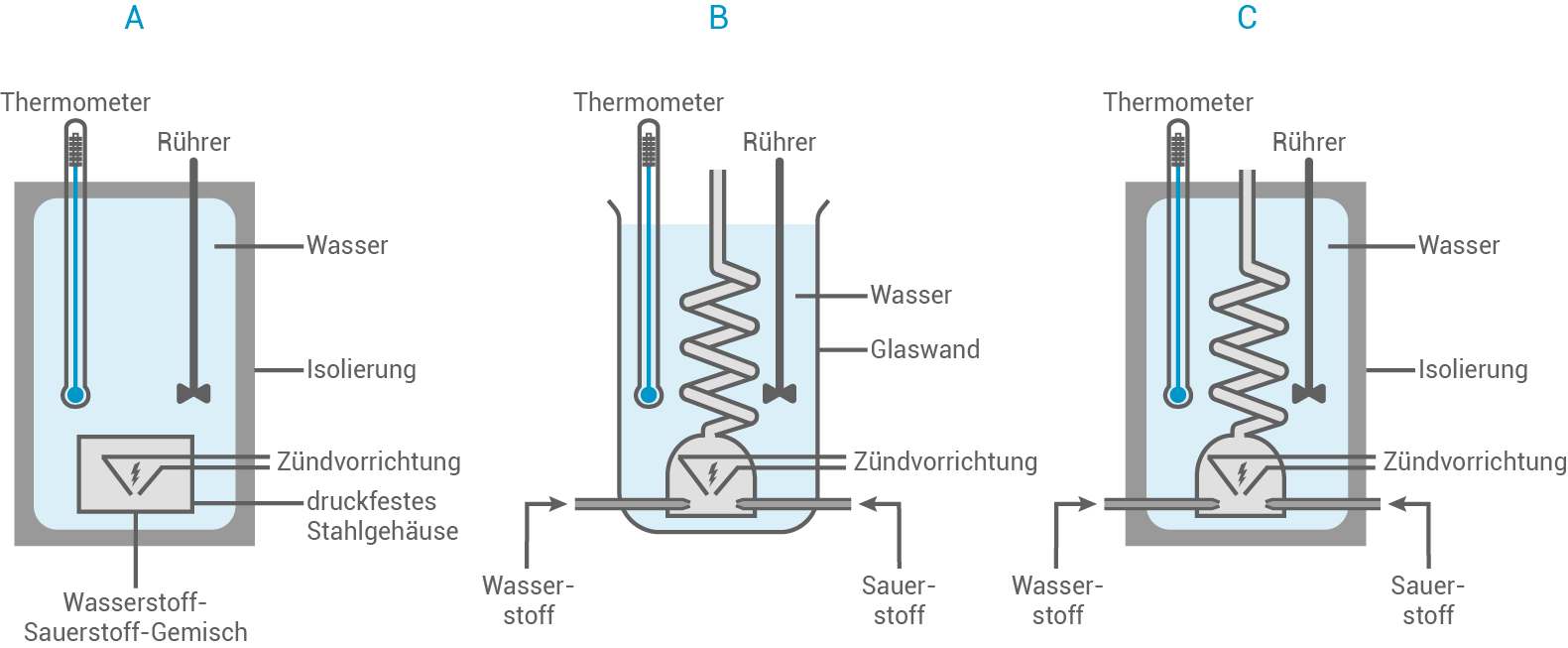

Abbildung 2: Unterschiedliche Kalorimeter
- Erkläre anhand der Kalorimeter die Begriffe offenes System und isoliertes System.
- Wähle ein geeignetes Kalorimeter zur experimentellen Bestimmung der Verbrennungsenthalpie aus und begründe deine Auswahl.
(4 VP)
2.2
Wasserstoff reagiert mit Sauerstoff nach der folgenden Reaktionsgleichung:


 Die Reaktion verläuft bei Raumtemperatur exergonisch. Dennoch ist bei Raumtemperatur in einem Wasserstoff-Sauerstoff-Gemisch weder ein stofflicher noch ein energetischer Umsatz beobachtbar. Dies ist erst dann der Fall, wenn das Gemisch gezündet wird oder in Berührung mit einem geeigneten Katalysator kommt.
Die Reaktion verläuft bei Raumtemperatur exergonisch. Dennoch ist bei Raumtemperatur in einem Wasserstoff-Sauerstoff-Gemisch weder ein stofflicher noch ein energetischer Umsatz beobachtbar. Dies ist erst dann der Fall, wenn das Gemisch gezündet wird oder in Berührung mit einem geeigneten Katalysator kommt.
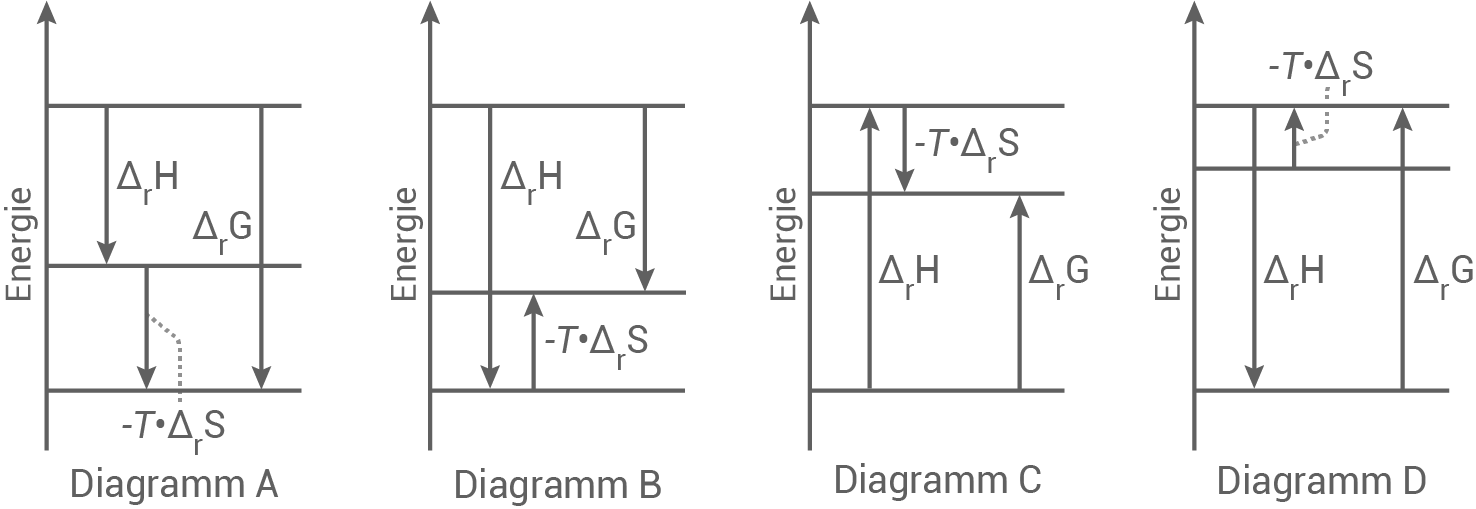
- Begründe das Vorzeichen der Reaktionsentropie.
- Ordne der Reaktion bei Raumtemperatur eines der in Abbildung 3 angegebenen Energiediagramme zu und begründe deine Zuordnung.
- Erkläre die geschilderte Stabilität eines Wasserstoff-Sauerstoff-Gemischs und die Bedeutung des Zündens bzw. des Katalysatoreinsatzes für den Ablauf der Reaktion.

Abbildung 3: Energiediagramme
(5 VP)
(20 VP)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Reaktionsgleichung für die Verbrennung von Methan


 Nachweis der Verbrennungsprodukte
Nachweis der Verbrennungsprodukte
Berechnung der Wärmemenge  Gegeben sind:
Gegeben sind:
 und
und ![\(\begin{array}[t]{rll}
\quad \Delta T&=& 11,6^\circ C - 6,3^\circ C &\\[5pt]
&=& 5,3 ^\circ C &\\[5pt]
&=& 5,3 \,\text{K}
\end{array}\)](https://www.schullv.de/resources/formulas/538d9e032f123fb2959db800505c60bc3e3f2f697a9c518022ebebc3cbca9e09_light.svg) Daraus ergibt sich:
Daraus ergibt sich:
![\(\begin{array}[t]{rll}
Q &=& c_w \cdot m \cdot \Delta T &\\[5pt]
&=& 4,186 \,\text{J} \cdot \,\text{g}^{-1} \cdot \text{K}^{-1} \cdot 400 \,\text{g} \cdot 5,3 \,\text{K} &\\[5pt]
&=& 8874,32 \,\text{J} &\\[5pt]
&\approx& 8,87 \,\text{kJ} \\[5pt]
\end{array}\)](https://www.schullv.de/resources/formulas/cf2bde3cc3a5012efd0cac95253defc5c2ead4f408828f85b9fd07d0ba461b1a_light.svg) Masse an Kohlenstoffdioxid
Mit der Verbrennungsenthalpie von Methan
Masse an Kohlenstoffdioxid
Mit der Verbrennungsenthalpie von Methan  und der im Experiment gemessenen Wärmemenge von
und der im Experiment gemessenen Wärmemenge von  ergibt sich:
ergibt sich:
![\(\begin{array}[t]{rll}
n(CH_4)&=& \dfrac{Q}{\Delta_cH^0 (CH_4) } \\[5pt]
&=& \dfrac{8,9 \,\text{kJ}}{891\ 000 \,\text{J} \cdot \,\text{mol}^{-1}} \\[5pt]
&=& 0,00996 \,\text{mol} \\[5pt]
&\approx& 0,01 \,\text{mol}
\end{array}\)](https://www.schullv.de/resources/formulas/1ef95279055beac007cea2e8d5503a97ea1a014b560f3e19e8b3252bea4bfba1_light.svg) Aus der Reaktionsgleichung folgt:
Aus der Reaktionsgleichung folgt:
 Damit ergibt sich für die mind. verbrannte Menge an Methan:
Damit ergibt sich für die mind. verbrannte Menge an Methan:
![\(\begin{array}[t]{rll}
m(CO_2) &=& n \cdot M & \\[5pt]
&=& 0,1 \,\text{mol} \cdot 44 \,\text{g} \cdot \text{mol} ^{-1} \\[5pt]
&=& 0,44 \,\text{g}
\end{array}\)](https://www.schullv.de/resources/formulas/05cea079c39a5b71c3ce87a33402ae62a3efd3e94d7b73a6d63435202bf2c6c3_light.svg)
|
|
1.2
Reaktionsenthalpie für die Verbrennung von Octan
Emissionsfaktor Benzin
Für die Verbrennung von  Octan gilt:
Octan gilt:
![\(\begin{array}[t]{rll}
n (C_8H_{18}) &=& \dfrac{Q}{\Delta_rH_m^0}&\\[5pt]
&=& 2 \cdot \dfrac{-1000 \,\text{kJ}}{-10160\,\text{kJ} \cdot \,\text{mol}^{-1} } & \\[5pt]
&=& 0,1969 \,\text{mol} & \\[5pt]
&=& 1969 \,\text{mmol}
\end{array}\)](https://www.schullv.de/resources/formulas/7a2bfc5c27e67306bce334eb50ffe89f7671c49b669752457b2dd16576f21d66_light.svg) Für die Masse ergibt sich daraus:
Für die Masse ergibt sich daraus:
![\(\begin{array}[t]{rll}
n (CO_2)&=& 8\,n \,\text{(Octan)}&\\[5pt]
&=& 8 \cdot 1969 \,\text{mmol} &\\[5pt]
&=& 1576 \,\text{mmol}
\end{array}\)](https://www.schullv.de/resources/formulas/a7d6c9782c456fc247107d6131e2c8f85cc4abd9b5caa1571ab1687472e74e04_light.svg)
![\(\begin{array}[t]{rll}
m (CO_2)&=& n \cdot M&\\[5pt]
&=& 1,576 \,\text{mol}l \cdot 44 \,\text{g} \cdot \,\text{mol} \cdot \text{L} ^{-1} &\\[5pt]
&=& 69, 31 \,\text{g}
\end{array}\)](https://www.schullv.de/resources/formulas/de5dc5ee08c16a379b42a13a20219300ae502d1e361ea46ade2067c9f7da1aba_light.svg) Es entstehen also
Es entstehen also  Kohlenstoff, womit der Emissionsfaktor von Benzin näherungsweise
Kohlenstoff, womit der Emissionsfaktor von Benzin näherungsweise  pro
pro  beträgt.
beträgt.
 Der Emissionsfaktor von Benzin ist also um ca.
Der Emissionsfaktor von Benzin ist also um ca.  höher als der von Erdgas.
Mögliche Kriterien zur Beurteilung der Klimaschädlichkeit eines Brennstoffs:
höher als der von Erdgas.
Mögliche Kriterien zur Beurteilung der Klimaschädlichkeit eines Brennstoffs:
- Die Emission klimaschädlicher Gase in der Vorkette, d.h. bei der Förderung, Produktion, Lagerung und Auslieferung des Brennstoffs
- Die Kohlenstoffdioxidneutralität bei Brennstoffen aus nachwachsenden Rohstoffen
- Allgemein die Klimaschädlichkeit des Brennstoffs selbst
(insbesondere bei Methan ein großes Problem)
2.1
Erklärung der Systeme
In Abbildung 2 zeigen die Kalorimeter B und C zur Umgebung offene Verbrennungsräume – Wasserstoff und Sauerstoff werden als Gas zugeführt und das Reaktionsprodukt Wasser wird als Gas abgeführt.
Kalorimeter A zeigt hingegen ein druckfestes Stahlgehäuse, in dem die Edukte und Produkte verbleiben (Bombenkalorimeter).
A und C zeigen außerdem dickwandige Ummantelungen zur Wärmeisolierung – bei B findet ein Wärmeverlust über die Glaswand statt. Kalorimeter A wäre demnach ein isoliertes System und Kalorimeter B ein offenes. Auswahl eines geeigneten Kalorimeters Um die Verbrennungsenthalpie experimentell zu bestimmen eignet das Bombenkalorimeter A als isoliertes System am besten. Hierbei bleibt das Volumen konstant, allerdings findet eine Druckänderung statt, welche bei der Berechnung von beachtet werden muss.
Alternativ kann auch Kalorimeter C verwendet werden, wobei hierbei der Heizwert eines Gases ermittelt werden würde.
beachtet werden muss.
Alternativ kann auch Kalorimeter C verwendet werden, wobei hierbei der Heizwert eines Gases ermittelt werden würde.
| Offenes System |
|
|---|---|
| Isoliertes System |
|
A und C zeigen außerdem dickwandige Ummantelungen zur Wärmeisolierung – bei B findet ein Wärmeverlust über die Glaswand statt. Kalorimeter A wäre demnach ein isoliertes System und Kalorimeter B ein offenes. Auswahl eines geeigneten Kalorimeters Um die Verbrennungsenthalpie experimentell zu bestimmen eignet das Bombenkalorimeter A als isoliertes System am besten. Hierbei bleibt das Volumen konstant, allerdings findet eine Druckänderung statt, welche bei der Berechnung von
2.2
Reaktion von H2 mit O2
Aus der Reaktionsgleichung lässt sich entnehmen, dass sich die Anzahl der Teilchen in der Gasphase bei der Reaktion verringert. Die "Unordnung" des Systems nimmt ab, womit die Verbrennung von Wasserstoff unter Entropieabnahme verläuft.
Das Vorzeichen der Reaktionsentropie ist negativ.
Zuordnung eines Energiediagramms
Für eine beliebige Reaktion gilt:
 Die Reaktion verläuft exergonisch, also ist
Die Reaktion verläuft exergonisch, also ist  . Im Diagramm muss daher für
. Im Diagramm muss daher für  der Pfeil nach unten stehen.
der Pfeil nach unten stehen.
Außerdem nimmt die Entropie bei der Reaktion ab, also gilt . Im Diagramm muss dafür also ein Pfeil nach oben stehen.
. Im Diagramm muss dafür also ein Pfeil nach oben stehen.
Anhand dieser Kriterien kommt nur Diagramm B in Frage. Stabilität des Wasserstoff-Sauerstoff-Gemisches Bei einem Wasserstoff-Sauerstoff-Gemisch handelt es sich um ein metastabiles System – die Systemenergie ist hier höher als die des Reaktionsprodukt. Die Umsetzung zu Wasser ist zwar mit energetisch günstig, jedoch läuft die Reaktion aufgrund kinetischer Hemmung bei Raumtemperatur nicht schnell genug ab.
Das Zünden bewirkt die Zufuhr von erforderlicher Aktivierungsenergie, damit die Energiebarriere überwunden wird.
Der Einsatz eines Katalysators bewirkt außerdem die Herabsetzung der Aktivierungsenergie.
energetisch günstig, jedoch läuft die Reaktion aufgrund kinetischer Hemmung bei Raumtemperatur nicht schnell genug ab.
Das Zünden bewirkt die Zufuhr von erforderlicher Aktivierungsenergie, damit die Energiebarriere überwunden wird.
Der Einsatz eines Katalysators bewirkt außerdem die Herabsetzung der Aktivierungsenergie.
Außerdem nimmt die Entropie bei der Reaktion ab, also gilt
Anhand dieser Kriterien kommt nur Diagramm B in Frage. Stabilität des Wasserstoff-Sauerstoff-Gemisches Bei einem Wasserstoff-Sauerstoff-Gemisch handelt es sich um ein metastabiles System – die Systemenergie ist hier höher als die des Reaktionsprodukt. Die Umsetzung zu Wasser ist zwar mit