C2 Molekularküche
Seit den 1980er Jahren versucht die Molekularküche, sich mithilfe der Lebensmitteltechnologie durch die Zubereitung von Speisen mit ungewohnter Konsistenz und Farbe von der herkömmlichen Küche abzugrenzen.
1
In der Molekularküche werden Cremes hergestellt. Dabei handelt es sich um Gemische aus fein ineinander verteilten wässrigen und ölhaltigen Komponenten. Die Größe der Öltröpfchen beeinflusst dabei sowohl die Konsistenz als auch den Geschmack einer Creme. Als besonders angenehm werden kleine, fein verteilte Tröpfchen empfunden. Emulgatoren wie Saccharosestearat (Abb. 1) werden zugesetzt, um eine Entmischung zu verhindern.
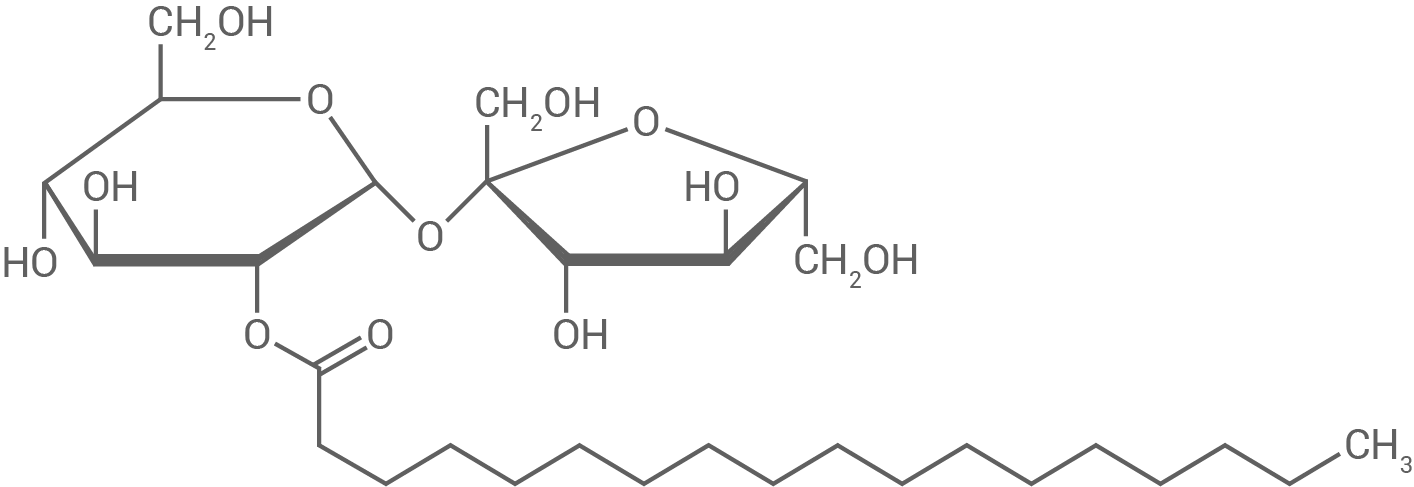

Abb. 1: Strukturformel von Saccharosestearat
1.1
Begründe anhand der Strukturformel und unter Verwendung beschrifteter Skizzen die emulgierende Wirkung von Saccharosestearat.
(6 BE)
1.2
In einer Versuchsreihe wurden drei verschiedene Gemische aus Wasser, Orangenöl und Saccharosestearat unter kräftigem Rühren hergestellt (Tab. 1):
Anschließend wurde jeweils der Anteil verschiedener großer Öltröpfchen am Gesamtvolumen des Orangenöls bestimmt:
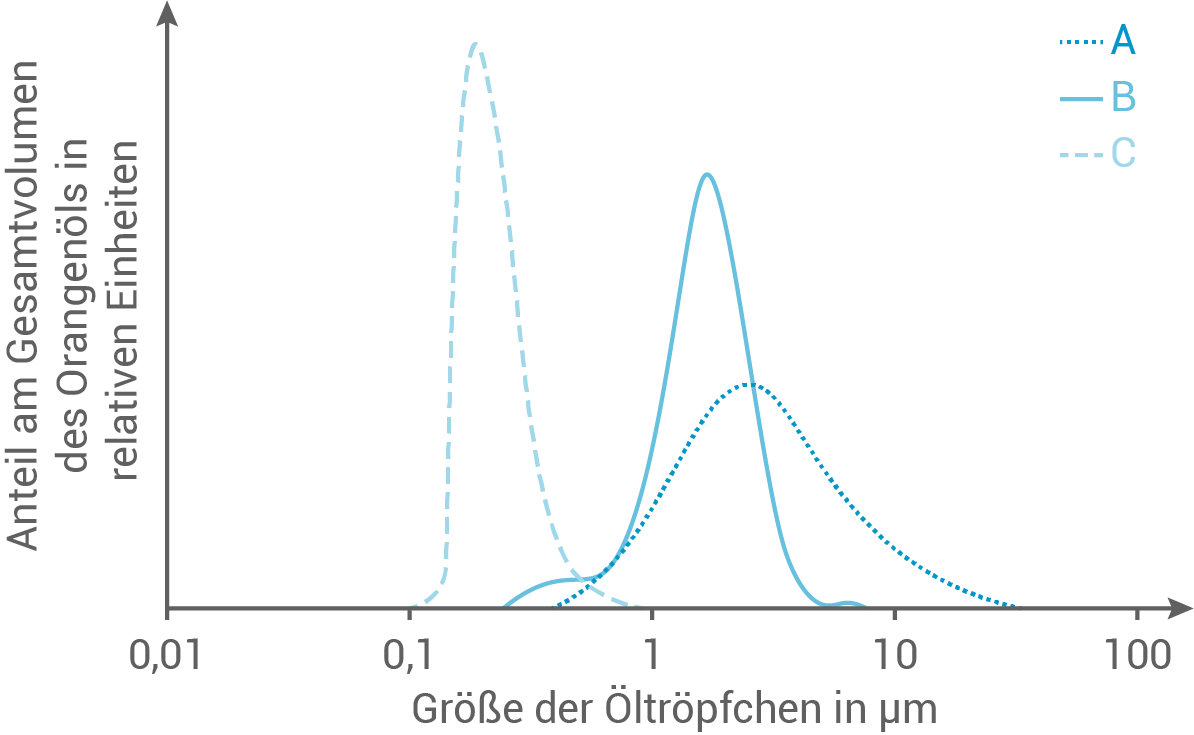 Beschreibe die Versuchsergebnisse und formuliere eine Hypothese zur Abhängigkeit der Öltröpfchengröße vom Saccharosestearat-Anteil.
Beschreibe die Versuchsergebnisse und formuliere eine Hypothese zur Abhängigkeit der Öltröpfchengröße vom Saccharosestearat-Anteil.
Tab. 1: Zusammensetzung der Gemische der Versuchsreihe
nach: Ariyaprakai, Suwimon; Hu, Xuanyi; Tran, Minh Thú (2018). Spontaneous Formation of Flavor, Oil Emulsions by Using Sucrose Esters and Emulsion Stability Study. Food Biophysics. 3 - 7.
| Ansatz | Massen-anteil Wasser in % | Massen-anteil Orangenöl in % | Massen-anteil Saccharose-stearat in % |
|---|---|---|---|
| A | |||
| B | |||
| C |

Abb. 2: Anteil verschieden großer Öltröpfchen am Gesamtvolumen des Orangenöls
nach: Ariyaprakai, Suwimon; Hu, Xuanyi; Tran, Minh Thú (2018). Spontaneous Formation of Flavor Oil Emulsions by Using Sucrose Esters and Emulsion Stability Study. Food Biophysics. 3 - 7.
(7 BE)
1.3
Man erhofft sich in der Molekularküche von Maltosestearat (Abb. 3) zusätzliche Einsatzmöglichkeiten im Vergleich zu denen von Saccharosestearat.
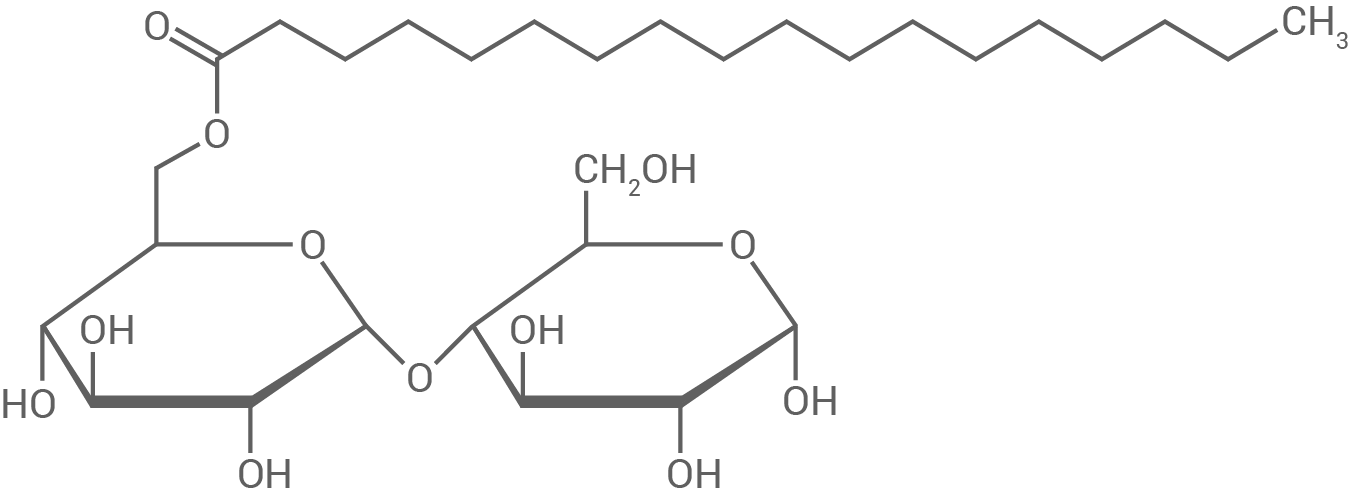

Abb. 3: Strukturformel von Maltosestearat
1.3.1
Plane und beschreibe einen Versuch zur Unterscheidung der beiden Emulgatoren.
(8 BE)
1.3.2
Ausgewählte Eigenschaften der beiden Emulgatoren sind in Abbildung 4 angegeben.
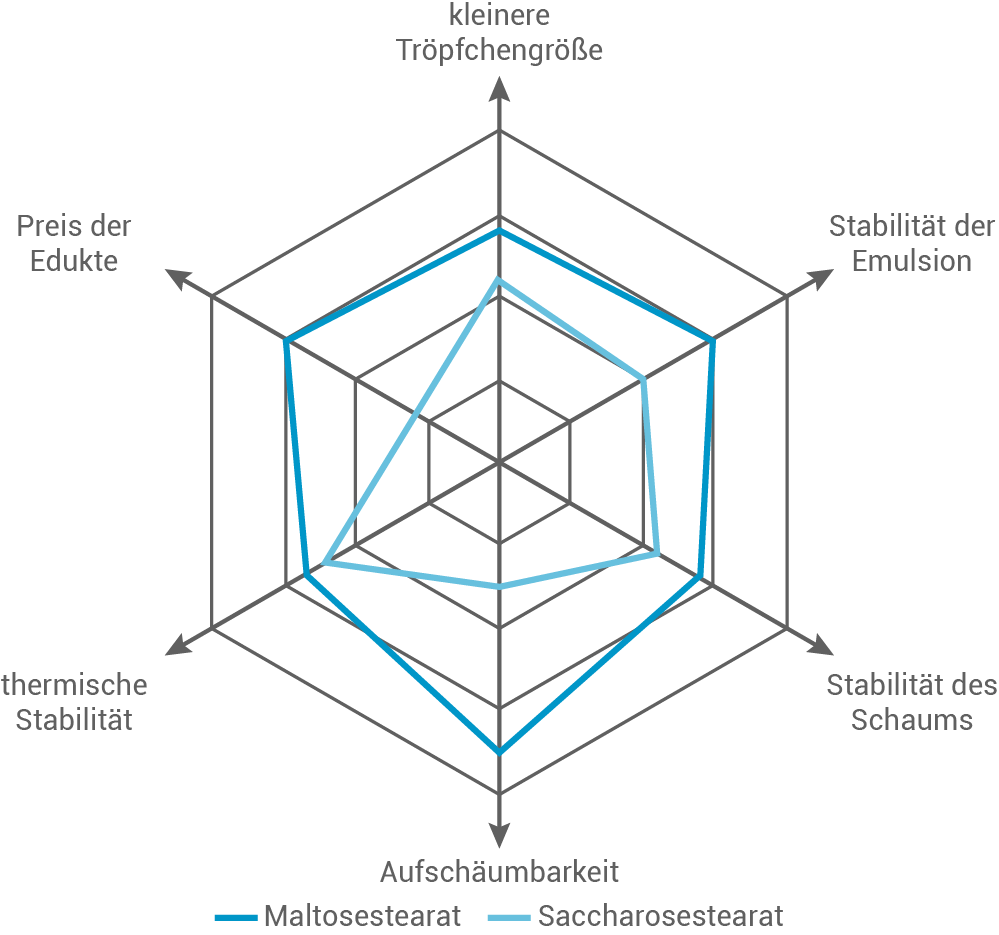 Beurteile mithilfe von Abbildung 4 den Einsatz der beiden Emulgatoren zur Herstellung von warmen Cremes sowie von Schäumen in der Molekularküche.
Beurteile mithilfe von Abbildung 4 den Einsatz der beiden Emulgatoren zur Herstellung von warmen Cremes sowie von Schäumen in der Molekularküche.

Abb. 4: Vergleich ausgewählter Eigenschaften von Maltosestearat und Saccharosestearat
nach: Ma YR, Banwell MG, Yan R, Lan P. (2013). Comparative Study of the Emulsifying Properties of a Homologous Series of Long-Chain 6'- O-Acylmaltose Esters. J Agric Food Chem. 66(33), 8832 - 8840.
(5 BE)
2
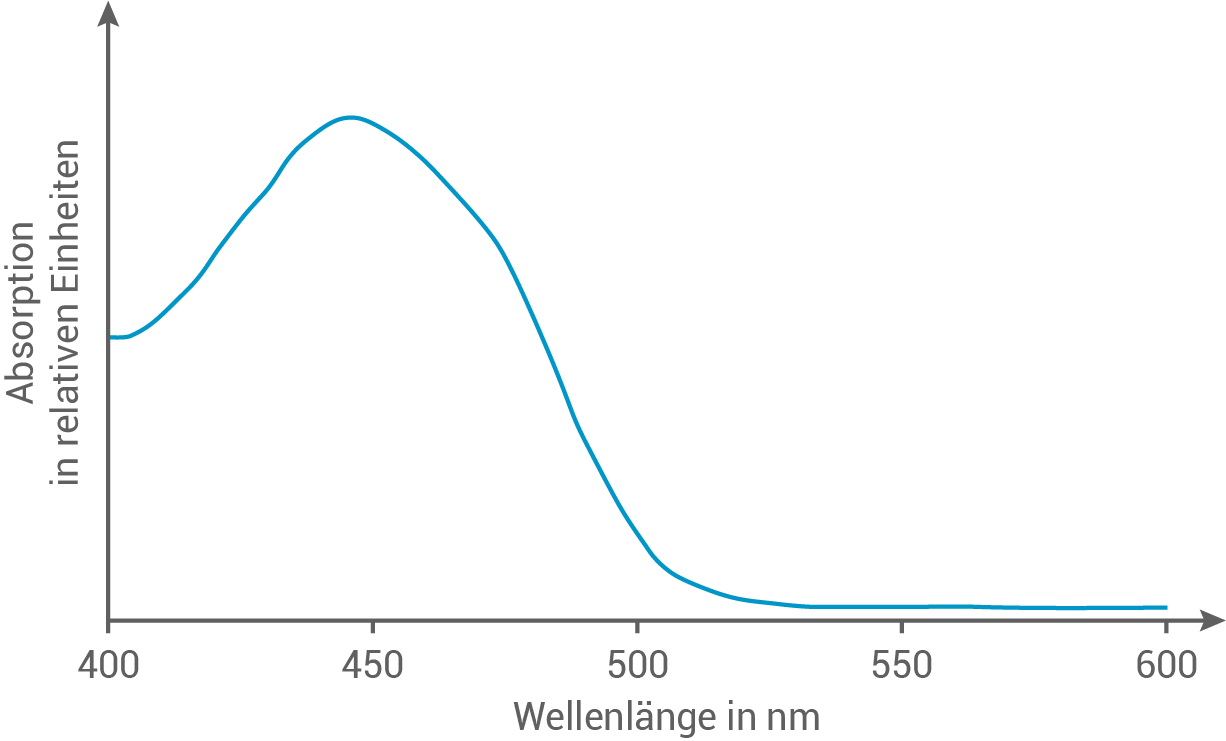
Riboflavin wird zum Färben von Gerichten eingesetzt. Das Absorptionsspektrum dieses Farbstoffs ist in Abbildung 5 dargestellt.
 Mit Riboflavin gefärbte Gerichte können auch zum Leuchten gebracht werden. Bei Anregung mit UV-Licht der Wellenlänge 349 nm emittiert Riboflavin Licht einer bestimmten Farbe (Abb. 6).
Mit Riboflavin gefärbte Gerichte können auch zum Leuchten gebracht werden. Bei Anregung mit UV-Licht der Wellenlänge 349 nm emittiert Riboflavin Licht einer bestimmten Farbe (Abb. 6).
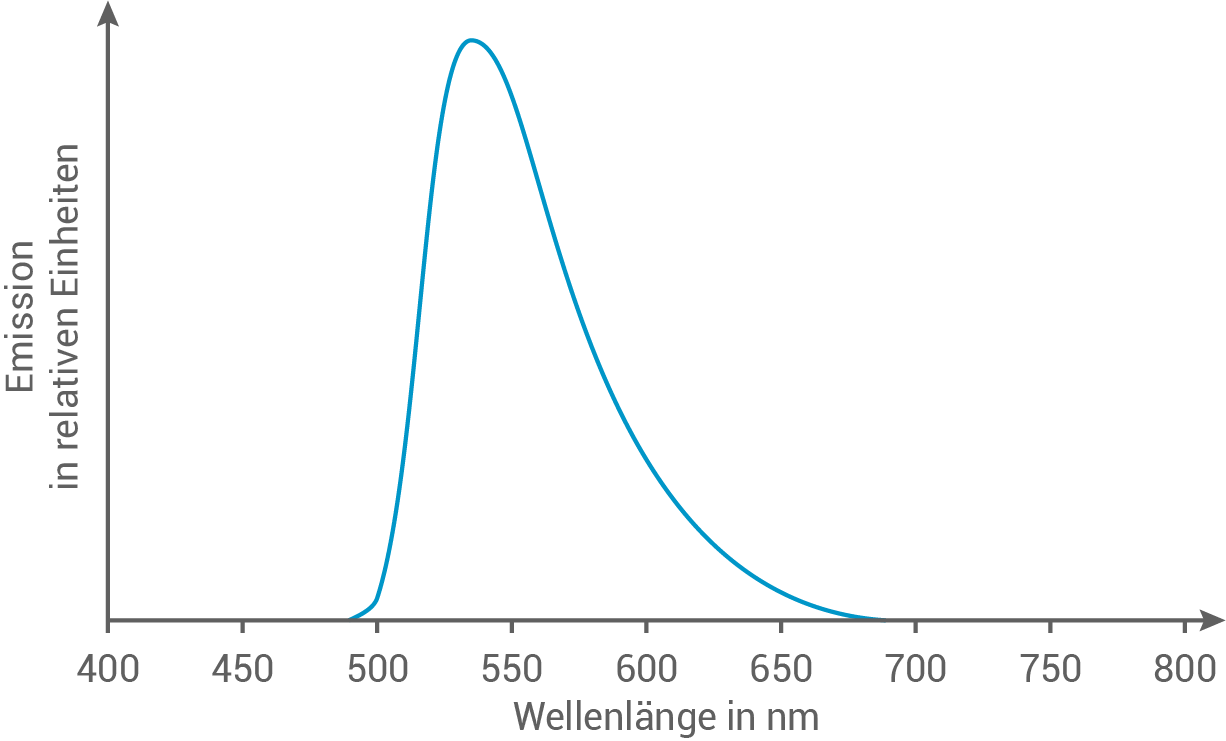

Abb. 5: Absorptionsspektrum von Riboflavin
nach: Zhang, Yuntao & Sukthankar, Pinakin & Tomich, John & Conrad, Gary. (2012). Effect of the Synthetic NC-1059 Peptide on Diffusion of Riboflavin across an Intact Corneal Epithelium. Investigative ophthalmology \& visual science. 53.

Abb. 6: Emissionsspektrum von Riboflavin bei Anregung mit UV-Licht der Wellenlänge  nach: Zhang, Yuntao & Sukthankar, Pinakin & Tomich, John & Conrad, Gary. (2012). Effect of the Synthetic NC-1059 Peptide on Diffusion of Riboflavin across an Intact Corneal Epithelium. Investigative ophthalmology \& visual science. 53.
nach: Zhang, Yuntao & Sukthankar, Pinakin & Tomich, John & Conrad, Gary. (2012). Effect of the Synthetic NC-1059 Peptide on Diffusion of Riboflavin across an Intact Corneal Epithelium. Investigative ophthalmology \& visual science. 53.
Tab. 2: Zusammenhang zwischen Wellenlänge, Farbe und Komplementärfarbe des Lichts
| Wellenlänge des absorbierten Lichts in nm |
Farbe des Lichts | Komplementärfarbe |
|---|---|---|
| Violett | Gelb | |
| Blau | Orange | |
| Blaugrün | Rot | |
| Gelbgrün | Purpur | |
| Gelb | Violett | |
| Orange | Blau | |
| Rot | Blaugrün |
2.1
Leite mithilfe von Abbildung 5 und Tabelle 2 die Farbe von Riboflavin ab. Ermittle sie mithilfe von Abbildung 6 und Tabelle 2 die Farbe, in der Riboflavin unter UV-Licht leuchtet.
(5 BE)
2.2
Gib man zu einer Riboflavin-Lösung Natriumdithionit  wird die Lösung farblos. Dithionit-Ionen reagieren dabei zu Schwefeldioxid-Ionen, Riboflavin-Moleküle von der Chinon-Form in die Hydrochinon-Form (Abb. 7). Bei längerem Stehenlassen an der Luft färbt sich die Lösung wieder.
wird die Lösung farblos. Dithionit-Ionen reagieren dabei zu Schwefeldioxid-Ionen, Riboflavin-Moleküle von der Chinon-Form in die Hydrochinon-Form (Abb. 7). Bei längerem Stehenlassen an der Luft färbt sich die Lösung wieder.
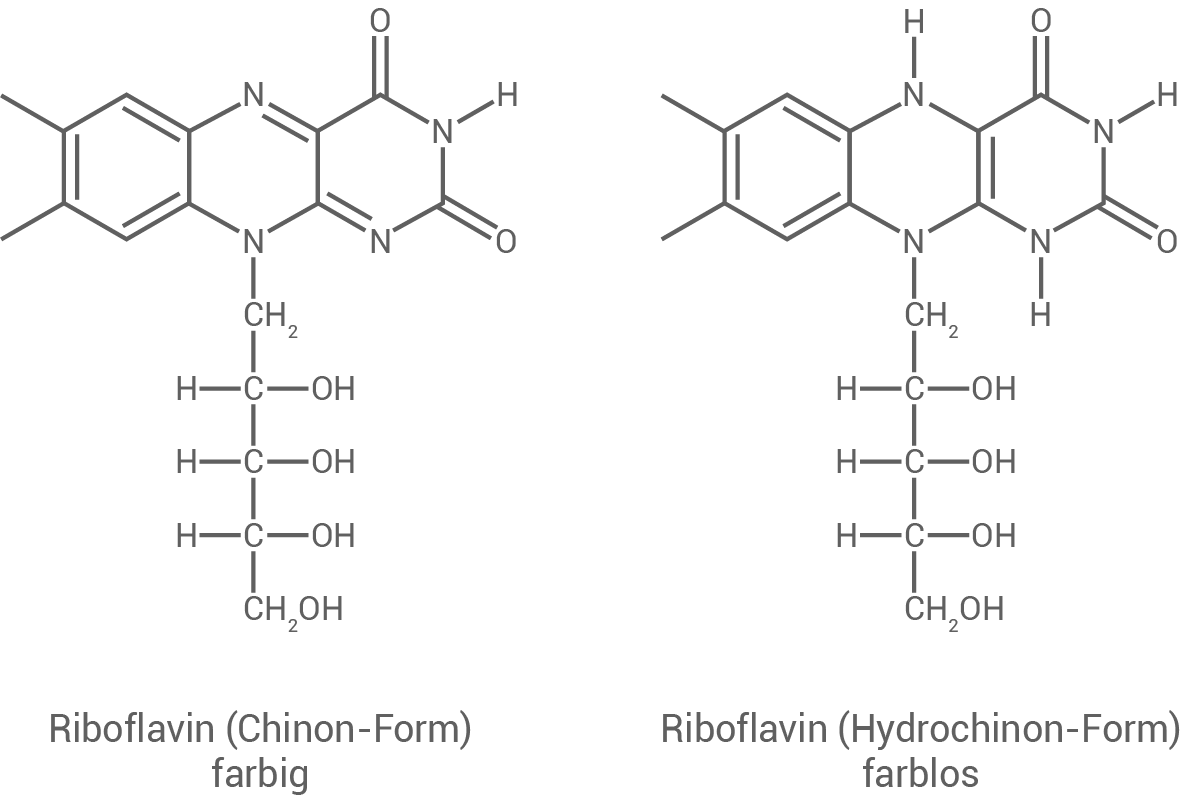

Abb. 7: Strukturformeln der Chinon- und Hydrochinon-Form von Riboflavin
2.2.1
Formuliere die Teilgleichungen für die Reaktion von Riboflavin-Molekülen mit Dithionit-Ionen in saurer Lösung. Nicht benötigte Molekülteile können mit R abgekürzt werden.
(6 BE)
2.2.2
Stelle eine Hypothese zum Wiederauftreten der Farbigkeit bei längerem Stehenlassen an der Luft auf.
(3 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Begründung der emulgierenden Wirkung von Saccharosestearat
Saccharosestearat wirkt als Emulgator, da es amphiphile Eigenschaften besitzt. Der hydrophile Teil besteht aus der Saccharose-Einheit, die durch zahlreiche Hydroxygruppen stark polar ist und Wasserstoffbrückenbindungen mit Wasser eingehen kann. Der hydrophobe Teil besteht aus der Stearatkette, einer langen, unpolaren Alkylkette, die hydrophobe Wechselwirkungen mit Öl eingeht.
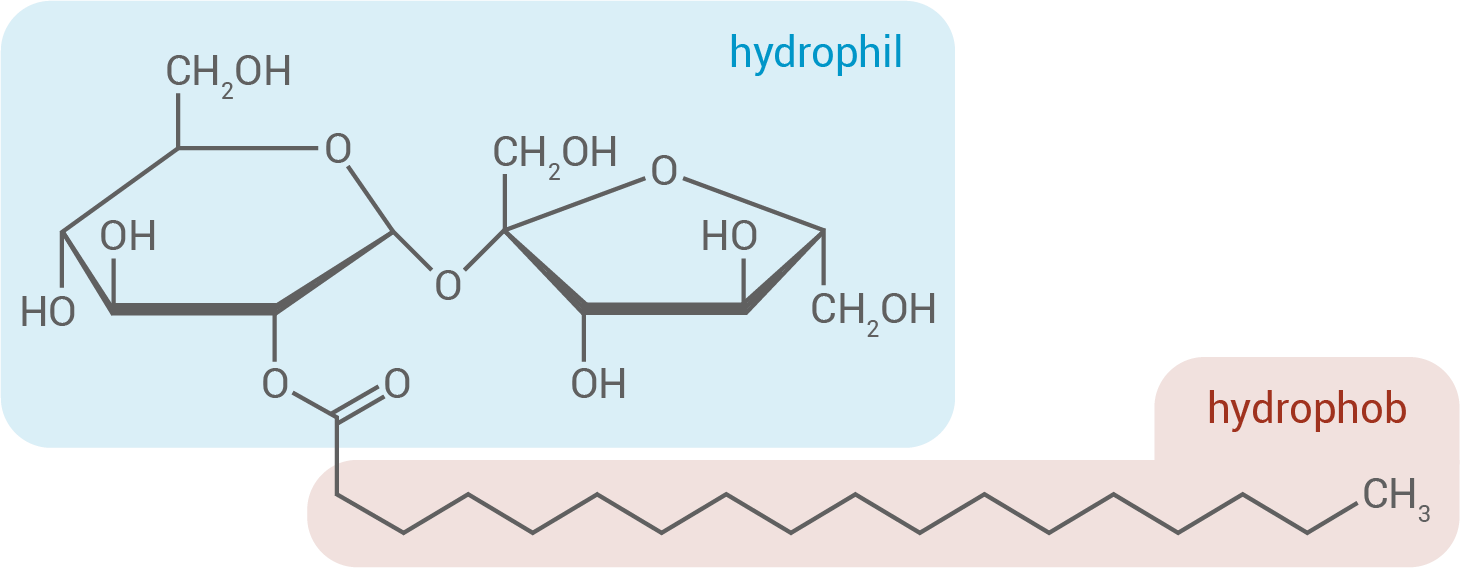 In einer Emulsion ordnet sich Saccharosestearat so an, dass der hydrophile Teil ins Wasser und der hydrophobe Teil ins Öl zeigt:
In einer Emulsion ordnet sich Saccharosestearat so an, dass der hydrophile Teil ins Wasser und der hydrophobe Teil ins Öl zeigt:
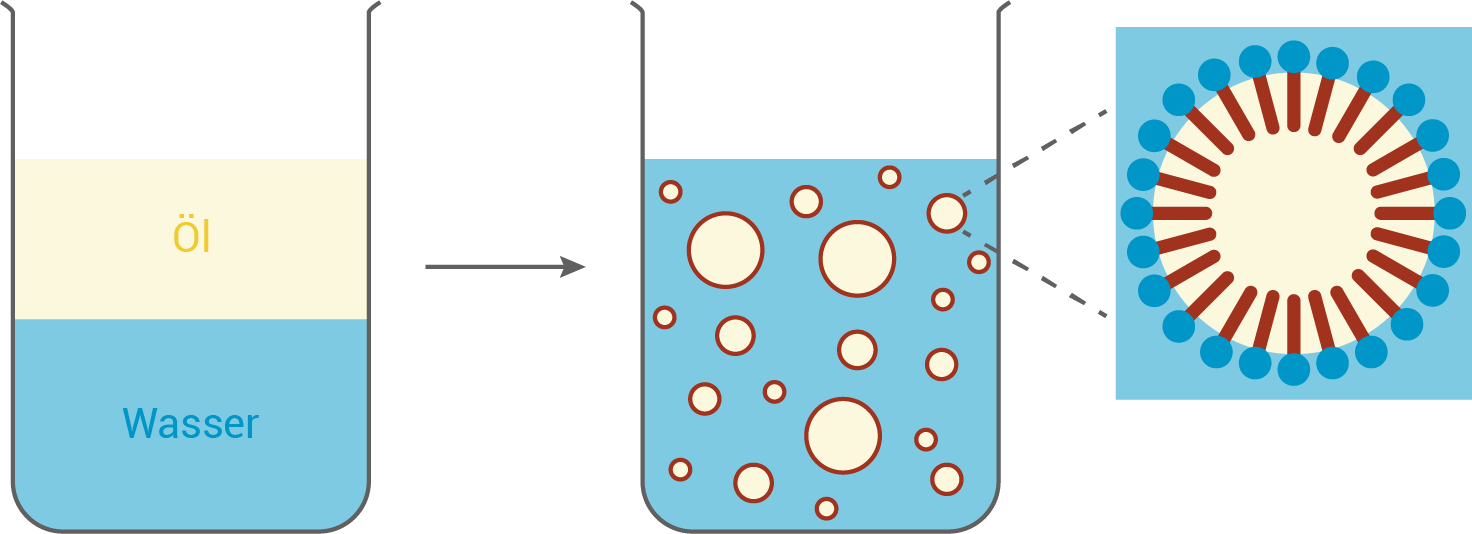 Diese Struktur reduziert die Grenzflächenspannung zwischen den beiden Phasen und verhindert die Entmischung. Die entstehende Stabilität ermöglicht die feine Verteilung der Öltröpfchen.
Diese Struktur reduziert die Grenzflächenspannung zwischen den beiden Phasen und verhindert die Entmischung. Die entstehende Stabilität ermöglicht die feine Verteilung der Öltröpfchen.


1.2
Beschreibung der Versuchsergebnisse
Die Versuchsergebnisse zeigen, dass der Anteil kleiner Öltröpfchen mit steigendem Saccharosestearat-Anteil signifikant zunimmt.
- Ansatz A (niedriger Saccharosestearat-Anteil): Die Öltröpfchen sind groß und ungleichmäßig verteilt. Die Emulsion erscheint instabil, mit sichtbarer Entmischung nach kurzer Zeit.
- Ansatz B (mittlerer Saccharosestearat-Anteil): Die Öltröpfchen sind kleiner und gleichmäßiger verteilt als in Ansatz A. Die Emulsion zeigt eine deutlich höhere Stabilität.
- Ansatz C (hoher Saccharosestearat-Anteil): Die Öltröpfchen sind sehr fein und gleichmäßig verteilt. Die Emulsion ist stabil, ohne sichtbare Entmischung, auch nach längerer Zeit.
1.3.1
Versuch zur Unterscheidung von Saccharosestearat und Maltosestearat
Ein geeigneter Versuch zur Unterscheidung der beiden Emulgatoren ist die Herstellung und Untersuchung der Stabilität von Emulsionen mit beiden Substanzen.
Dafür werden zunächst jeweils  Wasser mit
Wasser mit  Speiseöl gemischt. In eine Emulsion wird
Speiseöl gemischt. In eine Emulsion wird  Saccharosestearat und in die andere
Saccharosestearat und in die andere  Maltosestearat gegeben.
Maltosestearat gegeben.
Beide Mischungen werden anschließend in einem Becherglas mit einem Magnetrührer oder einem Stabmixer homogenisiert.
Die Stabilität der Emulsionen wird über einen Zeitraum von 24 Stunden beobachtet. Insbesondere wird geprüft, ob sich Öl und Wasser trennen (Entmischung) oder ob die Emulsion stabil bleibt. Auswertung: Eine stabilere Emulsion deutet auf einen effektiveren Emulgator hin.
Beide Mischungen werden anschließend in einem Becherglas mit einem Magnetrührer oder einem Stabmixer homogenisiert.
Die Stabilität der Emulsionen wird über einen Zeitraum von 24 Stunden beobachtet. Insbesondere wird geprüft, ob sich Öl und Wasser trennen (Entmischung) oder ob die Emulsion stabil bleibt. Auswertung: Eine stabilere Emulsion deutet auf einen effektiveren Emulgator hin.
1.3.2
Beurteilung der Einsatzmöglichkeiten von Saccharosestearat und Maltosestearat
In der Abbildung bleibt bei Emulsionen mit Saccharosestearat eine größere Menge des Öl-Wasser-Gemischs stabil. Dies zeigt, dass Saccharosestearat besser für die Herstellung stabiler Emulsionen geeignet ist, insbesondere für Anwendungen, die eine hohe Temperaturstabilität erfordern, wie bei warmen Cremes.
Bei Schäumen zeigt die Abbildung, dass mit Maltosestearat hergestellte Schäume ein größeres Volumen beibehalten. Dies deutet darauf hin, dass Maltosestearat besser für die Herstellung stabiler Schäume geeignet ist, da es die Oberflächenspannung stärker reduziert.
2.1
Farbe von Riboflavin und Farbe des emittierten Lichts unter UV-Licht
Riboflavin absorbiert Licht im Bereich von  was der Farbe Blau entspricht. Nach Tabelle 2 wird dadurch die Komplementärfarbe, Gelb, sichtbar. Riboflavin erscheint somit gelb.
was der Farbe Blau entspricht. Nach Tabelle 2 wird dadurch die Komplementärfarbe, Gelb, sichtbar. Riboflavin erscheint somit gelb.
Unter UV-Licht emittiert Riboflavin Licht im Bereich von was der Farbe Grün entspricht. Da man bei Riboflavin unter UV-Licht die tatsächliche Wellenlänge des emittierten Lichts sieht und nicht die Komplementärfarbe, leuchtet es grün.
was der Farbe Grün entspricht. Da man bei Riboflavin unter UV-Licht die tatsächliche Wellenlänge des emittierten Lichts sieht und nicht die Komplementärfarbe, leuchtet es grün.
Unter UV-Licht emittiert Riboflavin Licht im Bereich von
2.2.1
Teilgleichungen für die Reaktion von Riboflavin mit Dithionit-Ionen
2.2.2
Hypothese zum Wiederauftreten der Farbigkeit
Beim Stehenlassen an der Luft oxidiert Riboflavin in der Hydrochinon-Form  wieder zurück in die Chinon-Form
wieder zurück in die Chinon-Form  da Sauerstoff aus der Luft als Oxidationsmittel wirkt. Dadurch kehrt die gelbe Farbe zurück.
da Sauerstoff aus der Luft als Oxidationsmittel wirkt. Dadurch kehrt die gelbe Farbe zurück.