C2 Kohlenstoffdioxid als Rohstoff
Kohlenstoffdioxid ist in großen Mengen vorhanden und kann durch innovative Technik als Rohstoff nutzbar gemacht werden.
1
Eine vielversprechende Technologie zur Nutzung von Kohlenstoffdioxid ist der Sabatier-Prozess, bei dem Kohlenstoffdioxid zu Methan umgesetzt wird. Methan kann bei entsprechender Reinheit als SNG (= synthetisches Erdgas) in das Erdgasnetz eingespeist werden.





1.1
Erkläre anhand des Prinzips von Le Chatelier die Auswirkungen einer Druckerhöhung auf die Methan-Konzentration im Gleichgewicht.
(4 BE)
1.2
Beurteile auf Basis einer Berechnung, ob die beim Sabatier-Prozess ablaufende Reaktion bei einer Temperatur von 
 freiwillig abläuft.
freiwillig abläuft.
(5 BE)
1.3
In einer Versuchsreihe wird die Wirksamkeit zweier Katalysatoren für den SABATIER-Prozess untersucht und mit berechneten Werten zur Kohlenstoffdioxidumsetzung verglichen. Diese Werte können mit Hilfe von theoretischen Modellen bei verschiedenen Temperaturen im Gleichgewicht ermittelt werden. Für den Versuch bringt man bei verschiedenen Temperaturen das jeweils gleiche Eduktgemisch zur Reaktion. Nach jeweils der gleichen Zeit misst man die Umsetzungsrate von Kohlenstoffdioxid (Abb. 1).
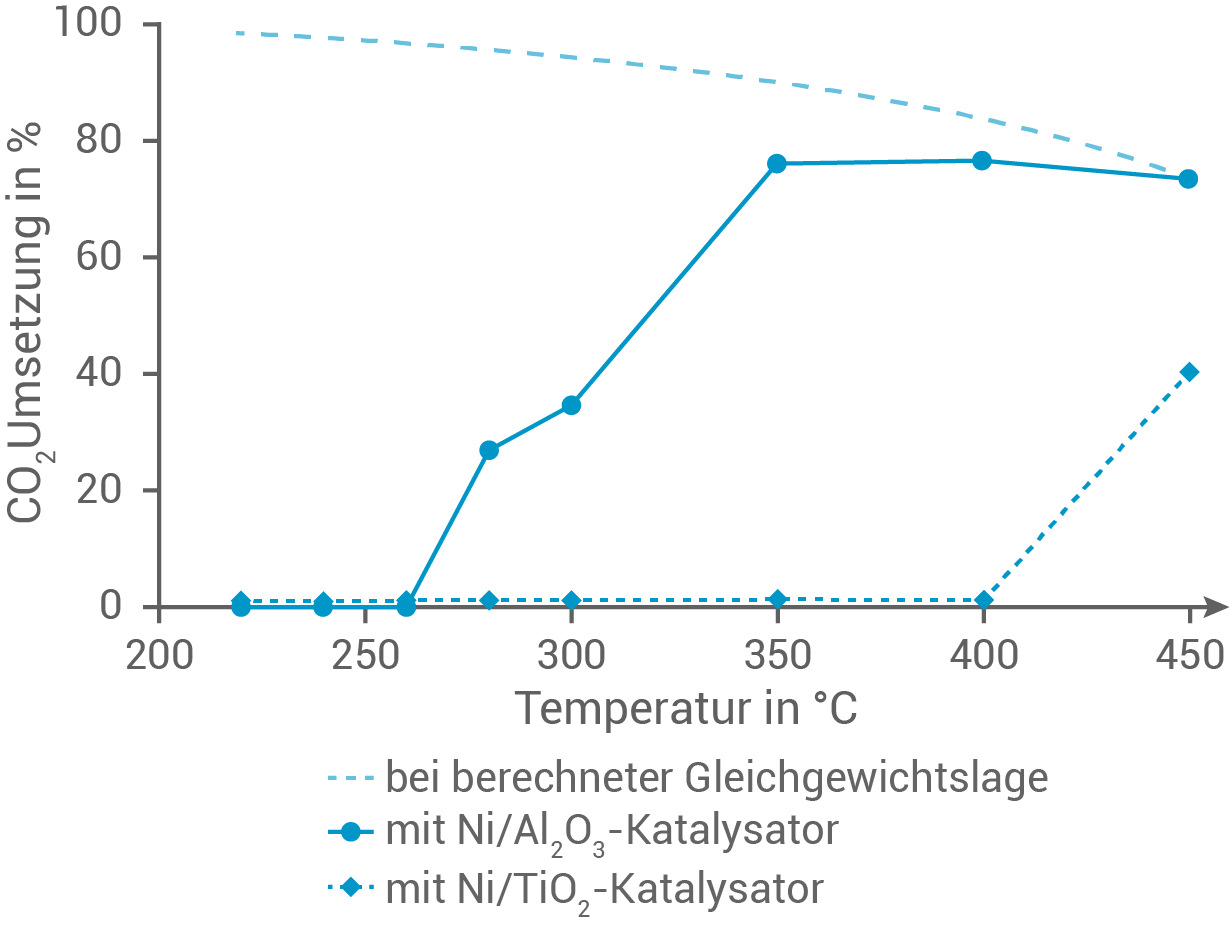

Abb. 1: Berechnete und unter Verwendung von verschiedenen Katalysatoren ermittelte Umsetzungsraten von Kohlenstoffdioxid
1.3.1
Begründe den in Abbildung 1 dargestellten Kurvenverlauf für die berechnete Gleichgewichtslage anhand des Prinzips von Le Chatelier. Erkläre den Kurvenverlauf unter Verwendung des  -Katalysators im Temperaturbereich zwischen
-Katalysators im Temperaturbereich zwischen  und
und  auf Grundlage energetischer Aspekte chemischer Reakionen.
auf Grundlage energetischer Aspekte chemischer Reakionen.
(7 BE)
1.3.2
Beurteile den Einsatz der beiden Katalysatoren für die Sabatier-Reaktion hinsichtlich des Aspekts Ressourceneinsparung.
(3 BE)
2
Kohlenstoffdioxid kann mit Epoxiden und Polyolen zu sog. Polyethercarbonat-polyolen (PEC-Polyolen) (Abb. 2) reagieren. Diese können mit Diisocyanaten zu verschiedenen Kunststoffen umgesetzt werden:
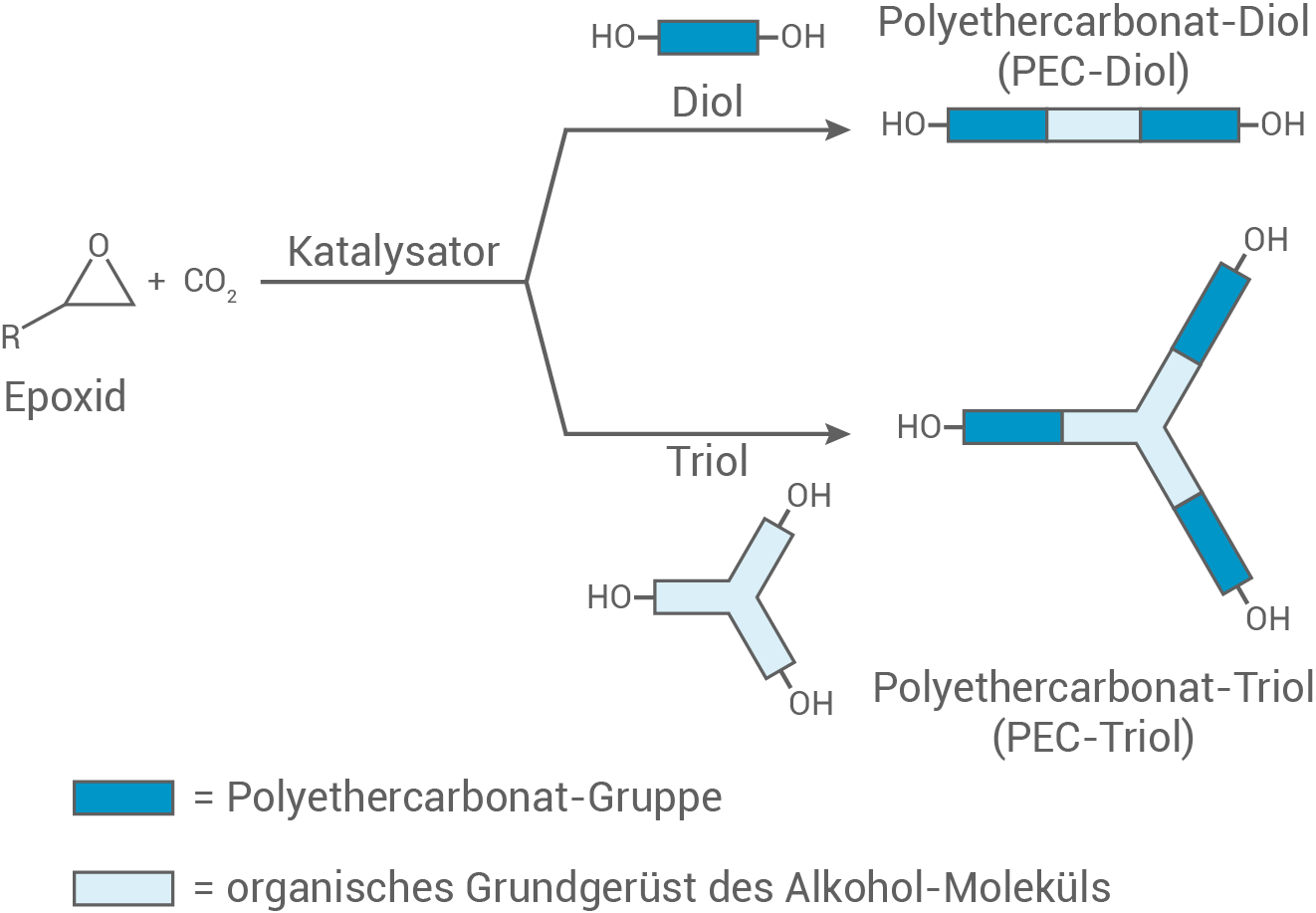
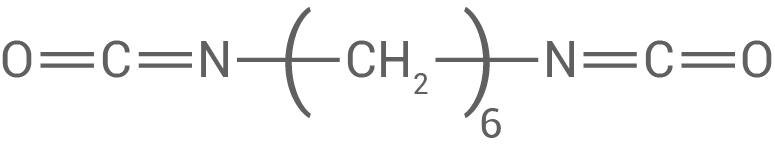

Abb. 2: Schema der Herstellung von Polyethercarbonatdiolen (PEC-Diolen) und Polyethercarbonattriolen (PEC-Triolen)

Abb. 3: Hexamethylendiisocyanat
2.1
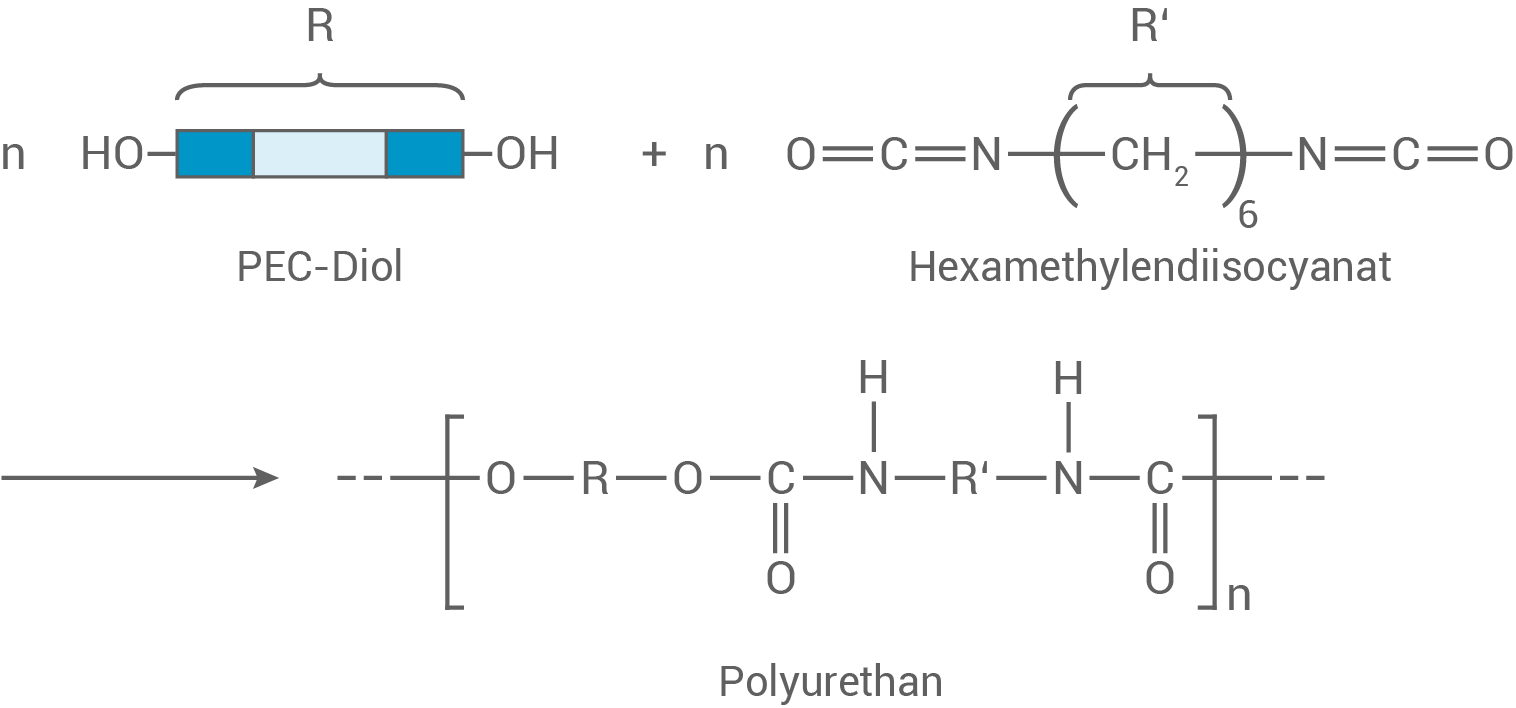
Formuliere ein Reaktionsschema für die Reaktion des PEC-Diols (Abb.2) mit Hexamethylendiisocyanat (Abb.3) zu einem Polymer und benenne den Typ der Polyreaktion.
(5 BE)
2.2
Die Eigenschaften der Kunststoffe können durch die Wahl der PEC-Polyol-Komponente beeinflusst werden.
Erkläre die unterschiedlichen thermischen Eigenschaften der Kunststoffe, die sich jeweils durch Reaktion von PEC-Diolen bzw. PEC-Triolen mit Hexamethylendiisocyanat herstellen lassen.
Erkläre die unterschiedlichen thermischen Eigenschaften der Kunststoffe, die sich jeweils durch Reaktion von PEC-Diolen bzw. PEC-Triolen mit Hexamethylendiisocyanat herstellen lassen.
(5 BE)
2.3
Als weitere Diisocyanate lassen sich sowohl Toluol-2,4-diisocyanat als auch Isophorondiisocyanat (IPDI) (Abb. 4) einsetzen.
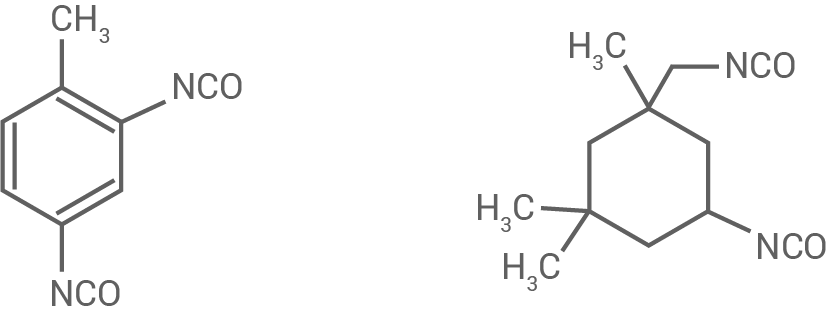

Abb. 4: Strukturformeln von Toluol-2,4-diisocyanat (links) und Isophorondiisocyanat (rechts)
(1 BE)
2.3.1
Vergleiche den räumlichen Bau der Ringsysteme dieser beiden Moleküle.
(5 BE)
2.3.2
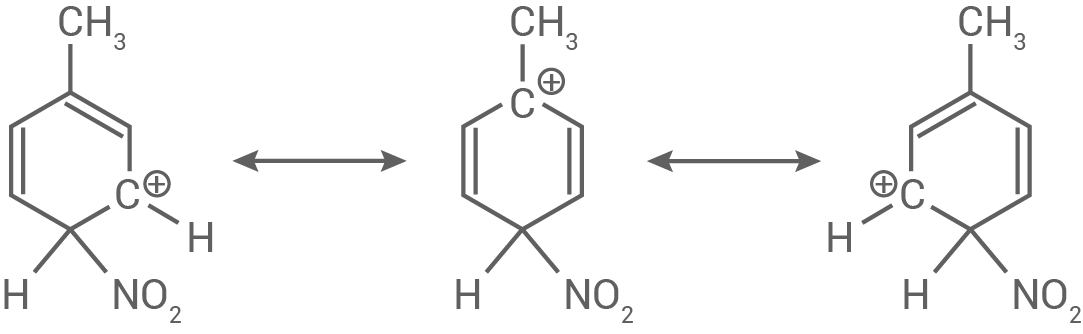
Toluol-2,4-diisocyanat lässt sich aus Toluol herstellen (Abb.5). Als reaktives Teilchen tritt dabei im ersten Reaktionsschritt das Nitronium-lon  auf.
auf.
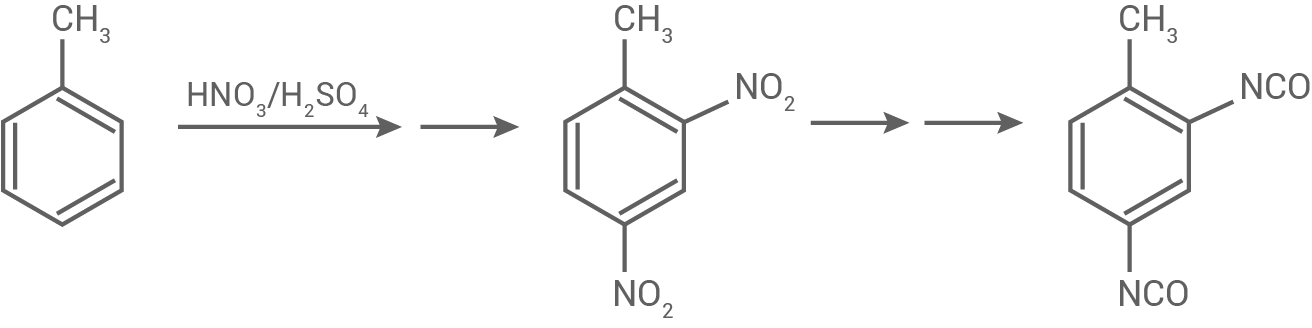 Formuliere den Mechanismus für die Reaktion von Toluol zu 4-Nitrotoluol. Stelle die Stabilisierung des Zwischenprodukts anhand mesomerer Grenzstrukturformeln dar.
Formuliere den Mechanismus für die Reaktion von Toluol zu 4-Nitrotoluol. Stelle die Stabilisierung des Zwischenprodukts anhand mesomerer Grenzstrukturformeln dar.

Abb. 5: Reaktionsschema zur Synthese von Tolùol-2,4-diisocyanat
(6 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Auswirkungen einer Druckerhöhung
Das Prinzip von Le Chatelier bzw. des kleinsten Zwangs besagt: wenn ein äußerer Einfluss auf ein System ausgeübt wird, das sich im chemischen Gleichgewicht befindet, verschiebt sich die Position des Gleichgewichts so, dass die Auswirkung des Einflusses minimiert wird.
Bei einer Druckerhöhung wird demnach die volumenverkleinernde Reaktion bevorzugt. Die Reaktionsgleichung zeigt auf der Eduktseite fünf und auf der Produktseite drei Gasteilchen. Die Hinreaktion ist folglich die volumenverkleinernde Reaktion, womit bei einer Druckerhöhung diese bevorzugt wird und die Ausbeute an Methan gesteigert wird.
Bei einer Druckerhöhung wird demnach die volumenverkleinernde Reaktion bevorzugt. Die Reaktionsgleichung zeigt auf der Eduktseite fünf und auf der Produktseite drei Gasteilchen. Die Hinreaktion ist folglich die volumenverkleinernde Reaktion, womit bei einer Druckerhöhung diese bevorzugt wird und die Ausbeute an Methan gesteigert wird.
1.2
Beurteilung des freiwilligen Ablaufs
Gegeben sind die Enthalpie und Entropie. Mithilfe der Gibbs-Helmholtz-Gleichung lässt sich damit die freie Enthalpie berechnen:
Die freie Enthalpie ergibt für den bei  ablaufenden Sabatier-Prozess einen negativen Wert. Damit ist die Hinreaktion bei entsprechender Temperatur exergonisch und läuft freiwillig ab.
ablaufenden Sabatier-Prozess einen negativen Wert. Damit ist die Hinreaktion bei entsprechender Temperatur exergonisch und läuft freiwillig ab.
1.3.1
Begründung des Kurvenverlaufs für die berechnete Gleichgewichtslage
Im Diagramm ist zu sehen, dass die  -Umsetzung der berechneten Gleichgewichtslage mit zunehmender Temperatur sinkt.
-Umsetzung der berechneten Gleichgewichtslage mit zunehmender Temperatur sinkt.
Nach dem Prinzip von Le Chatelier wird bei Temperaturerhöhung die endotherme Reaktion bevorzugt. Da die Hinreaktion des Sabatier-Prozesses exotherm verläuft, verschiebt sich die Gleichgewichtslage mit steigender Temperatur auf die Eduktseite. Folglich sinkt die -Umsetzung.
Erklärung des Kurvenverlaufs mit
-Umsetzung.
Erklärung des Kurvenverlaufs mit  -Katalysator
Damit Teilchen miteinander reagieren, müssen sie gemäß der Stoßtheorie mit einer bestimmten kinetischen Energie aufeinandertreffen. Mit steigender Temperatur nimmt auch die kinetische Energie der Teilchen zu.
-Katalysator
Damit Teilchen miteinander reagieren, müssen sie gemäß der Stoßtheorie mit einer bestimmten kinetischen Energie aufeinandertreffen. Mit steigender Temperatur nimmt auch die kinetische Energie der Teilchen zu.
Der Einsatz eines -Katalysators senkt die Aktivierungsenergie einer Reaktion. Unter
-Katalysators senkt die Aktivierungsenergie einer Reaktion. Unter  besitzen allerdings nicht genügend Teilchen die erforderliche kinetische Energie, weshalb die
besitzen allerdings nicht genügend Teilchen die erforderliche kinetische Energie, weshalb die  -Umsetzung praktisch null ist. Oberhalb davon steigt die
-Umsetzung praktisch null ist. Oberhalb davon steigt die  -Umsetzung bis ca.
-Umsetzung bis ca.  an, da hier die Aktivierungsenergie überschritten wird. Der Anstieg erfolgt exponentiell, gemäß der RGT-Regel.
an, da hier die Aktivierungsenergie überschritten wird. Der Anstieg erfolgt exponentiell, gemäß der RGT-Regel.
Nach dem Prinzip von Le Chatelier wird bei Temperaturerhöhung die endotherme Reaktion bevorzugt. Da die Hinreaktion des Sabatier-Prozesses exotherm verläuft, verschiebt sich die Gleichgewichtslage mit steigender Temperatur auf die Eduktseite. Folglich sinkt die
Der Einsatz eines
1.3.2
Beurteilung der beiden Katalysatoren
In Bezug auf die Ressourceneinsparung ist ein  -Katalysator für das Sabatier-Verfahren besser geeignet als ein
-Katalysator für das Sabatier-Verfahren besser geeignet als ein  -Katalysator. Dies liegt daran, dass die
-Katalysator. Dies liegt daran, dass die  -Umsetzung nicht nur bei niedrigeren Temperaturen beginnt, sondern auch höhere Konversionsraten erreicht. Dadurch wird weniger Energie benötigt, um das Reaktionsgemisch zu erwärmen, was wiederum die Einsparung fossiler Brennstoffe ermöglicht.
-Umsetzung nicht nur bei niedrigeren Temperaturen beginnt, sondern auch höhere Konversionsraten erreicht. Dadurch wird weniger Energie benötigt, um das Reaktionsgemisch zu erwärmen, was wiederum die Einsparung fossiler Brennstoffe ermöglicht.
2.1
Reaktionsschema für PEC-Diol mit Hexamethylendiisocyanat
PEC-Diol und Hexamethylendiisocyanat reagieren zu einem Polyurethan-Kunststoff. Die Reaktion folgt dabei dem Mechanismus einer Polyaddition:

2.2
Erklärung der unterschiedlichen thermischen Eigenschaften
PEC-Diole bilden lineare Makromoleküle und weisen durch ihre Struktur bei Erwärmung thermoplastische Eigenschaften auf. Je höher die Temperatur, desto mehr Bindungen werden zwischen den Polymerketten überwunden. Dies bewirkt, dass sie sich gegeneinander verschieben lassen und der Kunststoff sich verformen lässt.
Im Gegensatz dazu führt der Einsatz von PEC-Triolen zur Bildung eines dreidimensionalen Netzwerks aus quervernetzten, verbundenen Molekülketten. Dadurch wird die Beweglichkeit der Polymerketten untereinander eingeschränkt, und bei höheren Temperaturen beginnen sie sich zu zersetzen. Dieses Verhalten ist charakteristisch für einen Duroplasten.
2.3.1
Vergleich des räumlichen Baus der Ringsysteme
| Toluol-2,4-diisocyanat | Isophorondiisocyanat |
|---|---|
| sechseckiges Ringsystem | sechseckiges Ringsystem |
| drei konjugierte Doppelbindungen |
|
| alle |
tetraedrische Bindungsumgebung (nicht in einer Ebene) |
| Bindungswinkel |
Bindungswinkel |
| Elektronen aus den Doppelbindungen über alle |
Bindungslängen entsprechen normalen Einfachbindungen |
2.3.2
Reaktionsmechanismus von Toluol
Wenn Toluol zu 4-Nitrotoluol reagiert, findet eine Nitrierung statt. Die Reaktion folgt dabei dem Mechanismus einer elektrophilen Substitution am aromatischen Ringsystem:
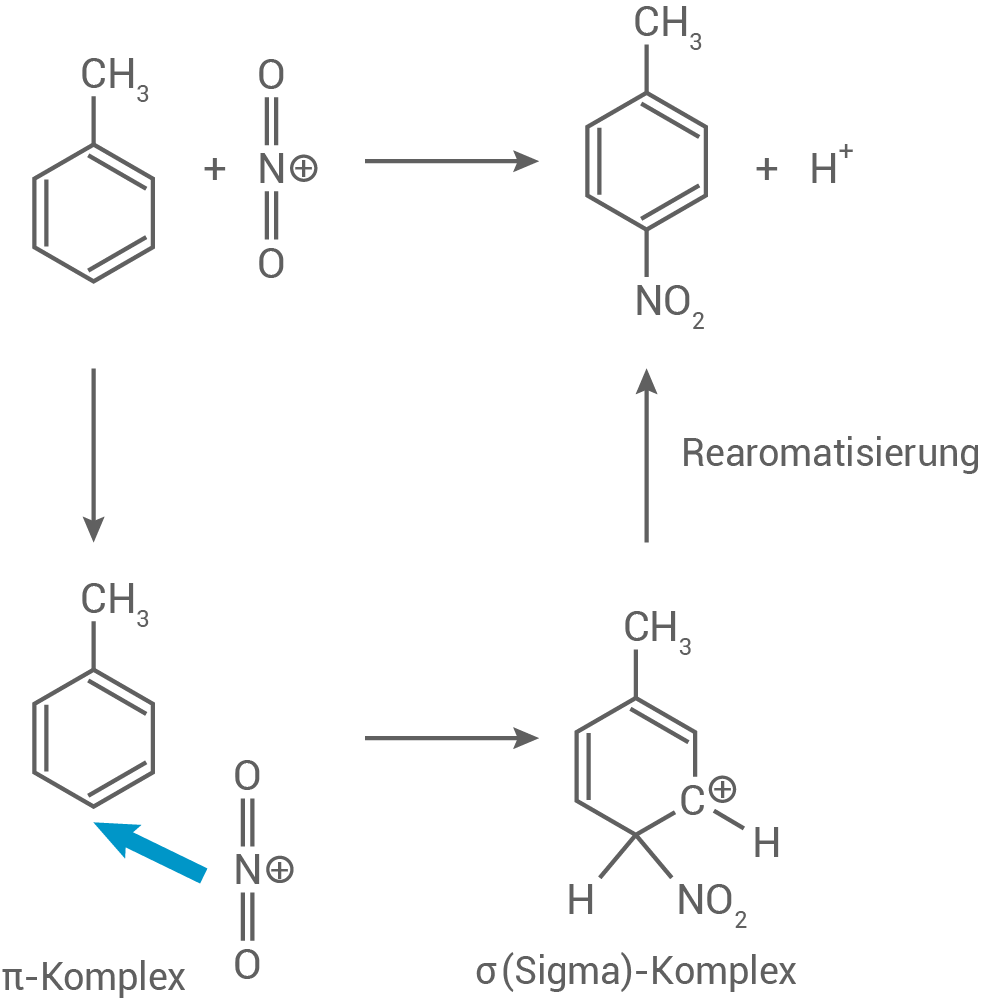 Stabilisierung des Zwischenprodukts
Die Stabilisierung des Zwischenprodukts vom Sigma-Komplex erfolgt durch Mesomere. Diese Mesomeriestabilsierung zeigt sich in folgenden Grenzstrukturen:
Stabilisierung des Zwischenprodukts
Die Stabilisierung des Zwischenprodukts vom Sigma-Komplex erfolgt durch Mesomere. Diese Mesomeriestabilsierung zeigt sich in folgenden Grenzstrukturen: