C2 Süßes Hefegebäck
Bäckereien bieten eine Vielzahl an süßen Hefegebäckstücken an. Die eingesetzte Hefe sorgt durch Produktion von Kohlenstoffdioxid für das Aufgehen des Teigs vor dem Backen.
1
Die Hefe bildet mithilfe verschiedener Enzyme aus Glucose durch alkoholische Gärung die Produkte Ethanol und Kohlenstoffdioxid. Alternativ kann zur Teiglockerung auch Backpulver eingesetzt werden, das überwiegend Natriumhydrogencarbonat  enthält. Im feuchten Teig findet dabei folgende Reaktion statt:
enthält. Im feuchten Teig findet dabei folgende Reaktion statt:



1.1
Formuliere die Reaktionsgleichung für die alkoholische Gärung.
Leite für die beiden oben genannten Prozesse der Teiglockerung ab, ob es sich um Redoxreaktionen handelt.
Leite für die beiden oben genannten Prozesse der Teiglockerung ab, ob es sich um Redoxreaktionen handelt.
(6 BE)
1.2
In einer Versuchsreihe wird Teig mit Hefe als Treibmittel, in einer anderen Versuchsreihe Teig mit Backpulver als Treibmittel angesetzt. Es werden beide Teigsorten in gleich größe Proben aufgeteilt. Diese werden bei verschiedenen Temperaturen aufbewahrt. Nach einer bestimmten Zeit wird jeweils die Volumenzunahme der Proben bestimmt. Das Diagramm in Abbildung 1 zeigt mögliche Versuchsergebnisse:
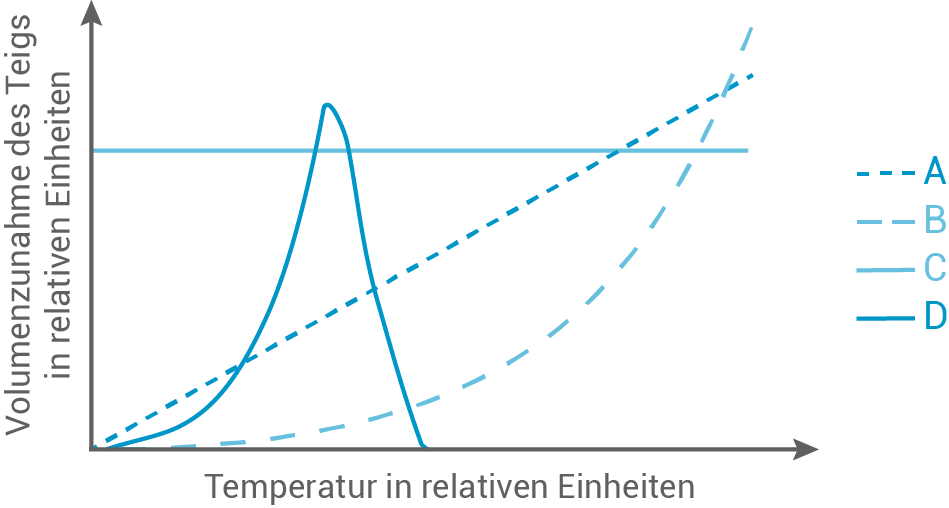 Ordne die beiden Versuchsreihen jeweils begründet einer der Kurven A, B, C oder D zu.
Ordne die beiden Versuchsreihen jeweils begründet einer der Kurven A, B, C oder D zu.

Abb. 1: Mögliche Versuchsergebnisse beim Aufgehen von Teig mit Hefe bzw. Backpulver
(6 BE)
2
Zu den Enzymen der Hefen gehören Peroxidasen, die reaktive Sauerstoffverbindungen unschädlich machen.
2.1
Die Katalase ist eine Peroxidase. Sie katalysiert die Reaktion von Wasserstoffperoxid zu Sauerstoff und Wasser.
In einer Versuchsreihe werden verschiedene Reagenzgläser jeweils mit Katalase und unterschiedlichen Mengen an Wasserstoffperoxid-Lösung und Wasser bestückt (Tab. 1). Nach einer bestimmten Zeit wird das Volumen an gebildetem Sauerstoff mittels der Höhe der neu entstandenen Schaumkrone abgeschätzt (Abb. 2):
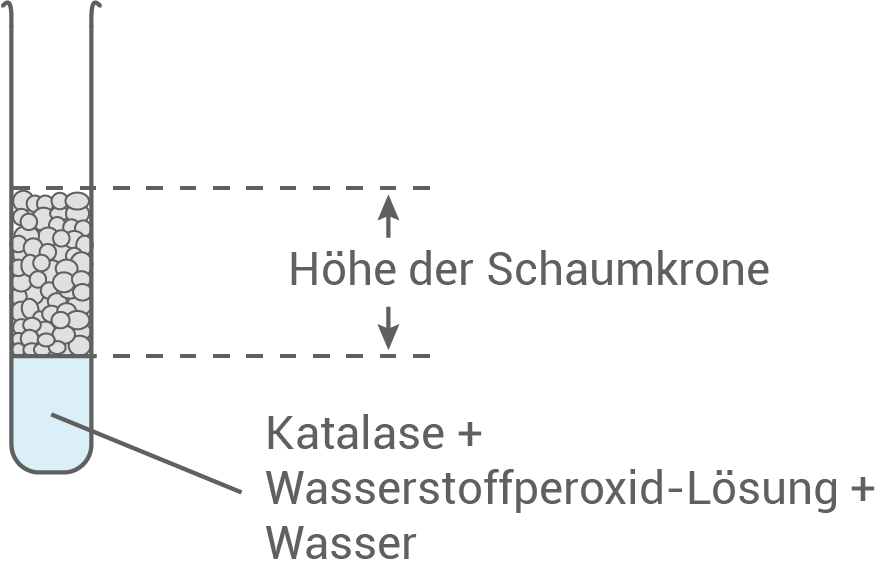
Formuliere eine naturwissenschaftliche Fragestellung, die man mit diesem Experiment prüfen kann. Erkläre die Messergebnisse anhand einer Modellvorstellung.
In einer Versuchsreihe werden verschiedene Reagenzgläser jeweils mit Katalase und unterschiedlichen Mengen an Wasserstoffperoxid-Lösung und Wasser bestückt (Tab. 1). Nach einer bestimmten Zeit wird das Volumen an gebildetem Sauerstoff mittels der Höhe der neu entstandenen Schaumkrone abgeschätzt (Abb. 2):

Abb. 2: Schematische Darstellung des Versuchs
| RG | Katalase-Lösung in |
H2O2-Lösung in |
dest. Wasser in |
Höhe der Schaum-krone in |
|---|---|---|---|---|
Tab. 1: Versuchsreihe und Messergebnisse
(7 BE)
2.2
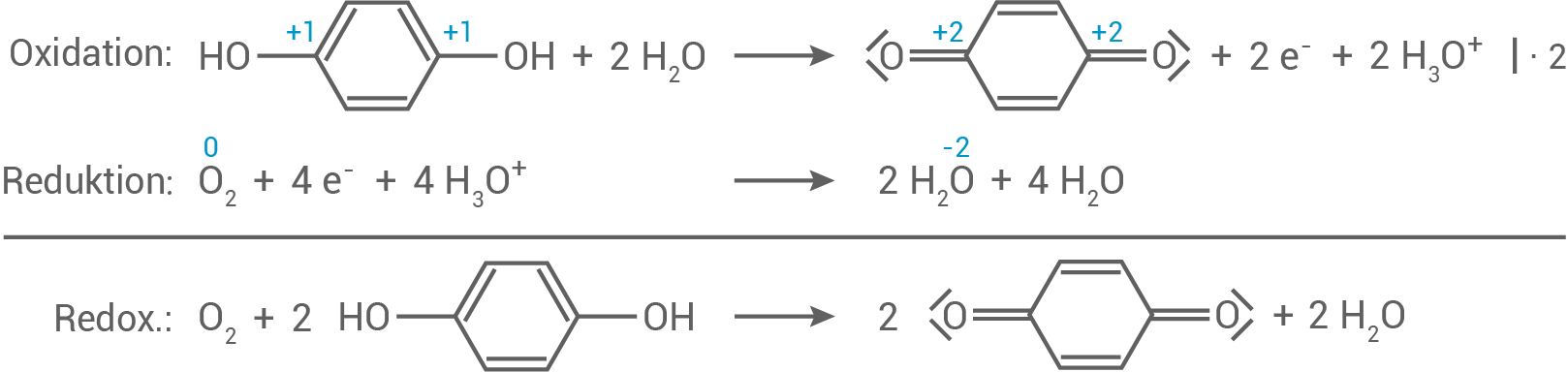
Eine andere Peroxidase katalysiert die Reaktion von Hydrochinon (1,4-Dihydroxybenzol) mit Sauerstoff zu 1,4-Benzochinon (Abb. 3) und Wasser.
 Formuliere die Teilgleichungen für diese Redoxreaktion in schwach saurer Lösung.
Formuliere die Teilgleichungen für diese Redoxreaktion in schwach saurer Lösung.

Abb. 3: Strukturformel von 1,4-Benzochinon
(5 BE)
3
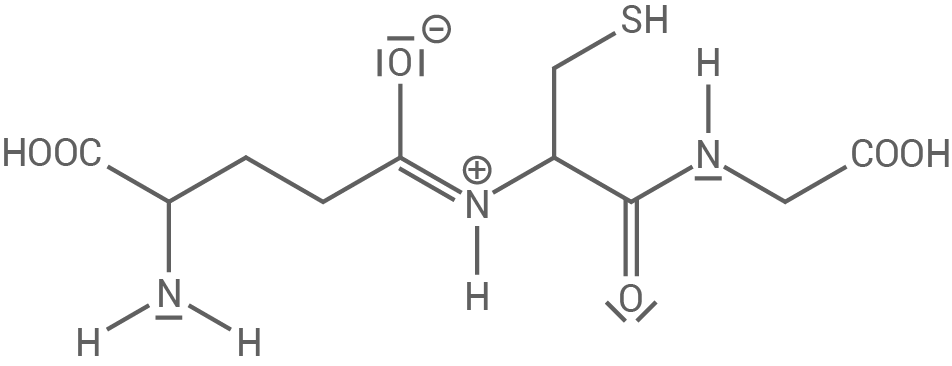
Das Tripeptid Glutathion (Abb. 4) dient vielen Organismen, unter anderem Weizen, als Speicherstoff für bestimmte Aminosäuren (Tab. 2). So ist auch in Backwaren aus Weizenmehl Glutathion vorhanden.
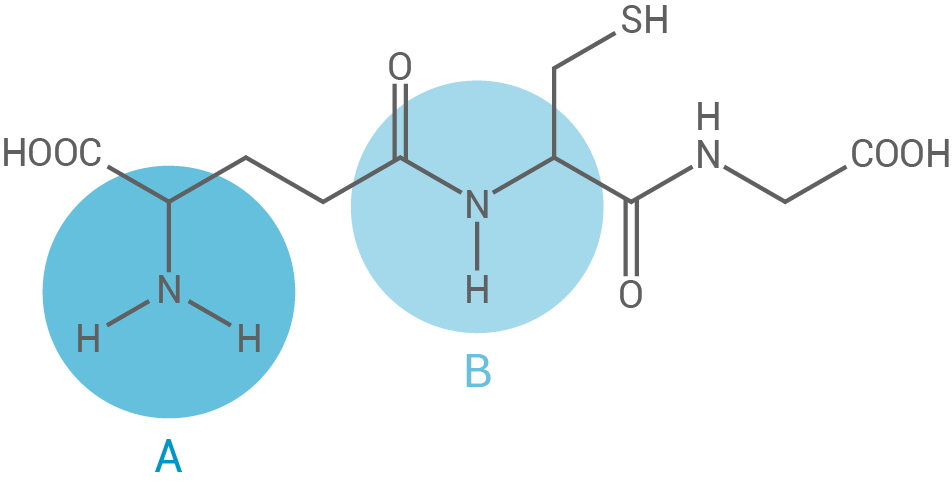

Abb. 4: Strukturformel von Glutathion
| systematischer Name | Trivialname | Iso-elektrischer Punkt |
|---|---|---|
| 2-Amino-propansäure | Alanin | |
| 2-Amino-3-phenyl-propansäure | Phenylalanin | |
| 2-Amino-pentandisäure | Glutaminsäure | |
| 2-Amino-3-methyl-pentansäure | Isoleucin | |
| 2,6-Diamino-hexansäure | Lysin | |
| 2-Amino-3-sulfanyl-propansäure | Cystein | |
| 2-Amino-ehtansäure | Glycin |
Tab. 2: Auswahl einiger biogener Aminosäuren
3.1
Erkläre den unterschiedlichen räumlichen Bau der beiden markierten Molekülabschnitte A und B im Glutathion-Molekül unter Verwendung einer weiteren Grenzstrukturformel.
(6 BE)
3.2
Glutathion wird vollständig hydrolysiert und das entstehende Aminosäuregemisch einer Elektrophorese bei pH-Wert  unterzogen. Das Ergebnis dieser Elektrophorese ist in Abbildung 5 dargestellt:
unterzogen. Das Ergebnis dieser Elektrophorese ist in Abbildung 5 dargestellt:
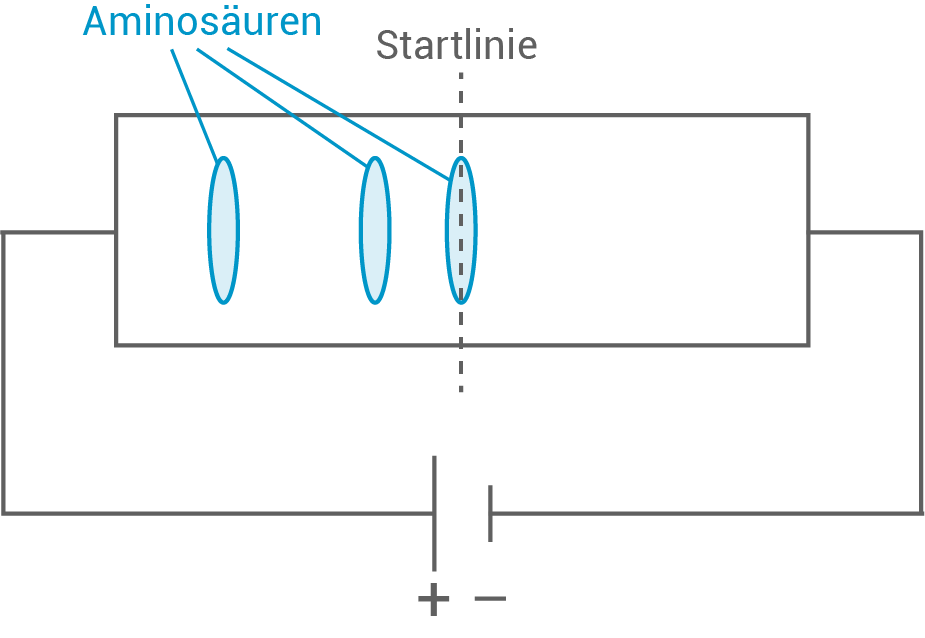 Identifiziere die Aminosäuren in Abbildung 5 mithilfe von Tabelle 2 und Abbildung 4. Erläutere deren Wanderungsverhalten unter Verwendung geeigneter Strukturformeln.
Identifiziere die Aminosäuren in Abbildung 5 mithilfe von Tabelle 2 und Abbildung 4. Erläutere deren Wanderungsverhalten unter Verwendung geeigneter Strukturformeln.

Abb. 5: Ergebnis der Elektrophorese des Aminosäuregemischs
(10 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Reaktionsgleichung für die alkoholische Gärung


 Die Veränderung der Oxidationszahlen zeigt, dass bei der alkoholischen Gärung ein Elektronenaustausch und somit eine Redoxreaktion stattfindet.
Im Gegensatz dazu ist die Reaktion von Natriumhydrogencarbonat keine Redoxreaktion, sondern eine Säure-Base-Reaktion, da sich die Oxidationszahlen bei keiner der beteiligten Atomsorten ändern.
Die Veränderung der Oxidationszahlen zeigt, dass bei der alkoholischen Gärung ein Elektronenaustausch und somit eine Redoxreaktion stattfindet.
Im Gegensatz dazu ist die Reaktion von Natriumhydrogencarbonat keine Redoxreaktion, sondern eine Säure-Base-Reaktion, da sich die Oxidationszahlen bei keiner der beteiligten Atomsorten ändern.
1.2
Zuordnung der Versuchsreihen
Die Versuchsreihe mit Backpulver als Treibmittel kann der Kurve B zugeordnet werden. Der Kurvenverlauf zeigt hier eine kontinuierliche Verdopplung der Reaktionsgeschwindigkeit bei einer Temperaturerhöhung von  welche der RGT-Regel entspricht und zeigt zudem exponentielles Wachstum.
Die Versuchsreihe mit dem Hefeteig entspricht der Kurve D. Die Reaktionen in den Hefezellen sind enzymatisch katalysiert, wodurch sich eine Optimumskurve ergibt, bei der die Enzyme bei einer bestimmten Temperatur die Substratmoleküle am effizientesten umsetzen. Oberhalb dieser Temperatur denaturieren die Enzyme, wodurch die Reaktionsgeschwindigkeit abnimmt.
welche der RGT-Regel entspricht und zeigt zudem exponentielles Wachstum.
Die Versuchsreihe mit dem Hefeteig entspricht der Kurve D. Die Reaktionen in den Hefezellen sind enzymatisch katalysiert, wodurch sich eine Optimumskurve ergibt, bei der die Enzyme bei einer bestimmten Temperatur die Substratmoleküle am effizientesten umsetzen. Oberhalb dieser Temperatur denaturieren die Enzyme, wodurch die Reaktionsgeschwindigkeit abnimmt.
2.1
Formulierung einer naturwissenschaftlichen Fragestellung
Mit dem Experiment lässt sich folgender Zusammenhang überprüfen:
„Wie beeinflusst die Konzentration einer Wasserstoffperoxid-Lösung die enzymatische Sauerstoffproduktion?“
Erklärung der Messergebnisse
Die Messergebnisse zeigen einen klaren Zusammenhang: Mit steigender Konzentration der Wasserstoffperoxid-Lösung steigt auch die Menge des in derselben Zeit produzierten Sauerstoffs.
Dieses Phänomen lässt sich durch die Stoßtheorie erklären. Demnach müssen Eduktteilchen (in diesem Fall Wasserstoffperoxid-Moleküle) mit Enzymmolekülen (z.B. Katalase) in Kontakt kommen, damit eine chemische Reaktion stattfinden kann. Je höher die Konzentration der Eduktteilchen, desto größer ist die Wahrscheinlichkeit, dass sie mit einem Enzymmolekül kollidieren. Dementsprechend steigt die Reaktionsgeschwindigkeit und somit auch die Sauerstoffproduktion mit zunehmender Wasserstoffperoxid-Konzentration.
Dieses Phänomen lässt sich durch die Stoßtheorie erklären. Demnach müssen Eduktteilchen (in diesem Fall Wasserstoffperoxid-Moleküle) mit Enzymmolekülen (z.B. Katalase) in Kontakt kommen, damit eine chemische Reaktion stattfinden kann. Je höher die Konzentration der Eduktteilchen, desto größer ist die Wahrscheinlichkeit, dass sie mit einem Enzymmolekül kollidieren. Dementsprechend steigt die Reaktionsgeschwindigkeit und somit auch die Sauerstoffproduktion mit zunehmender Wasserstoffperoxid-Konzentration.
2.2
Formulierung der Teilgleichungen

3.1
Erklärung des unterschiedlichen räumlichen Baus
Molekülteil A besitzt eine Amino-Gruppe  die an ein zentrales Stickstoffatom gebunden ist. Die beiden Wasserstoffatome und das Kohlenstoffatom sind pyramidal um das
die an ein zentrales Stickstoffatom gebunden ist. Die beiden Wasserstoffatome und das Kohlenstoffatom sind pyramidal um das  -Atom angeordnet. Diese Anordnung ist Folge des freien Elektronenpaars am
-Atom angeordnet. Diese Anordnung ist Folge des freien Elektronenpaars am  -Atom, welches im Vergleich zu einem einfach gebundenen Substituenten mehr Platz benötigt. Um die Abstoßung zwischen den Elektronenpaaren zu minimieren, nehmen die Bindungswinkel zwischen Stickstoff und den anderen Atomen etwas kleinere Werte an als in einem Tetraeder.
Molekülteil B hingegen verfügt über eine Säureamid-Gruppe (Peptidbindung). In dieser Struktur liegen alle beteiligten Atome in einer Ebene, was zu einer planaren Anordnung führt. Das freie Elektronenpaar am
-Atom, welches im Vergleich zu einem einfach gebundenen Substituenten mehr Platz benötigt. Um die Abstoßung zwischen den Elektronenpaaren zu minimieren, nehmen die Bindungswinkel zwischen Stickstoff und den anderen Atomen etwas kleinere Werte an als in einem Tetraeder.
Molekülteil B hingegen verfügt über eine Säureamid-Gruppe (Peptidbindung). In dieser Struktur liegen alle beteiligten Atome in einer Ebene, was zu einer planaren Anordnung führt. Das freie Elektronenpaar am  -Atom und eines der beiden Elektronenpaare aus der Doppelbindung zum
-Atom und eines der beiden Elektronenpaare aus der Doppelbindung zum  -Atom sind delokalisiert. Dies führt zu einer Stabilisierung der Struktur und einem partiellen Doppelbindungscharakter zwischen
-Atom sind delokalisiert. Dies führt zu einer Stabilisierung der Struktur und einem partiellen Doppelbindungscharakter zwischen  und
und  Weitere Grenzstrukturformel der Peptidbindung im Glutathion-Molekül
Weitere Grenzstrukturformel der Peptidbindung im Glutathion-Molekül

3.2
Identifizierung der Aminosäuren und Erläuterung des Wanderungsverhaltens
Die Wanderungsgeschwindigkeit von Aminosäuren im elektrischen Feld ist proportional zu ihrer Ladung. Je stärker die Ladung, desto schneller wandert die Aminosäure. Daher ist die elektrophoretische Beweglichkeit von Aminosäuren vom pH-Wert abhängig.
| kein Wanderungsverhalten | |
|---|---|
| Da Glycin bei |
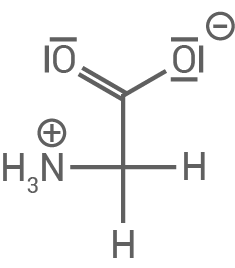
Glycin
|
| mittleres Wanderungsverhalten | |
| Cystein liegt hier in anionischer Form vor, da der IEP bei |
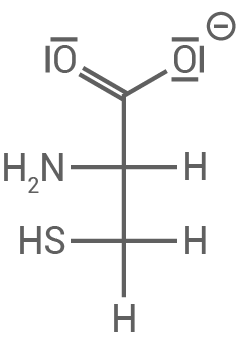
Cystein
|
| starkes Wanderungsverhalten | |
| Glutaminsäure liegt aufgrund der Deprotonierung beider Carboxylgruppen zum Teil als zweifach negativ geladenes Anion vor. Aufgrund des größten IEP-Unterschieds von |
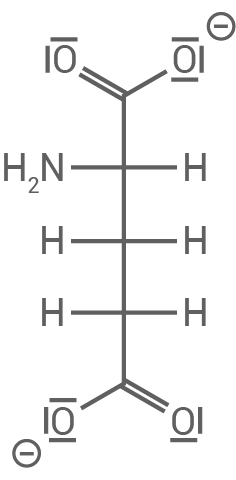
Glutaminsäure
|