B1 Photosynthese
Der bedeutendste biochemische Prozess auf der Erde ist die Photosynthese, bei der Lichtenergie in chemische Energie umgewandelt wird.
1
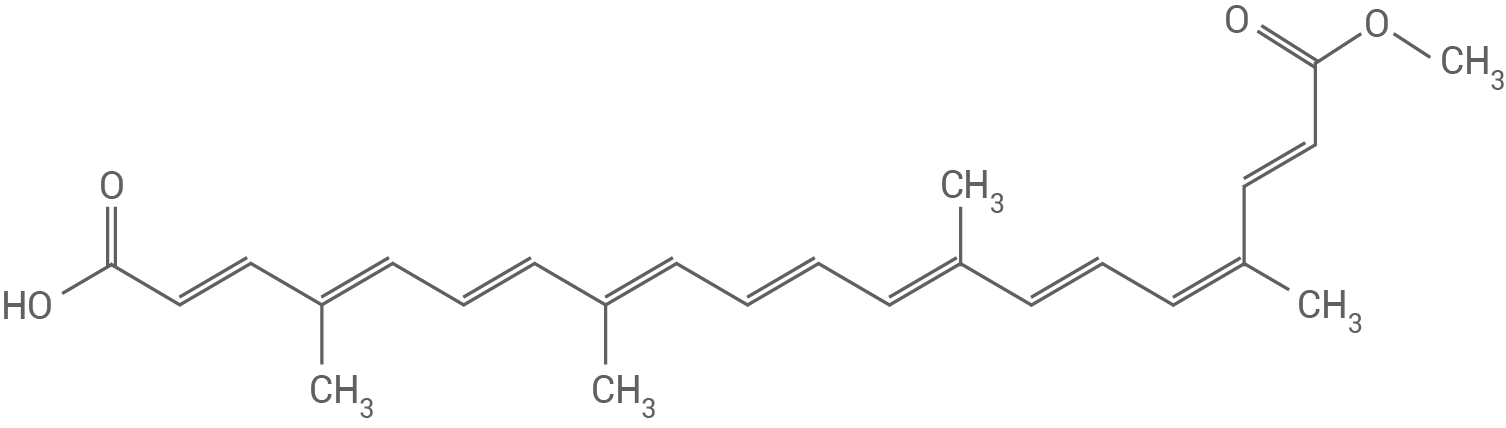
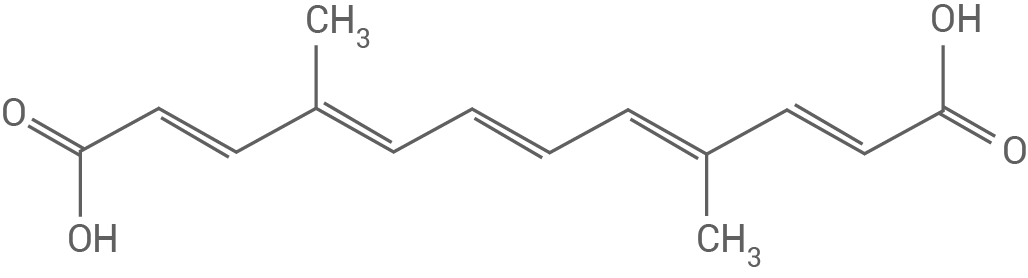
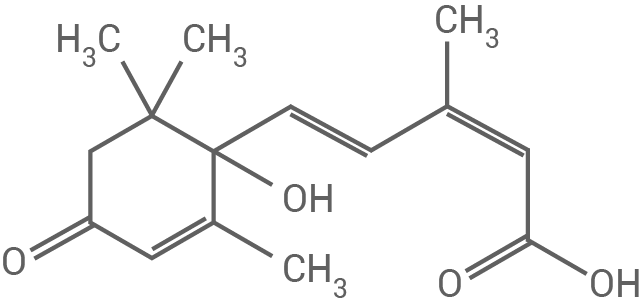
Bei der Photosynthese sind neben Chlorophyllen auch Carotinoide für die Absorption von Licht verantwortlich. Durch enzymatische Spaltung entstehen aus Carotinoiden die sogenannten Apocarotinoide. Tabelle 1 zeigt die Namen und Strukturformeln ausgewählter Apocarotinoide:
| Strukturformel und Name |
|---|
|
|
|
Tab. 1: Strukturformeln und Namen ausgewählter Apocarotinoide
1.1
Apocarotinoide lassen sich mit Heptan aus Pflanzen extrahieren. Erkläre die Eignung von Heptan als Lösungsmittel für die Extraktion der angegebenen Apocarotinoide.
(4 BE)
1.2
Eines der oben dargestellten Apocarotinoide A bis C erscheint rot, eines gelb und eines farblos.
Ordne den in Tabelle 1 dargestellten Apocarotinoiden A bis C mithilfe von Tabelle 2 die jeweilige Farbe zu und begründe deine Zuordnung.
| Wellenlänge des absorbierten Lichts in |
Farbe des absorbierten Lichts | Komplementär- farbe |
|---|---|---|
| Violett | Gelb | |
| Blau | Orange | |
| Blaugrün | Rot | |
| Gelbgrün | Purpur | |
| Gelb | Violett | |
| Orange | Blau | |
| Rot | Blaugrün |
Tab. 2: Wellenlängen und Farben des absorbierten Lichts sowie deren Komplementärfarben
(8 BE)
1.3
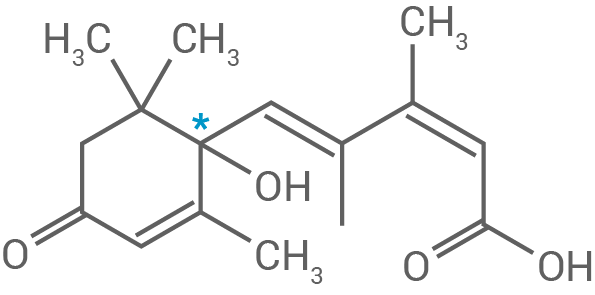
Beurteile die optische Aktivität der Verbindungen A, B und C.
(5 BE)
1.4
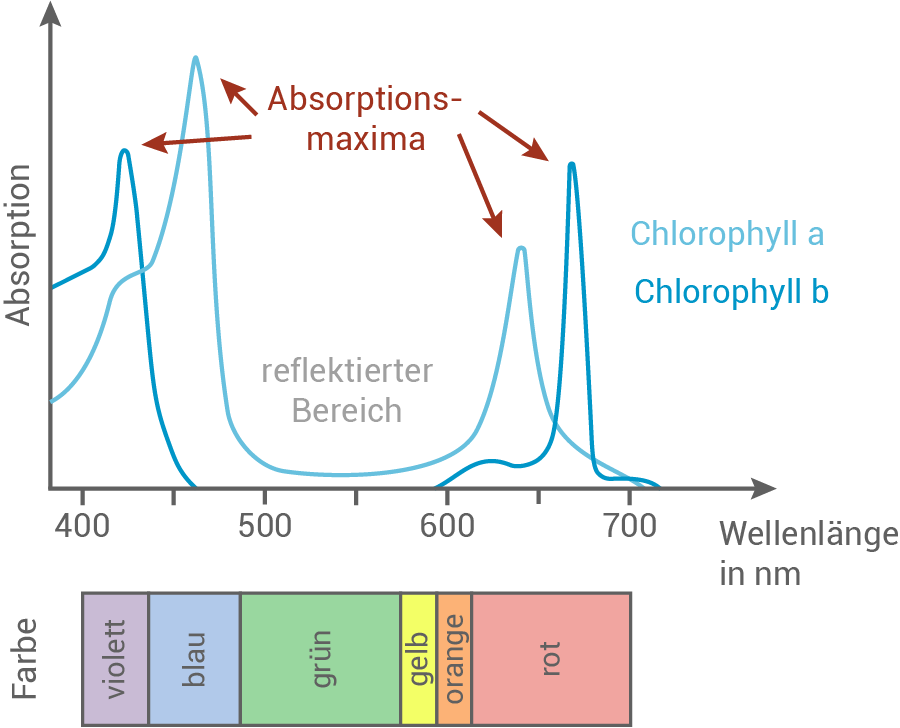
Chlorophylle sind grüne Farbstoffe. Erkläre den Farbeindruck anhand einer Skizze des Absorptionsspektrums eines Chlorophylls.
(6 BE)
2
Cyanobakterien wie Spirulina sind in der Lage, Photosynthese zu betreiben. Aus diesen Bakterien lässt sich Rhamnansulfat (Abb.1) gewinnen, das möglicherweise zur Therapie von viralen Erkrankungen genutzt werden kann:
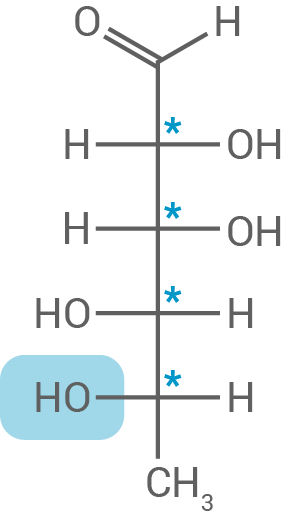
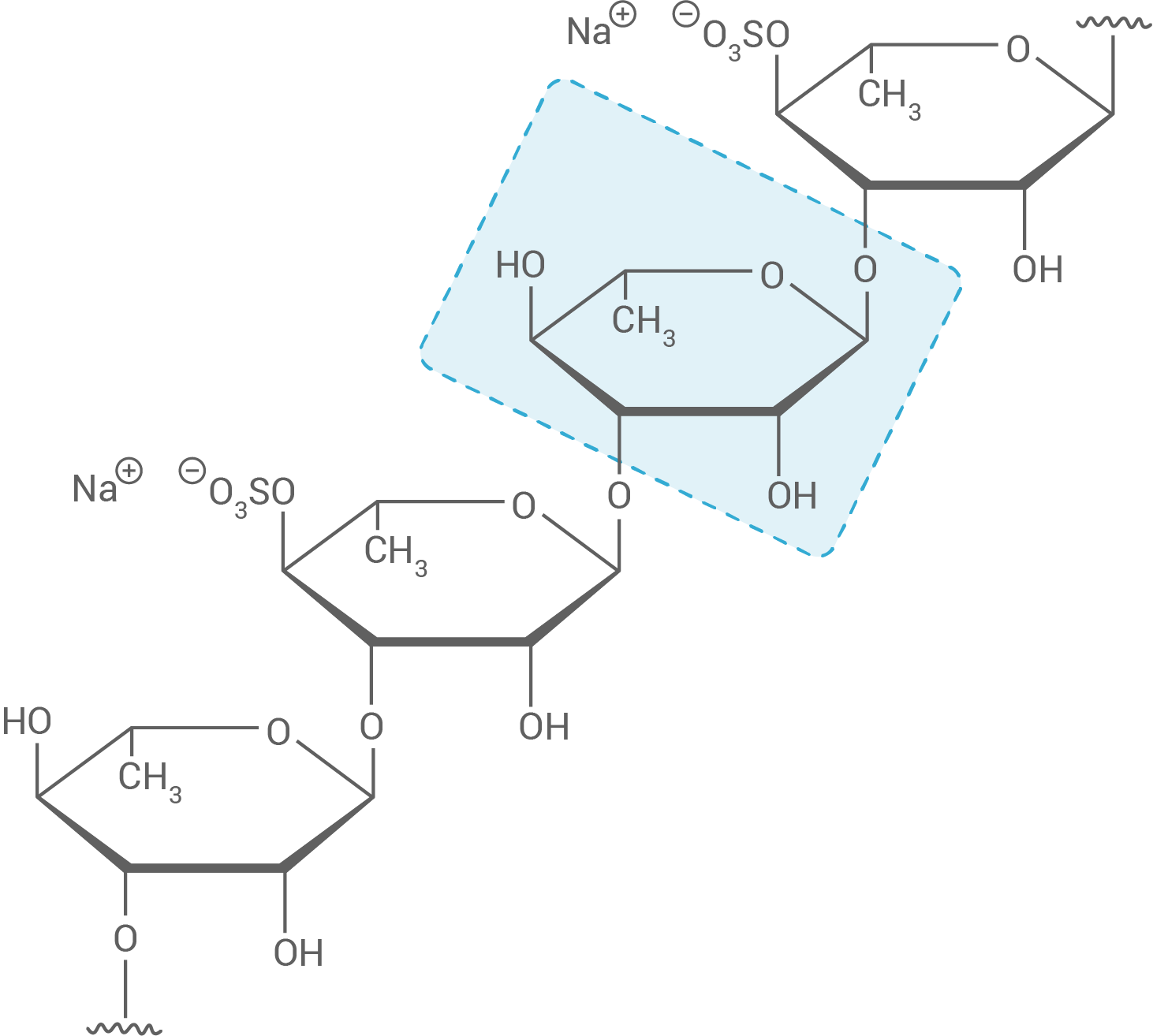 Zeichnen Sie den in Abbildung 1 markierten Monosaccharid-Baustein in der FISCHER-Projektion und leiten Sie ab, ob es sich um die D- oder L-Form handelt.
Zeichnen Sie den in Abbildung 1 markierten Monosaccharid-Baustein in der FISCHER-Projektion und leiten Sie ab, ob es sich um die D- oder L-Form handelt.

Abb. 1: Strukturformelausschnitt aus einem Rhamnansulfat-Molekül
(5 BE)
3
Bei der Photosynthese werden Elektronen schrittweise von einem Reduktionsmittel auf das jeweils nächste übertragen. Folgende hypothetische Reaktionswege sind prinzipiell denkbar (Abb. 2 und 3):
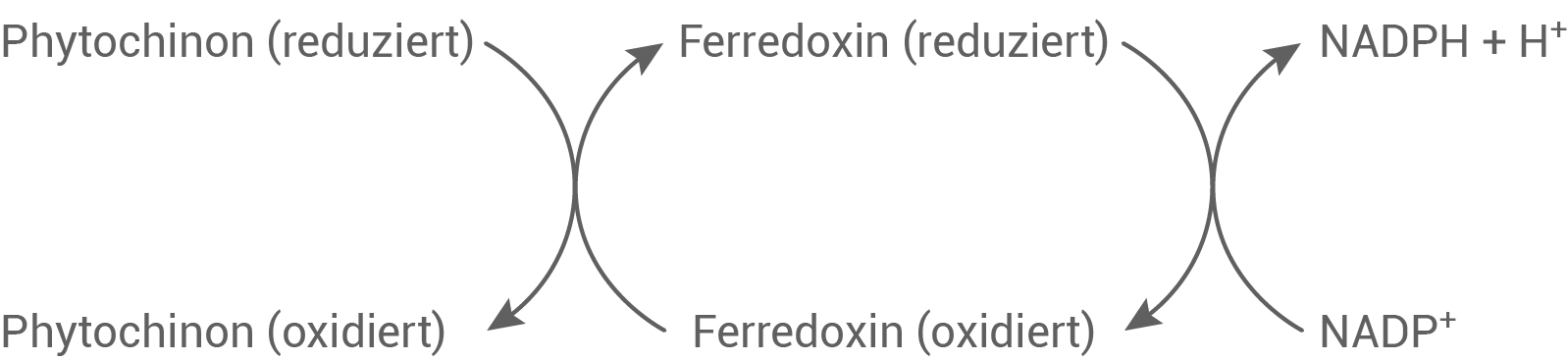
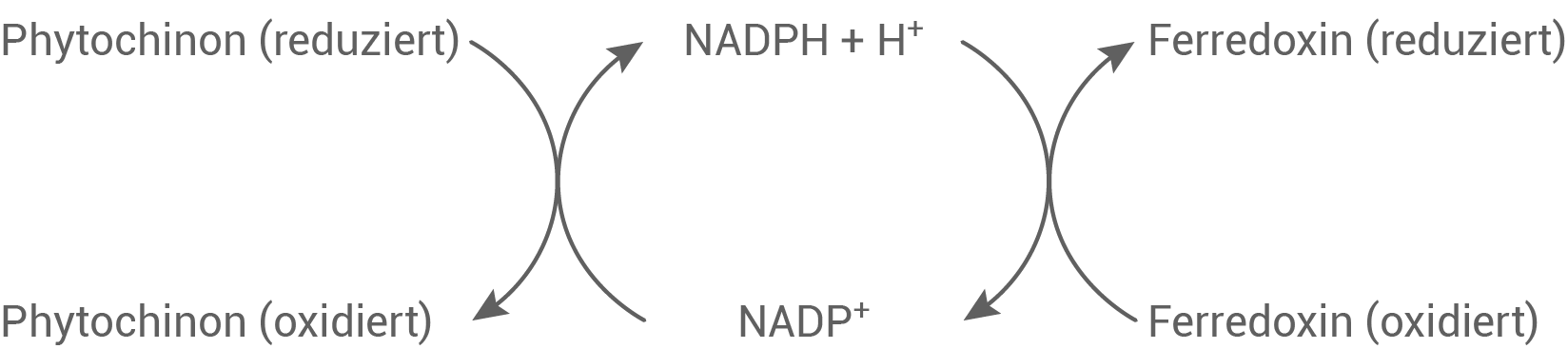

Abb. 2: Möglicher Reaktionsweg A

Abb. 3: Möglicher Reaktionsweg B
| Redoxpaar | Potenzial in V |
|---|---|
| Phytochinon (oxidiert) | Phytochinon (reduziert) | |
| Ferredoxin (oxidiert) | Ferredoxin (reduziert) | |
Tab. 3: Elektrochemische Potenziale ausgewählter Redoxpaare unter den Bedingungen in Pflanzenzellen
3.1
Leite anhand der in Tabelle 3 angegebenen elektrochemischen Potenziale ab, welcher der beiden in Abbildung 2 und 3 dargestellten Reaktionswege in der Pflanzenzelle freiwillig ablauft.
(6 BE)
3.2
Die elektrochemischen Potenziale in Tabelle 3 lassen sich aus den Standardpotenzialen der jeweiligen Redoxpaare berechnen. Skizziere einen Versuchsaufbau, mithilfe dessen sich das Standardpotenzial des Redoxpaars  ermitteln lässt.
ermitteln lässt.
(6 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Eignung von Heptan als Lösungsmittel
Die Moleküle von Heptan sind aufgrund ihrer langen Kohlenstoffkette unpolar und machen Heptan zu einem hydrophoben Lösungsmittel. Dem Prinzip folgend „Gleiches löst sich in Gleichem“, werden durch Heptan nur unpolare Moleküle extrahiert.
Bixin (Verbindung A) zeigt die beste Löslichkeit in Heptan, da der Einfluss des großen unpolaren Kohlenwasserstoffrests den Effekt der polaren Ester- und Carboxygruppen an den Enden überwiegt.
Mycrorradicin (Verbindung B) ist nach außen hin etwas polarer, da es an den Enden zwei polare Carboxylgruppen besitzt und löst sich folglich schlechter als Bixin in Heptan.
Abscisinsäure (Verbindung C) löst sich am wenigsten in Heptan, da die vielen polaren Molekülteile (Carbonyl-, Hydroxy- und Carboxylgruppen) der Verbindung hydrophile Eigenschaften verleihen.
Mycrorradicin (Verbindung B) ist nach außen hin etwas polarer, da es an den Enden zwei polare Carboxylgruppen besitzt und löst sich folglich schlechter als Bixin in Heptan.
Abscisinsäure (Verbindung C) löst sich am wenigsten in Heptan, da die vielen polaren Molekülteile (Carbonyl-, Hydroxy- und Carboxylgruppen) der Verbindung hydrophile Eigenschaften verleihen.
1.2
Zuordnung und Begründung der jeweiligen Farben
Eine chemische Verbindung ist farbig, wenn spezifische Wellenlängen im sichtbaren Bereich des elektromagnetischen Spektrums absorbiert werden. Für das menschliche Auge erscheinen diese in den entsprechenden Komplementärfarben.
Die Größe des Chromophors ist entscheidend für die Farbigkeit. Bei organischen Farbstoffen hängt dies von der Anzahl und Position der Mehrfachbindungen ab. Ein größeres System konjugierter Doppelbindungen führt zu einer größeren Ausdehnung der delokalisierten -Elektronen. Dadurch wird die absorbierte Wellenlänge erhöht, da die Anregungsenergie der Elektronen abnimmt.
Bixin (Verbindung A) ist das Molekül mit der größten Chromophorgröße der drei Verbindungen und absorbiert folglich Das farblose Apocarotinoid absorbiert elektromagnetische Strahlung mit einer Wellenlänge im längeren Wellenlängenbereich. Bixin erscheint daher rot.
-Elektronen. Dadurch wird die absorbierte Wellenlänge erhöht, da die Anregungsenergie der Elektronen abnimmt.
Bixin (Verbindung A) ist das Molekül mit der größten Chromophorgröße der drei Verbindungen und absorbiert folglich Das farblose Apocarotinoid absorbiert elektromagnetische Strahlung mit einer Wellenlänge im längeren Wellenlängenbereich. Bixin erscheint daher rot.
Mycorradicin (Verbindung B) hat einen kleineren Chromophor, was zu einer Verschiebung des Absorptionsmaximums in den weniger langen Wellenlängenbereich führt. Demnach erscheint diese Verbindung gelb.
Abscisinsäure (Verbindung C) erscheint farblos, da der Chromophor am kleinsten ist und der Absorptionsbereich im UV-Spektrum (außerhalb des sichtbaren Bereichs) liegt.
Die Größe des Chromophors ist entscheidend für die Farbigkeit. Bei organischen Farbstoffen hängt dies von der Anzahl und Position der Mehrfachbindungen ab. Ein größeres System konjugierter Doppelbindungen führt zu einer größeren Ausdehnung der delokalisierten
Mycorradicin (Verbindung B) hat einen kleineren Chromophor, was zu einer Verschiebung des Absorptionsmaximums in den weniger langen Wellenlängenbereich führt. Demnach erscheint diese Verbindung gelb.
Abscisinsäure (Verbindung C) erscheint farblos, da der Chromophor am kleinsten ist und der Absorptionsbereich im UV-Spektrum (außerhalb des sichtbaren Bereichs) liegt.
1.3
Beurteilung der optischen Aktivität
Eine chemische Verbindung zeigt optische Aktivität, wenn sie ein Chiralitätszentrum aufweist. Ein solches Stereozentrum entsteht, wenn an einem asymmetrischen Kohlenstoffatom vier verschiedene Substituenten gebunden sind. In diesem Fall können die Verbindung und ihr Spiegelbild nicht zur Deckung gebracht werden – sie sind Enantiomere.
Die Apocarotinoide A und B enthalten keine solchen Chiralitätszentren und sind daher nicht optisch aktiv. Im Gegensatz dazu besitzt Abscisinsäure (Verbindung C) ein asymmetrisches Kohlenstoffatom im Ringsystem  und zeigt somit optische Aktivität:
und zeigt somit optische Aktivität:

1.4
Erklärung des Farbeindrucks von Chlorophyll
Die Hauptabsorptionsmaxima von Chlorophyll liegt vorwiegend im roten und blauen Bereich des sichtbaren Lichtspektrums. Chlorophyll zeigt eine charakteristische "Grünlücke", da es kein grünes Licht absorbiert. Diese Farbe wird stattdessen reflektiert, wodurch Chlorophyll für uns grün erscheinen.

2
Markierter Monosaccharid-Baustein
Der markierte Monosaccharid-Baustein zeigt die Hexose Rhamnose.
Ob es sich um die D- oder L-Form handelt, ist an dem am weitesten unten liegenden asymmetrischen Kohlenstoff-Atom  zu erkennen. Da hier die Hydroxygruppe nach links zeigt, handelt es sich um L-Rhamnose.
zu erkennen. Da hier die Hydroxygruppe nach links zeigt, handelt es sich um L-Rhamnose.

3.1
Ableitung des freiwilligen Ablaufs
Damit eine Redoxreaktion ohne Energiezufuhr freiwillig abläuft, muss die Differenz der Redoxpotentiale  größer als null sein.
Reaktionsweg A
Für die Reduktion von Phytochinon und die Oxidation von Ferredoxin ergibt sich:
größer als null sein.
Reaktionsweg A
Für die Reduktion von Phytochinon und die Oxidation von Ferredoxin ergibt sich:
![\(\begin{array}[t]{rll}
\Delta E&=& E_{\,\text{Ox-Mittel}} - E_{\,\text{Red-Mittel}} & \\[5pt]
&=& E_{\,\text{Ferredoxin}} - E_{\,\text{Phytochinon}} & \\[5pt]
&=& -0,43\,\text{V} - (-0,90\,\text{V}) & \\[5pt]
&=& 0,47\,\text{V}
\end{array}\)](https://mathjax.schullv.de/2cef3bcb1884ced9960488974bf4ceadb9022bacb1edcebfebb1d224628b7a5a?color=5a5a5a) Für die Reduktion von Ferredoxin mit
Für die Reduktion von Ferredoxin mit  folgt:
folgt:
![\(\begin{array}[t]{rll}
\Delta E&=& E_{\,\text{Ox-Mittel}} - E_{\,\text{Red-Mittel}} & \\[5pt]
&=& E_{NADP^+} - E_{\,\text{Ferredoxin}} & \\[5pt]
&=& -0,32\,\text{V} - (-0,43\,\text{V}) & \\[5pt]
&=& 0,11\,\text{V}
\end{array}\)](https://mathjax.schullv.de/4321addb976fe2239132bc07e02316c7683d065f027532b4d904cb377f211fd3?color=5a5a5a) Für beide Reaktionen gilt
Für beide Reaktionen gilt  weswegen Reaktionsweg A freiwillig ablaufen kann.
Reaktionsweg B
Für die Reduktion von Phytochinon mit
weswegen Reaktionsweg A freiwillig ablaufen kann.
Reaktionsweg B
Für die Reduktion von Phytochinon mit  ergibt sich:
ergibt sich:
![\(\begin{array}[t]{rll}
\Delta E&=& E_{\,\text{Ox-Mittel}} - E_{\,\text{Red-Mittel}} & \\[5pt]
&=& E_{NADP^+} - E_{\,\text{Phytochinon}} & \\[5pt]
&=& -0,32\,\text{V} - (-0,90\,\text{V}) & \\[5pt]
&=& 0,58\,\text{V}
\end{array}\)](https://mathjax.schullv.de/7147a6df6894aa63890c921cda4968b188f78dec4cb005722e3e8eac6aa3b5fe?color=5a5a5a) Für die Oxidation von
Für die Oxidation von  mit Ferredoxin folgt:
mit Ferredoxin folgt:
![\(\begin{array}[t]{rll}
\Delta E&=& E_{\,\text{Ox-Mittel}} - E_{\,\text{Red-Mittel}} & \\[5pt]
&=& E_{\,\text{Ferredoxin}} - E_{NADPH} & \\[5pt]
&=& -0,43\,\text{V} - (-0,32\,\text{V}) & \\[5pt]
&=& - 0,11\,\text{V}
\end{array}\)](https://mathjax.schullv.de/73f01e337c8eb25c1b73cb6fff3392185671a01da71fc10a147574aa44187f47?color=5a5a5a) Für die letzte Teilreaktion gilt
Für die letzte Teilreaktion gilt  nicht, deswegen kann Reaktionsweg B nicht freiwillig ablaufen.
nicht, deswegen kann Reaktionsweg B nicht freiwillig ablaufen.
3.2
Skizze eines Versuchsaufbaus
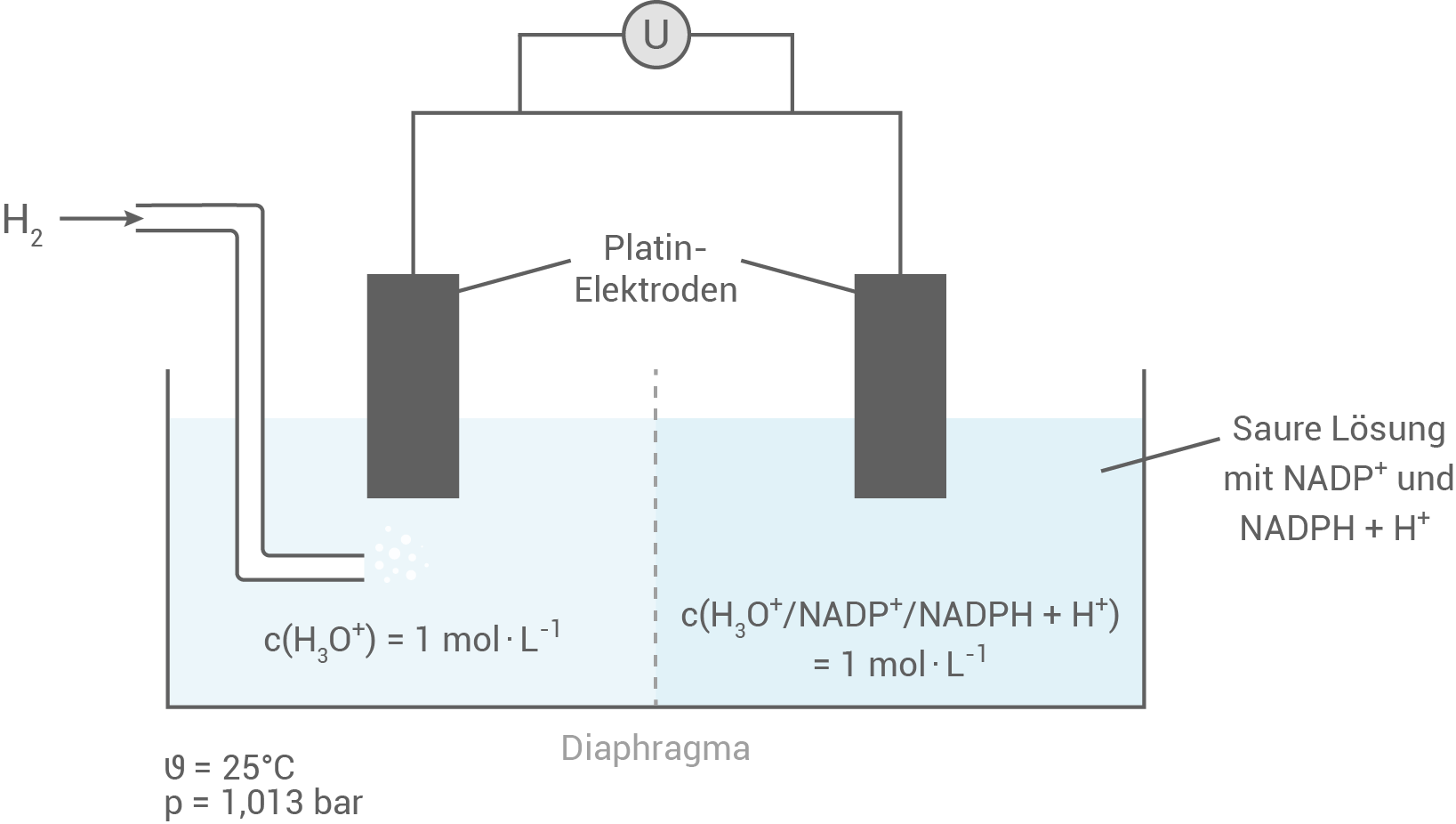 Die linke Elektrode ist eine Standard-Wasserstoff-Elektrode, die in der Elektrochemie als Referenzpunkt dient. Ihr Potential wird auf null festgelegt und bietet somit eine stabile Bezugsgröße für die Messung von Redoxpotenzialen in verschiedenen chemischen Systemen.
Die linke Elektrode ist eine Standard-Wasserstoff-Elektrode, die in der Elektrochemie als Referenzpunkt dient. Ihr Potential wird auf null festgelegt und bietet somit eine stabile Bezugsgröße für die Messung von Redoxpotenzialen in verschiedenen chemischen Systemen.
