B2 Grüner Wasserstoff
Wasserstoff gilt als Energietrāger der Zukunft. „Grüner Wasserstoff' wird durch Elektrolyse von Wasser unter Nutzung erneuerbarer Energiequellen erzeugt. Transport und Lagerung des Wasserstoffs stellen allerdings noch Probleme dar, weshalb verschiedene Speichermöglichkeiten erforscht werden.
1
Formuliere die Teilgleichungen und die Gesamtgleichung für die Elektrolyse von Wasser im sauren Milieu.
(3 BE)
2
Zur Speicherung kann Wasserstoff beispielsweise mit Stickstoff zu Ammoniak umgesetzt werden. Das flüssige Ammoniak kann problemlos in bestehenden Systemen gelagert und transportiert werden. Um den Wasserstoff bei Bedarf wieder freizusetzen, wird ein Ammoniak-Cracker verwendet. In diesem wird Ammoniak verdampft und an einem Nickel-Katalysator gespalten:






Abb. 1: Reaktionsgleichung zur Ammoniak-Spaltung
Tab. 1: Mögliche Reaktionsbedingungen in einem Ammoniak-Cracker
| Temperatur in °C | Druck in bar | |
|---|---|---|
| A | ||
| B | ||
| C | ||
| D |
2.1
Leite mithilfe des Prinzips von Le Chatelier die für den Crackvorgang am besten geeigneten Bedingungen aus Tabelle 1 ab.
(5 BE)
2.2
Berechne die Temperatur in Kelvin, ab der die Spaltung von Ammoniak freiwillig abläuft.
(3 BE)
3
Wasserstoff kann auch durch Verwendung von sogenannten LOHCs (Liquid Organic Hydrogen Carrier; flüssige organische Wasserstoffträger) gespeichert werden. Bei den bei Raumtemperatur flüssigen LOHCs handelt es sich um ungesättigte Kohlenwasserstoffe. An diese kann Wasserstoff durch Hydrierung chemisch gebunden und bei Bedarf durch Dehydrierung wieder freigesetzt werden (Abb. 2).
LOHC-System I
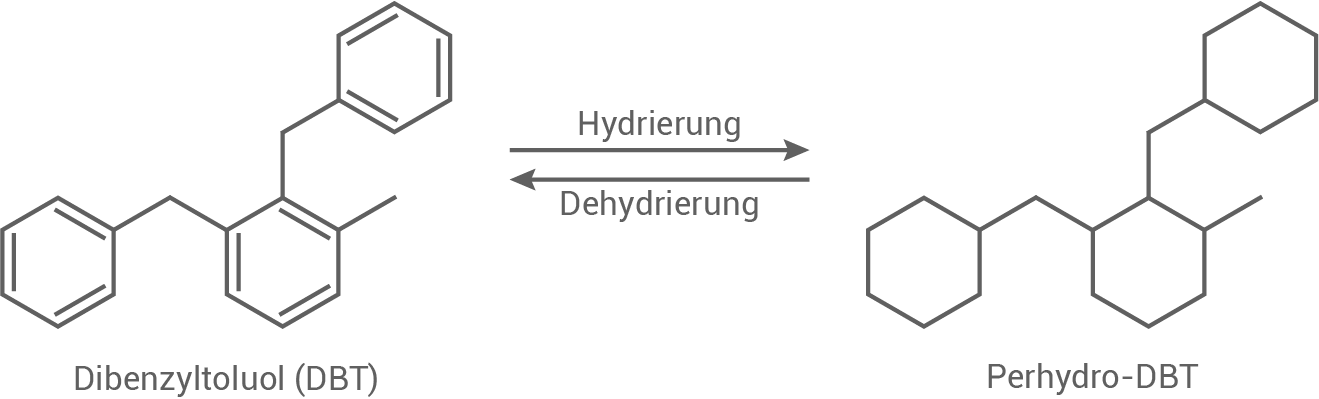 LOHC-System II
LOHC-System II


Abb. 2: Reaktionsschema der Hydrierung und Dehydrierung des LOHC-Systems I und II
Tabelle 2 zeigt Informationen aus den Datenblättern beider LOHCSysteme.
Tab. 2: Auszüge aus den Datenblättern der LOHC-Systeme
| LOHC-System | I | II |
|---|---|---|
| Dichte | ||
| Flammpunkt | ||
| Gefahrensymbole |


|



|
| Wasserstoff-speicherdichte |
3.1
Vergleiche den räumlichen Bau der cyclischen Molekülbestandteile von Dibenzyloluol und Perhydro-DBT.
(5 BE)
3.2
Dibenzyltoluol lässt sich in einer zweistufigen elektrophilen aromatischen Substitution aus Toluol und Benzylchlorid  herstellen. Dabei bildet sich bei Schritt A Benzyltoluol (Abb. 3).
herstellen. Dabei bildet sich bei Schritt A Benzyltoluol (Abb. 3).
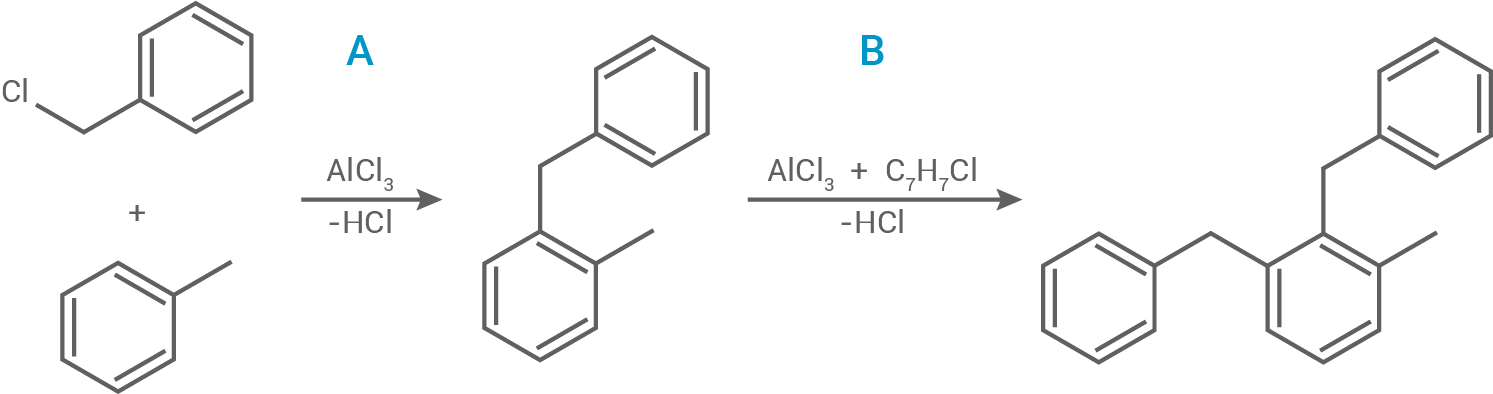 Formuliere den Reaktionsmechanismus für Schritt A der Synthese von Dibenzyloluol (Abb. 3). Als Elektrophil reagiert hier das Benzylchlorid-Molekül.
Formuliere den Reaktionsmechanismus für Schritt A der Synthese von Dibenzyloluol (Abb. 3). Als Elektrophil reagiert hier das Benzylchlorid-Molekül.

Abb. 3: Reaktionsschema der zweistufigen Synthese von Dibenzyltoluol aus Toluol und Benżylchlorid.
(6 BE)
3.3
Berechne unter Verwendung von Tabelle 2 das Volumen an gasförmigem Wasserstoff  das von einem Liter Dibenzyloluol
das von einem Liter Dibenzyloluol  gebunden werden kann.
gebunden werden kann.
(5 BE)
3.4
Bewerte mithilfe von Tabelle 2 die Eignung der angegebenen LOHCs als Wasserstoffspeicher unter Beachtung von Gesundheit, Umweltschutz und Wirtschaftlichkeit.
(6 BE)
4
Eine Möglichkeit der Speicherung von gasförmigem Wasserstoff ist die Anlagerung an der Oberfläche von Feststoffen (= Adsorption). Dazu werden hochporöse Polyamide als mögliche Trägersysteme erforscht. In einer Versuchsreihe wurden drei Polyamide auf Basis unterschiedlicher Edukte hergestellt (Tab. 3).
Tab. 3: Strukturformeln der Edukte der untersuchten Polyamide
| Polyamid | Edukt 1 | Edukt 2 |
|---|---|---|
| PA1 |
|
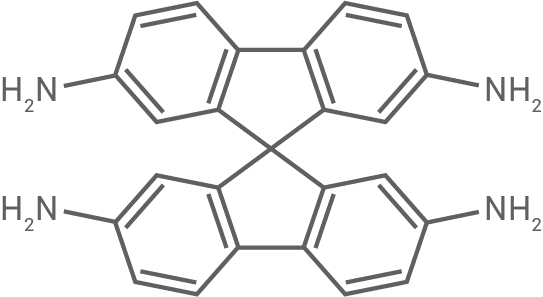
|
| PA2 |
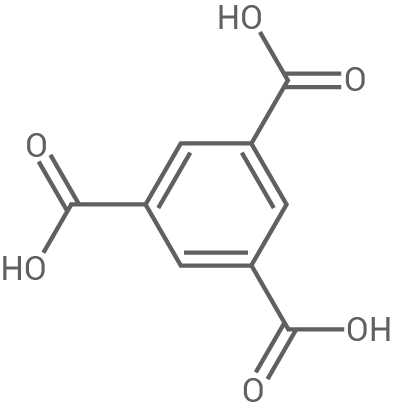
|
|
| PA3 |
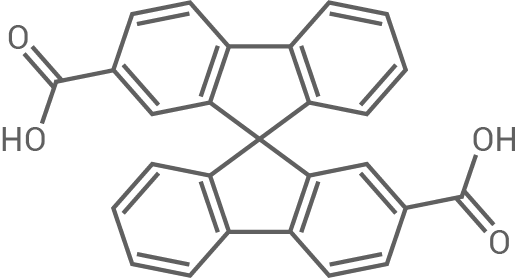
|
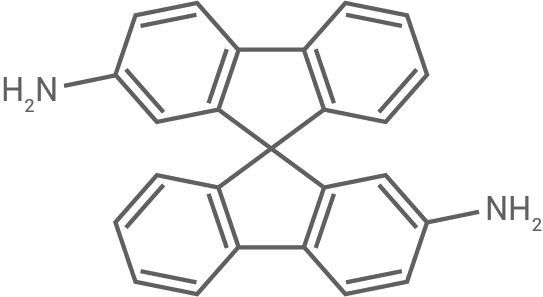
|
4.1
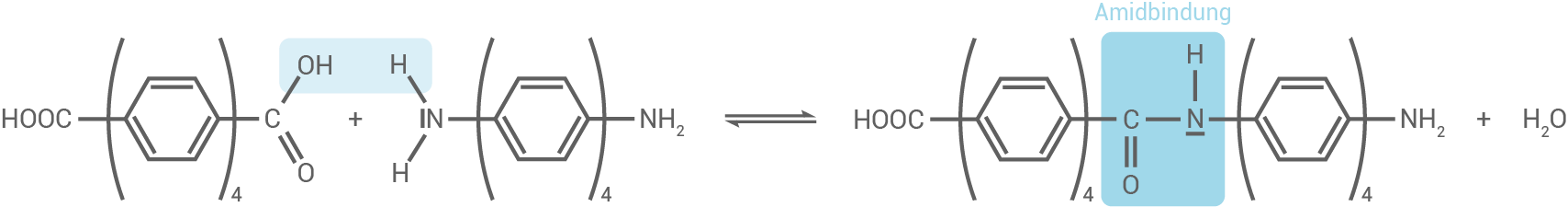
Formuliere ein Reaktionsschema der Polyreaktion zur Bildung eines zwei Monomere umfassenden Strukturformelausschnitts aus PA3. Nicht an der Reaktion beteiligte Molekülteile können abgekürzt dargestellt werden.
(3 BE)
4.2
Die Oberfläche von porösen Festkörpern wird in Quadratmeter pro Gramm Feststoff angegeben. Abbildung 4 zeigt die ermittelten Werte für die drei Polyamide aus Tabelle 3.
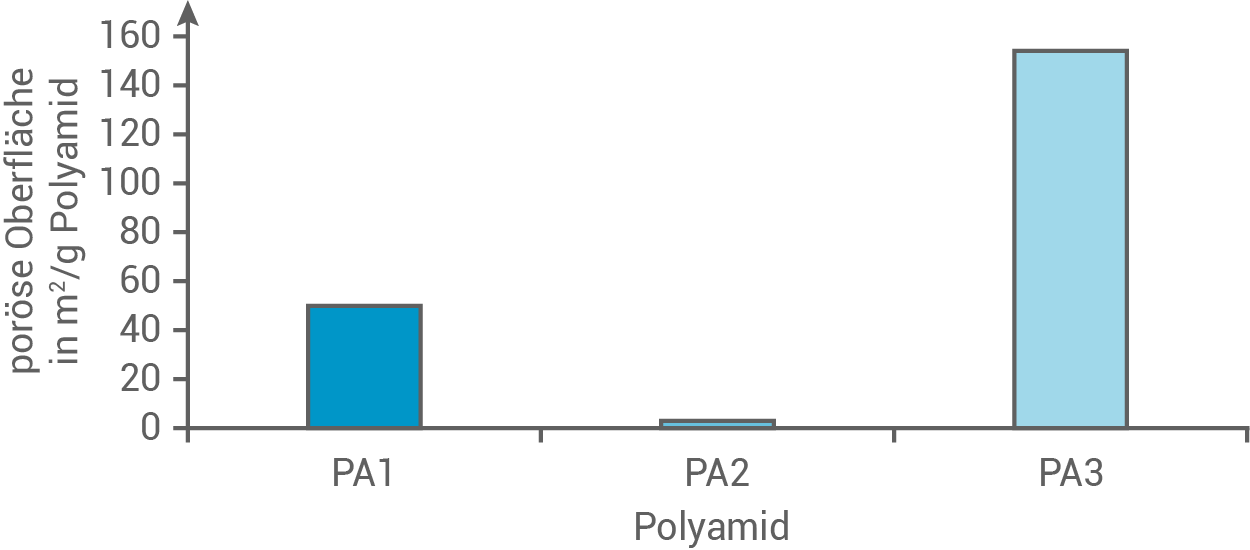 Formuliere mithilfe von Abbildung 4 und Tabelle 3 eine Hypothese, mit der man den Zusammenhang zwischen den verwendeten Monomeren und der jeweiligen porösen Oberfläche der Polyamide erklären kann.
Formuliere mithilfe von Abbildung 4 und Tabelle 3 eine Hypothese, mit der man den Zusammenhang zwischen den verwendeten Monomeren und der jeweiligen porösen Oberfläche der Polyamide erklären kann.

Abb. 4: poröse Oberflächen der drei untersuchten Polyamide
Weber, J., Su, Q., Antionetti, M. \& Thomas A. (2007). Exploring Polymers of Intrinsic Microporosity Microporous, Soluble Polyamide and Polyimide. Macromolecular Rapid Communications, 28, 1872+1874
(4 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Reaktionsgleichungen für die Elektrolyse von Wasser
Im sauren Milieu entsteht an der Kathode Wasserstoff, während Sauerstoff an der Anode entsteht.
2.1
Optimale Bedingungen für den Ammoniak-Cracker
Mit  ist die Reaktion zur Spaltung von Ammoniak endotherm.
ist die Reaktion zur Spaltung von Ammoniak endotherm.
Nach dem Prinzip von Le Chatelier werden endotherme Reaktionen durch hohe Temperaturen begünstigt. Das Gleichgewicht verschiebt sich in Richtung der Produkte, um die überschüssige Wärme zu „verbrauchen“.
Außerdem führt die Reaktion zu einem Anstieg der Teilchenzahl (von 2 auf 4 Moleküle), weswegen sich das Gleichgewicht bei einem niedrigeren Druck auf die Seite der Produkte verschieben würde. Aus Tabelle 1 sind hier die Reaktionsbedingungen A mit und
und  zu wählen.
zu wählen.
Nach dem Prinzip von Le Chatelier werden endotherme Reaktionen durch hohe Temperaturen begünstigt. Das Gleichgewicht verschiebt sich in Richtung der Produkte, um die überschüssige Wärme zu „verbrauchen“.
Außerdem führt die Reaktion zu einem Anstieg der Teilchenzahl (von 2 auf 4 Moleküle), weswegen sich das Gleichgewicht bei einem niedrigeren Druck auf die Seite der Produkte verschieben würde. Aus Tabelle 1 sind hier die Reaktionsbedingungen A mit
2.2
Berechnung der Temperatur für die freiwillige Ammoniak-Spaltung
Als Grundlage dient die Gibbs-Helmholtz-Gleichung:
 Damit eine Reaktion freiwillig abläuft, muss gelten:
Damit eine Reaktion freiwillig abläuft, muss gelten:
 Daraus ergibt sich für die Temperatur:
Daraus ergibt sich für die Temperatur:
![\(\begin{array}[t]{rlll}
T&\gt& \dfrac{\Delta H}{\Delta S} & \\[5pt]
&\gt& \dfrac{92 \, \text{kJ} \cdot \text{mol}^{-1}}{198 \, \text{J} \cdot \text{mol}^{-1} \cdot \text{K}^{-1}} & \\[5pt]
&\gt & \dfrac{92\ 000 \, \text{J} \cdot \text{mol}^{-1}}{198 \, \text{J} \cdot \text{mol}^{-1} \cdot \text{K}^{-1}} & \\[5pt]
T &\approx & 465\,\text{K}
\end{array}\)](https://mathjax.schullv.de/fdd36574ba059d4ae0622d99abf1de321c32f28b6a2fcadf035649425b5cbf20?color=5a5a5a) Ab einer Temperatur von ca.
Ab einer Temperatur von ca.  verläuft die Spaltung von Ammoniak freiwillig ab.
verläuft die Spaltung von Ammoniak freiwillig ab.
3.1
Vergleich des räumlichen Baus der Molekülbestandteile
Das Molekül Dibenzyloluol besteht aus zwei aromatischen Ringen, die über eine Methylgruppe verbunden sind. Die Ringe sind in einer relativ starren Struktur angeordnet, da der aromatische Charakter der Ringe eine freie Rotation einschränkt.
Im Gegensatz dazu besitzt Perhydro-DBT eine zyklische Struktur, bei der die aromatischen Ringe durch eine vollständige Hydrierung zu gesättigten Kohlenstoffringen umgewandelt wurden. Dies führt zu einer flexibleren Struktur mit einer höheren Dichte, da die Moleküle räumlich dichter gepackt werden können.
3.2
Reaktionsmechanismus für die zweistufige Synthese
Die Synthese von Dibenzyloluol erfolgt über eine elektrophile aromatische Substitution von Benzylchlorid an Toluol.
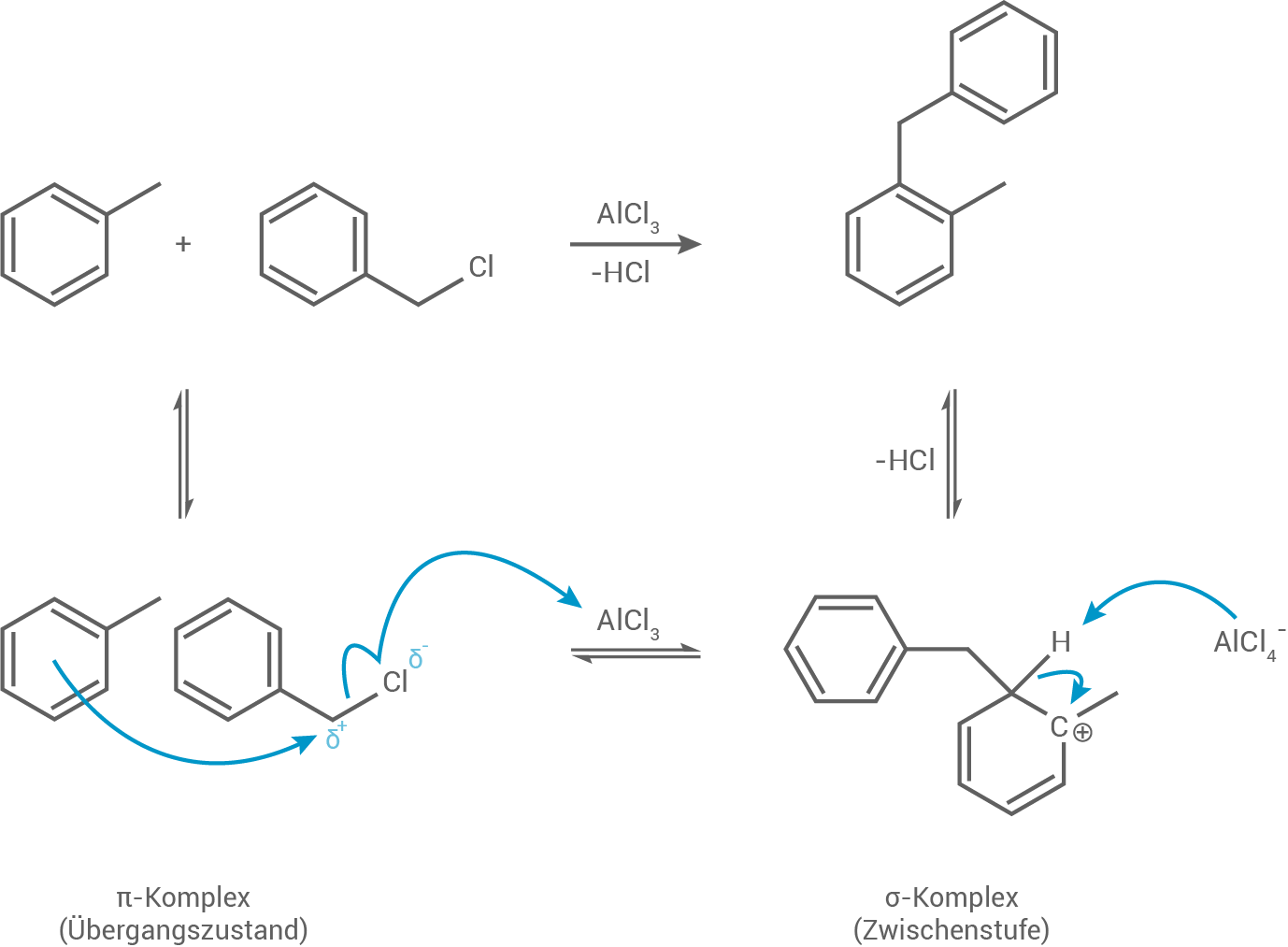 Schritt 1:
Schritt 1:
Zunächst entsteht durch die Wechselwirkung des Toluol-Moleküls mit dem Elektrophil ein -Komplex.
Schritt 2:
-Komplex.
Schritt 2:
Anschließend wird in Gegenwart des Katalysators Aluminiumchlorid die
die  -Bindung im Benzylchlorid-Molekül so stark polarisiert, dass ein Elektronenpaar aus dem Ringsystem an das Kohlenstoffatom im Chlormethan-Molekül bindet. Dadurch wird die Aromatizität aufgehoben und es entsteht der mesomeriestabilisierte
-Bindung im Benzylchlorid-Molekül so stark polarisiert, dass ein Elektronenpaar aus dem Ringsystem an das Kohlenstoffatom im Chlormethan-Molekül bindet. Dadurch wird die Aromatizität aufgehoben und es entsteht der mesomeriestabilisierte  -Komplex.
Schritt 3:
-Komplex.
Schritt 3:
Im dritten Schritt erfolgt die Abspaltung eines Protons. Das verbleibende Elektronenpaar klappt zurück in das Ringsystem, wodurch eine Rearomatisierung eintritt.

Zunächst entsteht durch die Wechselwirkung des Toluol-Moleküls mit dem Elektrophil ein
Anschließend wird in Gegenwart des Katalysators Aluminiumchlorid
Im dritten Schritt erfolgt die Abspaltung eines Protons. Das verbleibende Elektronenpaar klappt zurück in das Ringsystem, wodurch eine Rearomatisierung eintritt.
3.3
Berechnung des gebundenen Wasserstoffvolumens
Um das Volumen von gebundenem Wasserstoff zu berechnen, wird mithilfe der Wasserstoffspeicherdichte zunächst die Masse Wasserstoff pro Mol Dibenzyloluol berechnet.
![\(\begin{array}[t]{rlll}
m_{H_2}&=& 6,2\,\% \cdot M(DBT) \\[5pt]
&=& \dfrac{6,2}{100} \cdot 272,4\,\text{g} \cdot \text{mol}^{-1} \\[5pt]
&=& 16,89 \,\text{g}
\end{array}\)](https://mathjax.schullv.de/7a44088447e814ba0e16d3d773ec04852440ffb8afb66ca5734c412c826c999b?color=5a5a5a) Daraus folgt:
Daraus folgt:
![\(\begin{array}[t]{rlll}
V_{H_2} &=& \dfrac{m_{H_2}}{M_{H_2}} \cdot V_m \\[5pt]
&=& \dfrac{16,89 \,\text{g}}{2\,\text{g} \cdot \text{mol}^{-1} } \cdot 22,4 \,\text{L} \cdot \text{mol}^{-1} \\[5pt]
&\approx& 189,2 \,\text{L}
\end{array}\)](https://mathjax.schullv.de/6e797aabb767cc75f9df89af8b1769dfcfdc0c144cb4df1766a88e189b6f9191?color=5a5a5a) das Volumen an gasförmigem Wasserstoff, das von einem Liter Dibenzyloluol gebunden werden kann beträgt ca.
das Volumen an gasförmigem Wasserstoff, das von einem Liter Dibenzyloluol gebunden werden kann beträgt ca. 
3.4
Bewertung der LOHC-Systeme
Insgesamt ist das LOHC-System I stabiler und sicherer, weist daher eine bessere Sicherheits- und Umweltbilanz auf und ist daher die geeignetere Wahl.
| Gesundheit | LOHC-System II hat mit |
|---|---|
| Umweltschutz | Beide Systeme weisen eine identische Wasserstoffspeicherdichte auf |
| Wirtschaftlichkeit | LOHC-System I kann aufgrund der geringeren Sicherheitsanforderungen effizienter und kostengünstiger betrieben werden, während bei System II zusätzliche Investitionen in Sicherheitsmaßnahmen erforderlich sind. |
4.1
Reaktionsschema für die Polyreaktion von PA3
Die Polyreaktion zur Bildung des Polyamids PA3 erfolgt durch eine Kondensationsreaktion zwischen den beiden Monomeren. Dabei reagiert die Hydroxygruppe  des einen Monomers mit der Aminogruppe
des einen Monomers mit der Aminogruppe  des anderen Monomers unter Abspaltung von Wasser zu einer Amidbindung.
des anderen Monomers unter Abspaltung von Wasser zu einer Amidbindung.

4.2
Hypothese zum Zusammenhang zwischen Monomeren und poröser Oberfläche
Anhand der Daten in Abbildung 4 und Tabelle 3 könnte eine mögliche Hypothese sein:
Die poröse Oberfläche der Polyamide korreliert mit der räumlichen Struktur und der Flexibilität der Monomere. PA1 und PA2 bestehen aus weniger sperrigen und symmetrischen Monomeren, was zu einer geringeren Porosität führt. Im Gegensatz dazu weist PA3 eine asymmetrische und sperrigere Struktur auf, die während der Polymerisation unregelmäßige Netzwerke bildet und so eine größere poröse Oberfläche ermöglicht.