B2 Wasser für Injektionszwecke
Wasser für Injektionszwecke (WFI) ist Wasser, das in der pharmazeutischen Industrie verwendet wird und höchsten Qualitätsansprüchen genügen muss. Die Herstellung von WFI erfordert eine aufwendige Aufbereitung von Leitungswasser in vielen Einzelschritten.
1
Im Wasser enthaltene, unerwünschte lonen lassen sich mit verschiedenen lonenaustauschverfahren entfernen. Dazu werden vor allem lonentauscher auf Basis von Chitosan verwendet. Chitosan lässt sich aus Chitin (Abb. 1) herstellen:
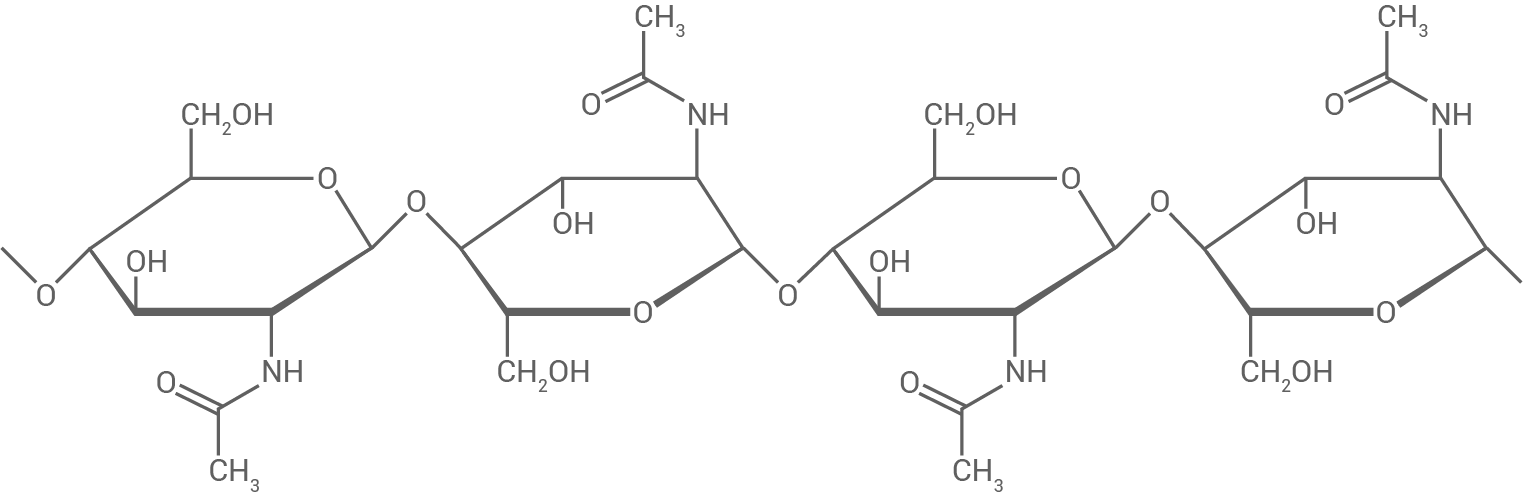

Abb. 1: Ausschnitt aus einem Chitin-Molekül
1.1
Benenne die Art der glykosidischen Bindung im Chitin-Molekül und vergleiche die Molekülstruktur mit der eines Cellulose-Moleküls.
(5 BE)
1.2
Chitin lässt sich sowohl in saurer als auch alkalischer Lösung hydrolysieren. Abhängig vom pH-Wert erfolgt die Hydrolyse an unterschiedlichen Stellen des Moleküls und es entstehen dabei verschiedene Produkte. Bei der alkalischen Hydrolyse erhält man durch Spaltung der Amidbindungen Chitosan-Moleküle.
1.2.1
Formuliere die Strukturformelgleichung zur Bildung von Chitosan aus Chitin. Die an der Reaktion nicht beteiligten Molekülabschnitte können abgekürzt werden.
(3 BE)
1.2.2
In einem Experiment wird Chitin einmal in saurer und einmal in alkalischer Lösung hydrolysiert. Mit den entstehenden Gemischen wird jeweils die Fehling-Probe durchgeführt. Nur in einem Fall entsteht ein rotbrauner Niederschlag. Erkläre die Versuchsbeobachtungen und formuliere die Redoxteilgleichungen für die positive Fehling-Probe.
(9 BE)
1.3
In einer Versuchsreihe wird eine Chitosan-Lösung jeweils für eine bestimmte Zeit mit Mikrowellen bestrahlt. Die Chitosan-Moleküle werden dadurch teilweise gespalten. Nach dem Abkühlen der Lösung wird jeweils die Viskosität gemessen (Abb. 2):
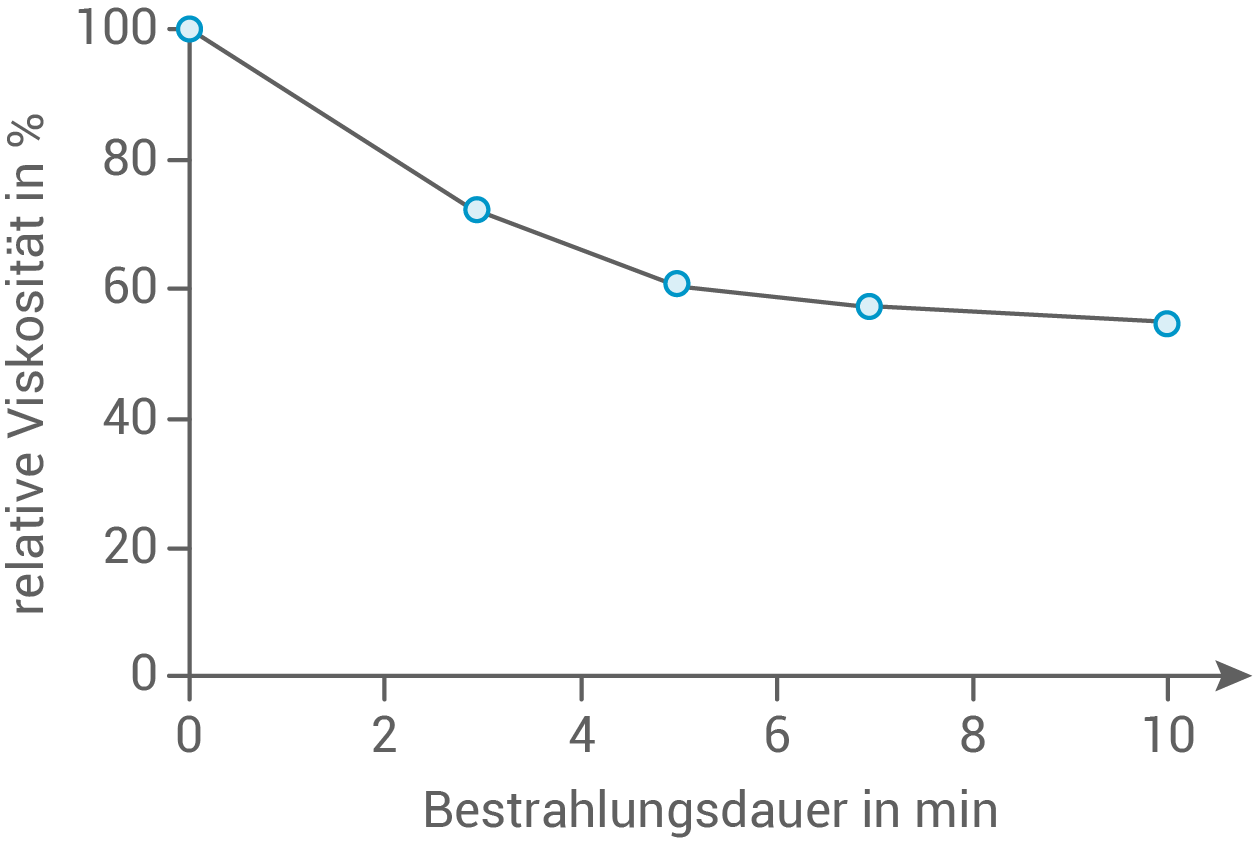 Begründe den in Abbildung 2 dargestellten Kurvenverlauf auf Teilchenebene.
Begründe den in Abbildung 2 dargestellten Kurvenverlauf auf Teilchenebene.

Abb. 2: Viskosität einer Chitosan-Lösung in Abhängigkeit von der Bestrahlungsdauer
Rokhati, N., Pramudono, B., Istirokhatun, T., Susanto, H. (2018). Microwave Irradiation Assisted Chitosan Hydrolysis Using Cellulase Enzyme. Bulletin of Chemical Reaction Engineering & Catalysis, 13 (3): 469 (doi:10.9767/bcrec.13.3.2378.466-474), https://core.ac.uk/download/pdf/234032347.pdf, zuletzt aufgerufen am 26.10.2021
(5 BE)
2
Um Bakterienwachstum in WFI zu verhindern, wird das Wasser während der Lagerung mit Ozon versetzt.
2.1
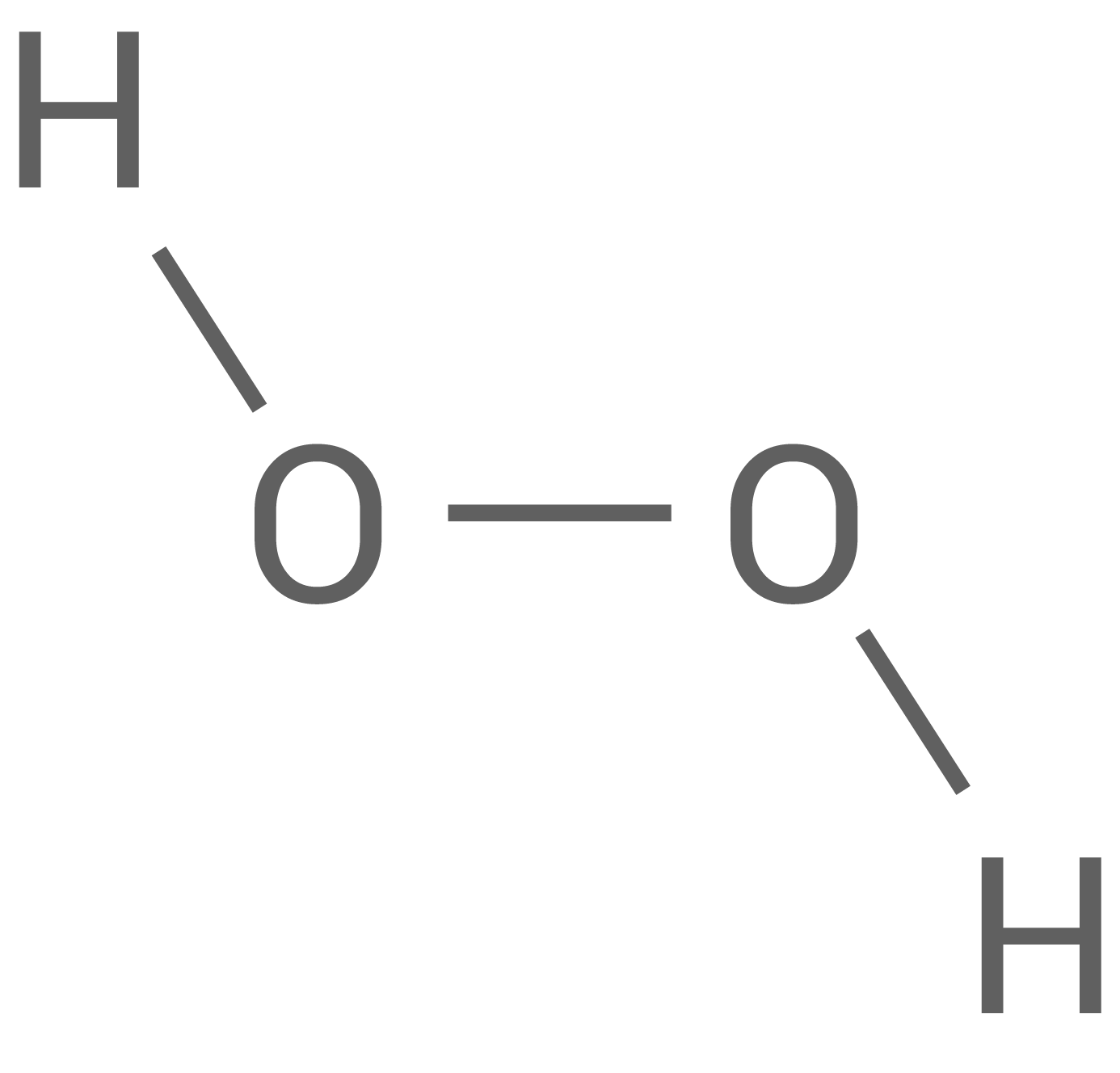
Die Löslichkeit von Ozon in Wasser ist ca. zehnmal höher als die von Sauerstoff.
Erkläre mithilfe von Strukturformeln die in der Tabelle angegebene Bindungslänge im Ozon-Molekül. Begründe die Unterschiede der Löslichkeit von Ozon und Sauerstoff in Wasser.
| Stoff | Summen-formel | Struktur-formel | Länge der Bindung zwischen den Sauerstoff- Atomen in |
|---|---|---|---|
| Sauer- stoff |
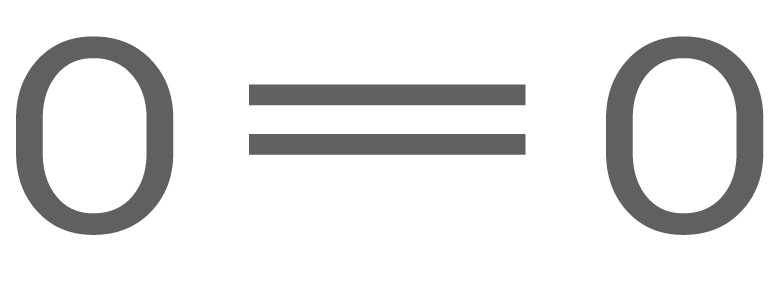
|
||
| Wasser- stoff- peroxid |
|
||
| Ozon |
Tab.: Summen- und Strukturformeln sowie Bindungslängen von Sauerstoff, Wasserstoffperoxid und Ozon
(7 BE)
2.2
Ozon ist sehr instabil und kann daher schlecht transportiert und gelagert werden. Es wird deshalb direkt bei der WFI-Herstellung in einer Redoxreaktion aus dem bereits hochreinen Wasser gebildet. Als weiteres Produkt entsteht Wasserstoff.
Formuliere für die beschriebene Reaktion die Teilgleichungen sowie die Gesamtgleichung.
Formuliere für die beschriebene Reaktion die Teilgleichungen sowie die Gesamtgleichung.
(5 BE)
2.3
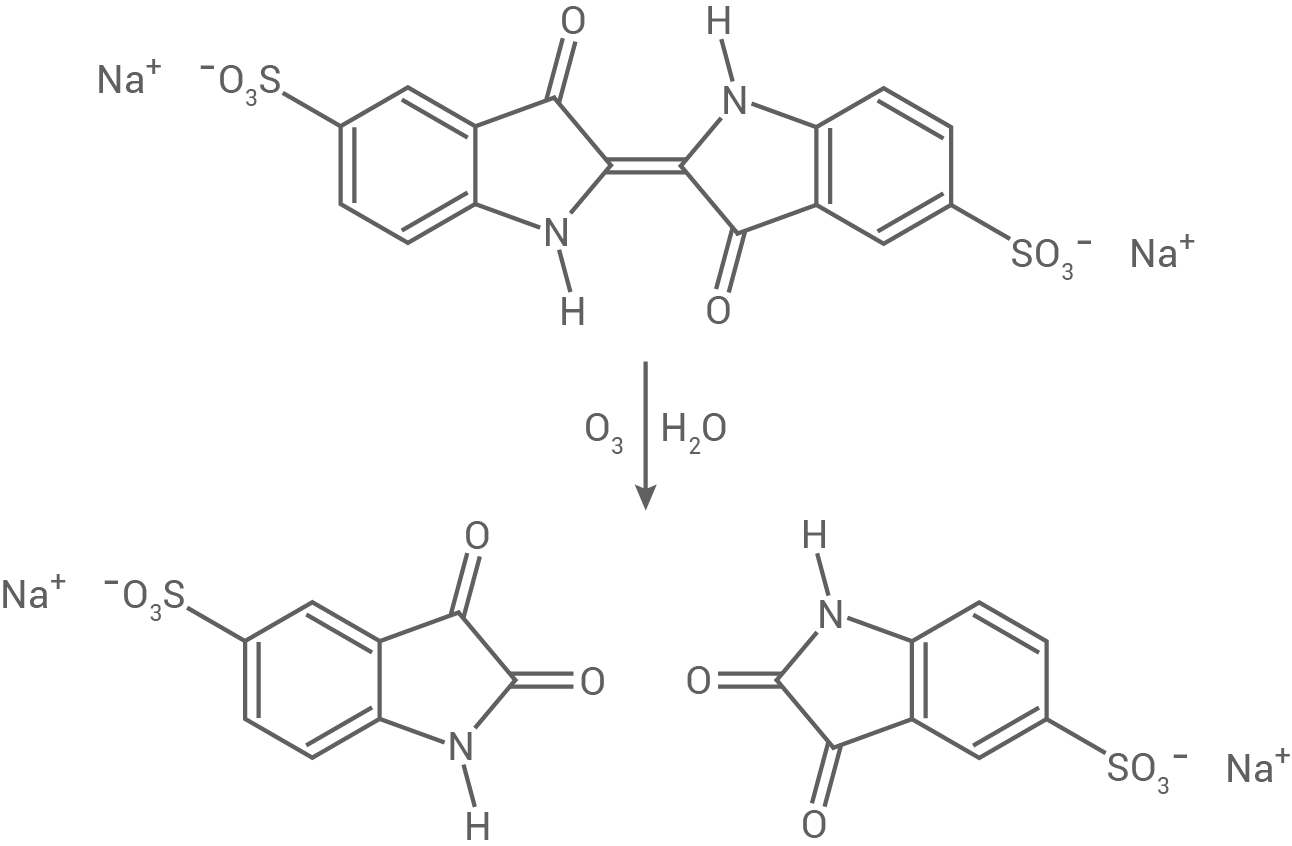
Vor der Verwendung des WFI muss sichergestellt werden, dass keine Ozonrückstände mehr vorhanden sind. Dazu setzt man einer Probe des WFI Indigocarmin zu. In Gegenwart von Ozon wird Indigocarmin zu Isatin-5-sulfonsäure oxidiert (Abb. 3):
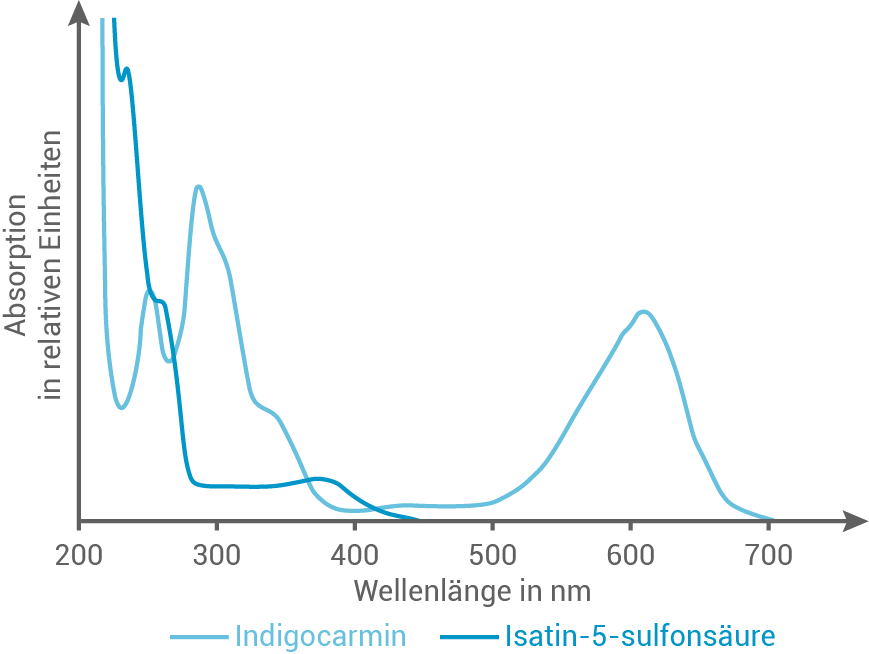
 In Abbildung 4 sind die Absorptionsspektren von Indigocarmin und Isatin-5-sulfonsäure dargestellt. Abbildung 5 zeigt das Spektrum des sichtbaren Lichts mit den zugehörigen Wellenlängen
In Abbildung 4 sind die Absorptionsspektren von Indigocarmin und Isatin-5-sulfonsäure dargestellt. Abbildung 5 zeigt das Spektrum des sichtbaren Lichts mit den zugehörigen Wellenlängen 
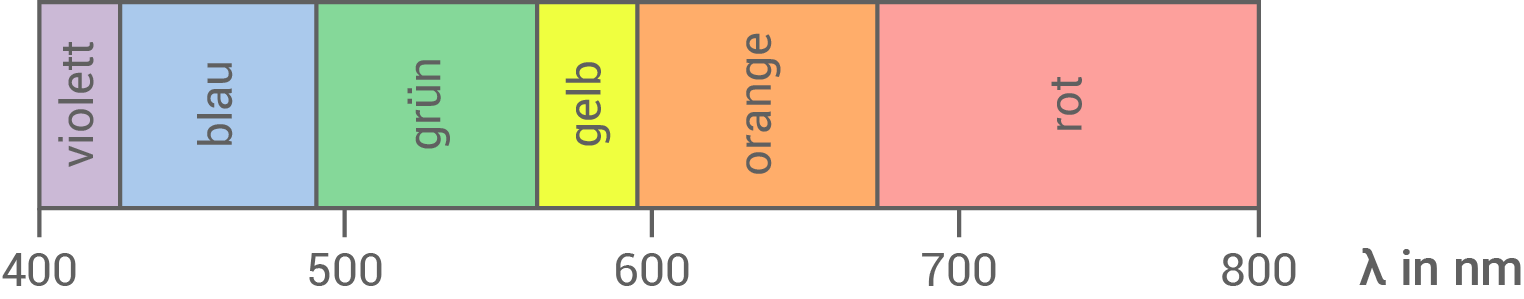 Erläutere anhand der Abbildungen 3,4 und 5 das Prinzip des Nachweises von Ozon mithilfe von Indigocarmin.
Erläutere anhand der Abbildungen 3,4 und 5 das Prinzip des Nachweises von Ozon mithilfe von Indigocarmin.

Abb. 3: Reaktionsschema zur Bildung von Isatin-5-sulfonsäure aus Indigocarmin und Ozon

Abb. 4: Absorptionsspektren von Indigocarmin und Isatin-5-sulfonsäure

Abb. 5: Spektrum des sichtbaren Lichts
(6 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Glykosidische Bindung
Die Sauerstoffbrücke des Chitin-Moleküls befindet sich an  auf derselben Seite des Pyranoserings wie die
auf derselben Seite des Pyranoserings wie die  -Reste am
-Reste am  Diese Anordnung zeigt eine
Diese Anordnung zeigt eine  -1,4-glykosidische Verknüpfung.
Vergleich der Molekülstrukturen
Cellulose- und Chitin-Moleküle bestehen beide aus linearen, unverzweigten Molekülketten und sind durch dieselbe glykosidische Bindung zwischen den Monomeren miteinander verbunden.
-1,4-glykosidische Verknüpfung.
Vergleich der Molekülstrukturen
Cellulose- und Chitin-Moleküle bestehen beide aus linearen, unverzweigten Molekülketten und sind durch dieselbe glykosidische Bindung zwischen den Monomeren miteinander verbunden.
Der Unterschied zwischen Chitin und Cellulose liegt in der Art der verknüpften Monomere. Cellulose besteht aus -D-Glucose, während bei den Monomeren der Chitin-Moleküle eine Säureamid- anstelle einer Hydroxygruppe am
-D-Glucose, während bei den Monomeren der Chitin-Moleküle eine Säureamid- anstelle einer Hydroxygruppe am  -Atom des Rings zu finden ist.
-Atom des Rings zu finden ist.
Der Unterschied zwischen Chitin und Cellulose liegt in der Art der verknüpften Monomere. Cellulose besteht aus
1.2.1
Strukturformelgleichung für die Bildung von Chitosan
Um Chitosan aus Chitin herzustellen, wird die Amidbindung durch alkalische Hydrolyse gespalten:


1.2.2
Erklärung der Versuchsbeobachtungen
Nach der alkalischen Hydrolyse von Chitin bleiben im Produktgemisch weiterhin Polysaccharide vorhanden, da die Monomere durch glykosidische Bindungen zwischen den anomeren Kohlenstoffatomen  verbunden bleiben. Dies führt dazu, dass der Pyranose-Ring nicht geöffnet wird und somit keine freien Aldehydgruppen entstehen. Als Ergebnis verläuft die Fehling-Probe negativ.
Im Gegensatz dazu führt die saure Hydrolyse von Chitin zur Spaltung der glykosidischen Bindungen. Dies ermöglicht eine Ringöffnung am anomeren Kohlenstoffatom
verbunden bleiben. Dies führt dazu, dass der Pyranose-Ring nicht geöffnet wird und somit keine freien Aldehydgruppen entstehen. Als Ergebnis verläuft die Fehling-Probe negativ.
Im Gegensatz dazu führt die saure Hydrolyse von Chitin zur Spaltung der glykosidischen Bindungen. Dies ermöglicht eine Ringöffnung am anomeren Kohlenstoffatom  wodurch im Produktgemisch freie Aldehydgruppen vorliegen. Infolgedessen verläuft die Fehling-Probe positiv.
Redoxteilgleichungen
Das Kohlenstoffatom des Chitins wird oxidiert: +I
wodurch im Produktgemisch freie Aldehydgruppen vorliegen. Infolgedessen verläuft die Fehling-Probe positiv.
Redoxteilgleichungen
Das Kohlenstoffatom des Chitins wird oxidiert: +I  +III
Das Kupfer wird reduziert: +II
+III
Das Kupfer wird reduziert: +II  +I
+I
1.3
Begründung des Kurvenverlaufs auf Teilchenebene
Das Diagramm in Abbildung 2 zeigt die Abhängigkeit der Viskosität der Chitosan-Lösung von der Bestrahlungsdauer mit Mikrowellen. Es ist zu sehen, dass mit zunehmender Bestrahlungsdauer die Viskosität der Lösung abnimmt.
Diese Feststellung legt nahe, dass die Mikrowellen die Chitosan-Moleküle zersetzen. Mit zunehmender Bestrahlungsdauer entstehen mehr Fragmente. Da diese Spaltprodukte stets kürzer werden, sind zwischenmolekulare Kräfte weniger wirksam. Als Folge können sich die kleineren Moleküle leichter verschieben, was zu einem Rückgang der Viskosität der Lösung führt.
2.1
Erklärung der Bindungslänge im Ozonmolekül und der Löslichkeitsunterschiede
Die Struktur eines Ozonmoleküls kann mithilfe seiner mesomeren Grenzstrukturen beschrieben werden:
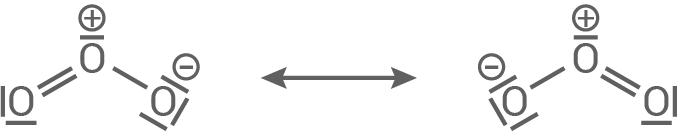 Gemäß dem Mesomeriemodell ergeben sich für Ozon zwei gleichwertige mesomere Grenzformeln, wobei die freien Elektronenpaare über die drei Sauerstoffatome delokalisiert sind. Die tatsächliche Elektronenverteilung liegt zwischen diesen Grenzformeln.
Daraus folgt für die
Gemäß dem Mesomeriemodell ergeben sich für Ozon zwei gleichwertige mesomere Grenzformeln, wobei die freien Elektronenpaare über die drei Sauerstoffatome delokalisiert sind. Die tatsächliche Elektronenverteilung liegt zwischen diesen Grenzformeln.
Daraus folgt für die  -Bindung im Ozonmolekül eine Bindungslänge von
-Bindung im Ozonmolekül eine Bindungslänge von  welche zwischen der einer Doppelbindung (wie im Sauerstoff-Molekül) und der einer Einfachbindung (wie im Wasserstoffperoxid-Molekül).
In den Grenzstrukturen von Ozon sind Formalladungen vorhanden, weshalb Ozonmoleküle polar sind im Gegensatz zu den völlig unpolaren Sauerstoffmolekülen. Daher ist Ozon besser in dem polaren Lösungsmittel Wasser löslich als Sauerstoff.
welche zwischen der einer Doppelbindung (wie im Sauerstoff-Molekül) und der einer Einfachbindung (wie im Wasserstoffperoxid-Molekül).
In den Grenzstrukturen von Ozon sind Formalladungen vorhanden, weshalb Ozonmoleküle polar sind im Gegensatz zu den völlig unpolaren Sauerstoffmolekülen. Daher ist Ozon besser in dem polaren Lösungsmittel Wasser löslich als Sauerstoff.

2.2
Formulierung der Reaktionsgleichungen
Es findet eine Disproportionierung des Wassers statt:
![\(\begin{array}[t]{rll}
\text{Oxidation}&:& 3\,H_2O + 6\,H_2O&\rightarrow & O_3 + 6\,e^- + 6\,H_3O^+ & \\[5pt]
\text{Reduktion}&:& H_2O + 2\,e^- + 2\,H_3O^+&\rightarrow& H_2 + 3\,H_2O &\quad \scriptsize \mid \cdot 3 \\[10pt]
\hline
\text{Redox}&:& 3\,H_2O &\rightarrow& O_3 + 3\,H_2O&
\end{array}\)](https://mathjax.schullv.de/4ce35aaa57b919fa53e99c2b414f57e9a949ae2217152848dcd88607f9cbf96f?color=5a5a5a) In dieser Redoxreaktion wird das Sauerstoffatom in Wasser oxidiert (-II
In dieser Redoxreaktion wird das Sauerstoffatom in Wasser oxidiert (-II  0) und der Wasserstoff wird reduziert (+I
0) und der Wasserstoff wird reduziert (+I  0).
0).
2.3
Erläuterung des Prinzips vom Ozon-Nachweis
Abbildung 4 (Absorptionsspektrum von Indigocarmin) und Abbildung 5 (Spektrum des sichtbaren Lichts) zeigen, dass die Absorptionsmaxima des Farbstoffs im roten und blauen Wellenlängenbereich liegen. Daher erscheint die Lösung für das menschliche Auge in der Komplementärfarbe Grün.
In Gegenwart von Ozon zerfällt Indigocarmin zu Isatin-5-sulfonsäure, welches laut dem Absorptionsspektrum UV-Licht mit Wellenlängen kleiner als absorbiert. Somit erscheint sie für das menschliche Auge farblos.
Die Nachweisreaktion von Ozon mit Indigocarmin zeigt somit eine Entfärbung der grünen Nachweislösung, da Indigocarmin zu Isatin-5-sulfonsäure oxidiert wird.
absorbiert. Somit erscheint sie für das menschliche Auge farblos.
Die Nachweisreaktion von Ozon mit Indigocarmin zeigt somit eine Entfärbung der grünen Nachweislösung, da Indigocarmin zu Isatin-5-sulfonsäure oxidiert wird.
In Gegenwart von Ozon zerfällt Indigocarmin zu Isatin-5-sulfonsäure, welches laut dem Absorptionsspektrum UV-Licht mit Wellenlängen kleiner als