A2 Antibiotika
Antibiotika sind Wirkstoffe in Arzneimitteln, die bei bakteriellen Infektionskrankheiten eingesetzt werden. Sie beeinflussen Stoffwechselprozesse von Bakterien und verhindern so ihre Vermehrung.
1
Das Antibiotikum Sulfamethoxydiazin (Abb. 1) stört die Synthese der für die Bakterien lebensnotwendigen Folsäure. Bakterien stellen Folsäure mithilfe des Enzyms Dihydropteroat-Synthase aus 4-Aminobenzoesäure her.
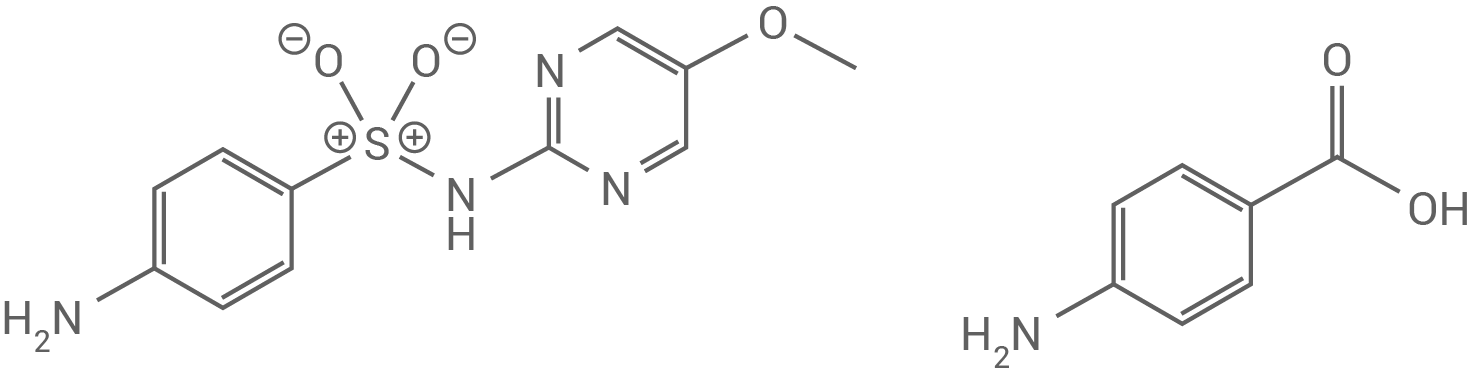 Stelle auf Grundlage der Strukturformeln von Sulfamethoxydiazin und 4-Aminobenzoesäure eine Hypothese zum Wirkmechanismus dieses Antibiotikums auf. Beschreibe die Wirkungsweise anhand einer modellhaften Darstellung.
Stelle auf Grundlage der Strukturformeln von Sulfamethoxydiazin und 4-Aminobenzoesäure eine Hypothese zum Wirkmechanismus dieses Antibiotikums auf. Beschreibe die Wirkungsweise anhand einer modellhaften Darstellung.

Abb. 1: Strukturformeln von Sulfamethoxydiazin (links) und 4-Aminobenzoesäure (rechts)
(6 BE)
2
Wird bei der Milchviehhaltung zur Vorbeugung von Krankheiten das Antibiotikum Penicillin verabreicht, so kann es auch in die Milch gelangen. Um dennoch die strengen Richtwerte zum Antibiotika-Gehalt von Milch einzuhalten, kann ihr das Penicillin spaltende Enzym  -Lactamase beigemengt werden. Abbildung 2 zeigt die Ergebnisse eines Experiments zum Abbau von Penicillin durch
-Lactamase beigemengt werden. Abbildung 2 zeigt die Ergebnisse eines Experiments zum Abbau von Penicillin durch  -Lactamase:
-Lactamase:
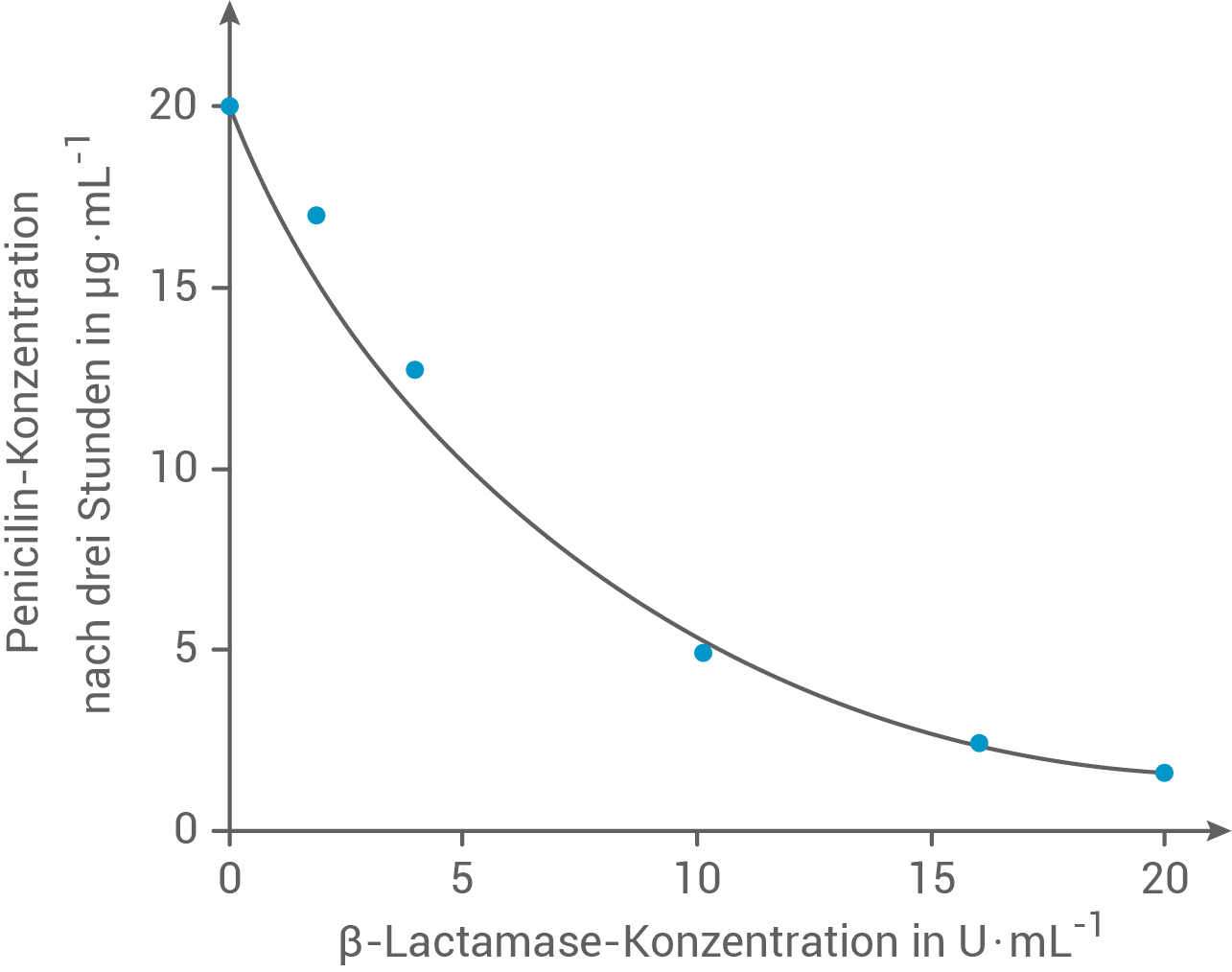

Abb. 2: Abbau von Penicillin durch  -Lactamase (Hinweis:
-Lactamase (Hinweis:  ist eine enzymspezifische Einheit für die Konzentration.)
verändert nach: https://www.sciencedirect.com/science/article/pii/ S0022030215000740\#fig0010, zuletzt aufgerufen am 26.10.2021
ist eine enzymspezifische Einheit für die Konzentration.)
verändert nach: https://www.sciencedirect.com/science/article/pii/ S0022030215000740\#fig0010, zuletzt aufgerufen am 26.10.2021
2.1
Plane eine Versuchsreihe, mit der man die in Abbildung 2 dargestellten Werte ermitteln kann.
(4 BE)
2.2
Begründe den Kurvenverlauf mithilfe der Stoßtheorie.
(4 BE)
2.3
Berechnen die mittlere Reaktionsgeschwindigkeit des Penicillinabbaus bei einer  -Lactamase-Konzentration von
-Lactamase-Konzentration von 
(4 BE)
3
Lariatin A (Abb.3) ist ein Polypeptid-Antibiotikum. Das Molekül besteht aus 18 Aminosäure-Bausteinen und gehört aufgrund seiner an ein Lasso erinnernden Struktur zu den sogenannten Lasso-Peptiden:
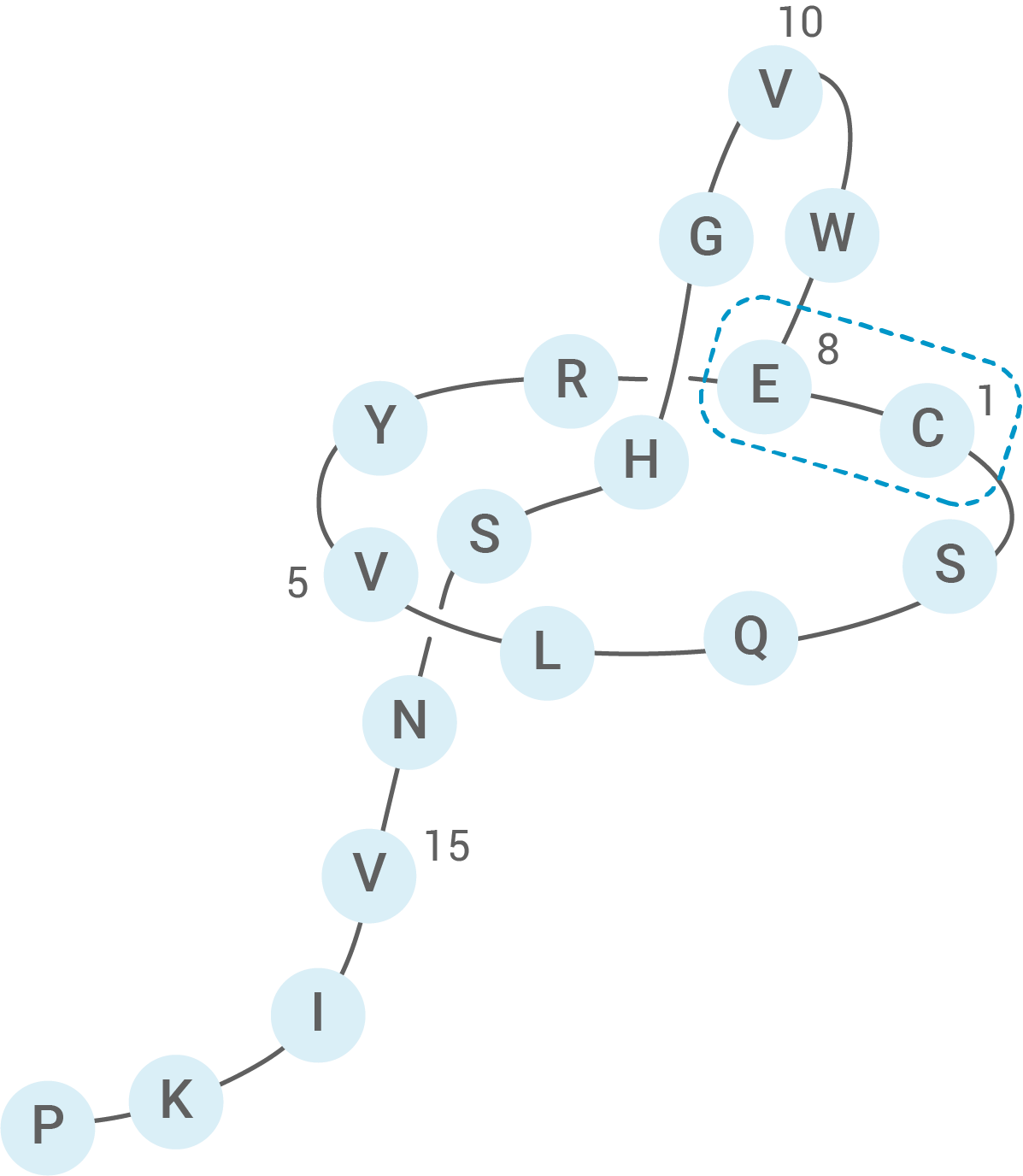

Abb. 3: Aminosäuresequenz des Lasso-Peptids Lariatin A
Junji Inokoshi & Maki Matsuhama & Midori Miyake & Haruo Ikeda & Hiroshi Tomoda: Molecular cloning of the gene cluster for lariatin biosynthesis of Rhodococcus jostii K01-B0171, Appl Microbiol Biotechnol (2012) 95:451-46, Springer, https://www.researchgate.net/ publication/221886389_Molecular _cloning_of_the_gene_cluster_for _lariatin_biosynthesis_of_ Rhodococcus_jostii_KOI-B0171, zuletzt aufgerufen am 26.10.2021
| Einbuchstaben- code |
Trivialname | systematischer Name |
|---|---|---|
| E | Glutamin-säure | 2-Aminopentandi- säure |
| G | Glycin | Aminoethan-säure |
Tab.: Einbuchstabencode, Trivialname und systematischer Name ausgewählter Aminosäuren
3.1
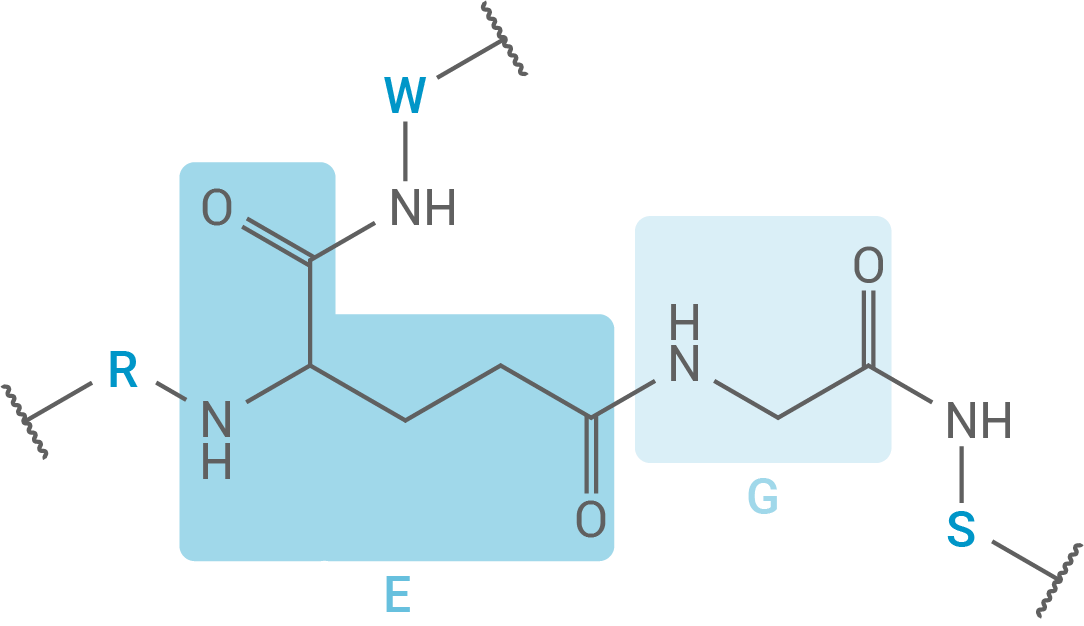
Die typische räumliche Struktur beruht auf einer Verzweigung in der linearen Aminosäurekette. Die Verknüpfung erfolgt über den Rest der Aminosäure 8. An dieser Stelle kommt es somit zu einer Ringbildung des Peptids und damit zur typischen Lasso-Struktur.
Zeichne einen Strukturformelausschnitt des gekennzeichneten Abschnitts des Lasso-Peptids. Markiere in deinem Strukturformelausschnitt, an welchen Stellen die Aminosäure-Bausteine S, R und W verknüpft sind.
Zeichne einen Strukturformelausschnitt des gekennzeichneten Abschnitts des Lasso-Peptids. Markiere in deinem Strukturformelausschnitt, an welchen Stellen die Aminosäure-Bausteine S, R und W verknüpft sind.
(6 BE)
3.2
Abbildung 4 zeigt eine Darstellung des räumlichen Baus eines Lariatin A-Moleküls, in der u. a. eine  -Faltblatt-Struktur erkennbar ist:
-Faltblatt-Struktur erkennbar ist:
 Vergleiche Abbildung 3 und 4 hinsichtlich der darin enthaltenen Informationen zu den Strukturebenen des Proteins. Beschreibe allgemein die Stabilisierung der
Vergleiche Abbildung 3 und 4 hinsichtlich der darin enthaltenen Informationen zu den Strukturebenen des Proteins. Beschreibe allgemein die Stabilisierung der  -Faltblatt-Struktur im Lariatin A-Molekül.
-Faltblatt-Struktur im Lariatin A-Molekül.

Abb. 4: Darstellung des räumlichen Baus eines Lariatin A-Moleküls
(5 BE)
3.3
Bei der Strukturanalyse von Peptiden kann ein Tris(hydroxymethyl)aminomethan-Puffer (= Tris-Puffer) eingesetzt werden. Die Strukturformel der Base Tris ist in Abbildung 5 dargestellt:


Abb. 5: Strukturformel der Tris-Base
3.3.1
Der pH-Wert eines Gemisches der Tris-Base und ihrer korrespondierenden Säure im Verhältnis 10:1 liegt bei 9,0. Berechne den  -Wert der Tris-Base.
-Wert der Tris-Base.
(5 BE)
3.3.2
Erkläre die Wirkungsweise des Tris-Puffers unter Verwendung von zwei Reaktionsgleichungen.
(5 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Wirkmechanismus des Antibiotikums
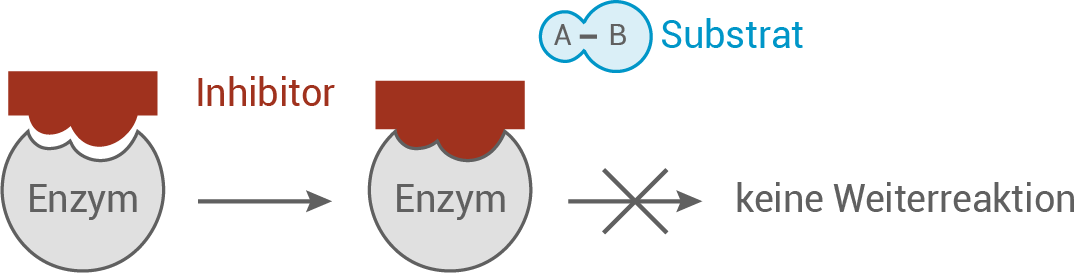
Das Substrat für das bakterielle Enzym Dihydropteroat-Synthase ist die 4-Aminobenzoesäure, welche strukturelle Ähnlichkeiten mit dem Antibiotikum Sulfamethoxydiazin aufweist, das ebenfalls einen aromatischen Rest mit einer Aminogruppe besitzt. Aufgrund dieser strukturellen Ähnlichkeit können beide Moleküle um die Bindungsstelle im aktiven Zentrum des bakteriellen Enzyms konkurrieren. Als Konsequenz wird die Synthese der für das Bakterium lebenswichtigen Folsäure gestört.
Aus dieser Beobachtung lässt sich die Hypothese ableiten, dass Sulfamethoxydiazin als kompetitiver Hemmstoff wirkt.
Reaktion:
Ohne das Vorhandensein des Hemmstoffs Sulfamethoxydiazin kann die 4-Aminobenzoesäure als Substrat ungehindert an das aktive Zentrum der Dihydropteroat-Synthase binden. Nach der Bildung des Enzym-Substrat-Komplexes erfolgt die enzymatisch katalysierte Reaktion, bei der das Produkt Folsäure abgespalten wird und das Enzym wieder für die Bindung eines neuen Substratmoleküls verfügbar ist.
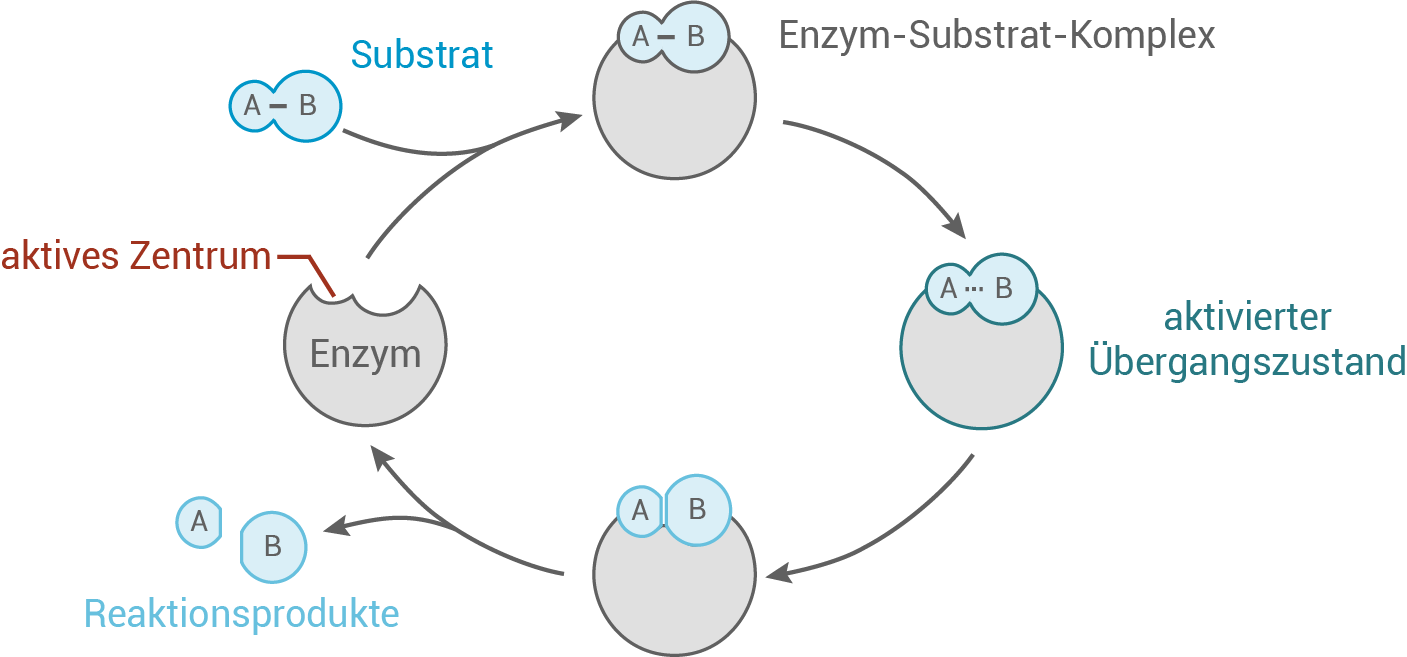 Inhibition:
Wenn Sulfamethoxydiazin zugeführt wird, besetzt das Antibiotikum das aktive Zentrum der Dihydropteroat-Synthase. Da nun das eigentliche Substrat nicht mehr in der Lage ist, an das Enzym zu binden, fungiert Sulfamethoxydiazin als Inhibitor. Die enzymatische Reaktion kann nicht mehr stattfinden, was zur Folge hat, dass keine Folsäure gebildet wird. Mit steigender Konzentration des Antibiotikums werden mehr Enzymmoleküle blockiert, was letztendlich dazu führt, dass die Reaktion zum Erliegen kommt.
Inhibition:
Wenn Sulfamethoxydiazin zugeführt wird, besetzt das Antibiotikum das aktive Zentrum der Dihydropteroat-Synthase. Da nun das eigentliche Substrat nicht mehr in der Lage ist, an das Enzym zu binden, fungiert Sulfamethoxydiazin als Inhibitor. Die enzymatische Reaktion kann nicht mehr stattfinden, was zur Folge hat, dass keine Folsäure gebildet wird. Mit steigender Konzentration des Antibiotikums werden mehr Enzymmoleküle blockiert, was letztendlich dazu führt, dass die Reaktion zum Erliegen kommt.


2.1
Planung einer Versuchsreihe
Das Experiment zielt darauf ab, den Abbau von Penicillin durch das Enzym  -Lactamase in Bezug auf die Enzymkonzentration zu untersuchen.
-Lactamase in Bezug auf die Enzymkonzentration zu untersuchen.
Die Kurve aus Abbildung 2 zeigt sechs Messpunkte, weshalb eine Versuchsreihe mit sechs Ansätzen geeignet ist. Jeder Ansatz enthält dabei dieselbe Ausgangskonzentration des Substrats Penicillin. Die Enzymkonzentration der
der  -Lactamase wird in den sechs Ansätzen gemäß der
-Lactamase wird in den sechs Ansätzen gemäß der  -Achse des Diagramms in Abbildung 2 ausgewählt:
-Achse des Diagramms in Abbildung 2 ausgewählt:
Alle sechs Ansätze werden nun drei Stunden lang inkubiert und anschließend wird die verbleibende Konzentration von Penicillin gemessen. Wichtig ist dabei, dass die Bedingungen, also Temperatur, Druck, etc., bei allen Ansätzen gleich sind.
Die Messwerte werden in Bezug gegen die Enzymkonzentration in den jeweiligen Ansätzen aufgetragen, wodurch das Diagramm in Abbildung 2 entsteht.
Die Kurve aus Abbildung 2 zeigt sechs Messpunkte, weshalb eine Versuchsreihe mit sechs Ansätzen geeignet ist. Jeder Ansatz enthält dabei dieselbe Ausgangskonzentration des Substrats Penicillin. Die Enzymkonzentration
| Ansatz 1 | Kein Enzym |
|---|---|
| Ansatz 2 | |
| Ansatz 3 | |
| Ansatz 4 | |
| Ansatz 5 | |
| Ansatz 6 |
Die Messwerte werden in Bezug gegen die Enzymkonzentration in den jeweiligen Ansätzen aufgetragen, wodurch das Diagramm in Abbildung 2 entsteht.
2.2
Begründung des Kurvenverlaufs
Im Diagramm ist zu sehen, dass mit zunehmender Konzentration des Enzyms  -Lactamase die verbleibende Menge an Penicillin in den Versuchsansätzen nach einer Inkubationszeit von drei Stunden abnimmt.
Als Grundlage zur Erklärung auf Teilchenebene dient die Stoßtheorie, nach welcher Teilchen wirksam zusammenstoßen müssen, damit eine chemische Reaktion stattfindet. Dabei wird angenommen, dass die Teilchen sich in einer ungeordneten Bewegung befinden. Je höher die Konzentration der Enzymmoleküle in der Reaktionslösung, desto wahrscheinlicher trifft ein Substratmolekül mit einer ausreichend hohen Energie (Aktivierungsenergie) in der richtigen Ausrichtung auf ein Enzymmolekül. Mit einer höheren Enzymkonzentration erhöht sich daher die Anzahl erfolgreicher Zusammenstöße in derselben Zeitspanne und folglich steigt damit auch die Reaktionsgeschwindigkeit. Dies erklärt, warum nach derselben Inkubationszeit von drei Stunden in den Ansätzen mit höherer
-Lactamase die verbleibende Menge an Penicillin in den Versuchsansätzen nach einer Inkubationszeit von drei Stunden abnimmt.
Als Grundlage zur Erklärung auf Teilchenebene dient die Stoßtheorie, nach welcher Teilchen wirksam zusammenstoßen müssen, damit eine chemische Reaktion stattfindet. Dabei wird angenommen, dass die Teilchen sich in einer ungeordneten Bewegung befinden. Je höher die Konzentration der Enzymmoleküle in der Reaktionslösung, desto wahrscheinlicher trifft ein Substratmolekül mit einer ausreichend hohen Energie (Aktivierungsenergie) in der richtigen Ausrichtung auf ein Enzymmolekül. Mit einer höheren Enzymkonzentration erhöht sich daher die Anzahl erfolgreicher Zusammenstöße in derselben Zeitspanne und folglich steigt damit auch die Reaktionsgeschwindigkeit. Dies erklärt, warum nach derselben Inkubationszeit von drei Stunden in den Ansätzen mit höherer  -Lactamase-Konzentration weniger Penicillin vorhanden ist. Durch die erhöhte Reaktionsgeschwindigkeit wurden mehr Substratmoleküle von den Enzymmolekülen umgesetzt.
-Lactamase-Konzentration weniger Penicillin vorhanden ist. Durch die erhöhte Reaktionsgeschwindigkeit wurden mehr Substratmoleküle von den Enzymmolekülen umgesetzt.
2.3
Berechnung der mittleren Reaktionsgeschwindigkeit
Für die Berechnung der mittleren Reaktionsgeschwindigkeit des Penicillinabbaus bei einer  -Lactamase-Konzentration von
-Lactamase-Konzentration von  wird die Reaktionsdauer
wird die Reaktionsdauer  und die entsprechende Veränderung der Edukt-Konzentration
und die entsprechende Veränderung der Edukt-Konzentration  benötigt.
Aus dem Diagramm ergibt sich:
benötigt.
Aus dem Diagramm ergibt sich:

![\(\begin{array}[t]{rll}
\Delta c &=& c_0\,\text{(Penicillin)} - c_3\,\text{(Penicillin)}& \\[5pt]
&=& 20\,\text{μg} \cdot \text{mL}^{-1} - 5\,\text{μg} \cdot \text{mL}^{-1}& \\[5pt]
&=& 15\,\text{μg} \cdot \text{mL}^{-1}
\end{array}\)](https://mathjax.schullv.de/d6a931056b1f890589213f6eebe622dabaa30a0569a5d5cdf6ac6e3ab289db48?color=5a5a5a) Für die mittlere Reaktionsgeschwindigkeit
Für die mittlere Reaktionsgeschwindigkeit  folgt:
folgt:
![\(\begin{array}[t]{rll}
\bar{v}&=& \dfrac{\Delta c}{\Delta t} & \\[5pt]
&=&\dfrac{15\,\text{μg} \cdot \text{mL}^{-1}}{3\,\text{h}} & \\[5pt]
&=& 5\,\text{μg} \cdot \text{mL}^{-1} \cdot\text{h}^{-1}
\end{array}\)](https://mathjax.schullv.de/7f664235794a94f859d2654380b4e4fd0951cfdf25f1375c54075d1da75a79cc?color=5a5a5a) Die mittlere Reaktionsgeschwindigkeit bei einer
Die mittlere Reaktionsgeschwindigkeit bei einer  -Lactamase-Konzentration von
-Lactamase-Konzentration von  beträgt
beträgt 
3.1
Strukturformelausschnitt des Lasso-Peptids

3.2
Vergleich der Abbildungen
In Abbildung 3 ist die Abfolge der miteinander verbundenen Bausteine von Aminosäuren zu sehen. Diese erkennbare Aminosäuresequenz stellt die Primärstruktur des Polypeptid-Antibiotikums Lariatin A dar.
In Abbildung 4 ist diese Abfolge nicht ersichtlich, sondern zeigt eine durch Wasserstoffbrücken stabilisierte -Faltblattstruktur. Die beiden antiparallelen Pfeile verdeutlichen diese Struktur.
-Faltblattstruktur. Die beiden antiparallelen Pfeile verdeutlichen diese Struktur.
Zudem ist in beiden Abbildungen die Tertiärstruktur erkennbar, welche die Faltung des gesamten Peptids beschreibt. Diese Struktur wird durch Wechselwirkungen zwischen den Aminosäureresten in der Peptidkette stabilisiert. Beschreibung der -Faltblatt Stabilisierung
Die Stabilisierung erfolgt durch Wasserstoffbrücken zwischen den Peptidbindungen. Dies geschieht durch eine intramolekulare Wechselwirkung, bei der ein freies Elektronenpaar eines Sauerstoffatoms und ein benachbartes Stickstoffatom in einer Peptidbindung interagieren.
-Faltblatt Stabilisierung
Die Stabilisierung erfolgt durch Wasserstoffbrücken zwischen den Peptidbindungen. Dies geschieht durch eine intramolekulare Wechselwirkung, bei der ein freies Elektronenpaar eines Sauerstoffatoms und ein benachbartes Stickstoffatom in einer Peptidbindung interagieren.
In Abbildung 4 ist diese Abfolge nicht ersichtlich, sondern zeigt eine durch Wasserstoffbrücken stabilisierte
Zudem ist in beiden Abbildungen die Tertiärstruktur erkennbar, welche die Faltung des gesamten Peptids beschreibt. Diese Struktur wird durch Wechselwirkungen zwischen den Aminosäureresten in der Peptidkette stabilisiert. Beschreibung der
3.3.1
Berechnung des  -Werts
Für die Berechnung des
-Werts
Für die Berechnung des  -Werts der Tris-Base
-Werts der Tris-Base  wird zunächst der
wird zunächst der  -Wert der korrespondierenden Säure Tris-Säure
-Wert der korrespondierenden Säure Tris-Säure  mithilfe der Henderson-Hasselbalch-Gleichung bestimmt.
Mit dem gegebenen Konzentrationsverhältnis und dem pH-Wert von
mithilfe der Henderson-Hasselbalch-Gleichung bestimmt.
Mit dem gegebenen Konzentrationsverhältnis und dem pH-Wert von  gilt:
gilt:
![\(\begin{array}[t]{rll}
pK_S&=& pH - \lg \dfrac{c(H\,\text{Tris})}{(\text{Tris}^-)}& \\[5pt]
&=& 9 - \lg\dfrac{10}{1} & \\[5pt]
&=& 8
\end{array}\)](https://mathjax.schullv.de/6278a104ce5f468ba6bb15d145b9c45ce6dabe8bc62e7f25a497727ba8283c3d?color=5a5a5a) Daraus folgt:
Daraus folgt:
![\(\begin{array}[t]{rll}
pK_B&=& 14 - pK_S & \\[5pt]
&=& 14 - 8 & \\[5pt]
&=& 6
\end{array}\)](https://mathjax.schullv.de/b50044be9cf040c9625ff6879ffea5bc1b254ba0ed611019a2d137295215c6df?color=5a5a5a) Der
Der  -Wert der Tris-Base beträgt
-Wert der Tris-Base beträgt 
3.3.2
Wirkungsweise des Tris-Puffers
Der Tris-Puffer ist eine Mischung aus einer schwachen Säure und ihrer korrespondierenden Base. Er dient dazu, den pH-Wert einer Lösung stabil zu halten, wenn Säuren oder Basen zugegeben werden, indem er die zugefügten Oxonium- oder Hydroxid-Ionen abfängt.
In der wässrigen Tris-Pufferlösung liegt folgendes Gleichgewicht vor:


 Wenn die Konzentration der Oxonium-Ionen durch die Zugabe einer Säure erhöht wird, wird die Rückreaktion gemäß dem Prinzip des kleinsten Zwangs verstärkt. Daraufhin werden die zugefügten Oxonium-Ionen durch die Puffer-Base
Wenn die Konzentration der Oxonium-Ionen durch die Zugabe einer Säure erhöht wird, wird die Rückreaktion gemäß dem Prinzip des kleinsten Zwangs verstärkt. Daraufhin werden die zugefügten Oxonium-Ionen durch die Puffer-Base  verbraucht:
verbraucht:


 Wenn allerdings Hydroxid-Ionen zugegeben werden, findet eine Reaktion mit der Puffersäure
Wenn allerdings Hydroxid-Ionen zugegeben werden, findet eine Reaktion mit der Puffersäure  statt:
statt:


 Beides mal wird Wasser gebildet, wodurch die zugegebene Säure oder Base durch die Pufferlösung neutralisiert wird. Darüber hinaus entsteht entweder die Säure
Beides mal wird Wasser gebildet, wodurch die zugegebene Säure oder Base durch die Pufferlösung neutralisiert wird. Darüber hinaus entsteht entweder die Säure  oder ihre korrespondierende Base
oder ihre korrespondierende Base  Trotz der erhöhten Konzentration der Pufferbestandteile bleibt der pH-Wert der Lösung unverändert.
Trotz der erhöhten Konzentration der Pufferbestandteile bleibt der pH-Wert der Lösung unverändert.

