C1 Thermopapier
Einkaufsbelege werden oft auf Thermopapier gedruckt, das aus mehreren Schichten aufgebaut ist (Abb. 1). Die thermoaktive Schicht enthält ein Gemisch aus drei Komponenten: einen pH-empfindlichen Farbstoff, einen schwach sauren Farbentwickler und ein bei Raumtemperatur festes Lösemittel.
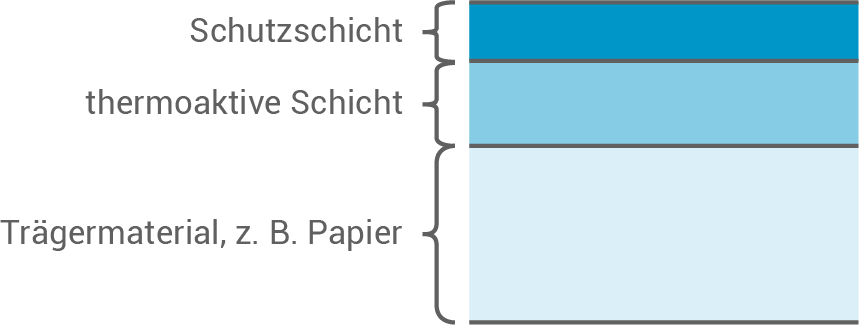

Abb. 1: Modelldarstellung des Aufbaus eines Thermopapiers
Jonas, A., Rubner, L., \& Oetken, M. (2020). Thermochromie und die Funktionsweise von Thermopapier: Das Experiment. Chemie in unserer Zeit, 54(3), 166 - 174.
1
Als pH-empfindlicher Farbstoff wird beispielsweise Kristallviolett-Carboxylat (KVC) verwendet. Dies liegt zunächst als farbloses Kristallviolett-Lacton (KVL) vor. Durch eine säurekatalysierte Reaktion entsteht der violette Farbstoff KVC (Abb. 2).
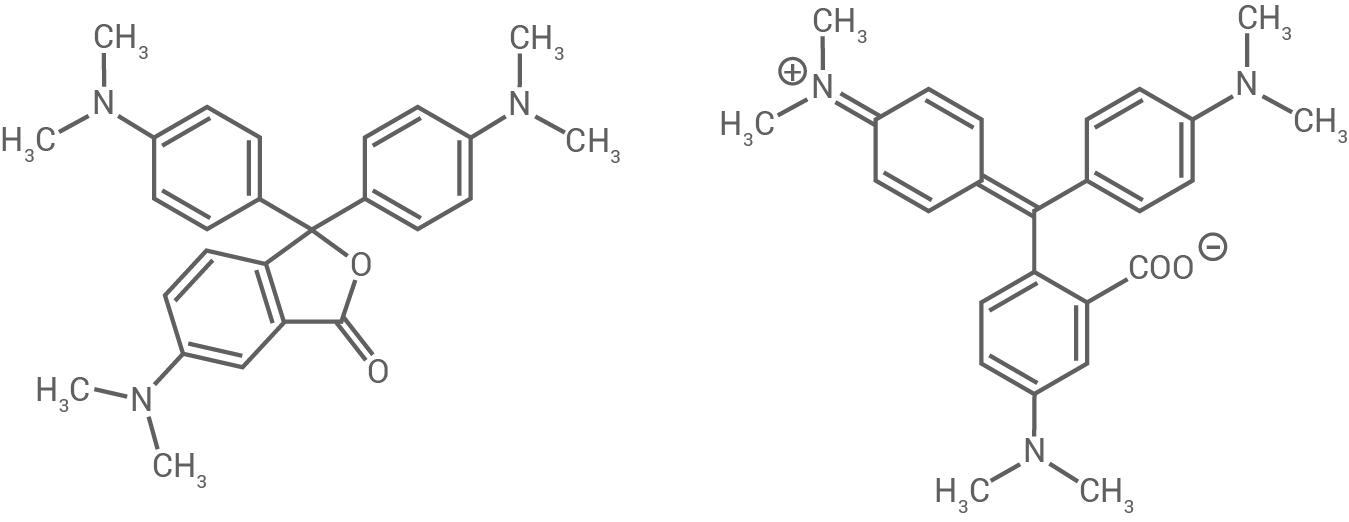

Abb. 2: Strukturformeln von Kristallviolett-Lacton (KVL) links sowie Kristallviolett-Carboxylat (KVC) rechts
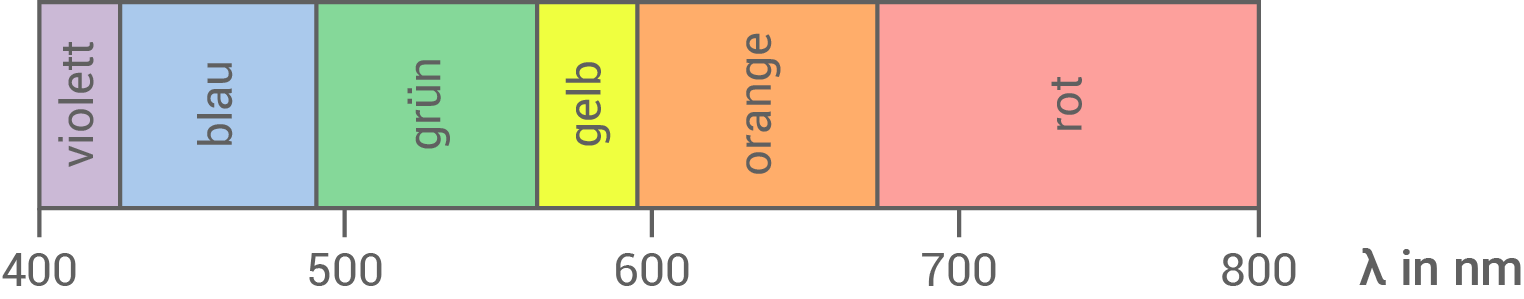
Tab. 1: Mögliche Reaktionsbedingungen in einem Ammoniak-Cracker
| Wellenlänge des absorbierten Lichts in nm |
Farbe des absorbierten Lichts | Komplementär- farbe |
|---|---|---|
| Violett | Gelb | |
| Blau | Orange | |
| Blaugrün | Rot | |
| Gelbgrün | Purpur | |
| Gelb | Violett | |
| Orange | Blau | |
| Rot | Blaugrün |
1.1
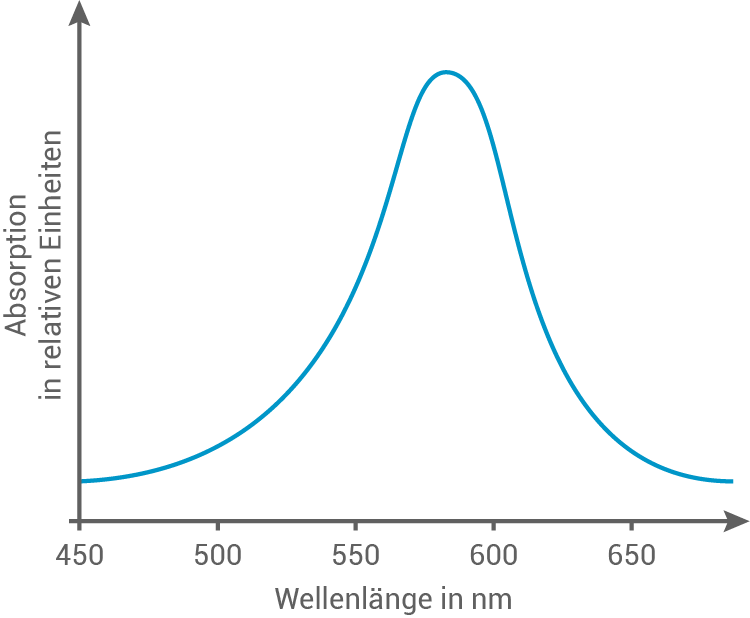
Skizziere mithilfe von Tabelle 1 ein passendes Absorptionsspektrum von KVC.
(4 BE)
1.2
Erkläre anhand der Strukturformeln in Abbildung 2 die unterschiedliche Farbigkeit von KVL und KVC.
(6 BE)
2
Beim Bedrucken von Thermopapier wird dieses an den Stellen erhitzt, die gefärbt werden sollen. Die dabei auftretenden Veränderungen sind in Abbildung 3 modellhaft dargestellt.
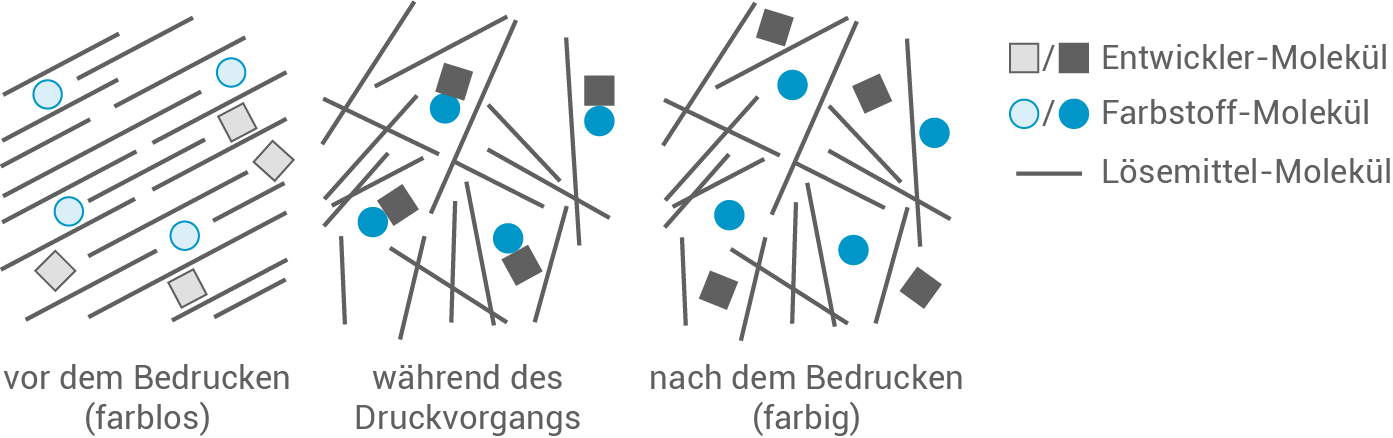

Abb. 3: Modelldarstellung zu Veränderungen in der thermoaktiven Schicht
nach: hittps://static.spektrum.de/fm/976/Magische_ Acetondaempfe _Spektrum_Online.pdf, 17.04.2023.
2.1
Erkläre mithilfe von Abbildung 3 die auftretende Färbung des Thermopapiers beim Erhitzen.
(4 BE)
2.2
Als Entwickler-Komponente im Thermopapier wird Gallussäureoctylester eingesetzt. Im Gegensatz zu Glycerin (Propan-1,2,3-triol) reagiert Gallussäureoctylester mit Wasser schwach sauer:
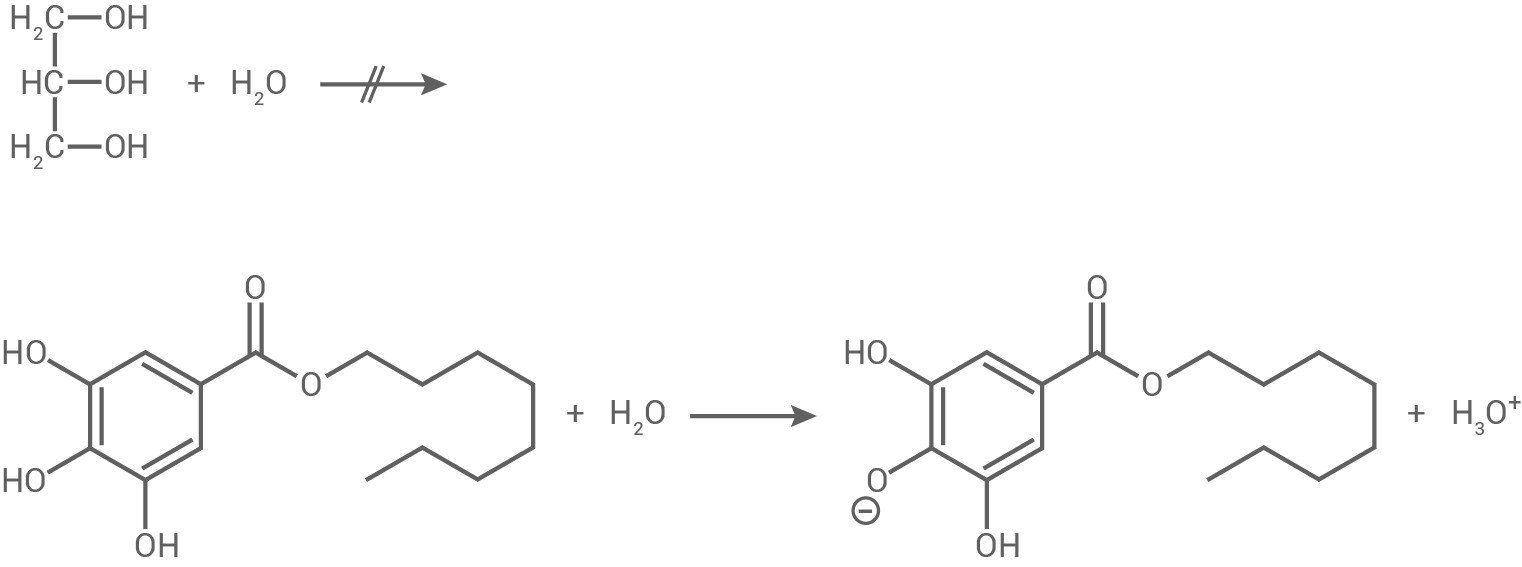 Erkläre das in Abbildung 4 dargestellte unterschiedliche Reaktionsverhalten von Glycerin und Gallussäureoctylester.
Erkläre das in Abbildung 4 dargestellte unterschiedliche Reaktionsverhalten von Glycerin und Gallussäureoctylester.

Abb. 4: Reaktionsverhalten von Glycerin und Gallussäureoctylester mit Wasser
(4 BE)
3
Bei der Herstellung des Papiers, das im Thermopapier als Trägermaterial dient, kommen verschiedene Chemikalien zum Einsatz. So werden der Papiermasse u.a. Tenside zugesetzt, die für eine gleichmäßige Verteilung der Papierfasern sorgen.
3.1
Durch den Einsatz von Tensiden kann es bei der Papierherstellung zur Schaumbildung kommen. In Abbildung 5 ist der Aufbau einer Schaumbalse modellhaft dargestellt.
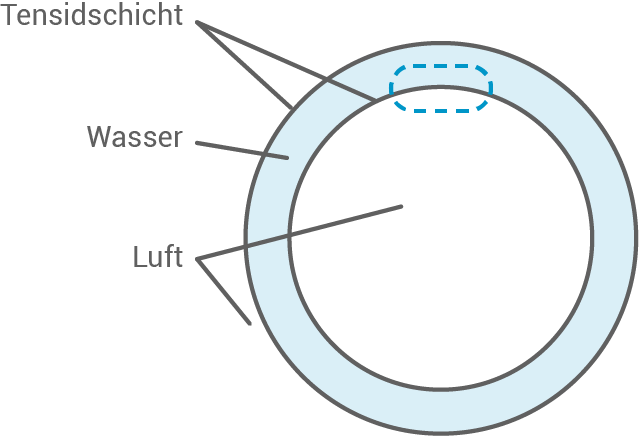 Stelle den in Abbildung 5 markierten Ausschnitt an der Grenze zwischen Wasser und Luft in einer beschrifteten Skizze auf Teilchenebene dar. Begründe die von dir gewählte Anordnung der Tensid-Moleküle.
Stelle den in Abbildung 5 markierten Ausschnitt an der Grenze zwischen Wasser und Luft in einer beschrifteten Skizze auf Teilchenebene dar. Begründe die von dir gewählte Anordnung der Tensid-Moleküle.

Abb. 5: Modelldarstellung zum Aufbau einer Schaumblase
(6 BE)
3.2
Da die Schaumbildung die weiteren Arbeitsprozesse behindert, werden sogenannte Entschäumer wie z.B. Tributylphosphat (TBP) zugesetzt:
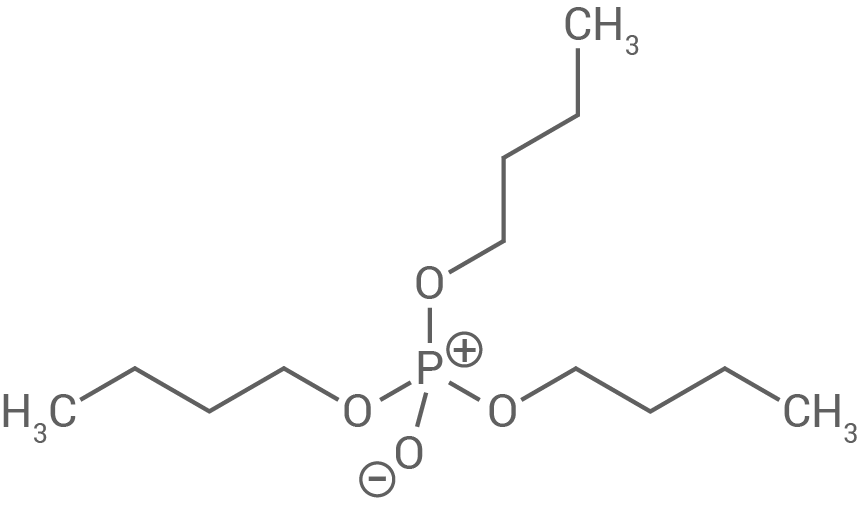 Zeichne die Strukturformel eines natürlich vorkommenden Fett-Moleküls. Vergleiche dessen Molekülstruktur mit der eines TBP-Moleküls (Abb. 6) anhand von drei Merkmalen.
Zeichne die Strukturformel eines natürlich vorkommenden Fett-Moleküls. Vergleiche dessen Molekülstruktur mit der eines TBP-Moleküls (Abb. 6) anhand von drei Merkmalen.

Abb. 6: Strukturformel von Tributylphosphat
(6 BE)
4
Das in der Trägerschicht des Thermopapiers verwendete Papier besteht zum Teil aus dem Polysaccharid Arabinogalactan, das hauptsächlich aus β-1,3-glykosidisch verknüpften D-Galactopyranose-Bausteinen aufgebaut ist. D-Galactose-Moleküle unterscheiden sich von D-Glucose-Molekülen durch die Stellung der Hydroxygruppe am C4-Atom.
4.1
Zeichne einen aus zwei Galactopyranose-Bausteinen bestehenden Strukturformelausschnitt von Arabinogalactan in der Haworth-Projektion.
(5 BE)
4.2
Mit der bei der hydrolytischen Spaltung des Arabinogalactans entstehenden D-Galactose wird die Nylander-Probe durchgeführt. Diese läuft analog zur Silberspiegelprobe ab, wobei statt Silber-Ionen Bismut(III)-Ionen  eingesetzt werden. Bei positivem Nachweis bilden sich Bismut-Atome.
eingesetzt werden. Bei positivem Nachweis bilden sich Bismut-Atome.
Formuliere die Teilgleichungen für die ablaufende Reaktion. Nicht beteiligte Molekülteile können mit R abgekürzt werden.
Formuliere die Teilgleichungen für die ablaufende Reaktion. Nicht beteiligte Molekülteile können mit R abgekürzt werden.
(5 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Absorptionsspektrum von KVC


1.2
Erklärung der unterschiedlichen Farbigkeit von KVL und KVC
KVL besitzt eine Lacton-Struktur, die keine ausgedehnten delokalisierten  -Elektronensysteme aufweist. Dadurch kann KVL kein sichtbares Licht absorbieren und erscheint daher farblos.
Im Gegensatz dazu liegt bei KVC eine Carboxylat-Struktur vor, die ein ausgedehntes delokalisiertes
-Elektronensysteme aufweist. Dadurch kann KVL kein sichtbares Licht absorbieren und erscheint daher farblos.
Im Gegensatz dazu liegt bei KVC eine Carboxylat-Struktur vor, die ein ausgedehntes delokalisiertes  -Elektronensystem aufweist. Dieses System ermöglicht die Absorption von sichtbarem Licht, insbesondere im violetten Bereich, wodurch KVC als gelb wahrgenommen wird. Die Struktur und das Ausmaß der Elektronendelokalisation sind entscheidend für die Farbigkeit der Substanzen.
-Elektronensystem aufweist. Dieses System ermöglicht die Absorption von sichtbarem Licht, insbesondere im violetten Bereich, wodurch KVC als gelb wahrgenommen wird. Die Struktur und das Ausmaß der Elektronendelokalisation sind entscheidend für die Farbigkeit der Substanzen.
2.1
Erklärung der auftretenden Färbung des Thermopapiers beim Erhitzen
Thermopapier besteht aus einer thermoaktiven Schicht, die einen Farbstoff und einen Farbentwickler enthält. Beim Erhitzen schmilzt das Lösemittel in dieser Schicht und ermöglicht die chemische Reaktion zwischen Farbstoff und Farbentwickler. Diese Reaktion führt zur Bildung einer farbigen Verbindung, die durch die dabei entstehenden  -Systeme Licht im sichtbaren Bereich absorbiert. Dadurch wird die Oberfläche des Papiers sichtbar eingefärbt. Diese Eigenschaft macht Thermopapier ideal für den Einsatz in Thermodruckern.
-Systeme Licht im sichtbaren Bereich absorbiert. Dadurch wird die Oberfläche des Papiers sichtbar eingefärbt. Diese Eigenschaft macht Thermopapier ideal für den Einsatz in Thermodruckern.
2.2
Unterschiedliches Reaktionsverhalten von Glycerin und Gallussäureoctylester
Gallussäureoctylester enthält eine Carboxylgruppe, die durch Hydrolyse Protonen abgeben kann. Diese Protonenabgabe führt dazu, dass Gallussäureoctylester eine schwach saure Reaktion zeigt.
Glycerin hingegen besitzt keine funktionellen Gruppen, die Protonen abgeben können. Es handelt sich um ein neutrales Molekül mit drei Hydroxylgruppen, die nur als Wasserstoffbrücken-Donoren wirken. Daher zeigt Glycerin keine sauren Eigenschaften, sondern reagiert neutral.
3.1
Ausschnitt der Schaumblase
 Begründung der Tensid-Anordnung
Tensidmoleküle haben amphiphile Eigenschaften mit einem hydrophilen Kopf und einer hydrophoben Alkylkette. In wässriger Lösung ordnen sie sich so an, dass die hydrophilen Köpfe mit dem Wasser in Kontakt sind, während die hydrophoben Ketten in die Luft oder in unpolare Bereiche ragen. Diese Anordnung minimiert die freie Energie der Grenzfläche, da die unpolaren Ketten der Tenside nicht mit dem Wasser in Kontakt kommen. Dies erklärt auch ihre Funktion bei der Senkung der Oberflächenspannung.
Begründung der Tensid-Anordnung
Tensidmoleküle haben amphiphile Eigenschaften mit einem hydrophilen Kopf und einer hydrophoben Alkylkette. In wässriger Lösung ordnen sie sich so an, dass die hydrophilen Köpfe mit dem Wasser in Kontakt sind, während die hydrophoben Ketten in die Luft oder in unpolare Bereiche ragen. Diese Anordnung minimiert die freie Energie der Grenzfläche, da die unpolaren Ketten der Tenside nicht mit dem Wasser in Kontakt kommen. Dies erklärt auch ihre Funktion bei der Senkung der Oberflächenspannung.

3.2
Strukturformel eines natürlich vorkommenden Fett-Moleküls
Die Strukturformel eines natürlich vorkommenden Fett-Moleküls zeigt den Aufbau eines Triglycerids, das aus einem Glycerin-Molekül (Propan-1,2,3-triol) und drei Fettsäuren besteht, die durch Esterbindungen verbunden sind.
Die drei Fettsäuren können beispielsweise gesättigte Palmitinsäuren sein 
 Vergleich der Molekülstruktur von TBP und einem Fett-Molekül
TBP (Tributylphosphat) besitzt ein zentrales Phosphatatom, an das drei kurze Alkylketten gebunden sind. Fett-Moleküle hingegen bestehen aus einem Glycerin-Rückgrat, an das drei lange Fettsäurereste gebunden sind. Beide Moleküle sind amphiphil, da sie sowohl hydrophile als auch hydrophobe Teile besitzen. TBP ist jedoch deutlich kleiner und weniger komplex als ein Fett-Molekül. Die Struktur von TBP macht es besonders geeignet für den Einsatz als Lösungsmittel oder Additiv in der chemischen Industrie.
Vergleich der Molekülstruktur von TBP und einem Fett-Molekül
TBP (Tributylphosphat) besitzt ein zentrales Phosphatatom, an das drei kurze Alkylketten gebunden sind. Fett-Moleküle hingegen bestehen aus einem Glycerin-Rückgrat, an das drei lange Fettsäurereste gebunden sind. Beide Moleküle sind amphiphil, da sie sowohl hydrophile als auch hydrophobe Teile besitzen. TBP ist jedoch deutlich kleiner und weniger komplex als ein Fett-Molekül. Die Struktur von TBP macht es besonders geeignet für den Einsatz als Lösungsmittel oder Additiv in der chemischen Industrie.

Fett-Molekül am Beispiel von Glycerintripalmitat
4.1
Strukturformelausschnitt von Arabinogalactan
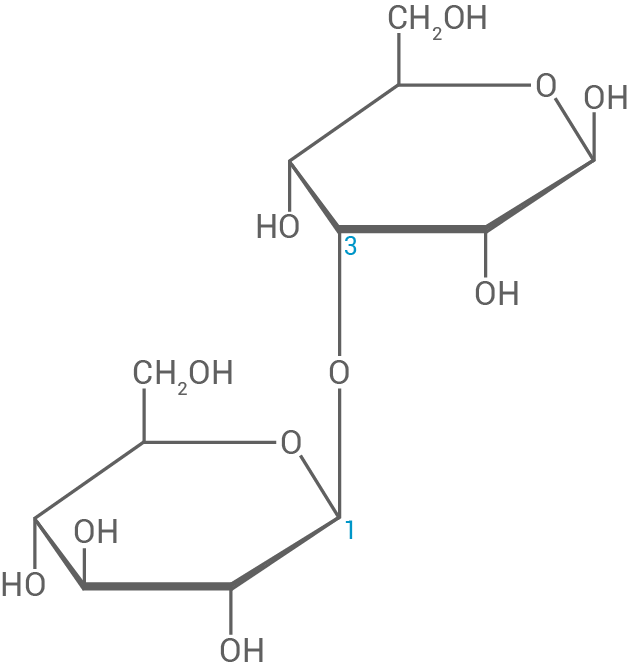

4.2
Teilgleichungen für die Nylander-Probe
Die Nylander-Probe beruht auf der Reduktion von Bismut(III)-Ionen zu elementarem Bismut und der gleichzeitigen Oxidation eines Aldehyds zu einer Carbonsäure. Dabei wird als Nachweis schwarzes elementares Bismut gebildet.