A1 Anammox-Bakterien
Stickstoff-Verbindungen werden in Kläranlagen durch Bakterien abgebaut. Anammox-Bakterien könnten in diesem Zusammenhang zukünftig eine Rolle spielen, da sie Ammonium-Salze über das giftige Zwischenprodukt Hydrazin zu Stickstoff umsetzen können.
1
Das als Zwischenprodukt auftretende Hydrazin  wird mithilfe des Enzyms Hydrazin-Dehydrogenase
wird mithilfe des Enzyms Hydrazin-Dehydrogenase  zu Stickstoff umgesetzt:
zu Stickstoff umgesetzt:



1.1
Zur Bestimmung der Aktivität der  wurde eine bestimmte Menge dieses Enzyms mit einer hydrazinhaltigen Lösung versetzt. Das Experiment wurde in einer Atmosphäre aus
wurde eine bestimmte Menge dieses Enzyms mit einer hydrazinhaltigen Lösung versetzt. Das Experiment wurde in einer Atmosphäre aus  Argon und
Argon und  Wasserstoff durchgeführt. Nach festgelegten Zeitabständen wurde jeweils die Stoffmenge an gebildetem Stickstoff bestimmt. Die Ergebnisse sind in Abbildung 1 dargestellt.
Wasserstoff durchgeführt. Nach festgelegten Zeitabständen wurde jeweils die Stoffmenge an gebildetem Stickstoff bestimmt. Die Ergebnisse sind in Abbildung 1 dargestellt.
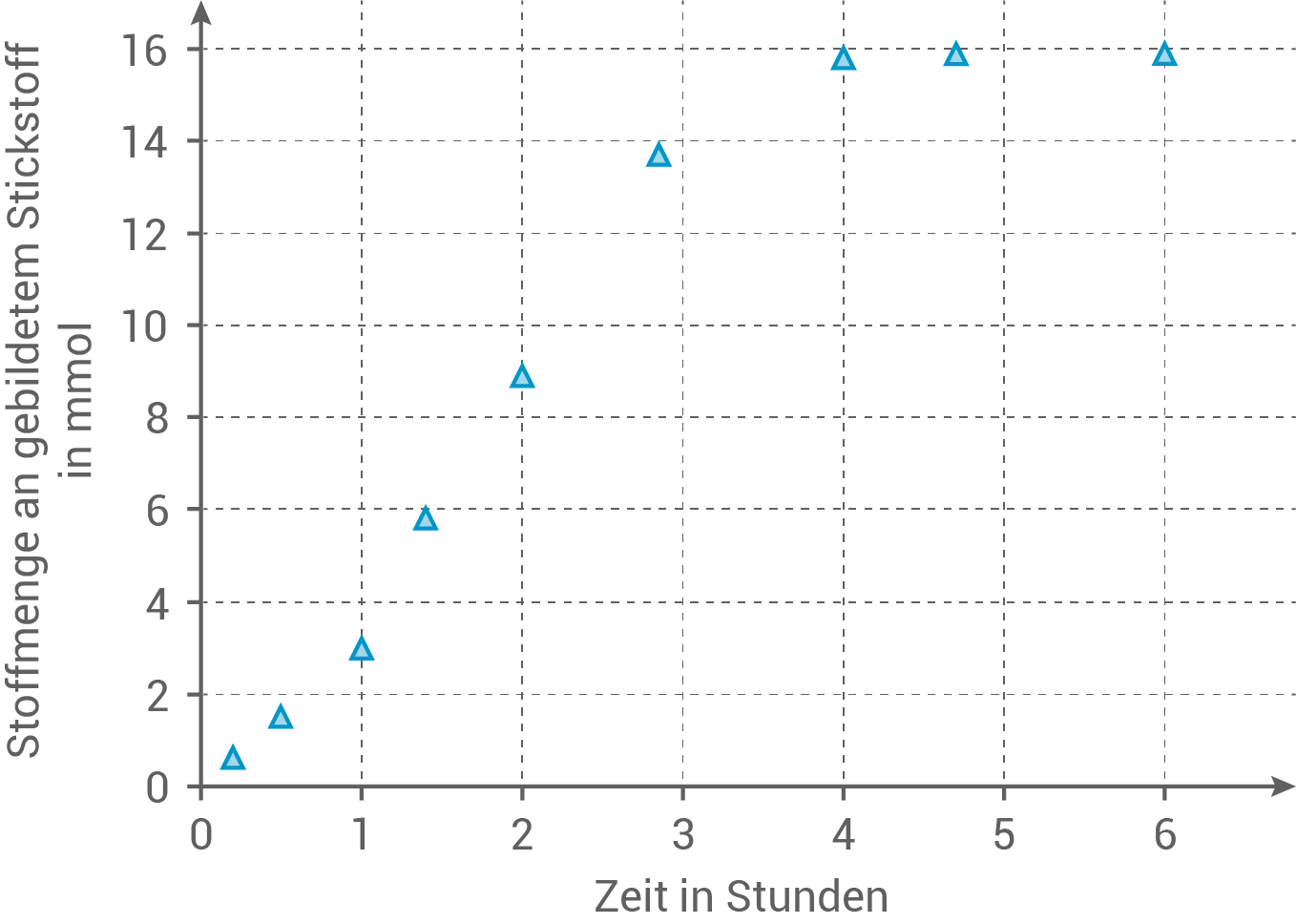

Abb. 1: Stoffmenge an gebildetem Stickstoff im Verlauf des Experiments
nach: Maalcke, W. J., Reimann, J., et al. (2016). Characterization of Anammox Hydrazine. Dehydrogenase, a Key N2-producing Enzyme in the Global Nitrogen Cycle. The Journal of biological chemistry, 291(33), 17077 - 17092
1.1.1
Ermittle unter Verwendung von Abbildung 1 die momentane Reaktionsgeschwindigkeit bei  und die durchschnittliche Reaktionsgeschwindigkeit während der ersten vier Stunden.
und die durchschnittliche Reaktionsgeschwindigkeit während der ersten vier Stunden.
(6 BE)
1.1.2
Ein zweites Experiment wurde bei ansonsten gleichen Bedingungen in einer Atmosphäre aus  Ethin durchgeführt. Die Reaktion im zweiten Experiment lief deutlich langsamer ab. Eine Erhöhung der Hydrazin-Konzentration konnte die verminderte Reaktionsgeschwindigkeit nicht ausgleichen.
Ethin durchgeführt. Die Reaktion im zweiten Experiment lief deutlich langsamer ab. Eine Erhöhung der Hydrazin-Konzentration konnte die verminderte Reaktionsgeschwindigkeit nicht ausgleichen.
Stelle anhand einer Modellvorstellung eine Hypothese zur Erklärung der veränderten Reaktionsgeschwindigkeit der von katalysierten Reaktion bei Anwesenheit von Ethin auf.
katalysierten Reaktion bei Anwesenheit von Ethin auf.
Stelle anhand einer Modellvorstellung eine Hypothese zur Erklärung der veränderten Reaktionsgeschwindigkeit der von
(5 BE)
1.2
Das giftige Hydrazin tritt in den Anammox-Bakterien nur in speziellen abgegrenzten Zellbereichen auf. Das  -Molekül besitzt einen speziellen Proteinabschnitt (Abb. 2), der die Aufnahme in diese Bereiche ermöglicht.
-Molekül besitzt einen speziellen Proteinabschnitt (Abb. 2), der die Aufnahme in diese Bereiche ermöglicht.
MRKFLKVTLASALIGCGVIGTV...
Abb. 2: Aminosäuresequenz des  -Proteinabschnitts mit Einbuchstabencode
-Proteinabschnitts mit Einbuchstabencode
Tab. 1: Einbuchstabencode, Trivialname und systematischer Name ausgewählter Aminosäuren
| Ein-buchstaben-code | Trivial-name | Systematischer Name |
|---|---|---|
| A | Alanin | 2-Aminopropansäure |
| G | Glycin | Aminoethansäure |
| I | Isoleucin | 2-Amino-3-methylpentansäure |
| L | Leucin | 2-Amino-4-methylpentansäure |
| S | Serin | 2-Amino-3-hydroxypropansäure |
1.2.1
Zeichne den Strukturformelausschnitt für den in Abbildung 2 hervorgehobenen Bereich der Aminosäuresequenz mithilfe von Tabelle 1.
(4 BE)
1.2.2
Beschreibe die Durchführung und die Beobachtung eines Experiments, mit dem der Proteincharakter des Enzyms  gezeigt werden kann.
gezeigt werden kann.
(4 BE)
2
Um die Menge des in Bakterien enthaltenen Hydrazins 

 bestimmen zu können, wird es zunächst isoliert. Eine solche aus Bakterien gewonnene wässrige Hydrazin-Lösung
bestimmen zu können, wird es zunächst isoliert. Eine solche aus Bakterien gewonnene wässrige Hydrazin-Lösung  wird mit Salzsäure
wird mit Salzsäure  titriert. Bis zum Erreichen des ersten Äquivalenzpunkts werden
titriert. Bis zum Erreichen des ersten Äquivalenzpunkts werden  Salzsäure verbraucht.
Salzsäure verbraucht.
2.1
Formuliere die Reaktionsgleichung für diese Titration und berechne die Konzentration an Hydrazin zu Beginn der Titration.
(6 BE)
2.2
Führt man bei Titrationen kontinuierlich Messwerterfassungen durch, können diese Messwerte in Titrationskurven dargestellt werden. Abbildung 3 zeigt die Titrationskurven von drei verschiedenen Titrationen.
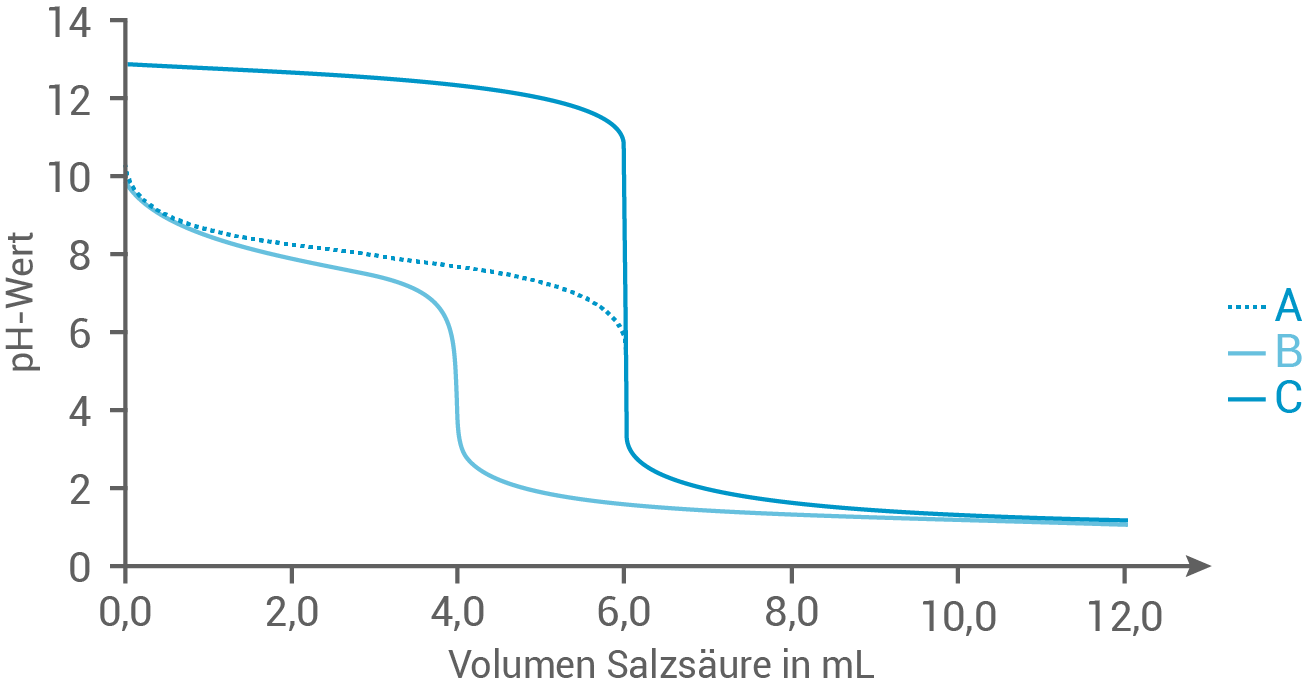 Ordne die oben beschriebene Titration von Hydrazin mit Salzsäure eine der Kurven begründet zu.
Ordne die oben beschriebene Titration von Hydrazin mit Salzsäure eine der Kurven begründet zu.

Abb. 3: Titrationskurven von drei verschiedenen Titrationen
(5 BE)
3
In herkömmlichen Kläranlagen werden Bakterien eingesetzt, die zum Abbau von Stickstoffverbindungen Sauerstoff benötigen. Um den Sauerstoff im Abwasser in ausreichendem Maß anzureichern, müssen elektrisch betriebene Umwälzpumpen eingesetzt werden. Bei Verwendung von Anammox-Bakterien sind diese nicht notwendig. Bei beiden Prozessen kann aus dem anfallenden Klärschlamm Strom erzeugt werden.
In Studien wurden beide Verfahren hinsichtlich der freigesetzten Gase sowie der entnommenen und eingespeisten elektrischen Energie verglichen.
In Studien wurden beide Verfahren hinsichtlich der freigesetzten Gase sowie der entnommenen und eingespeisten elektrischen Energie verglichen.
Tab. 2: Vergleich des herkömmlichen und des Anammox-Verfahrens hinsichtlich der Emission ausgewählter Gase bezogen auf  gereinigten Abwassers
nach: Weissenbacher, N., Wett, B., et al. (2013). Hauptstromdeammonifikation in Kläranlagen, Wien.
gereinigten Abwassers
nach: Weissenbacher, N., Wett, B., et al. (2013). Hauptstromdeammonifikation in Kläranlagen, Wien.
| Formeln der freigesetzten Gase | Emissionen in Gramm | |
|---|---|---|
| herkömmliches Verfahren | Anammox-Verfahren | |
Tab. 3: potenzieller Beitrag verschiedener Gase zum Treibhauseffekt in relativen Einheiten
| Gas | Formel | potenzieller Beitrag zum Treibhauseffekt in relativen Einheiten |
|---|---|---|
| Kohlenstoffdioxid | ||
| Methan | ||
| Lachgas |
Tab. 4: Vergleich des herkömmlichen und des Anammox-Verfahrens hinsichtlich der entnommenen und eingespeisten elektrischen Energie bezogen auf  gereinigten Abwassers
nach: Weissenbacher, N., Wett, B., et al. (2013). Hauptstromdeammonifikation in Kläranlagen, Wien.
gereinigten Abwassers
nach: Weissenbacher, N., Wett, B., et al. (2013). Hauptstromdeammonifikation in Kläranlagen, Wien.
| elektrische Energie in Wattstunden | ||
|---|---|---|
| herkömmliches Verfahren | Anammox-Verfahren | |
| aus dem Netz entnommen | ||
| ins Netz eingespeist | ||
3.1
Beurteile mithilfe der Tabellen 2, 3 und 4 den Einsatz des Anammox-Verfahrens als Alternative zum herkömmlichen Verfahren bezüglich wirtschaftlicher und ökologischer Aspekte.
(6 BE)
3.2
In einer ergänzenden Versuchsreihe zum Anammox-Verfahren wurden die Emissionen von Stickstoffmonoxid  und Lachgas
und Lachgas  bei verschiedenen Bedingungen genauer untersucht. Dabei wurde ein Reaktionsraum mit Abwasser und Anammox-Bakterien in drei aufeinanderfolgenden Versuchsabschnitten verschiedenen Sauerstoffkonzentrationen ausgesetzt. Die Ergebnisse der Emissionsmessungen sind in Abbildung 4 dargestellt.
bei verschiedenen Bedingungen genauer untersucht. Dabei wurde ein Reaktionsraum mit Abwasser und Anammox-Bakterien in drei aufeinanderfolgenden Versuchsabschnitten verschiedenen Sauerstoffkonzentrationen ausgesetzt. Die Ergebnisse der Emissionsmessungen sind in Abbildung 4 dargestellt.
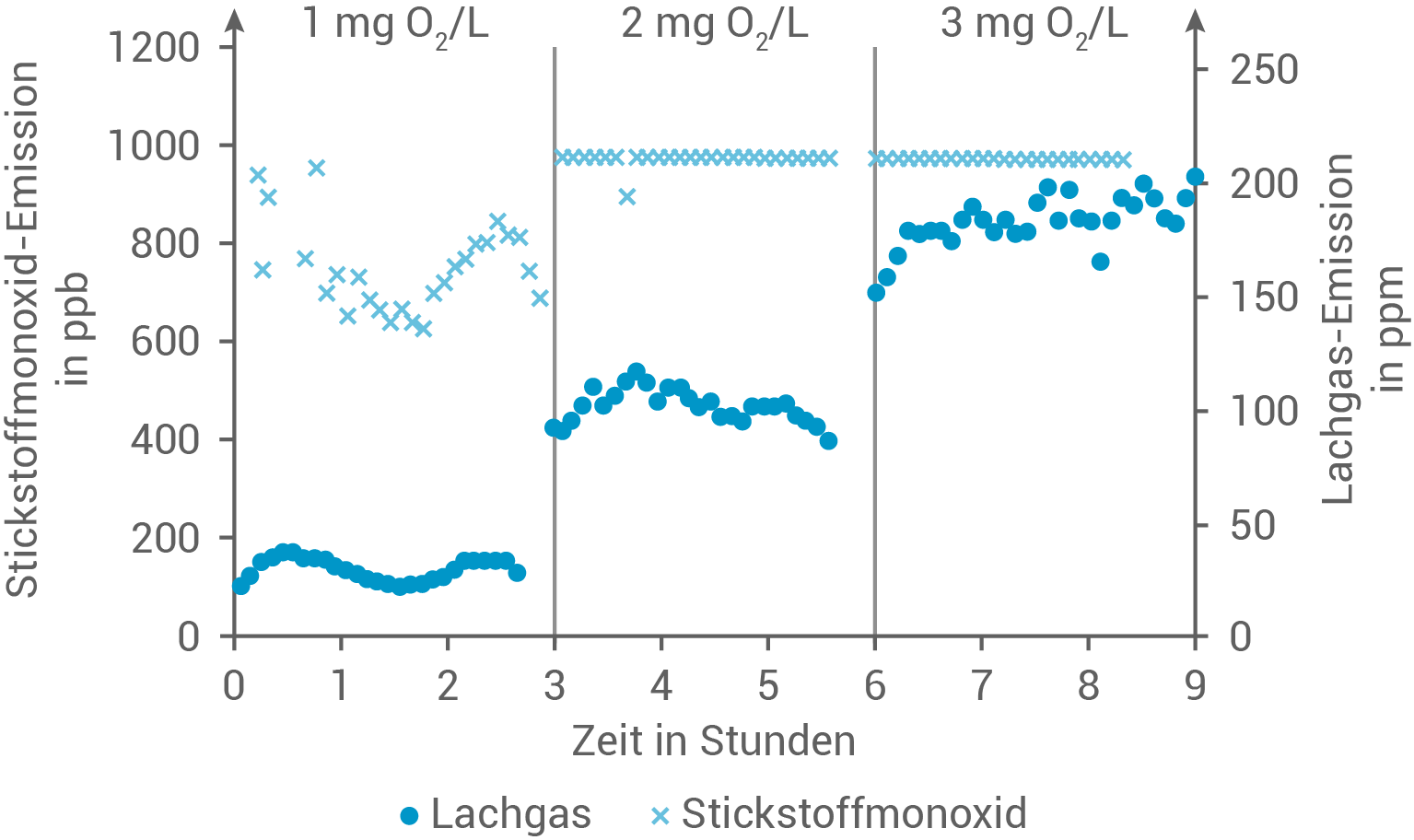 Beschreibe die Ergebnisse der Versuchsreihe. Formuliere eine Fragestellung, die der durchgeführten Versuchsreihe zugrunde liegen könnte.
Beschreibe die Ergebnisse der Versuchsreihe. Formuliere eine Fragestellung, die der durchgeführten Versuchsreihe zugrunde liegen könnte.

Abb. 4: Konzentration von Stickstoffmonoxid (ppb, parts per billion, Teilchen pro Milliarde) und Lachgas (ppm, parts per million, Teilchen pro Million) bei unterschiedlichen Sauerstoffkonzentrationen
nach: Weissenbacher, N., Wett, B., et al. (2013). Hauptstromdeammonifikation in Kläranlagen, Wien.
(4 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1.1
Momentane Reaktionsgeschwindigkeit bei 2 Stunden
Die momentane Reaktionsgeschwindigkeit wird als die Steigung der Tangente an der Kurve bei  betrachtet. Dafür werden die Werte bei
betrachtet. Dafür werden die Werte bei  und
und  für eine bessere Näherung verwendet:
für eine bessere Näherung verwendet:
![\(\begin{array}[t]{rlll}
v_{\text{momentan, 2h}}&=& \dfrac{6\, \text{mmol} - 2\, \text{mmol}}{3\, \text{h} - 1\, \text{h}} \\[5pt]
&=& \dfrac{4\, \text{mmol}}{2\, \text{h}} \\[5pt]
&=& 2\, \text{mmol} \cdot \text{h}^{-1}
\end{array}\)](https://mathjax.schullv.de/168b955b4918a22418bfec36746e815273eaf2669a8103e1b822603e1002d059?color=5a5a5a) Durchschnittliche Reaktionsgeschwindigkeit über vier Stunden
Die durchschnittliche Reaktionsgeschwindigkeit wird berechnet, indem die Änderung der Stickstoffmenge durch die Zeitdauer geteilt wird.
Mit
Durchschnittliche Reaktionsgeschwindigkeit über vier Stunden
Die durchschnittliche Reaktionsgeschwindigkeit wird berechnet, indem die Änderung der Stickstoffmenge durch die Zeitdauer geteilt wird.
Mit  und
und  ergibt sich:
ergibt sich:
![\(\begin{array}[t]{rlll}
v_{\text{durchschnitt}} &=& \dfrac{8\, \text{mmol} - 0\, \text{mmol}}{4\, \text{h} - 0\, \text{h}} \\[5pt]
&=& \dfrac{8\, \text{mmol}}{4\, \text{h}} \\[5pt]
&=& 2 \, \text{mmol} \cdot \text{h}^{-1}
\end{array}\)](https://mathjax.schullv.de/c0fd1c4d323a2dc1e94c101088513d318e86b06d27a1baaf604564cae48a55b7?color=5a5a5a) Die durchschnittliche Reaktionsgeschwindigkeit über die ersten vier Stunden und die momentane Reaktionsgeschwindigkeit bei zwei Stunden sind demnach gleich.
Die durchschnittliche Reaktionsgeschwindigkeit über die ersten vier Stunden und die momentane Reaktionsgeschwindigkeit bei zwei Stunden sind demnach gleich.
1.1.2
Hypothese zur Erklärung der veränderten Reaktionsgeschwindigkeit bei Anwesenheit von Ethin
Die Reaktion von Hydrazin zu Stickstoff, katalysiert durch das Enzym Hydrazin-Dehydrogenase, zeigt eine verringerte Geschwindigkeit in Gegenwart von Ethin, auch wenn die Konzentration von Hydrazin erhöht wird.
Eine Erklärung könnte die kompetitive Hemmung sein. Dabei agiert Ethin als kompetitiver Inhibitor, indem es die Bindungsstelle des Enzyms Hydrazin-Dehydrogenase blockiert. Dies würde verhindern, dass Hydrazin an das Enzym bindet und effektiv umgesetzt wird. Diese Blockade erklärt die beobachtete Reduktion der Reaktionsgeschwindigkeit, die nicht durch eine Erhöhung der Hydrazinkonzentration ausgeglichen werden konnte, da die aktiven Zentren des Enzyms durch Ethin besetzt waren.
Eine Erklärung könnte die kompetitive Hemmung sein. Dabei agiert Ethin als kompetitiver Inhibitor, indem es die Bindungsstelle des Enzyms Hydrazin-Dehydrogenase blockiert. Dies würde verhindern, dass Hydrazin an das Enzym bindet und effektiv umgesetzt wird. Diese Blockade erklärt die beobachtete Reduktion der Reaktionsgeschwindigkeit, die nicht durch eine Erhöhung der Hydrazinkonzentration ausgeglichen werden konnte, da die aktiven Zentren des Enzyms durch Ethin besetzt waren.
1.2.1
Strukturformelzeichnung der Aminosäuresequenz
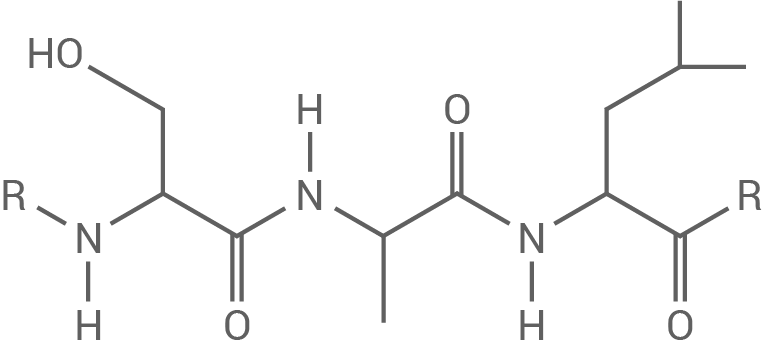

1.2.2
Experiment zur Bestimmung des Proteincharakters
Der Proteincharakter kann mithilfe der Biuret-Reaktion nachgewiesen werden.
Hierbei wird die zu untersuchende Halogenase-Lösung zunächst mit Natronlauge  versetzt. Anschließend wird die Biuret-Reagenz, eine Kupfer(II)-sulfat-Lösung, zur Probe gegeben. Der Proteincharakter zeigt sich durch eine Komplexbildung, die die Lösung blau-violett färbt. Bei einem negativen Test würde sich hingegen ein blauer Feststoff am Boden absetzen.
Eine weitere geeignete Nachweisreaktion ist die Xanthoprotein-Reaktion.
versetzt. Anschließend wird die Biuret-Reagenz, eine Kupfer(II)-sulfat-Lösung, zur Probe gegeben. Der Proteincharakter zeigt sich durch eine Komplexbildung, die die Lösung blau-violett färbt. Bei einem negativen Test würde sich hingegen ein blauer Feststoff am Boden absetzen.
Eine weitere geeignete Nachweisreaktion ist die Xanthoprotein-Reaktion.
2.1
Reaktionsgleichung der Titration
Die Reaktionsgleichung für die Titration von Hydrazin mit Salzsäure ist:


 Konzentration von Hydrazin
Bei der Titration wurden
Konzentration von Hydrazin
Bei der Titration wurden  der Salzsäure verbraucht. Daraus kann zunächst die Stoffmenge der Salzsäure berechnet werden:
der Salzsäure verbraucht. Daraus kann zunächst die Stoffmenge der Salzsäure berechnet werden:
![\(\begin{array}[t]{rlll}
n (HCl) &=& c(HCl) \cdot V(HCl) \\[5pt]
&=& 0,5 \,\text{mol} \cdot \text{L}^{-1} \cdot 0,006\,\text{L} \\[5pt]
&=& 0,003\,\text{mol}
\end{array}\)](https://mathjax.schullv.de/66ba0b7cd0636fdcf9208b8cb8d1f6653449df17273630271c3a09041083a4e9?color=5a5a5a) Aus der Reaktionsgleichung folgt, dass jedes Molekül Hydrazin zwei Moleküle
Aus der Reaktionsgleichung folgt, dass jedes Molekül Hydrazin zwei Moleküle  zur Neutralisation benötigt.
Für die Stoffmenge von Hydrazin folgt:
zur Neutralisation benötigt.
Für die Stoffmenge von Hydrazin folgt:
![\(\begin{array}[t]{rlll}
n (N_2H_4) &=& \dfrac{n (HCl)}{2} \\[5pt]
&=& \dfrac{0,003\,\text{mol}}{2} \\[5pt]
&=& 0,0015\,\text{mol}
\end{array}\)](https://mathjax.schullv.de/140e9647c53dab30ff4e8ae279d29a07e478c51d491fc352f0b0c5d9df3003ee?color=5a5a5a) Daraus ergibt sich nun die Konzentration von Hydrazin:
Daraus ergibt sich nun die Konzentration von Hydrazin:
![\(\begin{array}[t]{rlll}
c(N_2H_4) &=& \dfrac{n(N_2H_4)}{V(N_2H_4)}& \\[5pt]
&=& \dfrac{0,0015\,\text{mol}}{0,03\,\text{L}} & \\[5pt]
&=& 0,05 \,\text{mol} \cdot \text{L}^{-1}
\end{array}\)](https://mathjax.schullv.de/00344f9bb6af1eaa2a1f093c18fe21d02b3e45afd29b2edc455931de180c82a4?color=5a5a5a) Die Konzentration an Hydrazin zu Beginn der Titration beträgt
Die Konzentration an Hydrazin zu Beginn der Titration beträgt 
2.2
Zuordnung der Titrationskurve zur Titration von Hydrazin
Hydrazin eine Base ist und reagiert in der Titration mit der starken Säure  Demnach ist zu erwarten, dass der pH-Wert während der Titration sinkt, wenn die Säure hinzugefügt wird. Das Besondere bei Hydrazin ist, dass es als schwache Base reagiert und daher einen Pufferbereich haben sollte, bevor es vollständig neutralisiert wird. Dies würde in der Titrationskurve als relativ flacher Anfang mit einem anschließenden steilen Abfall erscheinen.
Unter Betrachtung der chemischen Eigenschaften von Hydrazin als schwache Base ist der Titration die Kurve C zuzuordnen.
Demnach ist zu erwarten, dass der pH-Wert während der Titration sinkt, wenn die Säure hinzugefügt wird. Das Besondere bei Hydrazin ist, dass es als schwache Base reagiert und daher einen Pufferbereich haben sollte, bevor es vollständig neutralisiert wird. Dies würde in der Titrationskurve als relativ flacher Anfang mit einem anschließenden steilen Abfall erscheinen.
Unter Betrachtung der chemischen Eigenschaften von Hydrazin als schwache Base ist der Titration die Kurve C zuzuordnen.
3.1
Ökonomische und ökologische Bewertung des Anammox-Verfahrens
Zusammenfassend kann man sagen, dass das Anammox-Verfahren ökonomisch und in Bezug auf bestimmte Emissionen ökologisch vorteilhaft ist, jedoch Herausforderungen durch die erhöhte Freisetzung von  birgt.
birgt.
| Ökologische Betrachtung |
|---|
| Das Anammox-Verfahren zeigt deutliche Vorteile in Bezug auf die Reduktion von Kohlenstoffdioxid |
| Ökonomische Betrachtung |
|---|
| Das Anammox-Verfahren bietet ökonomisch betrachtet Vorteile durch einen geringeren Energieverbrauch und eine höhere Energieeinspeisung ins Netz. Es verbraucht nur |
3.2
Beschreibung der Ergebnisse
Die grafisch dargestellten Daten zeigen, wie sich die Sauerstoffkonzentrationen von  bzw.
bzw. 
 auf die Emissionen von Stickstoffmonoxid
auf die Emissionen von Stickstoffmonoxid  und Lachgas
und Lachgas  auswirken:
Die Stickstoffmonoxid-Emissionen
auswirken:
Die Stickstoffmonoxid-Emissionen  variieren deutlich mit den Sauerstoffkonzentrationen in der Umgebung. Bei einer geringen Sauerstoffkonzentration von
variieren deutlich mit den Sauerstoffkonzentrationen in der Umgebung. Bei einer geringen Sauerstoffkonzentration von 
 zeigen die Emissionen zunächst einen Anstieg, stabilisieren sich jedoch schnell wieder, was auf eine Anpassung an die initiale Sauerstoffzufuhr hinweist. Bei einer Erhöhung auf
zeigen die Emissionen zunächst einen Anstieg, stabilisieren sich jedoch schnell wieder, was auf eine Anpassung an die initiale Sauerstoffzufuhr hinweist. Bei einer Erhöhung auf 
 und weiter auf
und weiter auf 
 bleiben die
bleiben die  -Emissionen konstant höher. Diese Beobachtung legt nahe, dass höhere Sauerstoffkonzentrationen eine kontinuierliche und verstärkte Bildung von Stickstoffmonoxid fördern, wahrscheinlich durch eine zunehmende oxidative Reaktion.
Im Gegensatz zu Stickstoffmonoxid zeigen die Lachgasemissionen über die verschiedenen Sauerstoffkonzentrationen hinweg eine relativ geringe Variation und bleiben auf einem niedrigeren Niveau. Dies deutet darauf hin, dass die Bildung von Lachgas weniger direkt von der Sauerstoffkonzentration beeinflusst wird, möglicherweise aufgrund anderer limitierenden Faktoren in der biochemischen Reaktionskette des Anammox-Prozesses.
Formulierung einer Fragestellung
Die Ergebnisse lassen vermuten, dass die Sauerstoffkonzentration einen signifikanten Einfluss auf die Emission von Stickstoffmonoxid, aber nicht unbedingt auf die von Lachgas hat. Eine mögliche zugrundeliegende Fragestellung für diese Versuchsreihe könnte daher lauten:
„Wie beeinflusst die Variation der Sauerstoffkonzentration die Emissionen von Stickstoffmonoxid und Lachgas bei der Anwendung des Anammox-Verfahrens?“
-Emissionen konstant höher. Diese Beobachtung legt nahe, dass höhere Sauerstoffkonzentrationen eine kontinuierliche und verstärkte Bildung von Stickstoffmonoxid fördern, wahrscheinlich durch eine zunehmende oxidative Reaktion.
Im Gegensatz zu Stickstoffmonoxid zeigen die Lachgasemissionen über die verschiedenen Sauerstoffkonzentrationen hinweg eine relativ geringe Variation und bleiben auf einem niedrigeren Niveau. Dies deutet darauf hin, dass die Bildung von Lachgas weniger direkt von der Sauerstoffkonzentration beeinflusst wird, möglicherweise aufgrund anderer limitierenden Faktoren in der biochemischen Reaktionskette des Anammox-Prozesses.
Formulierung einer Fragestellung
Die Ergebnisse lassen vermuten, dass die Sauerstoffkonzentration einen signifikanten Einfluss auf die Emission von Stickstoffmonoxid, aber nicht unbedingt auf die von Lachgas hat. Eine mögliche zugrundeliegende Fragestellung für diese Versuchsreihe könnte daher lauten:
„Wie beeinflusst die Variation der Sauerstoffkonzentration die Emissionen von Stickstoffmonoxid und Lachgas bei der Anwendung des Anammox-Verfahrens?“