B1 Schokolierte Erdnüsse
Schokolierte Erdnüsse wurden 1925 zum ersten Mal auf den Markt gebracht und haben sich seitdem zu einer weltweit beliebten Süßigkeit entwickelt. Ursprünglich nur in der Farbe Braun erhältlich gibt es sie heute in verschiedenen Farbvarianten.
1
Sowohl in den Erdnüssen als auch im Schokoladenüberzug sind Fette enthalten.
1.1
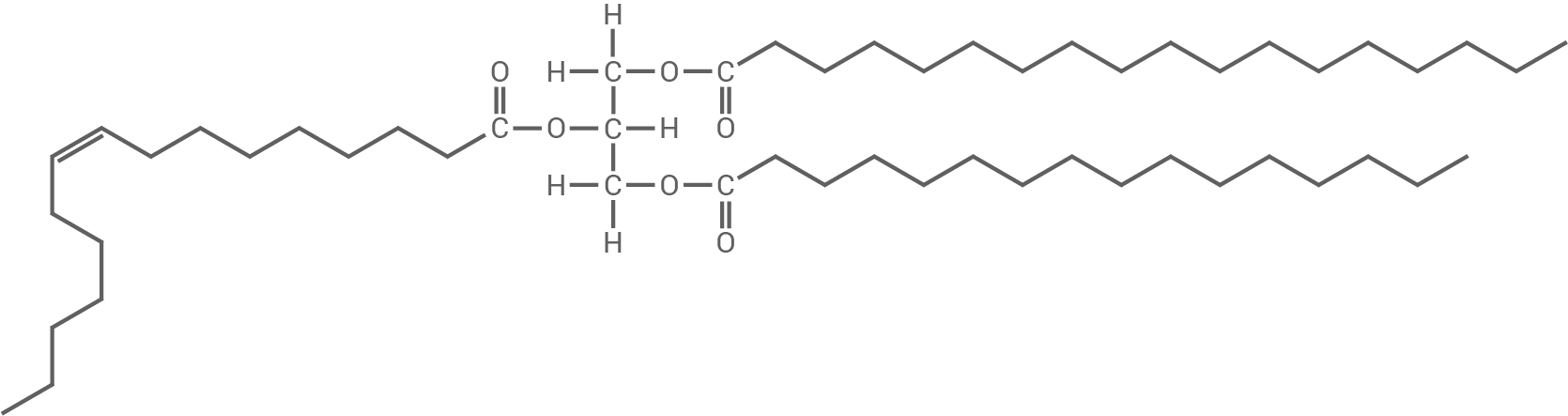
Abbildung 1 zeigt eine modellhafte Darstellung eines Fettmoleküls.
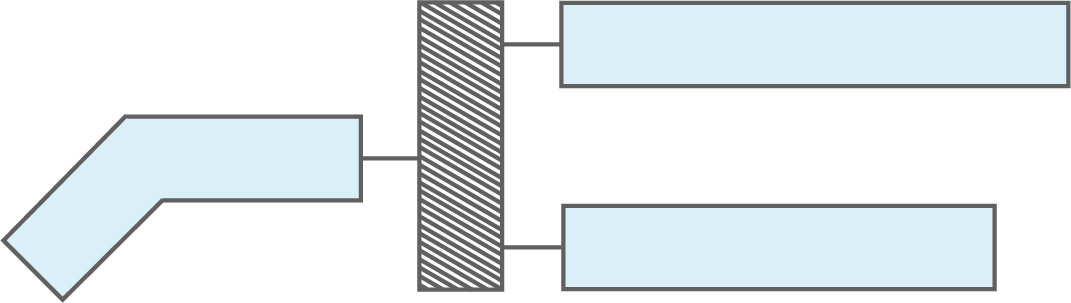 Zeichne eine der Abbildung 1 entsprechende Strukturformel eines Fettmoleküls. Nenne je zwei Vor- und Nachteile der Darstellung in Abbildung 1 im Vergleich zur Strukturformel.
Zeichne eine der Abbildung 1 entsprechende Strukturformel eines Fettmoleküls. Nenne je zwei Vor- und Nachteile der Darstellung in Abbildung 1 im Vergleich zur Strukturformel.

Abb. 1: Modellhafte Darstellung eines Fettmoleküls
(7 BE)
1.2
Kokosfett, das für die Schokoladenherstellung verwendet wird, weist einen Schmelzbereich zwischen  und
und  und eine Iodzahl von
und eine Iodzahl von  auf. Erdnussfett hat einen Schmelzbereich zwischen
auf. Erdnussfett hat einen Schmelzbereich zwischen  und
und  und eine Iodzahl von
und eine Iodzahl von  Die Iodzahl gibt die Masse an Iod in Gramm an, die an
Die Iodzahl gibt die Masse an Iod in Gramm an, die an  des Fettes addiert werden kann.
des Fettes addiert werden kann.
Erkläre den Zusammenhang zwischen den Iodzahlen der beiden Fette und deren Schmelzbereichen.
Erkläre den Zusammenhang zwischen den Iodzahlen der beiden Fette und deren Schmelzbereichen.
(5 BE)
1.3
Der Schokoladenüberzug enthält neben Kokosfett und einer großen Menge an Zucker auch Soja-Lecithin. Soja-Lecithin ist ein Stoffgemisch, das zu einem wesentlichen Teil aus Phosphatidylcholinen besteht. Ein Beispiel für ein Phosphatidylcholin ist in Abbildung 2 dargestellt.
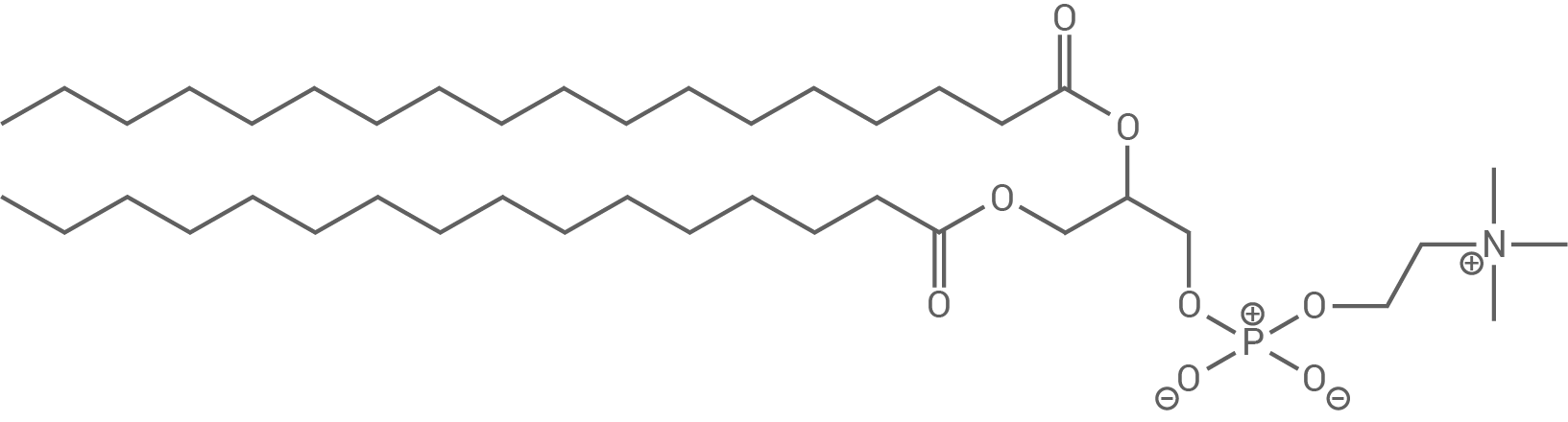 Stelle eine Hypothese zur Notwendigkeit der Beimischung des Soja-Lecithins bei der Schokoladenherstellung auf.
Stelle eine Hypothese zur Notwendigkeit der Beimischung des Soja-Lecithins bei der Schokoladenherstellung auf.

Abb. 2: Strukturformel eines Phosphatidylcholins
(4 BE)
2
Schokolierte Erdnüsse werden meist mit Saccharose gesüßt. Ein Hersteller bietet ein „zuckerfreies“ Produkt an, das als Süßstoff Maltit (Abb. 3) enthält. Maltit wird durch katalytische Hydrierung von Maltose hergestellt.
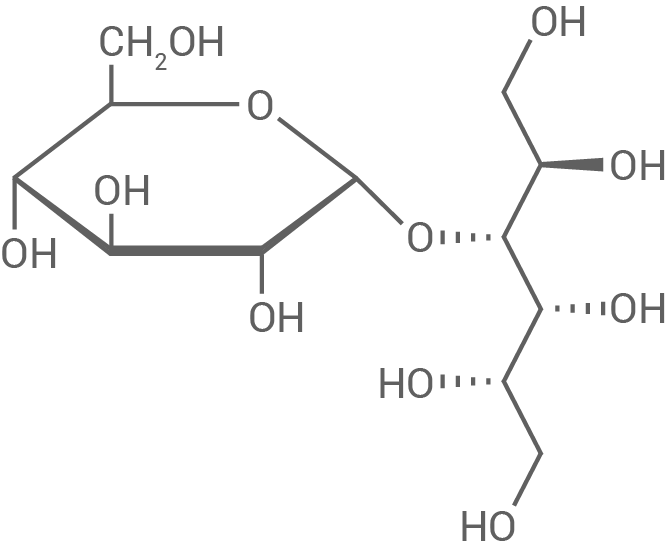

Abb. 3: Strukturformel von Maltit
2.1
Formuliere die Strukturformelgleichung für die Bildung von Maltit aus Maltose durch katalytische Hydrierung. Leite ab, ob es sich bei dieser Reaktion um eine Redoxreaktion handelt.
(5 BE)
2.2
Formuliere die Teilgleichungen einer positiv verlaufenden Silberspiegel-Probe. Beurteile, ob man die vollständige Umsetzung von Maltose zu Maltit mithilfe der Silberspiegel-Probe belegen kann.
(7 BE)
3
Der Farbstoff E131 wird zur Färbung von schokolierten Erdnüssen verwendet. E131 zeigt eine Farbänderung in Abhängigkeit vom pH-Wert. In Abbildung 4 sind Strukturformeln von E131 bei unterschiedlichen pH-Werten dargestellt.
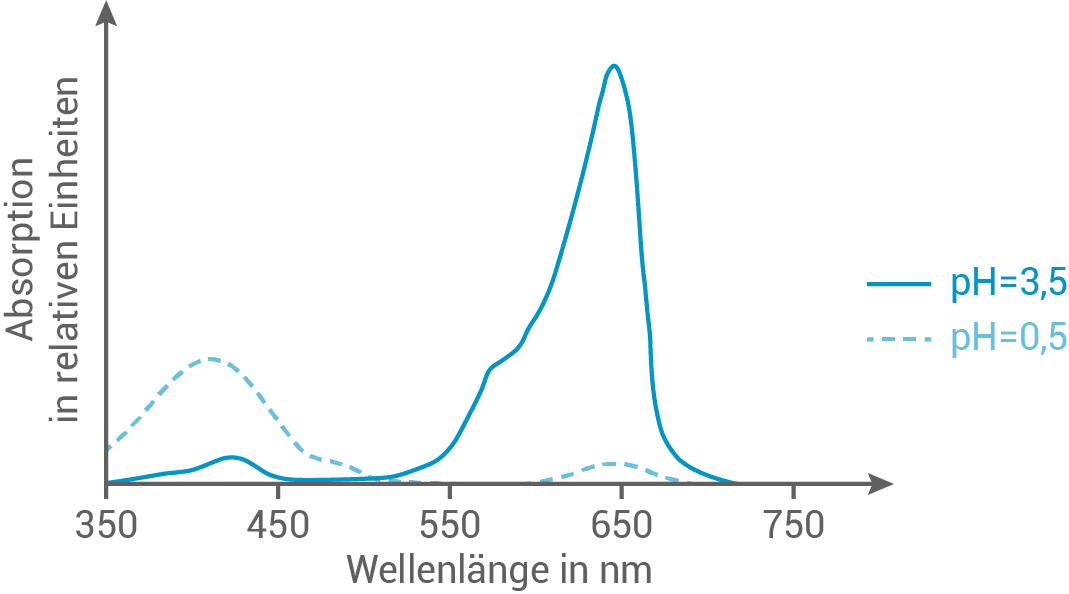
Abbildung 5 zeigt die Absorptionsspektren von E131 bei verschiedenen pH-Werten.
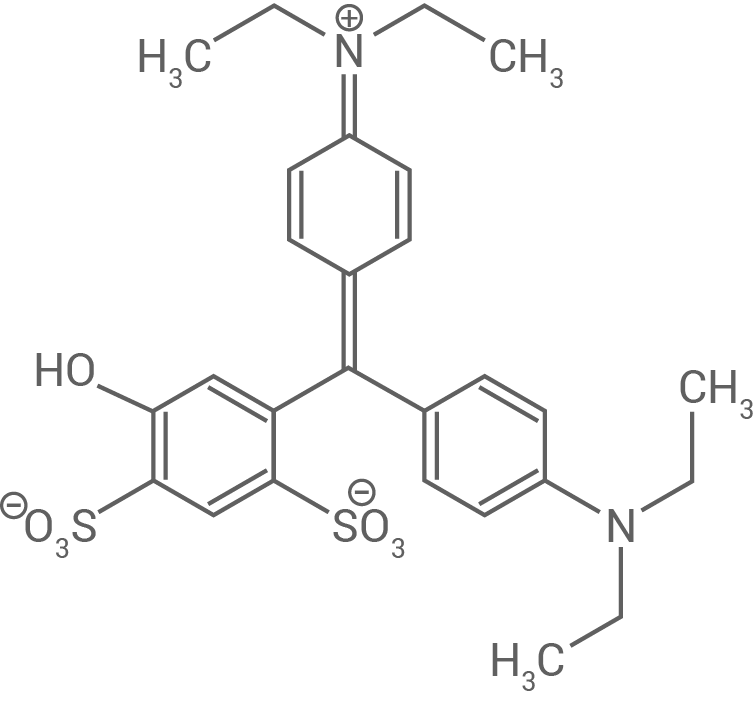
A
|
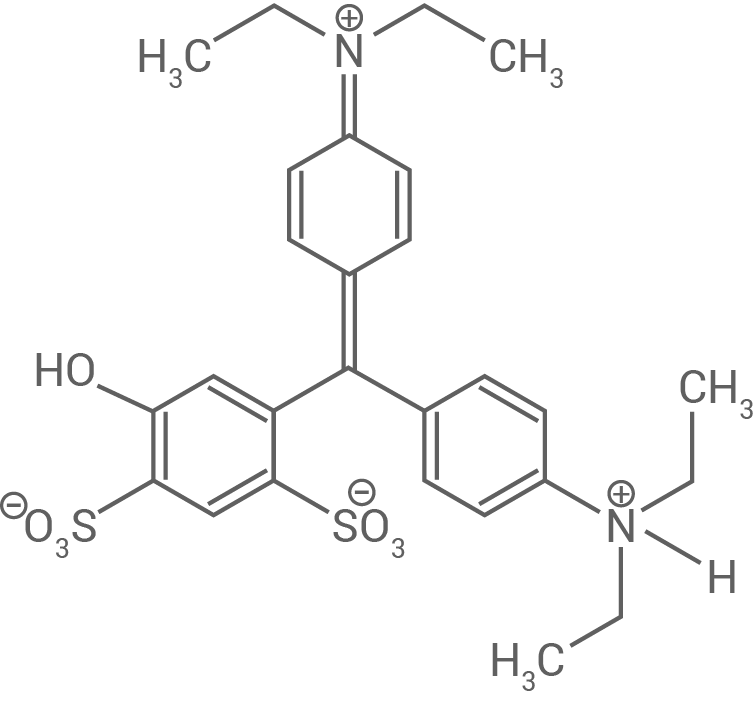
B
|
|
Abb. 4: Strukturformeln von E131 bei unterschiedlichen pH-Werten
nach: Bevziuk, K., Chebotarev, A., Fizer, M., Klochkova, A., Pliuta, K. & Snigur, D. (2018). Protonation of Patented Blue V in aqueous solutions: theoretical and experimental studies. Journal of Chemical Sciences, 130(2).
|
|

Abb. 5: Absorptionsspektren von E131 bei verschiedenen pH-Werten
nach: Bevziuk, K., Chebotarev, A., Fizer, M., Klochkova, A., Pliuta, K. & Snigur, D. (2018). Protonation of Patented Blue V in aqueous solutions: theoretical and experimental studies. Journal of Chemical Sciences, 130(2).
nach: Bevziuk, K., Chebotarev, A., Fizer, M., Klochkova, A., Pliuta, K. & Snigur, D. (2018). Protonation of Patented Blue V in aqueous solutions: theoretical and experimental studies. Journal of Chemical Sciences, 130(2).
| Wellenlänge des absorbierten Lichts in |
Farbe des absorbierten Lichts | Komplementär-farbe |
|---|---|---|
| Violett | Gelb | |
| Blau | Orange | |
| Blaugrün | Rot | |
| Gelbgrün | Purpur | |
| Gelb | Violett | |
| Orange | Blau | |
| Rot | Blaugrün |
Tab.: Zusammenhang zwischen Wellenlänge, Farbe und Komplementärfarbe des absorbierten Lichts
3.1
Leite mithilfe von Abbildung 5 und der Tabelle die Farbe von E131 bei den unterschiedlichen pH-Werten ab.
(4 BE)
3.2
Ordne die Spektren aus Abbildung 5 den Strukturformeln von E131 aus Abbildung 4 zu. Erkläre den Zusammenhang zwischen den Molekülstrukturen und der Wellenlänge des absorbierten Lichts bei den unterschiedlichen pH-Werten.
(8 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Strukturformel eines Fettmoleküls
 Vor- und Nachteile der modellhaften Darstellung
Vor- und Nachteile der modellhaften Darstellung

| Vorteile | Nachteile |
|---|---|
|
|
1.2
Zusammenhang zwischen Iodzahl und Schmelzbereich
Bei Fetten stellt die Iodzahl die Anzahl der ungesättigten Fettsäurereste dar. Eine höhere Iodzahl bedeutet also mehr Doppelbindungen. Im Gegensatz zu Kokosfett hat Erdnussfett eine viel höhere Iodzahl und folglich mehr ungesättigte Fettsäurereste.
Schmelztemperaturen sind abhängig von zwischenmolekularen Kräften. Die Substituenten an den Doppelbindungen in Fettsäuren sind immer in Z-Stellung angeordnet, was zu einer gewinkelten Molekülkette an diesen Stellen führt. Diese strukturellen "Knicke" verhindern eine effiziente Zusammenlagerung der Reste und reduzieren die London-Dispersionskräfte (Van-der-Waals-Wechselwirkungen) zwischen den Molekülen. Aufgrund dieser geringeren zwischenmolekularen Kräfte benötigt Erdnussfett vergleichsweise wenig Energie, um zu schmelzen. Daher hat Kokosfett einen höheren Schmelzbereich im Vergleich zu Erdnussfett.
1.3
Hypothese zur Notwendigkeit von Soja-Lecithin
Phosphatidylcholin ist ein Molekül, das aus zwei nicht polarisierten Fettsäureresten und einem geladenen Molekülteil besteht. Diese Struktur macht es zu einer grenzflächenaktiven Substanz. Wenn Soja-Lecithin hinzugefügt wird, können hydrophile Substanzen wie Wasser oder kurzkettige Kohlenhydrate besser mit hydrophoben Substanzen wie Erdnuss- oder Kokosfett vermischt werden. Dies ist entscheidend für die Herstellung einer gleichmäßigen Schokoladenmasse, da Soja-Lecithin als Emulgator wirkt.
2.1
Strukturformelgleichung für die Bildung von Maltit aus Maltose
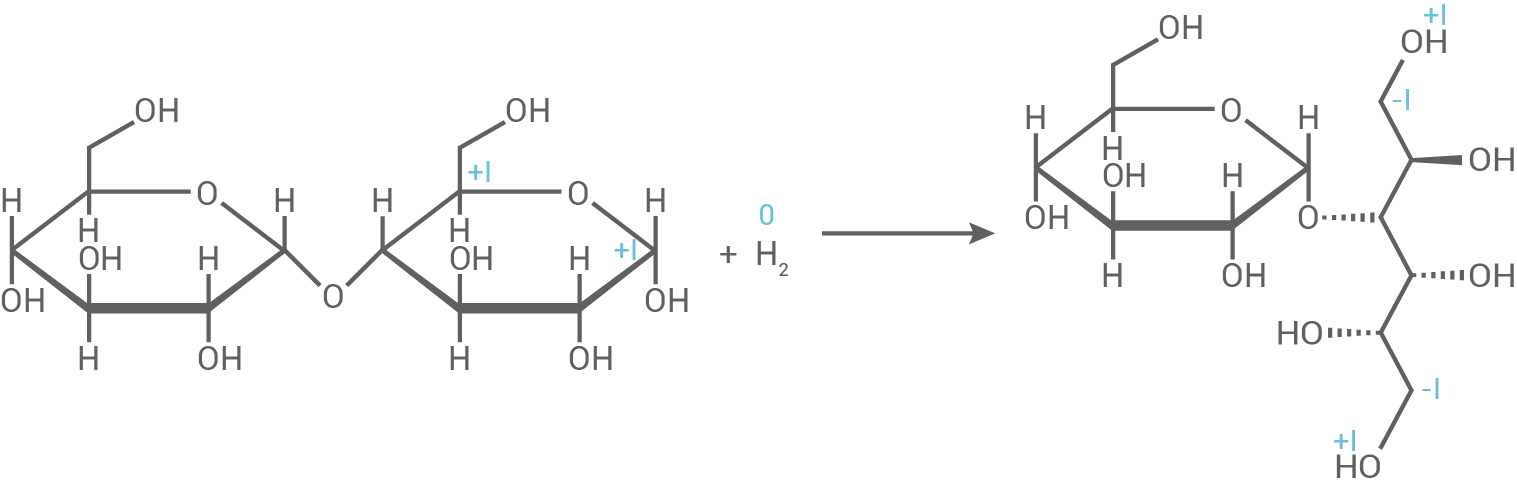 Ableitung einer Redox-Reaktion
Die Oxidationszahlen der Wasserstoffatome ändern sich von 0 im elementaren Wasserstoff zu +I bei den gebundenen H-Atomen im Maltit-Molekül. Im ringförmigen Halbacetal von Maltose haben das anomere
Ableitung einer Redox-Reaktion
Die Oxidationszahlen der Wasserstoffatome ändern sich von 0 im elementaren Wasserstoff zu +I bei den gebundenen H-Atomen im Maltit-Molekül. Im ringförmigen Halbacetal von Maltose haben das anomere  -Atom und das
-Atom und das  -Atom die Oxidationszahl +I, während sie im offenkettigen Molekülteil von Maltit die Oxidationszahl –I aufweisen. Dies macht die katalytische Hydrierung von Maltose zu Maltit zu einer Redoxreaktion.
-Atom die Oxidationszahl +I, während sie im offenkettigen Molekülteil von Maltit die Oxidationszahl –I aufweisen. Dies macht die katalytische Hydrierung von Maltose zu Maltit zu einer Redoxreaktion.

2.2
Teilgleichungen einer Silberspiegel-Probe
Beurteilung der Umsetzung von Maltose
Die Silberspiegel-Probe basiert auf der Reduktion von Silber -Ionen zu elementarem Silber in Anwesenheit von reduzierbaren Zuckern oder Aldehyden. Die Silberspiegel-Probe wird bei Mannit negativ verlaufen, da es weder freie Aldehydgruppen noch eine Ringöffnung am anomeren C-Atom aufweist. Bei Maltose ergibt die Probe hingegen ein positives Ergebnis. Somit deutet eine negative Silberspiegel-Probe darauf hin, dass die Reaktion abgeschlossen ist, was es ermöglicht, den Verlauf der Reaktion zu verfolgen.
-Ionen zu elementarem Silber in Anwesenheit von reduzierbaren Zuckern oder Aldehyden. Die Silberspiegel-Probe wird bei Mannit negativ verlaufen, da es weder freie Aldehydgruppen noch eine Ringöffnung am anomeren C-Atom aufweist. Bei Maltose ergibt die Probe hingegen ein positives Ergebnis. Somit deutet eine negative Silberspiegel-Probe darauf hin, dass die Reaktion abgeschlossen ist, was es ermöglicht, den Verlauf der Reaktion zu verfolgen.
3.1
Ableitung der Farbe von E131
Bei einem pH-Wert von  absorbiert der Farbstoff E131 rotes Licht mit einer Wellenlänge von etwa
absorbiert der Farbstoff E131 rotes Licht mit einer Wellenlänge von etwa  und erscheint in der Komplementärfarbe blaugrün.
und erscheint in der Komplementärfarbe blaugrün.
Wenn der pH-Wert auf gesenkt wird, absorbiert E131 violettes Licht mit einer Wellenlänge von ungefähr
gesenkt wird, absorbiert E131 violettes Licht mit einer Wellenlänge von ungefähr  und erscheint für das menschliche Auge gelb.
und erscheint für das menschliche Auge gelb.
Wenn der pH-Wert auf
3.2
Zuordnung der Spektren
Mit zunehmender Größe des Chromophors eines Moleküls steigt die Anzahl der konjugierten Doppelbindungen mit delokalisierten π-Elektronen. Je größer der Chromophor ist, desto geringer ist die erforderliche Anregungsenergie, und folglich ist die Wellenlänge des absorbierten Lichts größer. Da bei den Molekülen A und B die Chromophore gleich groß sind, haben vor allem auxochrome und antiauxochrome Gruppen einen Einfluss auf das Absorptionsverhalten.
Zusammenhang zwischen den Molekülstrukturen und Wellenlängen
Im Molekül A befindet sich eine tertiäre, ungeladene Aminogruppe, während im Molekül B diese als protonierte (quartäre) und geladene Aminogruppe vorliegt. Daraus folgt ein niedrigerer pH-Wert für Molekül B, nämlich 
Die Aminogruppe in Molekül A fungiert mit ihrem freien Elektronenpaar als Auxochrom. Durch die Protonierung in Molekül B und die dadurch entstehende positive Ladung bzw. das Fehlen des freien Elektronenpaars am Stickstoffatom wird diese Gruppe in ein weiteres Antiauxochrom umgewandelt. In Molekül B ist somit kein Auxochrom mehr vorhanden, wodurch der ursprünglich in Molekül A vorhandene bathochrome Effekt aufgehoben wird. Folglich absorbiert Molekül B Licht mit einer kürzeren Wellenlänge als Molekül A, was mit dem Absorptionsspektrum bei einem pH-Wert von übereinstimmt.
übereinstimmt.
Die Aminogruppe in Molekül A fungiert mit ihrem freien Elektronenpaar als Auxochrom. Durch die Protonierung in Molekül B und die dadurch entstehende positive Ladung bzw. das Fehlen des freien Elektronenpaars am Stickstoffatom wird diese Gruppe in ein weiteres Antiauxochrom umgewandelt. In Molekül B ist somit kein Auxochrom mehr vorhanden, wodurch der ursprünglich in Molekül A vorhandene bathochrome Effekt aufgehoben wird. Folglich absorbiert Molekül B Licht mit einer kürzeren Wellenlänge als Molekül A, was mit dem Absorptionsspektrum bei einem pH-Wert von