A1 Spinnenseide
Spinnenseide ist stabiler als Stahl und dehnbarer als Gummi. Hauptverantwortlich für diese Eigenschaften sind Proteine, die in den Spinndrüsen der Spinnen produziert werden. Künstliche Spinnfäden finden u. a. im medizinischen Bereich Anwendung.
1
Während der Herstellung von Spinnenseide kommt es zu einem Absinken des pH-Werts. Verantwortlich dafür ist das Enzym Carboanhydrase, das die Reaktion von Kohlenstoffdioxid mit Wasser zu Kohlensäure  katalysiert.
katalysiert.
1.1
Formuliere die Reaktionsgleichung für die beschriebene Reaktion und begründe das daraus resultierende Absinken des pH-Werts.
(4 BE)
1.2
Skizziere ein Diagramm, das die Abhängigkeit der Carboanhydrase-Aktivität von der Kohlenstoffdioxid-Konzentration zeigt und erläutere den Kurvenverlauf.
(7 BE)
1.3
Die Aktivität der Carboanhydrase ist abhängig vom pH-Wert (Abb. 1):
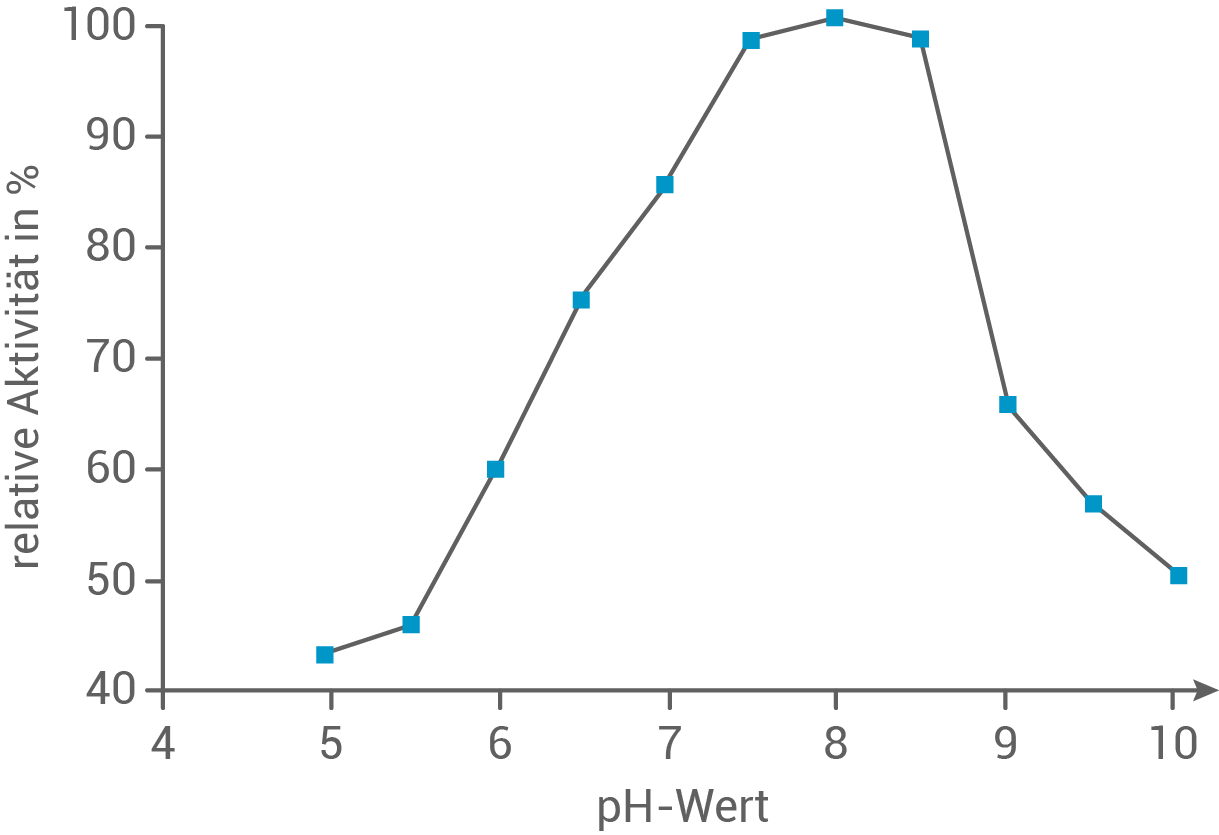 Um die maximale Aktivität der Carboanhydrase zu erreichen, benötigt man ein Puffersystem.
Um die maximale Aktivität der Carboanhydrase zu erreichen, benötigt man ein Puffersystem.
In einer Versuchsreihe soll die Carboanhydrase im Bereich ihrer maximalen Aktivität untersucht werden.
Leite aus Abbildung 1 und der Tabelle ein geeignetes Puffersystem ab. Berechne das Konzentrationsverhältnis von Base und korrespondierender Säure, das für die Aufrechterhaltung des optimalen pH-Werts erforderlich ist.

Abb. 1: Aktivität der Carboanhydrase in Abhängigkeit vom pH-Wert
verändert nach: https://www.scielo.br/j/gmb/a/wgKCTFCBsWQKR6T9Wzpz49H/?lang=en\#ModalFigf3, zuletzt aufgerufen am 26.10.2021
| Puffersystem | |
|---|---|
| Dihydrogenphosphat/Hydrogenphosphat-Puffer |
|
| Ameisensäure/Formiat-Puffer (Methansäure/Methanoat-Puffer) |
|
| Essigsäure/Acetat-Puffer (Ethansäure/Ethanoat-Puffer) |
Tab.: Ausgewählte Puffersysteme und  -Werte der zugehörigen Säuren
-Werte der zugehörigen Säuren
Leite aus Abbildung 1 und der Tabelle ein geeignetes Puffersystem ab. Berechne das Konzentrationsverhältnis von Base und korrespondierender Säure, das für die Aufrechterhaltung des optimalen pH-Werts erforderlich ist.
(7 BE)
2
Seidenproteine liegen besonders häufig in Form von  -Helices vor, die hohe Anteile des Aminosäure-Bausteins Alanin (2-Aminopropansäure) enthalten. Die Bedeutung dieses Bausteins für die Ausbildung der
-Helices vor, die hohe Anteile des Aminosäure-Bausteins Alanin (2-Aminopropansäure) enthalten. Die Bedeutung dieses Bausteins für die Ausbildung der  -Helices soll untersucht werden. Dazu wird ein Oligopeptid aus zehn Alanin-Bausteinen (Oligoalanin = OA) hergestellt.
-Helices soll untersucht werden. Dazu wird ein Oligopeptid aus zehn Alanin-Bausteinen (Oligoalanin = OA) hergestellt.
2.1
Zeichne einen zwei Aminosäure-Bausteine umfassenden Strukturformelausschnitt aus einem OA-Molekül.
(3 BE)
2.2
In einem Experiment wird festgestellt, dass OA-Moleküle keine  -Helices in Wasser ausbilden. Zur Erklärung des unterschiedlichen Verhaltens von OA-Molekülen und Seidenproteinen gibt es verschiedene Hypothesen:
-Helices in Wasser ausbilden. Zur Erklärung des unterschiedlichen Verhaltens von OA-Molekülen und Seidenproteinen gibt es verschiedene Hypothesen:
- Hypothese 1
OA-Moleküle sind nicht in der Lage, stabile-Helices zu bilden. Dazu wären intramolekulare Wechselwirkungen mit den Resten weiterer Aminosäure-Bausteine nötig.
- Hypothese 2
OA-Moleküle können-Helices bilden, die jedoch in Wasser nicht stabil sind. In Proteinen können zusätzliche Aminosäure-Bausteine die
-Helices stabilisieren, indem sie Wechselwirkungen mit Wasser-Molekülen verhindern.
- Beobachtung 1
In einer Computer-Simulation bilden OA-Moleküle in lipophiler Lösung in deutlichem Maße helicale Strukturen aus. - Beobachtung 2
Ersetzt man in OA-Molekülen einen Alanin- durch einen Lysin-Baustein, liegt dieses Peptid in wässriger Lösung zu einem hohen Anteil als Helix vor.
(5 BE)
3
Bei der Herstellung von künstlichen Spinnfäden wird Methansäure benötigt. Abbildung 2 zeigt eine Titrationskurve von Methansäure mit Natronlauge. Dabei wurde eine Probe von  Methansäure-Lösung unbekannter Konzentration vorgelegt und mit Natronlauge der Konzentration
Methansäure-Lösung unbekannter Konzentration vorgelegt und mit Natronlauge der Konzentration  titriert (Abb. 2):
titriert (Abb. 2):
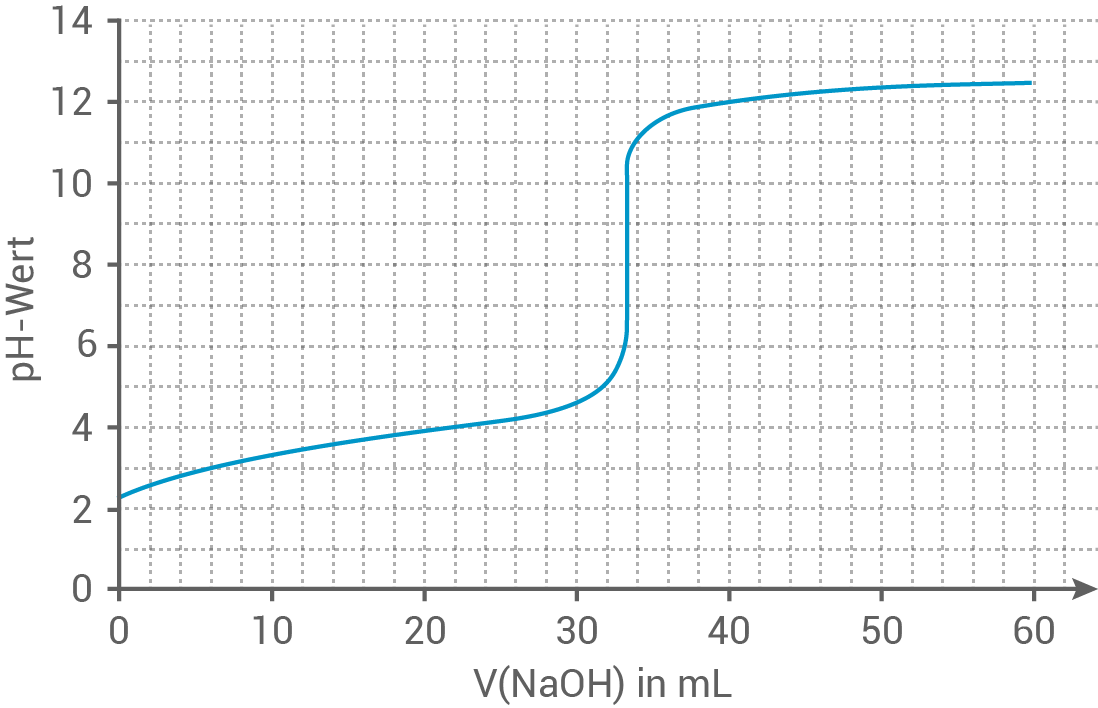

Abb. 2: Titrationskurve von Methansäure-Lösung mit Natronlauge
3.1
Erkläre anhand der Reaktionsgleichung von Methansäure mit Natronlauge den Begriff „Äquivalenzpunkt" und markiere diesen in Abbildung 2. Berechne die Konzentration der Methansäure-Lösung zu Beginn der Titration.
(8 BE)
3.2
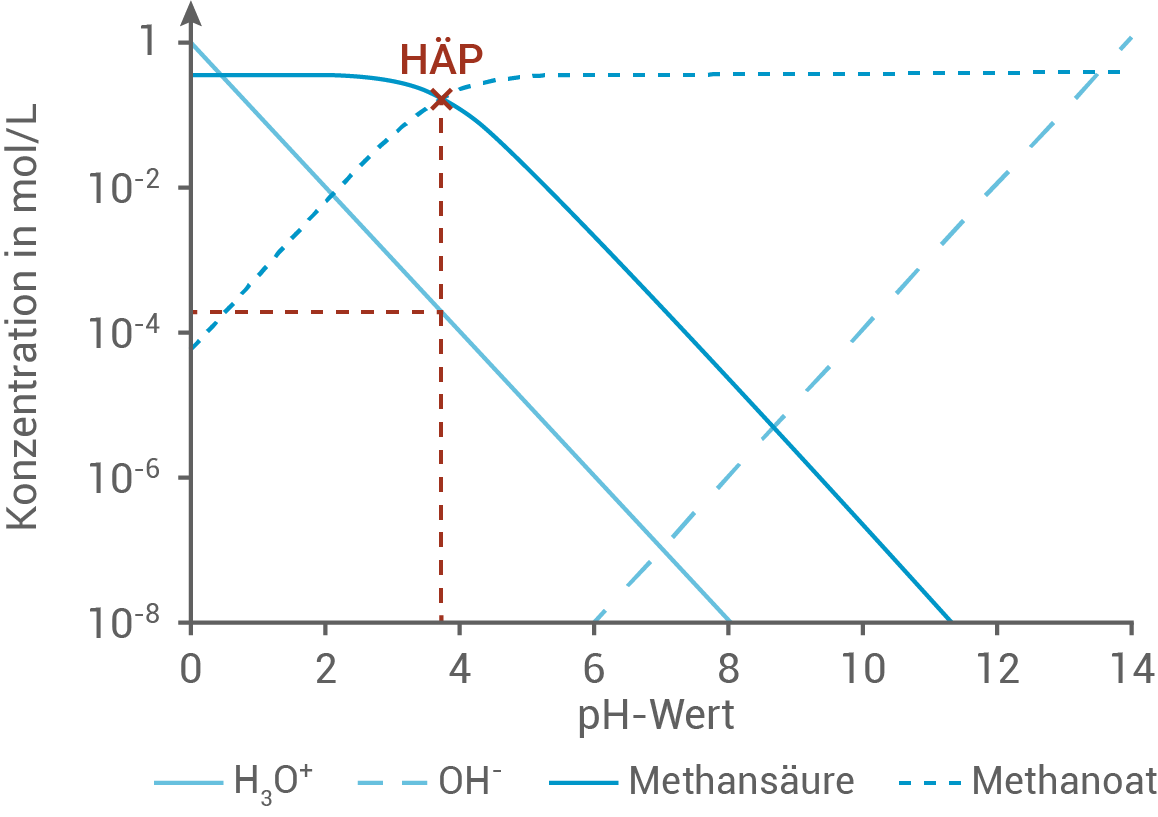
In Abbildung 3 ist ein sogenanntes Hägg-Diagramm dargestellt. Es zeigt die Konzentrationen verschiedener Teilchen, die bei der Titration von Methansäure mit Natronlauge auftreten:
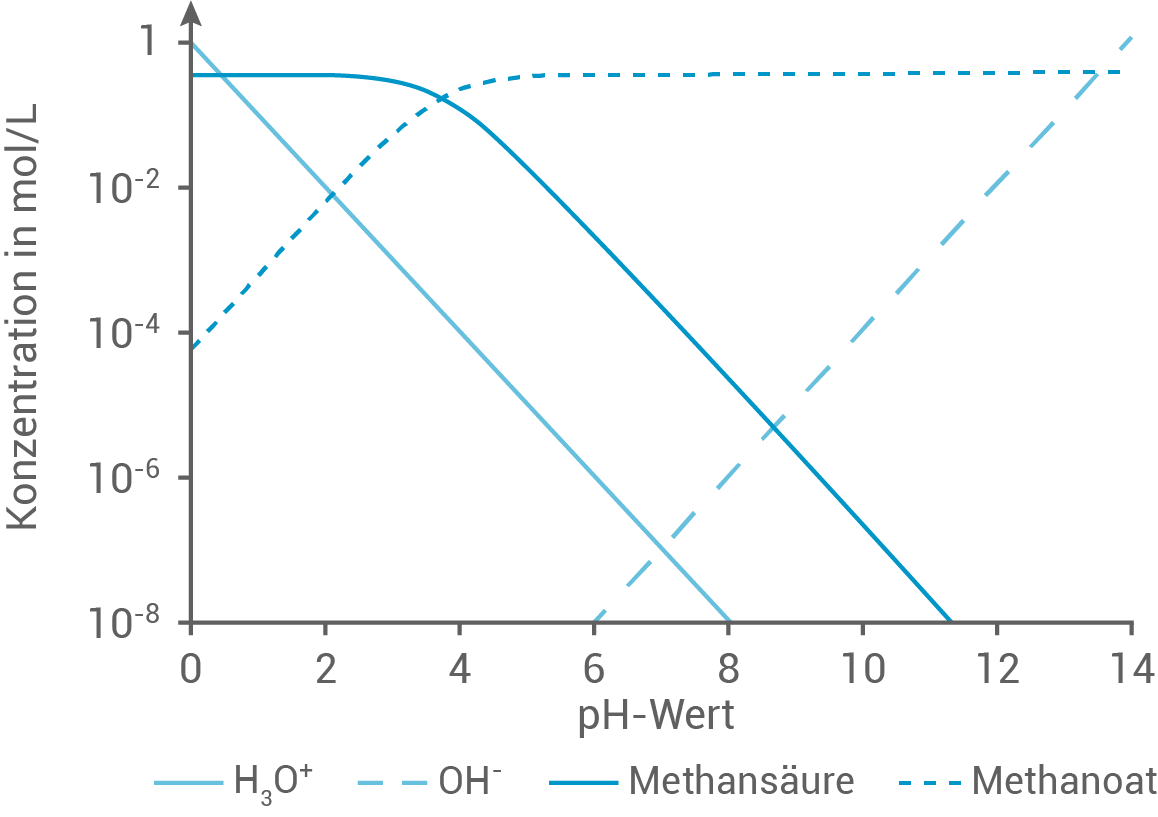 Erkläre die Vorgehensweise zur Bestimmung des
Erkläre die Vorgehensweise zur Bestimmung des  -Werts von Methansäure sowohl aus Abbildung 2 als auch aus Abbildung 3 und ermittle diesen.
-Werts von Methansäure sowohl aus Abbildung 2 als auch aus Abbildung 3 und ermittle diesen.

Abb. 3: Hägg-Diagramm einer Titration von Methansäure mit Natronlauge
(6 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Reaktionsgleichung und Begründung des pH-Werts
Kohlenstoffdioxid und Wasser reagieren zu Kohlensäure gemäß:
In Wasser protolysiert die entstandene Kohlensäure:
Durch die Protolyse steigt Konzentration der Oxonium-Ionen, wodurch der pH-Wert saurer wird und absinkt.
1.2
Diagramm zur Abhängigkeit der Carboanhydrase-Aktivität
Kohlenstoffdioxid wird vom Enzym Carboanhydrase als Substrat genutzt, wobei die Geschwindigkeit dieser Umsetzung mit der Konzentration des Substrats korreliert. Diese Abhängigkeit kann durch eine Sättigungskurve dargestellt werden:
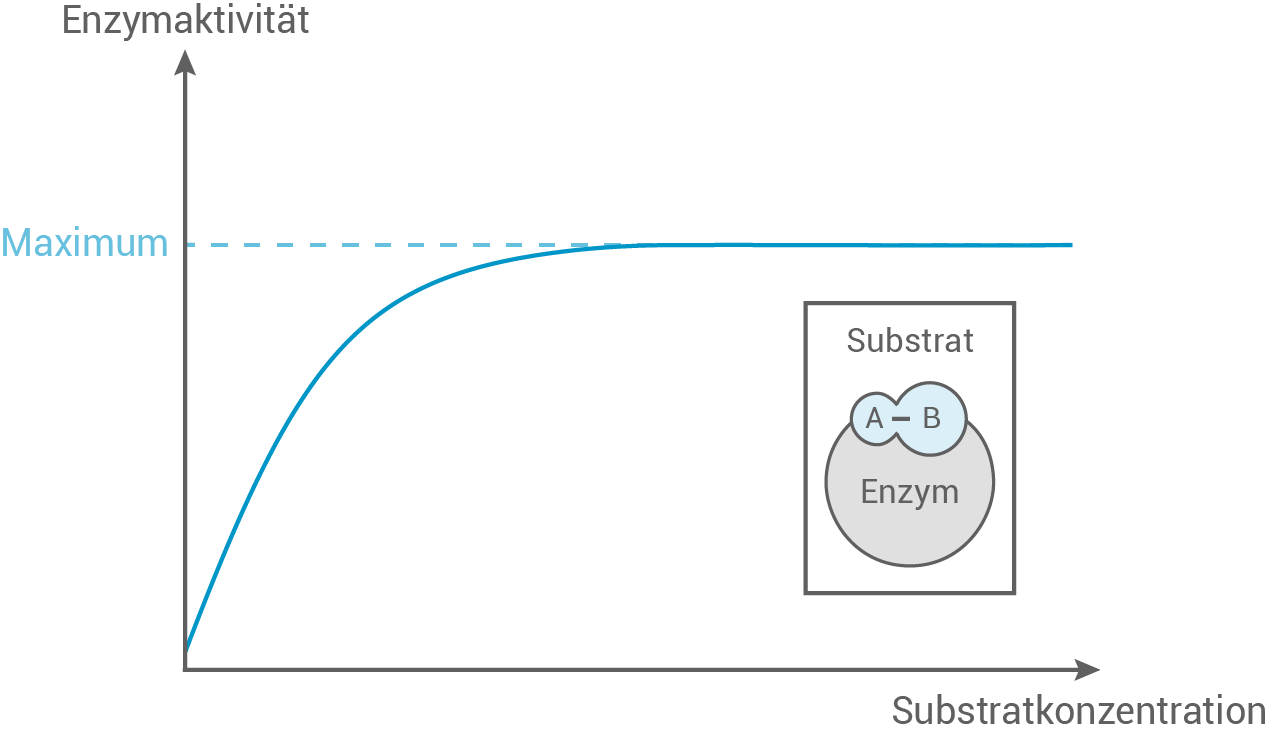 Erläuterung des Kurvenverlaufs
Bei enzymatisch katalysierten Reaktionen liegt der geschwindigkeitsbestimmende Schritt darin, dass Substratmoleküle an das aktive Zentrum der Enzyme gebunden werden. Bei niedrigen Substratkonzentrationen bleiben einige der aktiven Zentren der Carboanhydrase unbesetzt und eine Erhöhung der Kohlenstoffdioxid-Konzentration führt zunächst zu einer Anhebung der Reaktionsgeschwindigkeit und infolgedessen der Enzymaktivität. Diese lineare Zunahme setzt sich fort, bis sämtliche aktiven Zentren mit Substratmolekülen besetzt sind, wodurch das Enzym gesättigt ist und seine maximale Enzymaktivität erreicht wird. Trotz einer weiteren Erhöhung der Substratkonzentration kann die Reaktionsgeschwindigkeit nicht weiter gesteigert werden.
Erläuterung des Kurvenverlaufs
Bei enzymatisch katalysierten Reaktionen liegt der geschwindigkeitsbestimmende Schritt darin, dass Substratmoleküle an das aktive Zentrum der Enzyme gebunden werden. Bei niedrigen Substratkonzentrationen bleiben einige der aktiven Zentren der Carboanhydrase unbesetzt und eine Erhöhung der Kohlenstoffdioxid-Konzentration führt zunächst zu einer Anhebung der Reaktionsgeschwindigkeit und infolgedessen der Enzymaktivität. Diese lineare Zunahme setzt sich fort, bis sämtliche aktiven Zentren mit Substratmolekülen besetzt sind, wodurch das Enzym gesättigt ist und seine maximale Enzymaktivität erreicht wird. Trotz einer weiteren Erhöhung der Substratkonzentration kann die Reaktionsgeschwindigkeit nicht weiter gesteigert werden.

1.3
Ableitung eines geeigneten Puffersystems
Die Enzymaktivität der Carboanhydrase variiert in Abhängigkeit vom pH-Wert der umgebenden Flüssigkeit. Aus Abbildung 1 lässt sich ableiten, dass Carboanhydrase ihre maximale Aktivität bei einem pH-Wert von etwa  erreicht. Abweichungen zu höheren oder niedrigeren pH-Werten führen zur Denaturierung des Proteinanteils des Enzyms, was zu einer Veränderung seiner räumlichen Struktur führt. Als Folge passt das Substrat nicht mehr optimal in das aktive Zentrum des Enzyms gemäß dem Schlüssel-Schloss-Prinzip, wodurch die Enzymfunktion eingeschränkt wird. Dies führt zu einem Rückgang der Reaktionsgeschwindigkeit und der Enzymaktivität.
Für die Betrachtung geeigneter Puffersysteme gilt:
erreicht. Abweichungen zu höheren oder niedrigeren pH-Werten führen zur Denaturierung des Proteinanteils des Enzyms, was zu einer Veränderung seiner räumlichen Struktur führt. Als Folge passt das Substrat nicht mehr optimal in das aktive Zentrum des Enzyms gemäß dem Schlüssel-Schloss-Prinzip, wodurch die Enzymfunktion eingeschränkt wird. Dies führt zu einem Rückgang der Reaktionsgeschwindigkeit und der Enzymaktivität.
Für die Betrachtung geeigneter Puffersysteme gilt:  Da Carboanhydrase ihre maximale Aktivität bei einem pH-Wert von etwa
Da Carboanhydrase ihre maximale Aktivität bei einem pH-Wert von etwa  erreicht, kommt damit nur das
erreicht, kommt damit nur das  Puffersystem mit einem Pufferbereich von
Puffersystem mit einem Pufferbereich von  in Frage.
Berechnung des Konzentrationsverhältnisses
Es besteht folgendes Puffergleichgewicht:
in Frage.
Berechnung des Konzentrationsverhältnisses
Es besteht folgendes Puffergleichgewicht:


 Als Grundlage zur Berechnung des Konzentrationsverhältnisses von Säure und korrespondierender Base dient die Henderson-Hasselbalch-Gleichung, die Puffergleichung:
Als Grundlage zur Berechnung des Konzentrationsverhältnisses von Säure und korrespondierender Base dient die Henderson-Hasselbalch-Gleichung, die Puffergleichung:
 Durch Umstellung der Gleichung folgt:
Durch Umstellung der Gleichung folgt:
![\(\begin{array}[t]{rll}
\lg \dfrac{c(HPO_4^{2-})}{c(H_2PO_4^-)}&=& pH -pK_S & \\[5pt]
\dfrac{c(HPO_4^{2-})}{c(H_2PO_4^-)} &=& 10^{pH-pK_S} & \\[5pt]
&=& 10^{(8-7,21)} & \\[5pt]
&=& 6,17
\end{array}\)](https://mathjax.schullv.de/5bf3f54a7f595274cc395c0866ac1ffccc48ca49cfc2fed2a520293397377e4e?color=5a5a5a) Damit die Pufferlösung bei einem pH-Wert von
Damit die Pufferlösung bei einem pH-Wert von  stabil bleibt, sollt das Konzentrationsverhältnis
stabil bleibt, sollt das Konzentrationsverhältnis  betragen.
betragen.
2.1
Strukturformelausschnitt aus einem OA-Molekül
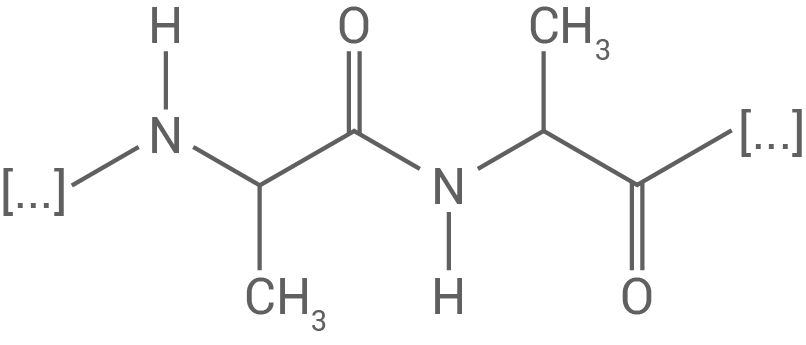

2.2
Überprüfung beider Hypothesen
Hypothese 1 wird durch die Ergebnisse aus Beobachtung 1 widerlegt. In der Computersimulation ist die Bildung von  -Helices auch ohne intramolekulare Wechselwirkungen mit Resten anderer Aminosäuren möglich.
-Helices auch ohne intramolekulare Wechselwirkungen mit Resten anderer Aminosäuren möglich.
Die Durchführung der Computersimulation in einer lipophilen Umgebung steht im Einklang mit der 2. Hypothese, da hier hydrophile Bedingungen angenommen werden. Die Ergebnisse aus Beobachtung 2 bestätigen Hypothese 2, da -Helices nach dem Austausch eines Alanins gegen ein Lysin gebildet werden.
-Helices nach dem Austausch eines Alanins gegen ein Lysin gebildet werden.
Die zusätzliche Aminogruppe in der Seitenkette des Lysins unterstützt die Stabilisierung der -helikalen Strukturen des OA-Peptids in einer wässrigen Lösung,
-helikalen Strukturen des OA-Peptids in einer wässrigen Lösung,
Die Durchführung der Computersimulation in einer lipophilen Umgebung steht im Einklang mit der 2. Hypothese, da hier hydrophile Bedingungen angenommen werden. Die Ergebnisse aus Beobachtung 2 bestätigen Hypothese 2, da
Die zusätzliche Aminogruppe in der Seitenkette des Lysins unterstützt die Stabilisierung der
3.1
Erklärung und Markierung des Äquivalenzpunkts
Die Reaktionsgleichung für die Reaktion von Methansäure mit Wasser lautet:


 Bei einer Säure-Base-Titration wurden am Äquivalenzpunkt alle Methansäuremoleküle durch die Hydroxid-Ionen der Natronlauge vollständig deprotoniert, wodurch eine Neutralisation stattfindet.
Die zugegebene Stoffmenge der Hydroxid-Ionen
Bei einer Säure-Base-Titration wurden am Äquivalenzpunkt alle Methansäuremoleküle durch die Hydroxid-Ionen der Natronlauge vollständig deprotoniert, wodurch eine Neutralisation stattfindet.
Die zugegebene Stoffmenge der Hydroxid-Ionen  aus der Maßlösung entspricht zu diesem Zeitpunkt genau der Anfangsstoffmenge an Methansäure
aus der Maßlösung entspricht zu diesem Zeitpunkt genau der Anfangsstoffmenge an Methansäure  in der Analyselösung.
Am Äquivalenzpunkt gilt demnach:
in der Analyselösung.
Am Äquivalenzpunkt gilt demnach:
 Dieser Punkt wird in der Titrationskurve nach der Zugabe von
Dieser Punkt wird in der Titrationskurve nach der Zugabe von  der Natronlauge-Maßlösung erreicht:
der Natronlauge-Maßlösung erreicht:
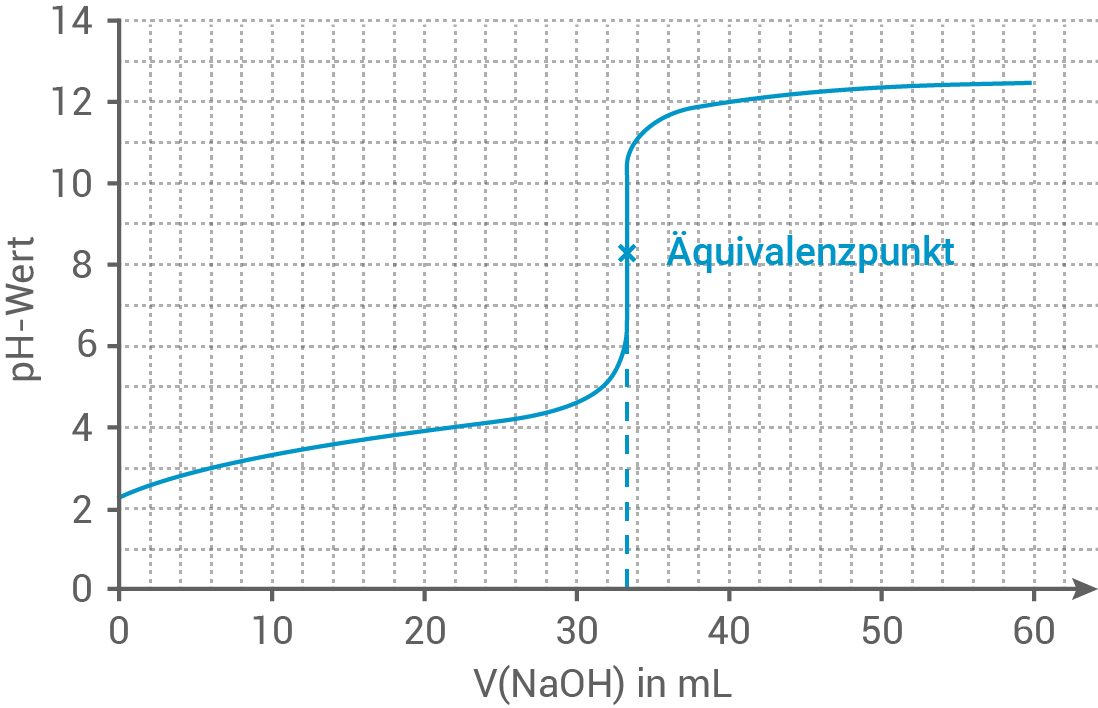 Berechnung der Konzentration
Mit den in der Aufgabenstellung gegebenen Werten kann die Anfangskonzentration der Methansäure wie folgt berechnet werden:
Zu Beginn beträgt die Konzentration von Methansäure ca.
Berechnung der Konzentration
Mit den in der Aufgabenstellung gegebenen Werten kann die Anfangskonzentration der Methansäure wie folgt berechnet werden:
Zu Beginn beträgt die Konzentration von Methansäure ca. 

3.2
Erklärung der Vorgehensweise
Am Halbäquivalenzpunkt (HÄP) sind die Säuremoleküle in der Analyselösung zur Hälfte durch die Base in der Maßlösung neutralisiert worden. Folglich erreichen die Konzentrationen der Säure und ihrer korrespondierenden Base an diesem Punkt Gleichheit.
Es gilt demnach:
 Für den Äquivalenzpunkt ergibt sich nach der Henderson-Hasselbalch-Gleichung folglich:
Für den Äquivalenzpunkt ergibt sich nach der Henderson-Hasselbalch-Gleichung folglich:
![\(\begin{array}[t]{rll}
pH&=& pK_S + \lg \dfrac{c(HCOOH)}{c(HCOO^-)} & \\[5pt]
&&\small \,\text{mit} \quad \lg 1 = 0 & \\[5pt]
pH&=& pK_S
\end{array}\)](https://mathjax.schullv.de/0888770921434980e1bb33261902f1ea460dda1f7404c49a4bd660b85f715dee?color=5a5a5a) In der Titrationskurve entspricht dies dem ersten Wendepunkt.
Eine alternative Möglichkeit besteht darin, den pH-Wert zu messen, wenn die Hälfte des Volumens an Natronlauge verwendet wurde, das bis zur vollständigen Neutralisation am Äquivalenzpunkt benötigt wird
In der Titrationskurve entspricht dies dem ersten Wendepunkt.
Eine alternative Möglichkeit besteht darin, den pH-Wert zu messen, wenn die Hälfte des Volumens an Natronlauge verwendet wurde, das bis zur vollständigen Neutralisation am Äquivalenzpunkt benötigt wird  Gemäß Abbildung 2 ergibt sich für die Methansäure in der Titration ein ungefährer
Gemäß Abbildung 2 ergibt sich für die Methansäure in der Titration ein ungefährer  -Wert von
-Wert von 
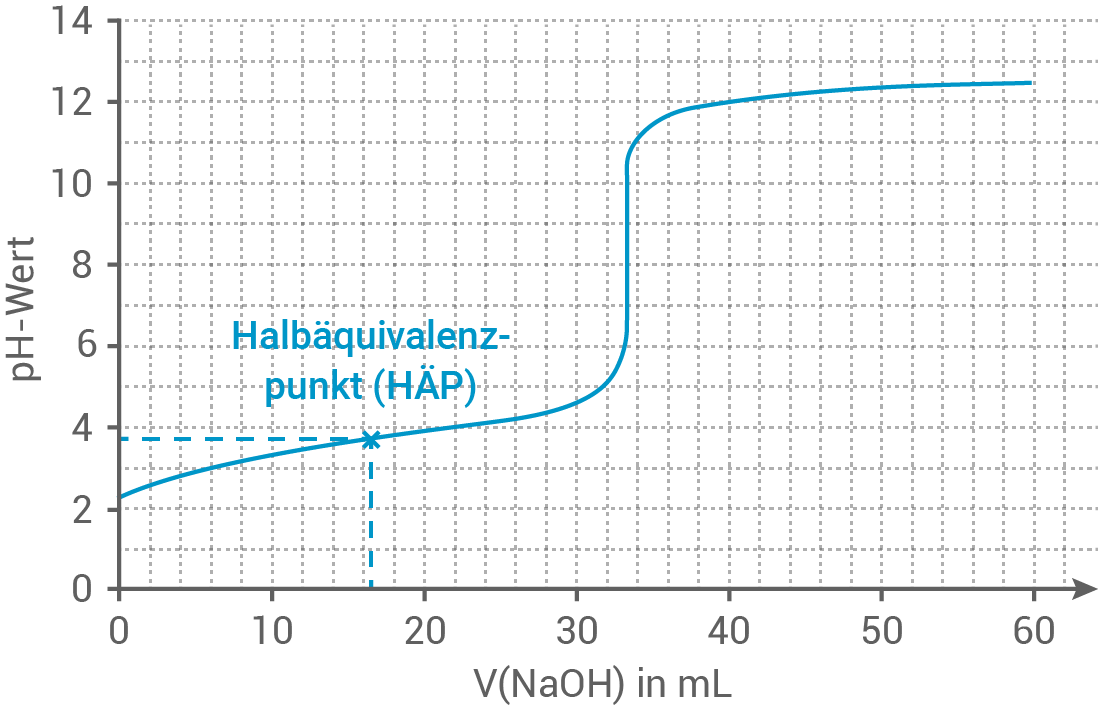 Im Hägg-Diagramm aus Abbildung 3 entspricht der Halbäquivalenzpunkt dieser Titration dem Punkt, an dem sich die Kurven von Methansäure und Methanoat schneiden.
An diesem Punkt gilt ebenfalls:
Im Hägg-Diagramm aus Abbildung 3 entspricht der Halbäquivalenzpunkt dieser Titration dem Punkt, an dem sich die Kurven von Methansäure und Methanoat schneiden.
An diesem Punkt gilt ebenfalls:
 Der pH-Wert kann entweder direkt an der
Der pH-Wert kann entweder direkt an der  -Achse abgelesen werden oder durch die Oxonium-Ionenkonzentration
-Achse abgelesen werden oder durch die Oxonium-Ionenkonzentration  an diesem Schnittpunkt berechnet werden:
an diesem Schnittpunkt berechnet werden:
![\(\begin{array}[t]{rll}
pH&=& - \lg c(H_3O^+) & \\[5pt]
&=& - \lg 10^{-3,8} & \\[5pt]
&=& 3,8
\end{array}\)](https://mathjax.schullv.de/ae1b9b9247b8cc4e36808864b99a8266480f6e07e83a9f1fa274fbc1061d9e80?color=5a5a5a) Folglich ergibt sich mit
Folglich ergibt sich mit  am Halbäquivalenzpunkt auch mittels dieser Methode für die Methansäure ein
am Halbäquivalenzpunkt auch mittels dieser Methode für die Methansäure ein  -Wert von
-Wert von