A2 Lactoperoxidase
Lactoperoxidase ist ein Enzym, das zusammen mit Thiocyanat-Ionen unter anderem in der Milch von Säugetieren enthalten ist. In Anwesenheit von Wasserstoffperoxid-Molekülen unterstützt es beim Säugling die Infektabwehr.
1
Um Lactoperoxidase von anderen Milch-Proteinen wie dem  -Casein zu isolieren, bedarf es eines Trennverfahrens, wie z. B. der Elektrophorese. Diese eignet sich, da sich nicht nur für einzelne Aminosäuren, sondern auch für Proteine isoelektrische Punkte (IEP) bestimmen lassen.
-Casein zu isolieren, bedarf es eines Trennverfahrens, wie z. B. der Elektrophorese. Diese eignet sich, da sich nicht nur für einzelne Aminosäuren, sondern auch für Proteine isoelektrische Punkte (IEP) bestimmen lassen.
1.1
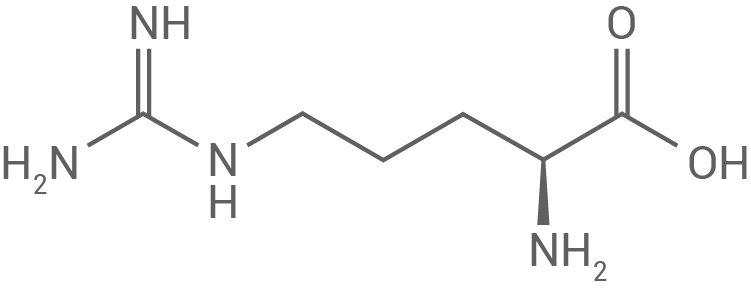
Im Protein  -Casein findet sich in der Primärstruktur ab Position
-Casein findet sich in der Primärstruktur ab Position  die Aminosäuresequenz
die Aminosäuresequenz  Zeichne mithilfe der Tabelle 2 einen Strukturformelausschnitt für diese Aminosäuresequenz.
Zeichne mithilfe der Tabelle 2 einen Strukturformelausschnitt für diese Aminosäuresequenz.
(4 BE)
1.2
Leite aus Tabelle 1 für die beiden Proteine Lactoperoxidase und  -Casein jeweils ihre Wanderungsrichtung während einer Elektrophorese bei pH-Wert
-Casein jeweils ihre Wanderungsrichtung während einer Elektrophorese bei pH-Wert  ab.
ab.
Erkläre mithilfe von Tabelle 2 den Zusammenhang zwischen den isoelektrischen Punkten von Lactoperoxidase bzw. -Casein und deren Aminosäureanteilen.
-Casein und deren Aminosäureanteilen.
Erkläre mithilfe von Tabelle 2 den Zusammenhang zwischen den isoelektrischen Punkten von Lactoperoxidase bzw.
(8 BE)
2
Das Enzym Lactoperoxidase katalysiert die Bildung der antibakteriell wirkenden Hypothiocyanit-Ionen durch Reaktion von Thiocyanat-Ionen und Wasserstoffperoxid-Molekülen  Das Reaktionsschema dieser Reaktion ist in Abbildung 1 dargestellt.
Das Reaktionsschema dieser Reaktion ist in Abbildung 1 dargestellt.
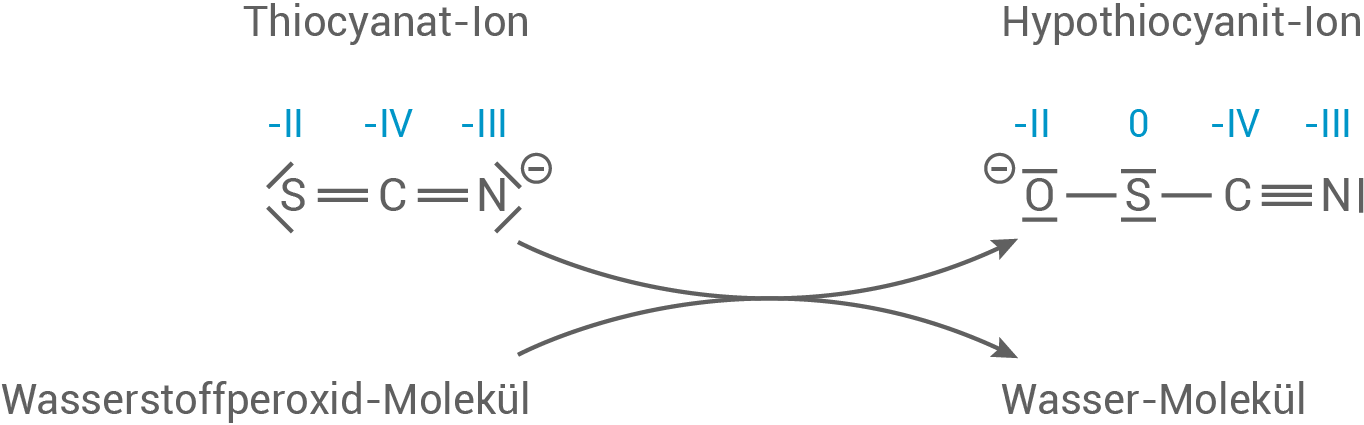

Abb. 1: Reaktionsschema der Bildung von Hypothiocyanit-Ionen
2.1
Formuliere mithilfe der in Abbildung 1 angegebenen Oxidationszahlen die Redoxteilgleichungen der Bildung von Hypothiocyanit-Ionen und Wasser-Molekülen durch Reaktion von Thiocyanat-Ionen mit Wasserstoffperoxid-Molekülen im sauren Milieu.
(5 BE)
2.2
In einer Versuchsreihe wird die enzymatische Bildung von Hypothiocyanit-Ionen in Abhängigkeit von der Wasserstoffperoxid-Konzentration untersucht.
In allen Versuchsansätzen wurden die gleichen Enzymmengen eingesetzt und Thiocyanat-Ionen im Überschuss zugegeben. Nach jeweils der gleichen Zeit wurde die Reaktion gestoppt. Anschließend wurde die Konzentration der Hypothiocyanit-Ionen bestimmt.
Abbildung 2 zeigt die Ergebnisse der Versuchsreihe.
 Stelle eine Hypothese zu den erwarteten Messergebnissen bei höheren Wasserstoffperoxid-Konzentrationen auf. Zeichne einen entsprechenden Graphen in Abbildung 2 ein.
Stelle eine Hypothese zu den erwarteten Messergebnissen bei höheren Wasserstoffperoxid-Konzentrationen auf. Zeichne einen entsprechenden Graphen in Abbildung 2 ein.
In allen Versuchsansätzen wurden die gleichen Enzymmengen eingesetzt und Thiocyanat-Ionen im Überschuss zugegeben. Nach jeweils der gleichen Zeit wurde die Reaktion gestoppt. Anschließend wurde die Konzentration der Hypothiocyanit-Ionen bestimmt.
Abbildung 2 zeigt die Ergebnisse der Versuchsreihe.

Abb. 2: Abhängigkeit der Bildung von Hypothiocyanit-Ionen von der Wasserstoffperoxid-Konzentration
nach: Thomas, E. L. & Aune, T. M. (1978). Lactoperoxidase, peroxide, thiocyanate anti-microbial system: correlation of sulfhydryl oxidation with antimicrobial action. Infection and immunity, 20(2). 456 – 463.
(5 BE)
3
Um den antibakteriellen Effekt der Lactoperoxidase zu untersuchen, sollen Bakterien in einem Medium mit  kultiviert werden. Zur Herstellung eines geeigneten Puffers stehen Lösungen von Phosphorsäure, Natriumdihydrogenphosphat, Natriumhydrogenphosphat und Natriumphosphat mit einer Konzentration von jeweils
kultiviert werden. Zur Herstellung eines geeigneten Puffers stehen Lösungen von Phosphorsäure, Natriumdihydrogenphosphat, Natriumhydrogenphosphat und Natriumphosphat mit einer Konzentration von jeweils  zur Verfügung.
zur Verfügung.
Leite mithilfe von Tabelle 3 die geeigneten Lösungen zur Herstellung einer Puffer-Lösung mit  ab. Berechne das Konzentrationsverhältnis des korrespondierenden Säure-Base-Paares in der Puffer- Lösung.
ab. Berechne das Konzentrationsverhältnis des korrespondierenden Säure-Base-Paares in der Puffer- Lösung.
| pKS | Säure | korrespondierende Base | pKB |
|---|---|---|---|
Tab. 3:  - und
- und  -Werte der Protolysestufen von Phosphorsäure
-Werte der Protolysestufen von Phosphorsäure
(7 BE)
4
Um Milch länger haltbar zu machen, kann diese pasteurisiert werden. Bei der klassischen Pasteurisierung wird Milch für einen Zeitraum von  bis
bis  Sekunden auf eine Temperatur zwischen
Sekunden auf eine Temperatur zwischen  und
und  erhitzt. Lactoperoxidase wird bei Erhitzung auf
erhitzt. Lactoperoxidase wird bei Erhitzung auf  schon nach vier Sekunden dauerhaft inaktiviert.
schon nach vier Sekunden dauerhaft inaktiviert.
4.1
Erkläre anhand einer Modellvorstellung die Inaktivierung der Lactoperoxidase bei zu starkem Erhitzen.
(4 BE)
4.2
Lactoperoxidase (LP) setzt auch farbloses Tetramethylbenzidin (TMB) zu blau gefärbtem Benzidinblau um. Zwei Milchproben A und B werden pasteurisiert. Mit den in Tabelle 4 dargestellten Versuchsansätzen soll festgestellt werden, ob diese Proben überpasteurisiert, d. h. beim Pasteurisieren zu hoch erhitzt wurden.
Aufgrund der Beobachtungen werden folgende Hypothesen aufgestellt:
Erkläre die Bedeutung der Versuchsansätze 3 und 4.
a)
Milchprobe A wurde vorschriftsmäßig pasteurisiert.
b)
Milchprobe B wurde für genau  Sekunden auf
Sekunden auf  erhitzt.
erhitzt.
c)
Milchprobe A enthält aktive Lactoperoxidase, Milchprobe B nicht.
Prüfe die aufgestellten Hypothesen auf ihre Richtigkeit.
Erkläre die Bedeutung der Versuchsansätze 3 und 4.
(7 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Strukturformelausschnitt der Aminosäuresequenz
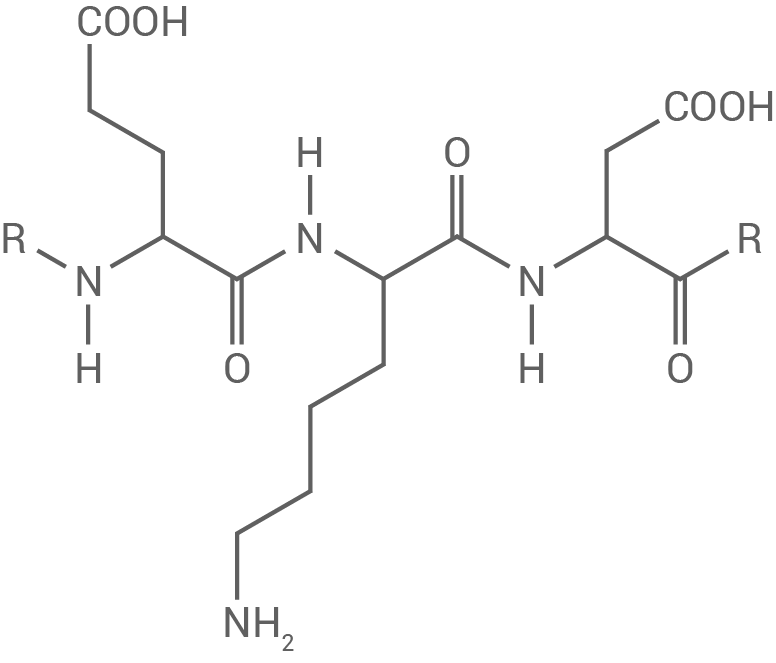

1.2
Wanderungsrichtung der beiden Proteine
Der isoelektrische Punkt (IEP) von Lactoperoxidase ist bei  und damit größer als der pH-Wert von
und damit größer als der pH-Wert von  bei der Elektrophorese. Damit liegt sie in kationischer Form vor und wandert zum Minuspol.
bei der Elektrophorese. Damit liegt sie in kationischer Form vor und wandert zum Minuspol.
Im Gegensatz dazu liegt Casein hier in anionischer Form vor, da der pH-Wert über dem IEP von liegt. Demzufolge bewegt es sich unter diesen Bedingungen zum Pluspol des Stromkreises hin.
Zusammenhang zwischen den isoelektrischen Punkten
Der IEP ermöglicht die Bestimmung, ob Teilchen bei einem gegebenen pH-Wert als Kation, Anion oder neutral geladen vorliegen. Der IEP eines Proteins hängt vom Verhältnis der Aminosäuren mit zusätzlichen Carboxyl- bzw. Aminogruppen in den Seitenketten ab. Aufgrund des höheren Anteils basischer Aminosäuren wie Lysin und Arginin im Vergleich zu sauren Aminosäuren wie Glutamin- und Asparaginsäure weist Lactoperoxidase einen höheren IEP als Casein auf.
liegt. Demzufolge bewegt es sich unter diesen Bedingungen zum Pluspol des Stromkreises hin.
Zusammenhang zwischen den isoelektrischen Punkten
Der IEP ermöglicht die Bestimmung, ob Teilchen bei einem gegebenen pH-Wert als Kation, Anion oder neutral geladen vorliegen. Der IEP eines Proteins hängt vom Verhältnis der Aminosäuren mit zusätzlichen Carboxyl- bzw. Aminogruppen in den Seitenketten ab. Aufgrund des höheren Anteils basischer Aminosäuren wie Lysin und Arginin im Vergleich zu sauren Aminosäuren wie Glutamin- und Asparaginsäure weist Lactoperoxidase einen höheren IEP als Casein auf.
Im Gegensatz dazu liegt Casein hier in anionischer Form vor, da der pH-Wert über dem IEP von
2.1
Formulierung der Redoxteilgleichungen
2.2
Hypothese zu den erwarteten Messergebnissen
Die Enzymaktivität der Lactoperoxidase steigt mit zunehmender Konzentration von Wasserstoffperoxid, da mehr aktive Zentren durch das Substrat besetzt werden. Jedoch kann die Enzymaktivität nicht weiter gesteigert werden, wenn alle aktiven Zentren der Lactoperoxidase-Moleküle belegt sind. Daher erreicht die Bildung von Hypothiocyanit-Ionen bei höheren Wasserstoffperoxid-Konzentrationen ein Maximum.
Die Abhängigkeit der Enzymaktivität von der Substratkonzentration folgt einer Sättigungskurve:
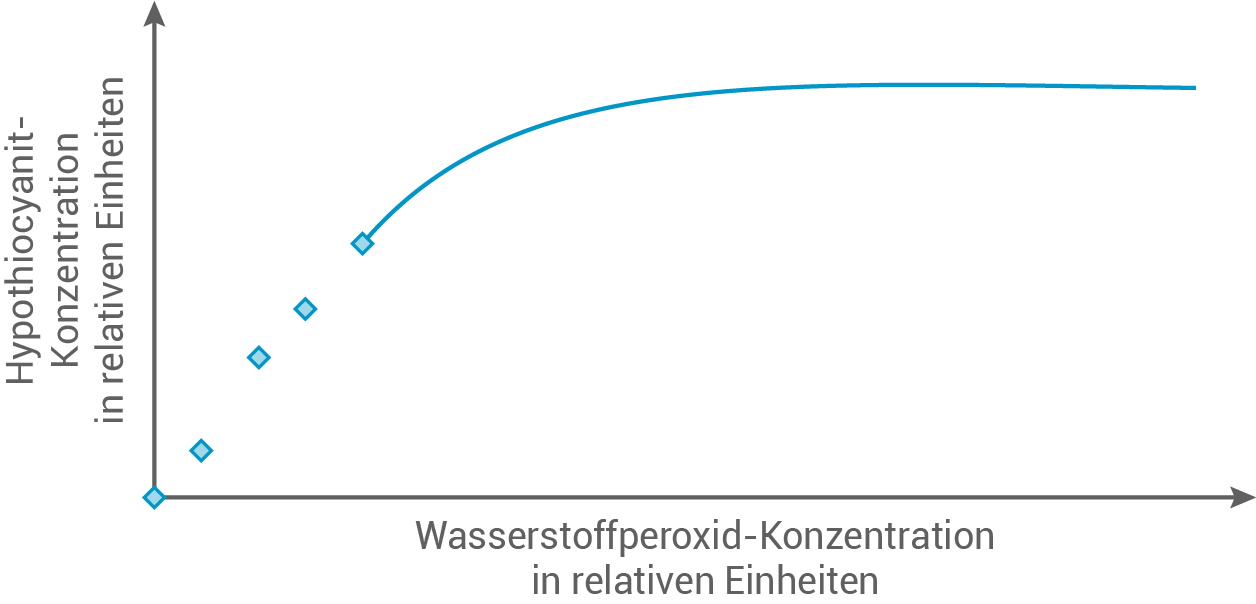
Die Abhängigkeit der Enzymaktivität von der Substratkonzentration folgt einer Sättigungskurve:

3
Ableitung geeigneter Lösungen
Die Puffer-Lösung soll einen pH-Wert von  haben. Da der optimale Pufferbereich einer gelösten Säure und ihrer korrespondierenden Base bei
haben. Da der optimale Pufferbereich einer gelösten Säure und ihrer korrespondierenden Base bei  liegt. Demnach ist
liegt. Demnach ist  als Pufferlösung am geeignetsten.
Berechnung des Konzentrationsverhältnisses
Zur Berechnung des Konzentrationsverhältnisses des korrespondierenden Säure-Base-Paares wird die Henderson-Hasselbalch-Gleichung verwendet:
als Pufferlösung am geeignetsten.
Berechnung des Konzentrationsverhältnisses
Zur Berechnung des Konzentrationsverhältnisses des korrespondierenden Säure-Base-Paares wird die Henderson-Hasselbalch-Gleichung verwendet:
![\(\begin{array}[t]{rll}
pH&=& pK_S - \lg \dfrac{c(H_2PO_4^-)}{c(HPO_4^{2-}}& \\[5pt]
\end{array}\)](https://mathjax.schullv.de/a2de32931c547aa3b0351ddee0971397a25034dd6ad42f64172da67e8d3b3a90?color=5a5a5a)
![\(\begin{array}[t]{rll}
\lg \dfrac{c(H_2PO_4^-)}{c(HPO_4^{2-}} &=& pK_S - pH & \\[5pt]
&=& 7,21 - 6,60 & \\[5pt]
&=& 0,61 & \\[5pt]
\dfrac{c(H_2PO_4^-)}{c(HPO_4^{2-}} &=& 10^{0,61} & \\[5pt]
&=& \dfrac{4,1}{1}
\end{array}\)](https://mathjax.schullv.de/9df8bf50a1dd4cdfd2eb6066ad6d05c1b2e79da896b480c306a30101f5b8c174?color=5a5a5a) Das Konzentrationsverhältnis des korrespondierenden Säure-Base-Paares in der Puffer-Lösung beträgt
Das Konzentrationsverhältnis des korrespondierenden Säure-Base-Paares in der Puffer-Lösung beträgt 
4.1
Erklärung der Inaktivierung
Die Lactoperoxidase besteht wie alle Enzyme aus einem Proteinanteil, der die räumliche Struktur des Enzyms bestimmt. Hohe Temperaturen beeinflussen die Tertiärstruktur, indem sie die intramolekularen Wechselwirkungen stören, was zur Denaturierung des Proteins führt. Durch diese Veränderung der räumlichen Struktur kann das Substrat nicht mehr effektiv an das aktive Zentrum des Enzyms binden, wie es im Schlüssel-Schloss-Modell vorgesehen ist. Dadurch wird das Enzym inaktiviert.
4.2
Richtigkeit der Hypothesen
a)
Da sich die Probe blau färbt, ist die Lactoperoxidase funktionsfähig. Demnach wurde die Milch vorschriftsmäßig pasteurisiert und nicht zu hoch erhitzt.
Hypothese A trifft zu.
Hypothese A trifft zu.
b)
Die fehlende Blaufärbung resultiert aus einer inaktiven Lactoperoxidase. Demnach muss die Probe eine gewisse Zeit auf  erhitzt worden sein, jedoch kann dieser Effekt auch nach längerem Erhitzen eintreten. Da keine Angaben über die Dauer des Vorgangs gemacht werden, ist die Hypothese mit
erhitzt worden sein, jedoch kann dieser Effekt auch nach längerem Erhitzen eintreten. Da keine Angaben über die Dauer des Vorgangs gemacht werden, ist die Hypothese mit  als genaue Zeitangabe falsch zu bewerten.
Hypothese B trifft nicht zu.
als genaue Zeitangabe falsch zu bewerten.
Hypothese B trifft nicht zu.
c)
Milchprobe A zeigt eine Blaufärbung, Milchprobe B hingegen nicht. Daraus kann geschlossen werden, dass in A Lactoperoxidase enthalten ist und in B nicht.
Hypothese C ist richtig.
Bedeutung der Versuchsansätze 3 und 4
Die Versuchsansätze 3 und 4 fungieren als Blindproben. Mit dem 3. Versuchsansatz wird kontrolliert, ob Lactoperoxidase überhaupt TMB umgesetzt wird und mit dem 4., ob die Lactoperoxidase für die Umsetzung überhaupt notwendig ist.
Hypothese C ist richtig.