A1 Biolumineszenz
Einige Lebewesen, zum Beispiel Glühwürmchen und Leuchtkrebse, können durch Biolumineszenz Licht erzeugen. Das Leuchten basiert auf der Umsetzung von sogenannten Luciferinen, die durch bestimmte Enzyme, die Luciferasen, katalysiert wird.
1
Für die Funktion der Luciferasen spielt deren räumlicher Bau eine wichtige Rolle. Abbildung 1 zeigt die modellhafte Darstellung eines Ausschnitts aus einem Luciferase-Molekül.
 Benenne die in Abbildung 1 dargestellten Sekundärstrukturen und vergleiche deren Stabilisierung.
Benenne die in Abbildung 1 dargestellten Sekundärstrukturen und vergleiche deren Stabilisierung.

Abb. 1: Modellhafte Darstellung eines Ausschnitts aus einem Luciferase-Molekül
nach: Bank, R. P. D. 3D PFV: 1VPR. https://www.rcsb.org/3d-sequence/1VPR?assemblyId=1
(6 BE)
2
Das Luciferin/Luciferase-System wird in der Analytik eingesetzt, um das Biomolekül ATP in kleinsten Mengen nachweisen zu können.
Bei der Messung wird die folgende Reaktion genutzt:
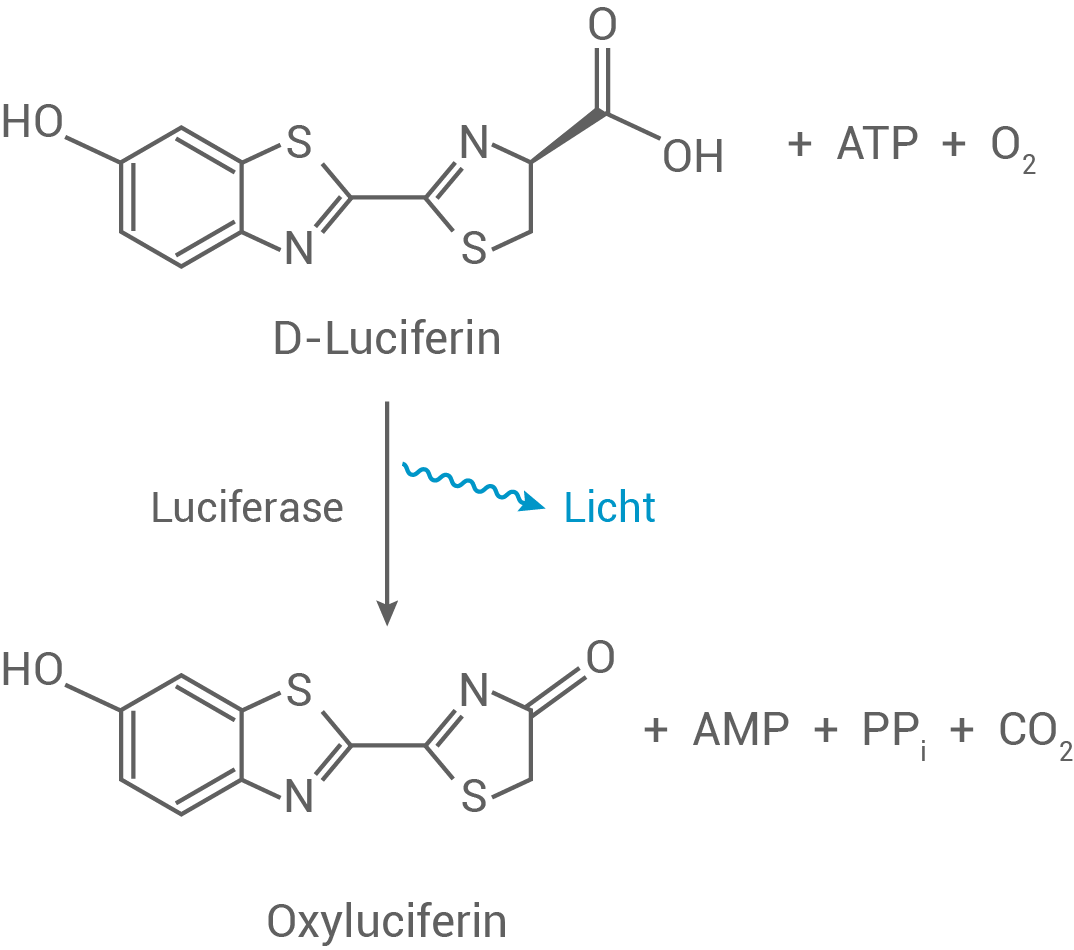
Bei der Messung wird die folgende Reaktion genutzt:

Abb. 2: Schema der Luciferin/Luciferase-Reaktion
nach: Man, T. P. Luciferase Reporter Assays: An Overview. https://info.gbiosciences.com/blog/luciferase-reporter-assays
2.1
Luciferasen, die in der Analytik eingesetzt werden, müssen vor ihrer Verwendung auf ihre Aktivität hin untersucht werden.
In einer Versuchsreihe wird die Abhängigkeit der Enzymaktivität einer Luciferase von der Konzentration des D-Luciferins geprüft:
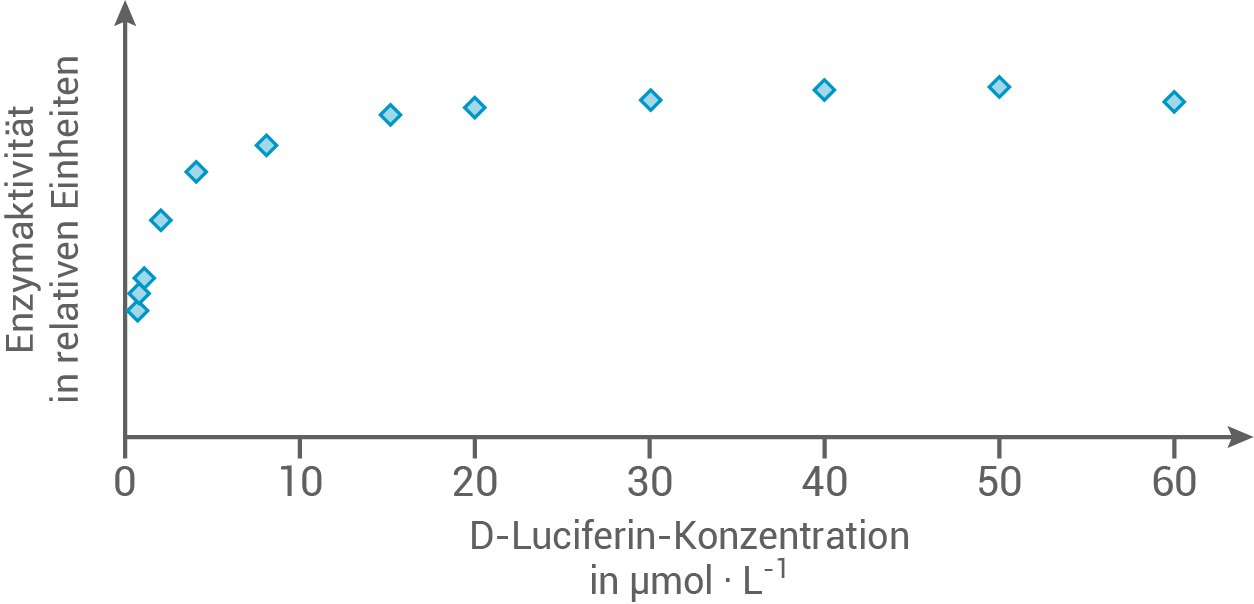
In einer Versuchsreihe wird die Abhängigkeit der Enzymaktivität einer Luciferase von der Konzentration des D-Luciferins geprüft:

Abb. 3: Ergebnisse der Versuchsreihe zur Abhängigkeit der Aktivität einer Luciferase von der Konzentration des D-Luciferins
nach: Pozzo, T., Akter F., Nomura, Y., Louie, A. Y. & Yokobayashi, Y. (2018). Firefly Luciferase Mutant with Enhanced Activity and Thermostability. ACS Omega, 3(3), 2628–2633.
2.1.1
Erkläre die Ergebnisse der Versuchsreihe.
(5 BE)
2.1.2
Ein für das Luciferin/Luciferase-System geeigneter Hemmstoff ist L-luciferin (Abb. 4)
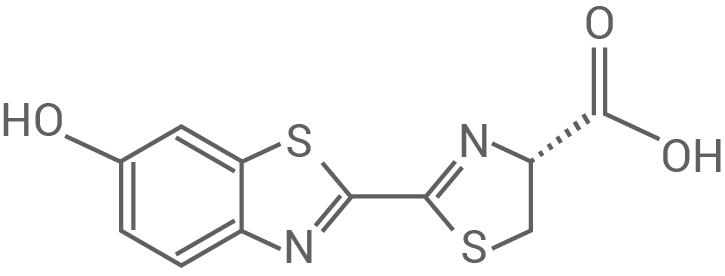 Beschreibe die stereochemische Beziehung von D- und L-Luciferin. Stelle eine Hypothese zur Art der hemmenden Wirkung von L-Luciferin auf. Zeichne davon ausgehend in Abbildung 3 die zu erwartenden Messergebnisse ein, wenn die Versuchsreihe mit Zusatz einer konstanten Menge L-Luciferin unter ansonsten gleichen Bedingungen durchgeführt wird.
Beschreibe die stereochemische Beziehung von D- und L-Luciferin. Stelle eine Hypothese zur Art der hemmenden Wirkung von L-Luciferin auf. Zeichne davon ausgehend in Abbildung 3 die zu erwartenden Messergebnisse ein, wenn die Versuchsreihe mit Zusatz einer konstanten Menge L-Luciferin unter ansonsten gleichen Bedingungen durchgeführt wird.

Abb. 4: Strukturformel von L-Luciferin
(7 BE)
2.2
Gibt man zu einem Pulver aus getrockneten Leuchtkrebsen Wasser, wird die durch Luciferase katalysierte Leuchtreaktion in Gang gesetzt. In einer Versuchsreihe wird der Einfluss verschiedener Faktoren auf die Biolumineszenz von Leuchtkrebspulver untersucht. Folgende Tabelle beinhaltet Informationen zu den einzelnen Versuchsansätzen:
Erkläre die Beobachtungen bei Versuch 2 und 3 anhand einer Modellvorstellung.
(5 BE)
3
D-Luciferin ist nur bei pH-Werten zwischen  und
und  stabil und wird deswegen in Pufferlösungen aufbewahrt.
stabil und wird deswegen in Pufferlösungen aufbewahrt.
Zur Herstellung von Pufferlösungen können Aminosäuren, zum Beispiel Alanin (2-Aminopropansäure), eingesetzt werden. In Abbildung 5 ist die Titrationskurve einer Alanin-Lösung mit Natronlauge der Konzentration dargestellt.
dargestellt.
Zu Beginn des Versuchs wurde die Alanin-Lösung mit Salzsäure auf eingestellt.
eingestellt.
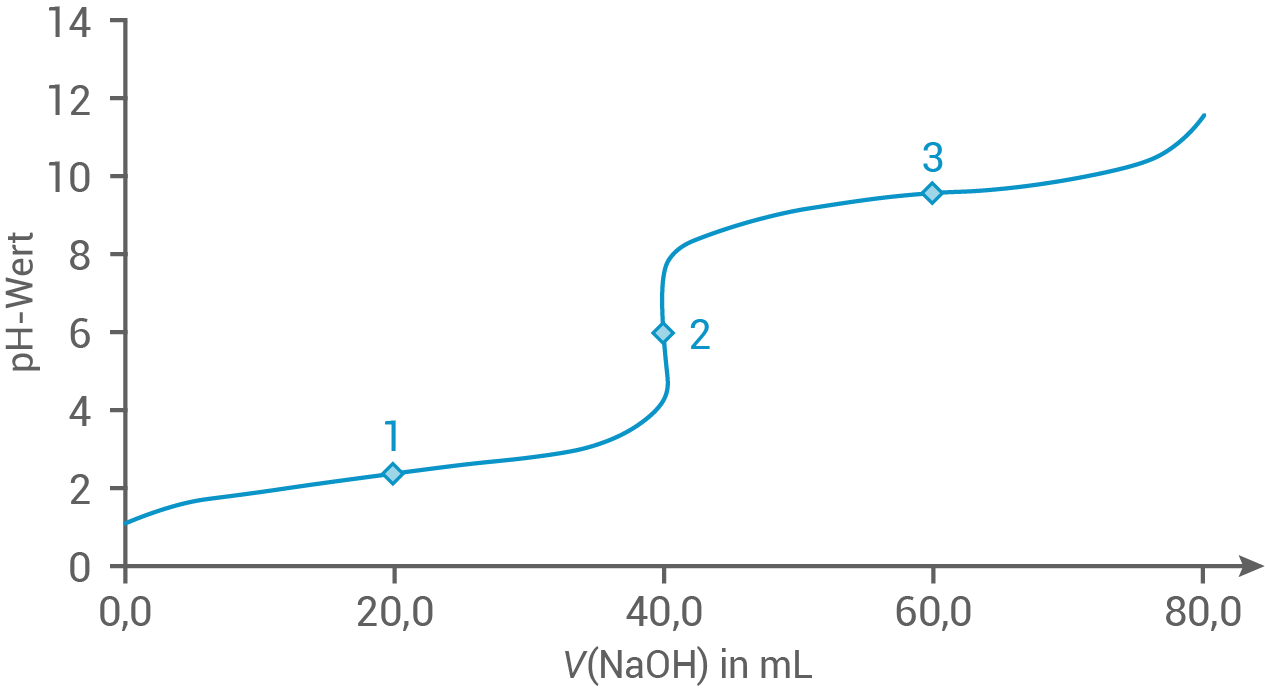
Zur Herstellung von Pufferlösungen können Aminosäuren, zum Beispiel Alanin (2-Aminopropansäure), eingesetzt werden. In Abbildung 5 ist die Titrationskurve einer Alanin-Lösung mit Natronlauge der Konzentration
Zu Beginn des Versuchs wurde die Alanin-Lösung mit Salzsäure auf

Abb. 5: Titrationskurve einer Alanin-Lösung mit Natronlauge
3.1
Berechne die benötigte Masse an Natriumhydroxid, um  Natronlauge der Konzentration
Natronlauge der Konzentration  herzustellen.
herzustellen.
(4 BE)
3.2
Formuliere die Reaktionsgleichungen für die bei der Titration ablaufenden Protolyseschritte mit Strukturformeln.
(6 BE)
3.3
Zur Verwendung des Alanin-Puffers gibt es drei Behauptungen:
Nimm zu allen Behauptungen begründet Stellung.
a)
Untersucht man eine Alanin-Lösung an einem Halbäquivalenzpunkt, kann man feststellen, dass sie dort eine gute Pufferwirkung aufweist.
b)
Die Pufferwirkung einer Alanin-Lösung ist am isoelektrischen Punkt am größten.
c)
Eine Alanin-Lösung ist eine geeignete Pufferlösung für D-Luciferin.
Ordne die Begriffe isoelektrischer Punkt und Halbäquivalenzpunkt den Punkten 1, 2 und 3 in der Titrationskurve (Abb. 5) zu.
Nimm zu allen Behauptungen begründet Stellung.
(7 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Benennung der Sekundärstrukturen und Vergleich der Stabilisierungen
Der Ausschnitt des Luciferase-Moleküls zeigt zum einen schraubenartige  -Helices und zum anderen ziehharmonikaähnliche
-Helices und zum anderen ziehharmonikaähnliche  -Faltblatt-Strukturen.
Die Stabilisierung dieser beiden Sekundärstrukturen basiert auf intramolekularen Wasserstoffbrückenbindungen zwischen dem Carbonyl-Sauerstoffatom und dem Wasserstoffatom einer Säureamidgruppe (Peptidbindung).
-Faltblatt-Strukturen.
Die Stabilisierung dieser beiden Sekundärstrukturen basiert auf intramolekularen Wasserstoffbrückenbindungen zwischen dem Carbonyl-Sauerstoffatom und dem Wasserstoffatom einer Säureamidgruppe (Peptidbindung).
2.1.1
Erklärung der Ergebnisse
Mit zunehmender Konzentration von D-Luciferin, steigt die Enzymaktivität der Luciferase, wobei sie sich einem maximalen Wert annähert. Dieser Anstieg folgt einer Sättigungskurve.
Mit zunehmender Konzentration des Substrats erhöht sich die Enzymaktivität, da immer mehr Enzyme besetzte aktive Zentren aufweisen. Sobald alle aktiven Zentren der Enzyme belegt sind, kann die Enzymaktivität auch durch weitere Erhöhung der Substratkonzentration nicht weiter gesteigert werden.
Mit zunehmender Konzentration des Substrats erhöht sich die Enzymaktivität, da immer mehr Enzyme besetzte aktive Zentren aufweisen. Sobald alle aktiven Zentren der Enzyme belegt sind, kann die Enzymaktivität auch durch weitere Erhöhung der Substratkonzentration nicht weiter gesteigert werden.
2.1.2
Stereochemische Beziehung von D- und L-Luciferin
D-Luciferin und L-Luciferin besitzen ein Chiralitätszentrum, also ein Kohlenstoffatom, das vier verschiedene Substituenten trägt. Aufgrund dieser strukturellen Eigenschaften sind die beiden Moleküle Enantiomere und verhalten sich wie Bild und Spiegelbild zueinander.
Hypothese zur Art der hemmenden Wirkung von L-Luciferin
Die strukturelle Ähnlichkeit der beiden Moleküle legt nahe, dass L-Luciferin als kompetitiver Hemmstoff für die Luciferase fungiert. Dabei konkurriert L-Luciferin mit D-Luciferin, dem eigentlichen Substrat, um die Bindung an das aktive Zentrum der Luciferase. Obwohl der kompetitive Hemmstoff das Enzym besetzt, erfolgt keine Umsetzung, was zu einer Verringerung der Enzymaktivität führt. Die Besetzung des aktiven Zentrums ist hierbei reversibel.
Mit steigender Substratkonzentration nimmt die Wahrscheinlichkeit zu, dass das passende Substrat an das aktive Zentrum der Luciferase bindet. Dadurch wird selbst in Anwesenheit eines kompetitiven Hemmstoffs die ursprüngliche maximale Enzymaktivität wieder erreicht. Dies tritt jedoch erst bei höheren Substratkonzentrationen auf.
Zu erwartende Messergebnisse
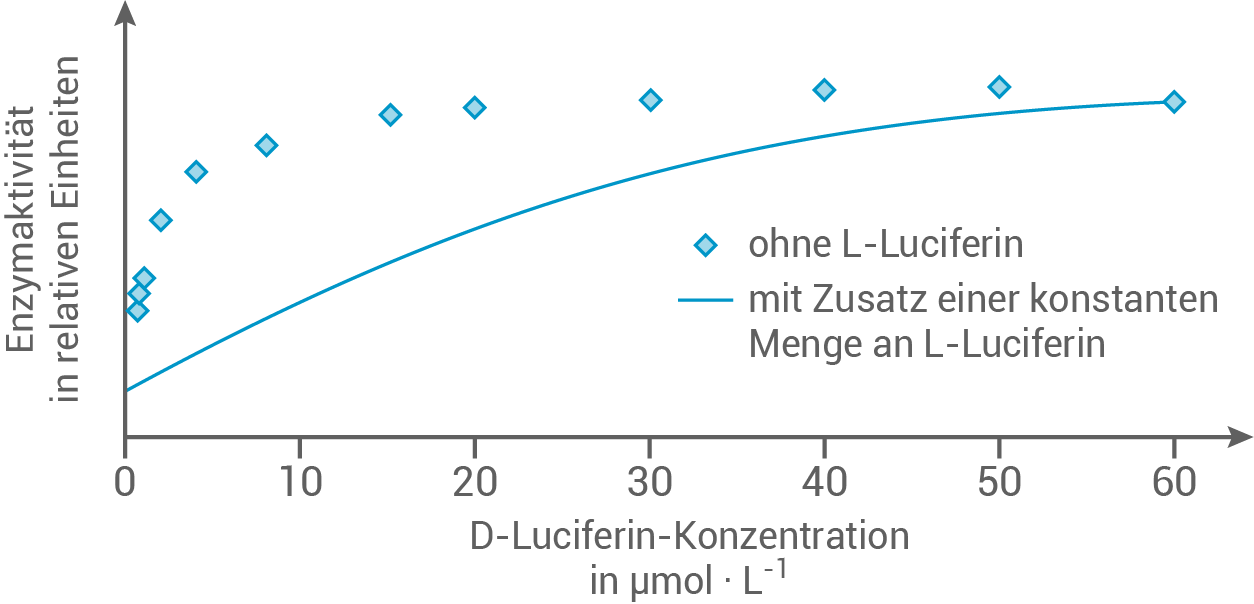

2.2
Erklärung der Beobachtungen
Die Grundlage einer enzymatischen Reaktion bildet das Schlüssel-Schloss-Prinzip. Nach diesem bindet ein Substrat an das aktive Zentrum des Enzyms und bildet einen Enzym-Substrat-Komplex:
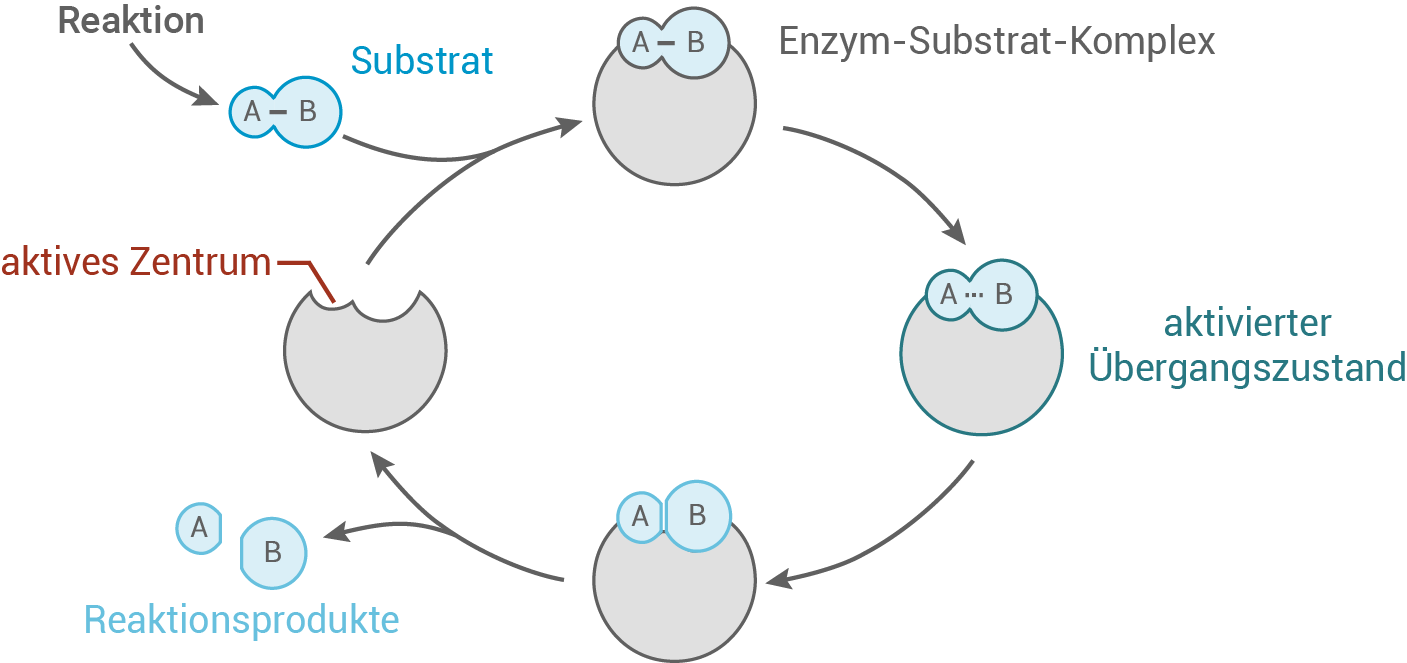 Im ersten Versuch verläuft die Reaktion ungestört, was als Kontrolle dient, um die Auswirkungen der Zugabe von Kupfersulfat-Lösung (Versuch 2) sowie hoher Temperaturen (Versuch 3) auf die Enzymaktivität zu untersuchen.
Sowohl das Vorhandensein von Schwermetall-Ionen in Form von
Im ersten Versuch verläuft die Reaktion ungestört, was als Kontrolle dient, um die Auswirkungen der Zugabe von Kupfersulfat-Lösung (Versuch 2) sowie hoher Temperaturen (Versuch 3) auf die Enzymaktivität zu untersuchen.
Sowohl das Vorhandensein von Schwermetall-Ionen in Form von  im 2. Versuch als auch die Exposition gegenüber
im 2. Versuch als auch die Exposition gegenüber  im 3. Versuch bewirken eine irreversible Veränderung der räumlichen Struktur der Enzyme, indem ihr Proteinanteil denaturiert wird. Aufgrund dieser veränderten Tertiärstruktur ist das Substrat nicht mehr in der Lage, effektiv an das aktive Zentrum des Enzyms zu binden. Dadurch erfolgt keine Substratumsetzung mehr, und in beiden Fällen zeigt sich keine Lumineszenz mehr in den Versuchsansätzen.
im 3. Versuch bewirken eine irreversible Veränderung der räumlichen Struktur der Enzyme, indem ihr Proteinanteil denaturiert wird. Aufgrund dieser veränderten Tertiärstruktur ist das Substrat nicht mehr in der Lage, effektiv an das aktive Zentrum des Enzyms zu binden. Dadurch erfolgt keine Substratumsetzung mehr, und in beiden Fällen zeigt sich keine Lumineszenz mehr in den Versuchsansätzen.

3.1
Berechnung der benötigten Masse an Natriumhydroxid
Aus den Angaben zu Volumen und Konzentration lässt sich zunächst die Stoffmenge berechnen:
![\(\begin{array}[t]{rll}
n (NaOH)&=& c(NaOH) \cdot V(NaOH) &\\[5pt]
&=& 0,15\,\text{mol} \cdot \text{L}^{-1} \cdot 0,5\,\text{L}&\\[5pt]
&=& 0,075\,\text{mol}
\end{array}\)](https://mathjax.schullv.de/04cbd52043b737fb68528ae50666ad017e7da055e2a983ae37e159f7d0d7960e?color=5a5a5a) Mit der aus dem PSE abgeleiteten molaren Masse
Mit der aus dem PSE abgeleiteten molaren Masse  folgt:
folgt:
![\(\begin{array}[t]{rll}
m&=& n \cdot M & \\[5pt]
&=& 0,075\,\text{mol} \cdot 40\,\text{g} \cdot \text{mol}^{-1} & \\[5pt]
&=& 3\,\text{g}
\end{array}\)](https://mathjax.schullv.de/bf52083a13ec79ca3e72384238d15eda573b1cf847d02d5e86286cecd0e6f933?color=5a5a5a) Um
Um  Natronlauge der angegebenen Konzentration herzustellen, werden
Natronlauge der angegebenen Konzentration herzustellen, werden  Natriumhydroxid benötigt.
Natriumhydroxid benötigt.
3.2
Reaktionsgleichungen der Protolyseschritte
Bis zum Äquivalenzpunkt der Titration:
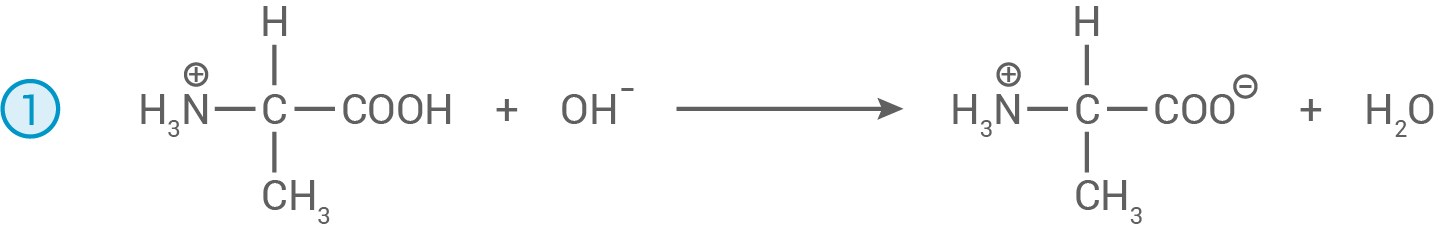 Nach dem Äquivalenzpunkt der Titration:
Nach dem Äquivalenzpunkt der Titration:

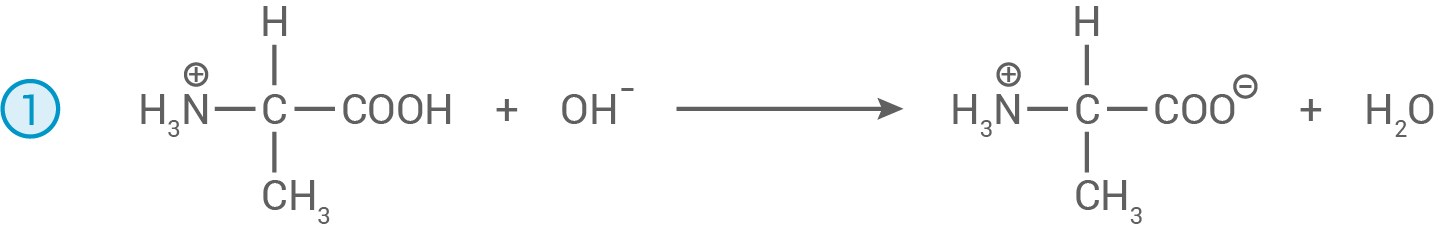

3.3
Zuordnung der Begriffe
Am Halbäquivalenzpunkt ist die Säurekonzentration genauso groß wie die Konzentration der korrespondierenden Base. Dies entspricht in der Titrationskurve dem 1. und 3. Punkt.
Der isoelektrische Punkt ist der Äquivalenzpunkt. In der Titrationskurve trifft dies auf den 2. Punkt zu. Hier sind die Teilchen nach außen hin neutral geladen und liegen in zwitterionischer Form vor, wodurch die Alanin-Teilchen nicht im elektrischen Feld wandern.
Stellungnahme zu allen Behauptungen
a)
Beim Halbäquivalenzpunkt ist die Pufferwirkung einer Lösung, bestehend aus einer Säure und ihrer korrespondierenden Base, am größten. Der pH-Wert zeigt an dieser Stelle der Titration die geringste Veränderung bei Zugabe von Säure oder Base (vgl. Diagramm).
Demnach trifft Aussage a) zu.
Demnach trifft Aussage a) zu.
b)
Am isoelektrischen Punkt ist die Pufferwirkung am kleinsten, da dieser dem Äquivalenzpunkt der Titration entspricht. An diesem Punkt der Titration bewirkt selbst eine minimale Zugabe von weiterer Säure oder Base eine signifikante Veränderung des pH-Werts.
Aussage b) ist folglich falsch.
Aussage b) ist folglich falsch.
c)
Im pH-Bereich zwischen  ist D-Luciferin am stabilsten, während D-Alanin dort seinen isoelektrischen Punkt hat und größtenteils in zwitterionischer Form vorliegt. Die Pufferwirkung ist demnach genau in diesem Bereich schlecht, da sich bereits die Zugabe kleiner Mengen von Säuren oder Basen stark auf den pH-Wert auswirkt.
ist D-Luciferin am stabilsten, während D-Alanin dort seinen isoelektrischen Punkt hat und größtenteils in zwitterionischer Form vorliegt. Die Pufferwirkung ist demnach genau in diesem Bereich schlecht, da sich bereits die Zugabe kleiner Mengen von Säuren oder Basen stark auf den pH-Wert auswirkt.
Aussage c) ist daher falsch.
Aussage c) ist daher falsch.