C2 Pflanzenöle
Pflanzliche Öle und Fette sind wichtig für eine gesunde Ernährung. Daneben gewinnen sie in der chemischen Industrie als Rohstoffe für nachhaltigere Kunststoffe zunehmend an Bedeutung.
1
Einer Gruppe von Wissenschaftlerinnen und Wissenschaftlern ist es gelungen, einen Kunststoff ausschließlich aus dem nachwachsenden Rohstoff Rapsöl herzustellen. Abbildung 1 zeigt ein Reaktionsschema ausgehend von einem in Rapsöl enthaltenen Fett-Molekül:
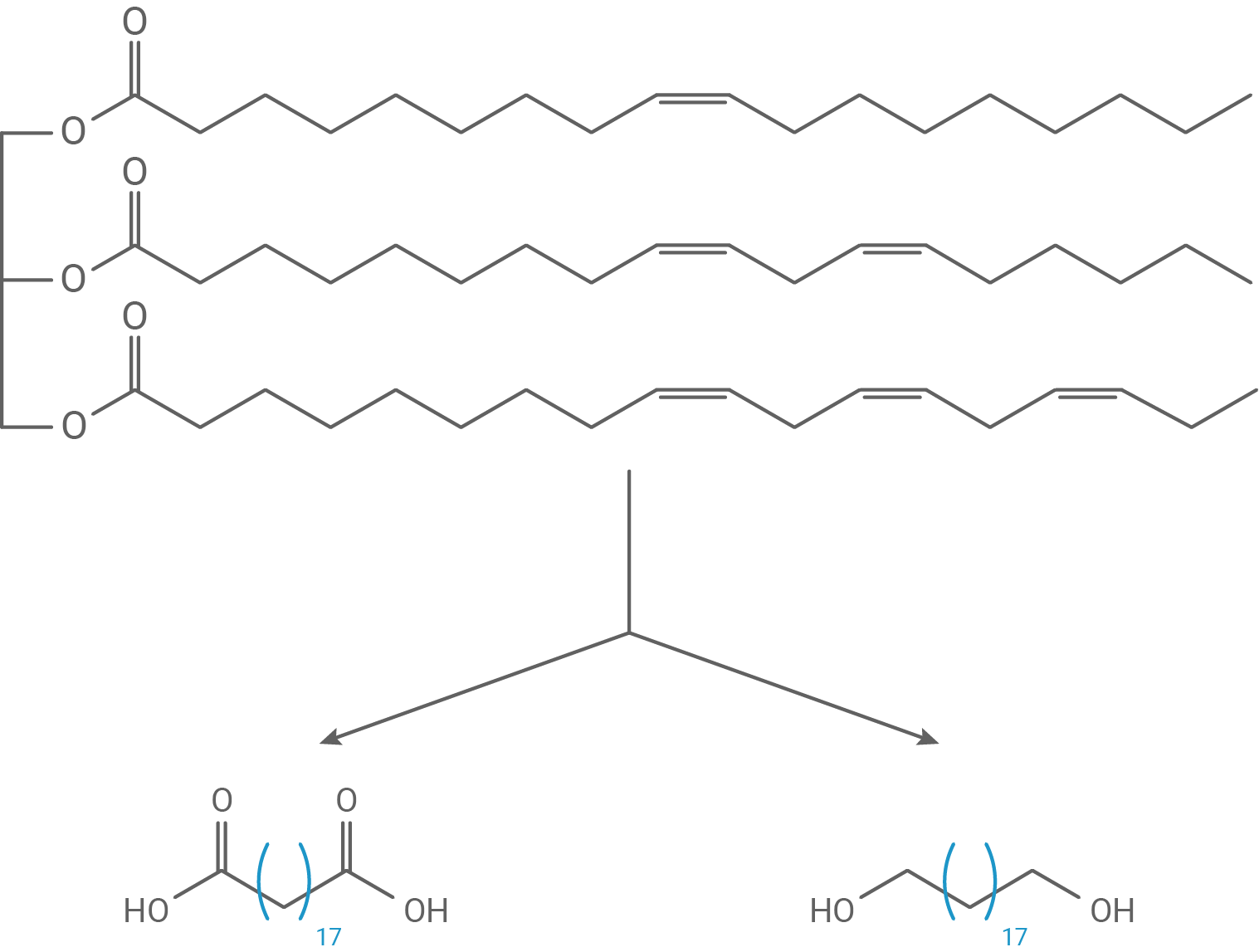

Abb. 1: Reaktionsschema zur Herstellung von Nonadecandisäure und Nonadecan-1,19-diol aus Rapsöl
eigene Darstellung nach: https://www.researchgate.net/publication/255752845_Polymer_ precursors_from_catalytic_reactions_of_natural_oils/download, zuletzt aufgerufen am 28.10.2021; https://www.biooekonomie-bw.de/fachbeitrag/pm/verlustfreiekunststofferzeugung-aus-pflanzenoel, zuletzt aufgerufen am 28.10.2021
1.1
Formuliere eine Strukturformelgleichung für die Synthese eines Kunststoffs aus Nonadecan-1,19-diol und Nonadecandisäure (Abb. 1). Benenne den Typ der zugrundeliegenden Polyreaktion.
(4 BE)
1.2
Der aus Rapsöl gewonnene Kunststoff ähnelt in seinen Eigenschaften dem Kunststoff Polyethen (PE).
Ordne PE aufgrund seines thermischen Verhaltens einer Kunststoffklasse zu und erläutere deine Zuordnung.
Ordne PE aufgrund seines thermischen Verhaltens einer Kunststoffklasse zu und erläutere deine Zuordnung.
(5 BE)
1.3
Rapsöl kann zur Gewinnung von Seifen genutzt werden. Häufig werden jedoch anstelle von Seifen synthetische Tenside verwendet.
Gib die Strukturformel eines aus Rapsöl (Abb. 1) gewonnenen Seifen-Moleküls an. Beurteile die Nutzung von Seifen auf Rapsölbasis gegenüber der von synthetischen, nichtionischen Tensiden auf Erdölbasis hinsichtlich ihrer Nachhaltigkeit und ihrer Waschwirkung bei hoher Wasserhärte.
Gib die Strukturformel eines aus Rapsöl (Abb. 1) gewonnenen Seifen-Moleküls an. Beurteile die Nutzung von Seifen auf Rapsölbasis gegenüber der von synthetischen, nichtionischen Tensiden auf Erdölbasis hinsichtlich ihrer Nachhaltigkeit und ihrer Waschwirkung bei hoher Wasserhärte.
(5 BE)
1.4
Um Rapsöl als Rohstoff für die chemische Industrie nutzen zu können, muss es für manche Prozesse vorher hydriert werden.
1.4.1
Erkläre die unterschiedlichen Schmelzbereiche der vor und nach der Hydrierung von Rapsöl vorliegenden Fette.
(5 BE)
1.4.2
Der für die Hydrierung benötigte Wasserstoff kann durch die sog. Dampfreformierung gewonnen werden. Dabei reagieren Methan und Wasser endotherm in einer Gleichgewichtsreaktion zu Wasserstoff und Kohlenstoffmonoxid. Bei den Bedingungen im Reaktor liegen alle Stoffe gasförmig vor.
In zwei Versuchsreihen wird der prozentuale Anteil an umgesetztem Methan in Abhängigkeit von der Temperatur bzw. dem Druck bestimmt. Die Ergebnisse der Versuchsreihen sind in den Abbildungen 2 und 3 dargestellt:
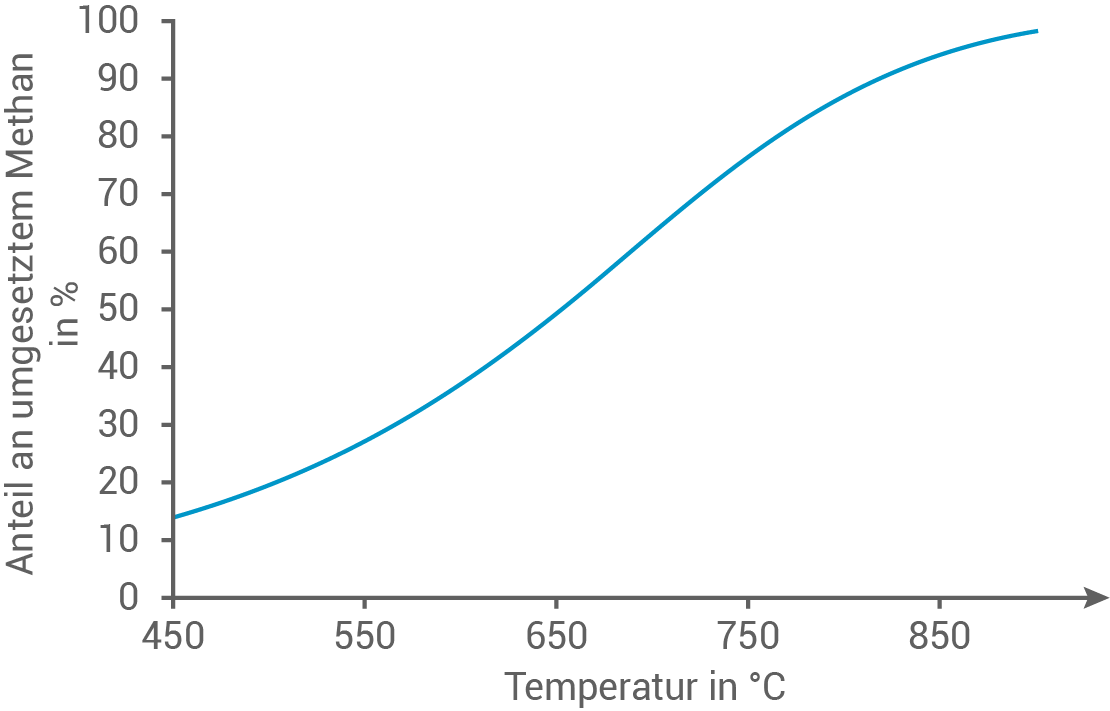
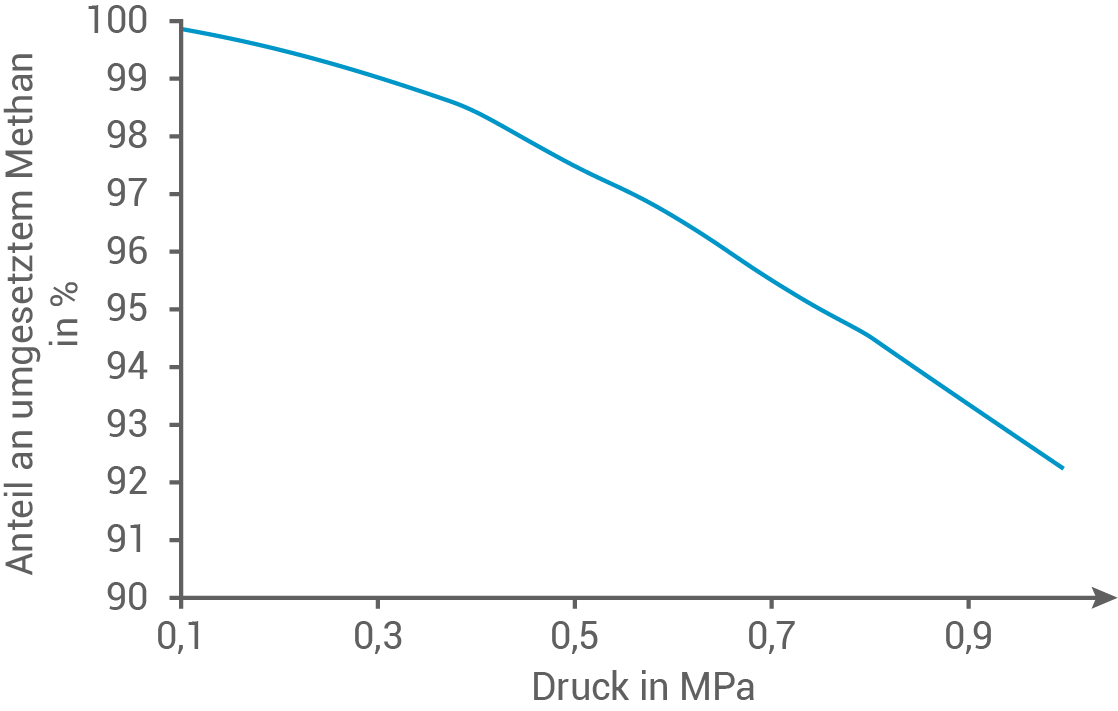 Formuliere die Reaktionsgleichung für die angegebene Reaktion. Erkläre mithilfe des Prinzips von Le Chatelier und den Abbildungen 2 und 3 die Abhängigkeit der Gleichgewichtslage der Dampfreformierungsreaktion von Temperatur und Druck.
Formuliere die Reaktionsgleichung für die angegebene Reaktion. Erkläre mithilfe des Prinzips von Le Chatelier und den Abbildungen 2 und 3 die Abhängigkeit der Gleichgewichtslage der Dampfreformierungsreaktion von Temperatur und Druck.
In zwei Versuchsreihen wird der prozentuale Anteil an umgesetztem Methan in Abhängigkeit von der Temperatur bzw. dem Druck bestimmt. Die Ergebnisse der Versuchsreihen sind in den Abbildungen 2 und 3 dargestellt:

Abb. 2: Prozentualer Anteil an umgesetztem Methan in Abhängigkeit von der Temperatur
Hae-Gu Park et al.: Bench-Scale Steam Reforming of Methane for Hydrogen Production, Catalysts 2019, 9(7), 615; MDPI, Basel, Switzerland, https://doi.org/10.3390/catal9070615, CC BY 4.0, zuletzt aufgerufen am 28.10.2021

Abb. 3: Prozentualer Anteil an umgesetztem Methan in Abhängigkeit vom Druck
Hae-Gu Park et al.: Bench-Scale Steam Reforming of Methane for Hydrogen Production, Catalysts 2019, 977), 615; MDPI, Basel, Switzerland, https://doi.org/10.3390/catal9070615, CC BY 4.0, zuletzt aufgerufen am 28. 10.2021
(8 BE)
2
Aus Sojaöl werden pflanzenölbasierte Epoxide (ESBO, Abb. 4) erzeugt, die als Alternative zu herkömmlichen Weichmachern wie z. B. Diethylhexylphthalat (DEHP, Abb. 5) in Kunststoffen dienen:
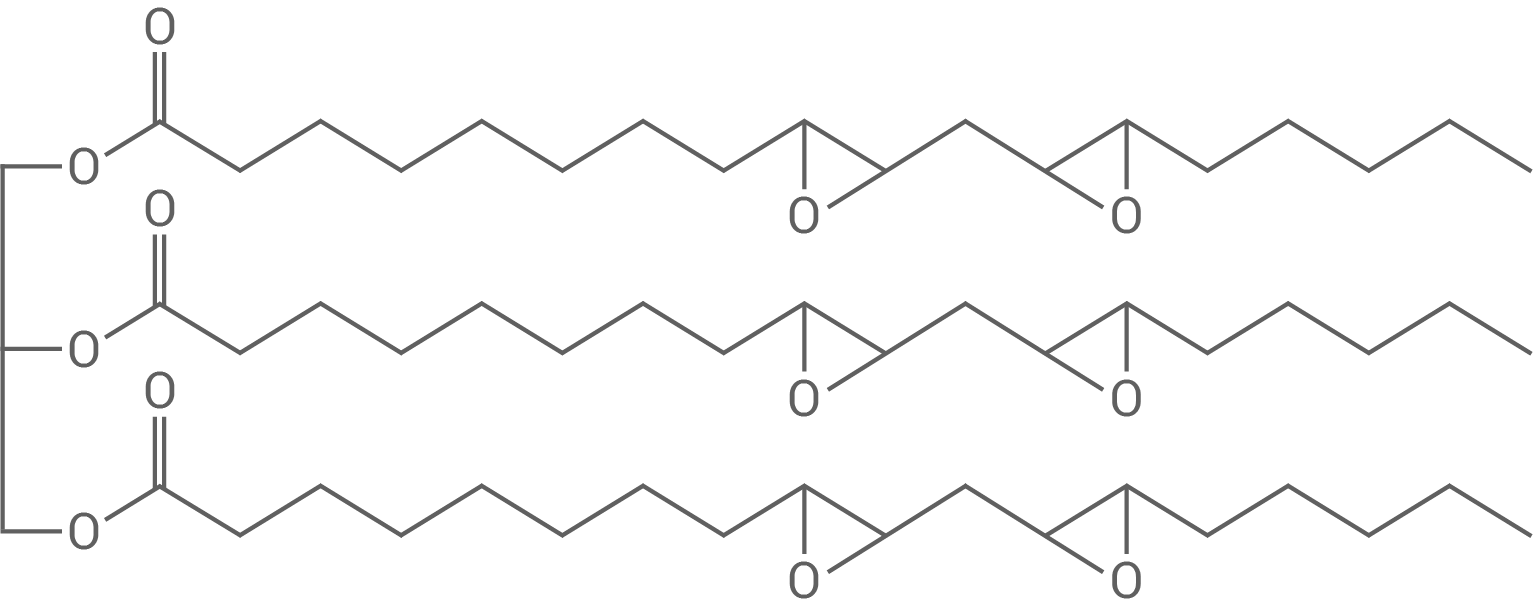
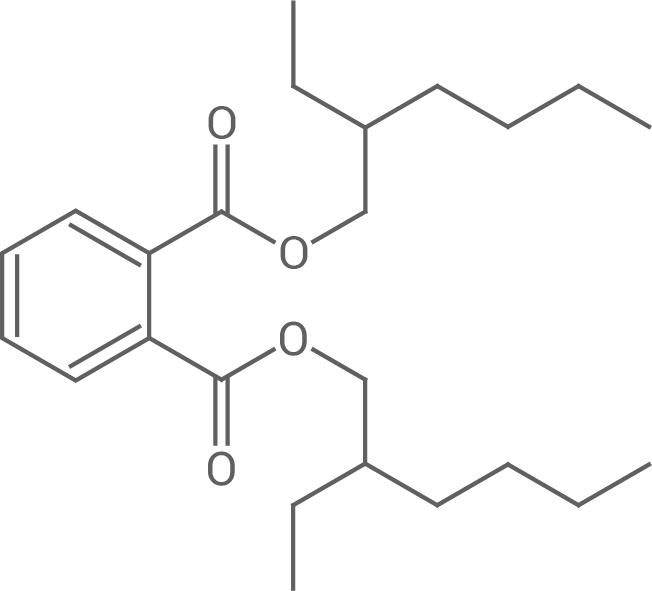

Abb. 4: Strukturformel von epoxidiertem Sojaöl (ESBO)

Abb. 5: Strukturformel von Diethylhexylphthalat (DEHP)
2.1
Für die Synthese von DEHP wird Phthalsäureanhydrid benötigt. Im Labor wird Phthalsäureanhydrid aus Benzol hergestellt, das zunächst zu Toluol reagiert (Abb. 6):
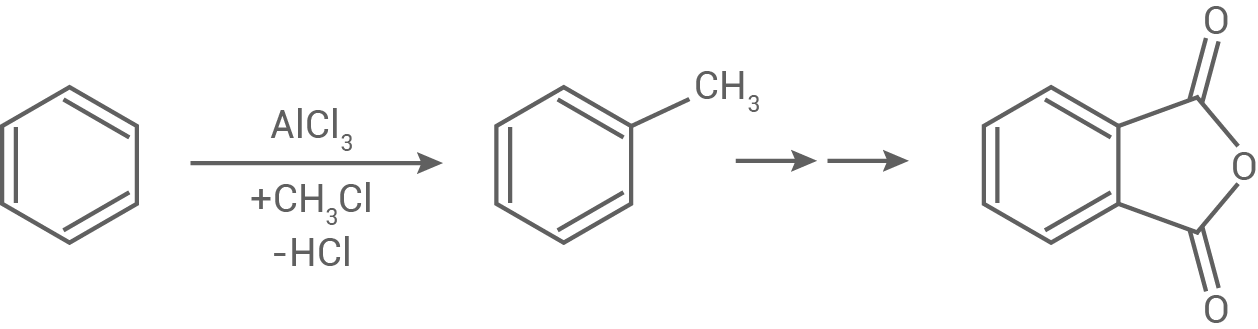 Formuliere den Reaktionsmechanismus für die Herstellung von Toluol ausgehend von Benzol. Als Elektrophil reagiert hier das Chlormethan-Molekül. Die polare Bindung zwischen dem Kohlenstoff-Atom und dem Chlor-Atom wird durch den Katalysator
Formuliere den Reaktionsmechanismus für die Herstellung von Toluol ausgehend von Benzol. Als Elektrophil reagiert hier das Chlormethan-Molekül. Die polare Bindung zwischen dem Kohlenstoff-Atom und dem Chlor-Atom wird durch den Katalysator  zusätzlich polarisiert.
zusätzlich polarisiert.

Abb. 6: Schema der Phthalsäureanhydrid-Synthese im Labor
(7 BE)
2.2
Kunststoffe, die Weichmacher wie DEHP oder ESBO enthalten, findet man u. a. als Dichtungsmaterial in den Schraubverschlüssen von Einmachgläsern. Sie sollen hier die abdichtende Eigenschaft des verwendeten Kunststoffs verbessern.
Weichmacher können aus den Kunststoffen austreten, da ihre Moleküle keine chemische Bindung mit den Polymeren eingehen. Viele Weichmacher stehen im Verdacht, schädliche Auswirkungen auf den menschlichen Körper zu haben.
Die Tabelle gibt die Ausgangsstoffe für die Herstellung sowie die als unbedenklich geltenden Grenzwerte für die Aufnahme (TDI-Wert) für DEHP und ESBO an:
Das Bundesinstitut für Risikobewertung (BfR) rät, DEHP nicht als Weichmacher in Dichtmassen einzusetzen, falls die Gläser für ölhaltige Lebensmittel, wie z. B. Pesto oder Pastasoßen, verwendet werden.
Begründe die Empfehlung des BfR und bewerte den Einsatz von ESBO als Alternative zu DEHP beim Einmachen ölhaltiger Lebensmittel in Einmachgläsern unter Abwägung der Werte Umwelt und Gesundheit.
Weichmacher können aus den Kunststoffen austreten, da ihre Moleküle keine chemische Bindung mit den Polymeren eingehen. Viele Weichmacher stehen im Verdacht, schädliche Auswirkungen auf den menschlichen Körper zu haben.
Die Tabelle gibt die Ausgangsstoffe für die Herstellung sowie die als unbedenklich geltenden Grenzwerte für die Aufnahme (TDI-Wert) für DEHP und ESBO an:
| DEHP | ESBO | |
|---|---|---|
| Ausgangsstoff | fossile Rohstoffe | Sojaöl |
| TDI-Wert in mg pro kg Körpergewicht |
Tab.: Ausgangsstoffe für die Herstellung und TDI-Werte für DEHP und ESBO
eigene Darstellung nach: https://mobil.bfr.bund.de/cm/343/uebergang_von_weichmachern_aus_schraubdeckel_dichtmassen_in _lebensmittel.pdf, zuletzt aufgerufen am 28.10.2021 https://www.laves.niedersachsen.de/startseite/lebensmittel/ruckstande_verunreingungen/phthalate-inlebensmitteln-99796.html, zuletzt aufgerufen am 28.10.2021
Begründe die Empfehlung des BfR und bewerte den Einsatz von ESBO als Alternative zu DEHP beim Einmachen ölhaltiger Lebensmittel in Einmachgläsern unter Abwägung der Werte Umwelt und Gesundheit.
(6 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Strukturformelgleichung und Typ der Kunststoffsynthese
Die Reaktion von Nonadecan-1,19-diol mit Nonadecandisäure folgt einer Polykondensation:
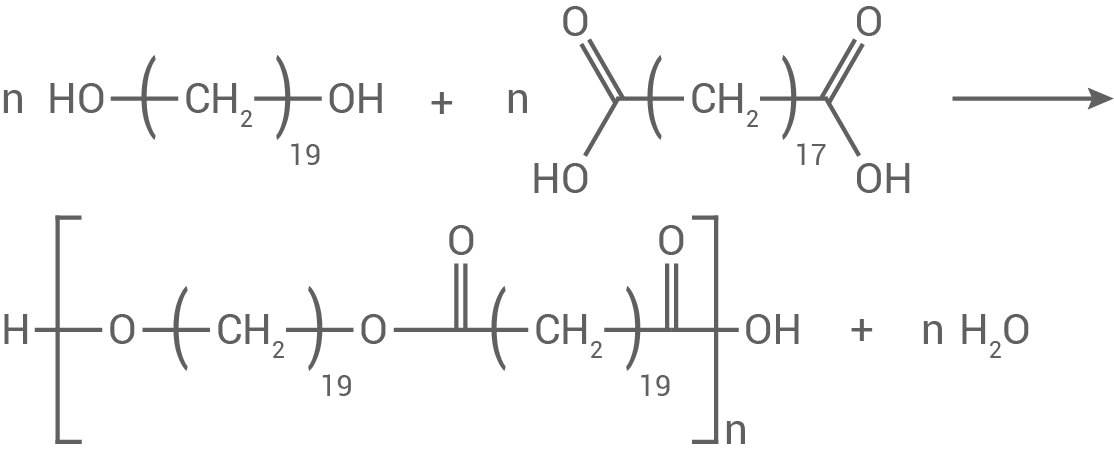

1.2
Zuordnung einer Kunststoffklasse
Polyethen (PE) besteht aus linearen Molekülketten, die sich beim Erhitzen gegeneinander verschieben lassen und dem Kunststoff somit eine Verformbarkeit verleihen. Die Polymermoleküle behalten nach dem Abkühlen ihre neue Position bei, wodurch das Werkstück eine neue Form erhält. Daher wird Polyethen als thermoplastischer Kunststoff klassifiziert.
1.3
Strukturformel eines Seifen-Moleküls
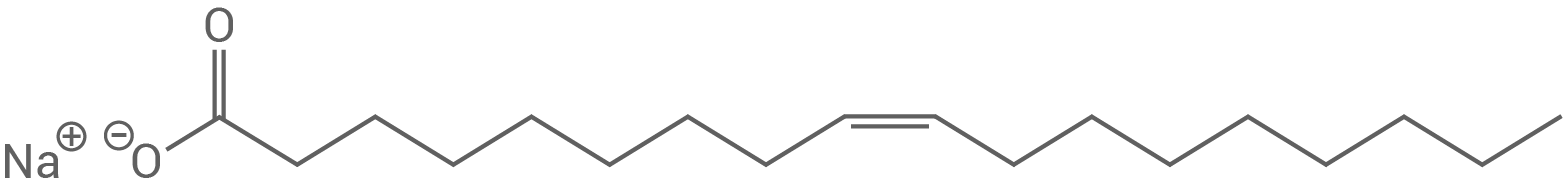 Beurteilung der Nutzung
In hartem Wasser ist eine bedeutende Menge an Calciumoxid (Kalk) vorhanden. Die Anionen der Seife bilden mit den
Beurteilung der Nutzung
In hartem Wasser ist eine bedeutende Menge an Calciumoxid (Kalk) vorhanden. Die Anionen der Seife bilden mit den  -Ionen bei hoher Wasserhärte schwer lösliche Salze, bekannt als Kalkseifen, die die Wäsche vergrauen lassen und die Waschwirkung der Seife beeinträchtigen. Im Gegensatz dazu reagieren nichtionische Tenside nicht mit den in hartem Wasser enthaltenen Ionen, wodurch ihre Waschwirkung unverändert bleibt.
Die Produktion nichtionischer Tenside erfordert Erdöl, welches begrenzt verfügbar ist. Im Gegensatz dazu stellen Seifen, die aus nachwachsenden Rohstoffen wie zum Beispiel Rapsöl hergestellt werden können, eine umweltfreundlichere Alternative dar. Die Herstellung von Seifen ist somit nachhaltiger als die von nichtionischen Tensiden.
-Ionen bei hoher Wasserhärte schwer lösliche Salze, bekannt als Kalkseifen, die die Wäsche vergrauen lassen und die Waschwirkung der Seife beeinträchtigen. Im Gegensatz dazu reagieren nichtionische Tenside nicht mit den in hartem Wasser enthaltenen Ionen, wodurch ihre Waschwirkung unverändert bleibt.
Die Produktion nichtionischer Tenside erfordert Erdöl, welches begrenzt verfügbar ist. Im Gegensatz dazu stellen Seifen, die aus nachwachsenden Rohstoffen wie zum Beispiel Rapsöl hergestellt werden können, eine umweltfreundlichere Alternative dar. Die Herstellung von Seifen ist somit nachhaltiger als die von nichtionischen Tensiden.

1.4.1
Erklärung der unterschiedlichen Schmelzbereiche
Die Fettmoleküle aus Rapsöl, wie in Abbildung 1 dargestellt, enthalten drei ungesättigte Fettsäuren, die aufgrund ihrer cis-Konfiguration an den  -Doppelbindungen eine gewinkelte Struktur aufweisen.
-Doppelbindungen eine gewinkelte Struktur aufweisen.
Die ungesättigten Bindungen bewirken, dass sich die Fettsäuren im Gegensatz zu gesättigten Fettsäuren nicht so eng aneinanderlagern können, wodurch der Schmelzbereich niedriger ist. Fette mit gesättigten Fettsäuren haben aufgrund ihrer stärkeren zwischenmolekularen Wechselwirkungen einen höheren Schmelzbereich.
Die Hydrierung führt zur Addition von Wasserstoffmolekülen an die Doppelbindungen, wodurch gesättigte Fettsäuren entstehen. Diese gesättigten Fette schmelzen erst bei höheren Temperaturen.
Die ungesättigten Bindungen bewirken, dass sich die Fettsäuren im Gegensatz zu gesättigten Fettsäuren nicht so eng aneinanderlagern können, wodurch der Schmelzbereich niedriger ist. Fette mit gesättigten Fettsäuren haben aufgrund ihrer stärkeren zwischenmolekularen Wechselwirkungen einen höheren Schmelzbereich.
Die Hydrierung führt zur Addition von Wasserstoffmolekülen an die Doppelbindungen, wodurch gesättigte Fettsäuren entstehen. Diese gesättigten Fette schmelzen erst bei höheren Temperaturen.
1.4.2
Reaktionsgleichung für die Dampfreformierung



 Abhängigkeit der Gleichgewichtslage
Nach dem Prinzip von Le Chatelier bzw. vom kleinsten Zwang gilt:
Abhängigkeit der Gleichgewichtslage
Nach dem Prinzip von Le Chatelier bzw. vom kleinsten Zwang gilt:
Wird auf ein System, das sich im chemischen Gleichgewicht befindet, ein äußerer Zwang ausgeübt, verschiebt sich die Lage des Gleichgewichts so, dass die Wirkung des Zwanges minimal wird. Eine Temperaturerhöhung bewirkt die Begünstigung der endothermen Reaktion. Somit wird hier bei steigender Temperatur die Hinreaktion bevorzugt und die umgesetzte Menge an Methan erhöht sich. Durch Verschiebung des Gleichgewichts auf Produktseite steigt auch die Ausbeute an Wasserstoff. Eine Druckerhöhung begünstigt die volumenverkleinernde Reaktion. Bei der Dampfreformierung sind auf der Produktseite mehr Gasteilchen als auf der Eduktseite, wodurch die Rückreaktion bevorzugt wird. Bei hohem Druck verringert sich die umgesetzte Menge an Methan und folglich die Ausbeute an Wasserstoff, da das Gleichgewicht zu den Edukten hin verschoben wird.
Wird auf ein System, das sich im chemischen Gleichgewicht befindet, ein äußerer Zwang ausgeübt, verschiebt sich die Lage des Gleichgewichts so, dass die Wirkung des Zwanges minimal wird. Eine Temperaturerhöhung bewirkt die Begünstigung der endothermen Reaktion. Somit wird hier bei steigender Temperatur die Hinreaktion bevorzugt und die umgesetzte Menge an Methan erhöht sich. Durch Verschiebung des Gleichgewichts auf Produktseite steigt auch die Ausbeute an Wasserstoff. Eine Druckerhöhung begünstigt die volumenverkleinernde Reaktion. Bei der Dampfreformierung sind auf der Produktseite mehr Gasteilchen als auf der Eduktseite, wodurch die Rückreaktion bevorzugt wird. Bei hohem Druck verringert sich die umgesetzte Menge an Methan und folglich die Ausbeute an Wasserstoff, da das Gleichgewicht zu den Edukten hin verschoben wird.
2.1
Formulierung des Reaktionsmechanismus
Die Herstellung von Toluol erfolgt über eine elektrophile aromatische Substitution von Chlormethan an Benzol.
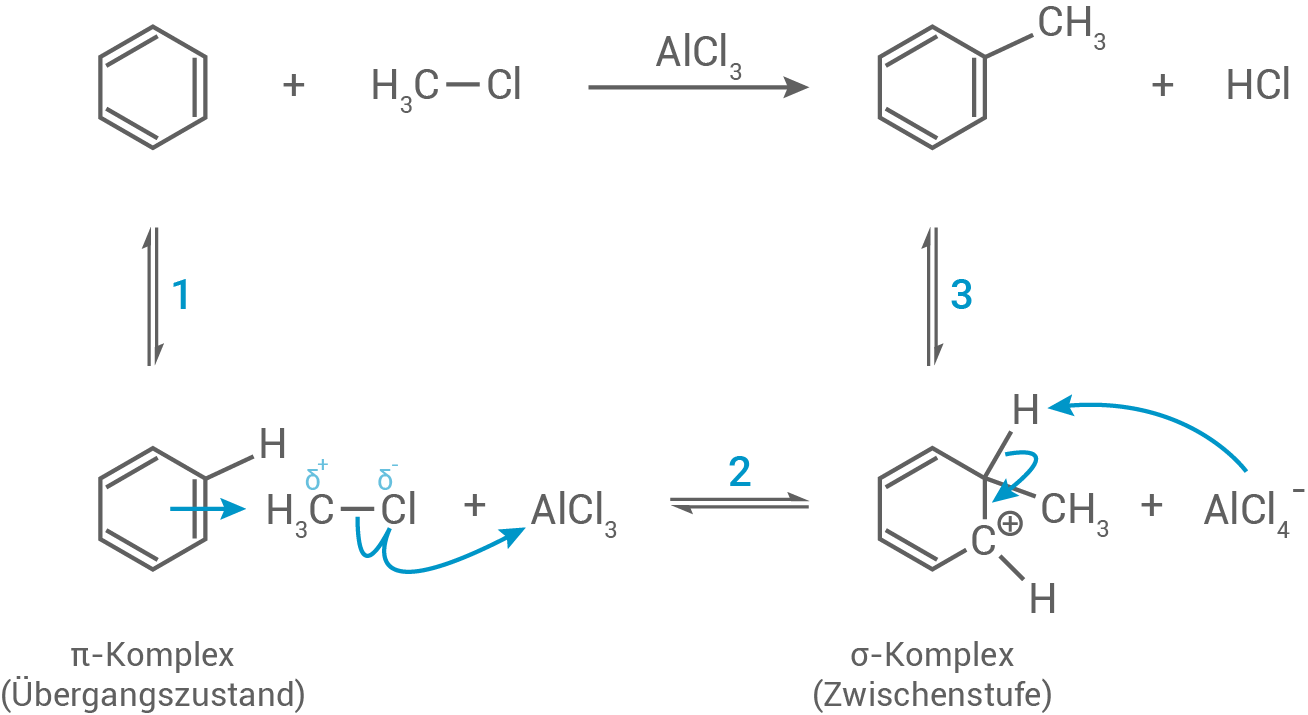 Schritt 1:
Schritt 1:
Zunächst entsteht durch die Wechselwirkung des Benzol-Moleküls mit dem Elektrophil ein -Komplex.
Schritt 2:
-Komplex.
Schritt 2:
Anschließend wird in Gegenwart des Katalysators Aluminiumchlorid die
die  -Bindung im Chlormethan-Molekül so stark polarisiert, dass ein Elektronenpaar aus dem Ringsystem an das Kohlenstoffatom im Chlormethan-Molekül bindet. Dadurch wird die Aromatizität aufgehoben und es entsteht der mesomeriestabilisierte
-Bindung im Chlormethan-Molekül so stark polarisiert, dass ein Elektronenpaar aus dem Ringsystem an das Kohlenstoffatom im Chlormethan-Molekül bindet. Dadurch wird die Aromatizität aufgehoben und es entsteht der mesomeriestabilisierte  -Komplex.
Schritt 3:
-Komplex.
Schritt 3:
Im dritten Schritt erfolgt die Abspaltung eines Protons. Das verbleibende Elektronenpaar klappt zurück in das Ringsystem, wodurch eine Rearomatisierung eintritt.

(Mechanismus einer Friedel-Craft-Alkylierung)
Zunächst entsteht durch die Wechselwirkung des Benzol-Moleküls mit dem Elektrophil ein
Anschließend wird in Gegenwart des Katalysators Aluminiumchlorid
Im dritten Schritt erfolgt die Abspaltung eines Protons. Das verbleibende Elektronenpaar klappt zurück in das Ringsystem, wodurch eine Rearomatisierung eintritt.
2.2
Empfehlung des BfR und Bewertung des Einsatzes von ESBO
Die Empfehlung des BfR, den Weichmacher DEHP nicht in Dichtmassen für das Einmachen ölhaltiger Produkte zu verwenden, basiert auf den physikalischen Eigenschaften von DEHP. Dieser Weichmacher enthält keine polaren endständigen Gruppen, und die Estergruppen sind mit langen, verzweigten Alkylresten verbunden, wodurch er lipophil ist. Ölhaltige Lebensmittel könnten daher den Weichmacher aus den Dichtmassen lösen, wodurch die chemische Verbindung möglicherweise in das Lebensmittel übergeht und den TDI-Wert von  Körpergewicht überschreitet. Dies stellt ein Risiko dar.
Im Gegensatz dazu weist ESBO wesentlich höhere TDI-Werte auf und ist daher aus gesundheitlicher Sicht weniger bedenklich. Zusätzlich wird ESBO aus dem nachwachsenden Rohstoff Sojaöl und nicht aus fossilen Rohstoffen hergestellt, was seinen Einsatz auch aus Umweltaspekten bevorzugt. Dies könnte dazu beitragen, den nicht nachhaltigen Abbau fossiler Rohstoffe einzudämmen.
Auf der anderen Seite stellt sich die Frage nach der Nahrungsmittelkonkurrenz, wenn landwirtschaftliche Produkte nicht zur Ernährung der Menschen, sondern für andere Zwecke verwendet werden. Dadurch wird weniger Anbaufläche für die Nahrungsmittelproduktion zur Verfügung stehen, was jedoch benötigt wird, um eine wachsende Bevölkerung zu ernähren.
Körpergewicht überschreitet. Dies stellt ein Risiko dar.
Im Gegensatz dazu weist ESBO wesentlich höhere TDI-Werte auf und ist daher aus gesundheitlicher Sicht weniger bedenklich. Zusätzlich wird ESBO aus dem nachwachsenden Rohstoff Sojaöl und nicht aus fossilen Rohstoffen hergestellt, was seinen Einsatz auch aus Umweltaspekten bevorzugt. Dies könnte dazu beitragen, den nicht nachhaltigen Abbau fossiler Rohstoffe einzudämmen.
Auf der anderen Seite stellt sich die Frage nach der Nahrungsmittelkonkurrenz, wenn landwirtschaftliche Produkte nicht zur Ernährung der Menschen, sondern für andere Zwecke verwendet werden. Dadurch wird weniger Anbaufläche für die Nahrungsmittelproduktion zur Verfügung stehen, was jedoch benötigt wird, um eine wachsende Bevölkerung zu ernähren.