A1 Zahngesundheit
Karies ist eine Erkrankung, die von einer durch Säureeinwirkung veränderten Zahnoberfläche verursacht wird. Daher stellt die bakterielle Bildung von Säuren aus Zuckern im Mundraum eine Gefahr für die Zahngesundheit dar. Zahnflegekaugummis sollen helfen, das Kariesrisiko zu senken.
1
Ein wichtiger Bestandteil der Zähne ist Hydroxylapatit  dessen Bildung und Auflösung in der Mundhöhle durch das folgende chemische Gleichgewicht beschrieben werden kann:
dessen Bildung und Auflösung in der Mundhöhle durch das folgende chemische Gleichgewicht beschrieben werden kann:



1.1
Erkläre den Einfluss des Verzehrs säurehaltiger Getränke, wie z.B. Orangensaft, auf dieses Gleichgewicht.
(4 BE)
1.2
Der pH-Wert im Mund liegt meist zwischen  und
und  Hauptverantwortlich dafür ist der Speichel. Bei einer zahnmedizinischen Untersuchung wird eine Speichelprobe mit Salzsäure der Konzentration
Hauptverantwortlich dafür ist der Speichel. Bei einer zahnmedizinischen Untersuchung wird eine Speichelprobe mit Salzsäure der Konzentration  versetzt und der pH-Wert nach einer festgelegten Zeit bestimmt (Tab. 1):
versetzt und der pH-Wert nach einer festgelegten Zeit bestimmt (Tab. 1):
Berechne den in Tabelle 1 fehlenden pH-Wert bei Ansatz B und erkläre die unterschiedlichen pH-Werte der beiden Ansätze fünf Minuten nach Säurezugabe.
| Ansatz | A | B |
|---|---|---|
| Probensubstanz | Speichel | Wasser |
| Volumen der Probe in mL | ||
| pH-Wert vor Säurezugabe | ||
| Volumen der zugegebenen Salzsäure |
||
| pH-Wert fünf Minuten nach Säure-zugabe |
Tab. 1: Bestimmung der Änderung des pH-Werts bei einer zahnmedizinischen Untersuchung
(6 BE)
2
Bakterien können Glucose im Mundraum u. a. zu den in Tabelle 2 angegebenen Säuren umsetzen:
| Säuren | pKS |
|---|---|
| Ethansäure (Essigsäure) | |
| 2-Hydroxypropansäure (Milchsäure) | |
| Propansäure (Propionsäure) |
Tab. 2: Mögliche Umsetzungsprodukte von Glucose im Mundraum
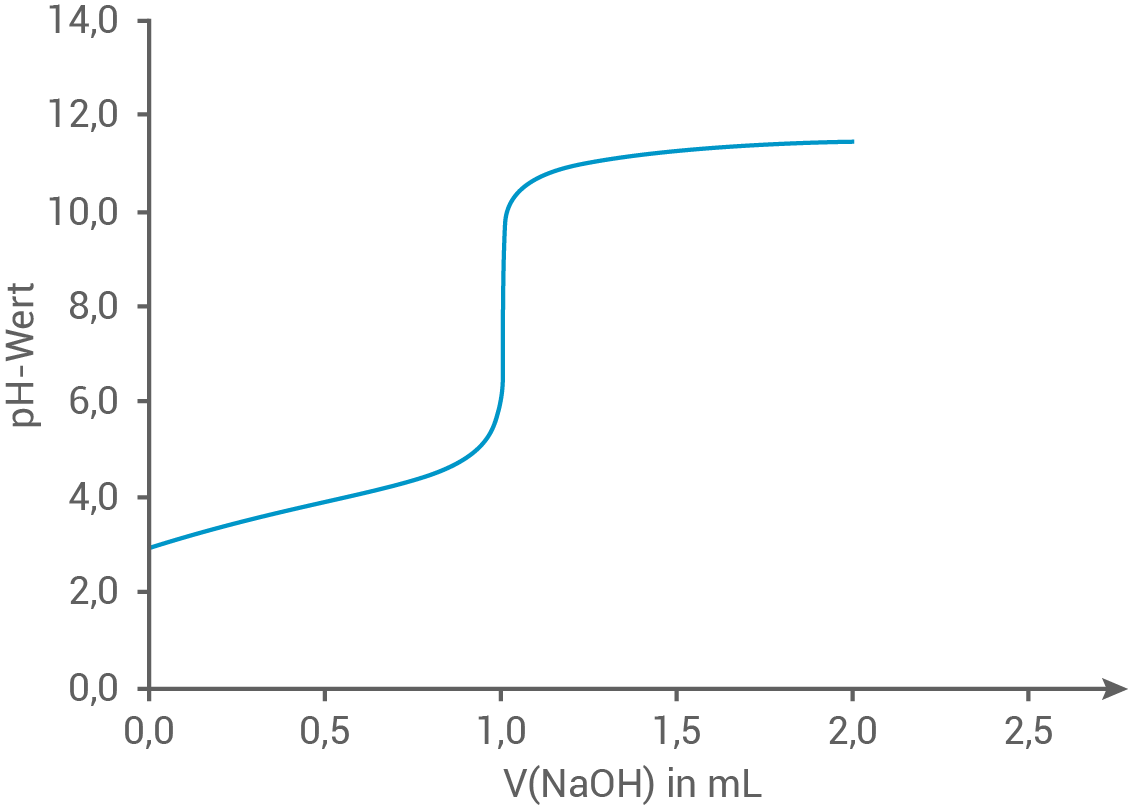
Mit einer dieser Säuren wird eine Titration mit Natronlauge durchgeführt. Die Titrationskurve ist in Abbildung 1 dargestellt:

Abb. 1: Titrationskurve einer Säure aus Tabelle 2
(5 BE)
3
Der Zuckeralkohol Xylit wird als Süßstoff in Zahnpflegekaugummis eingesetzt. Er kann z. B. nach folgendem Reaktionsschema gewonnen werden (Abb. 2):

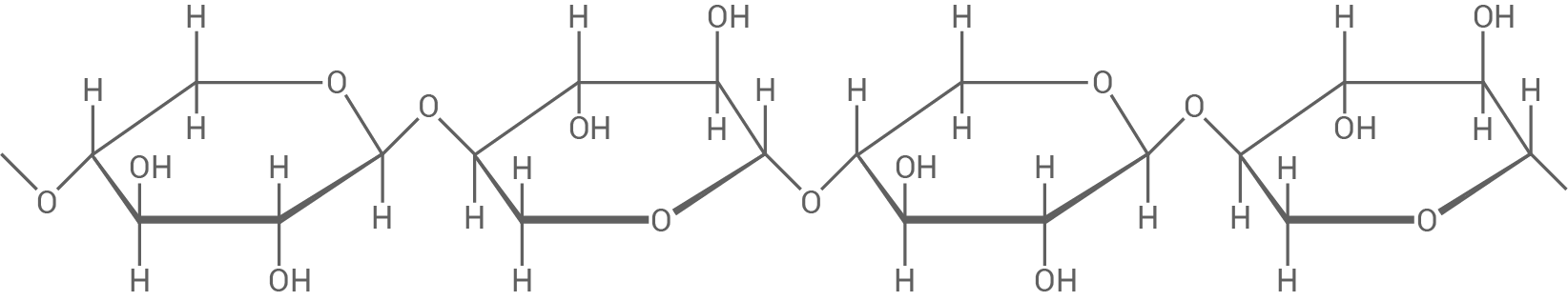

Abb. 2: Reaktionsschema zur Herstellung von Xylit aus einem Xylan

Abb. 3: Strukturformelausschnitt aus einem Xylan-Molekül
3.1
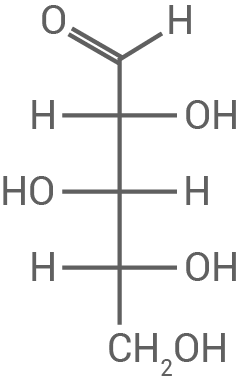
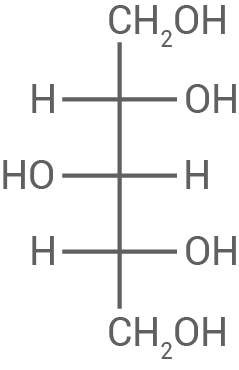
Benenne die Art der glykosidischen Bindung zwischen den Xylopyranose-Einheiten im angegebenen Strukturformelausschnitt (Abb. 3). Leite die Fischer-Projektionsformeln der Moleküle von Xylose und Xylit ab.
(5 BE)
3.2
Mit Xylose und Xylit wird jeweils die Silberspiegel-Probe durchgeführt. Beschreibe die Durchführung dieses Nachweises und begründe jeweils das zu erwartende Ergebnis. Formuliere allgemein für den Fall einer positiven Probe die Redoxgleichung mit Teilgleichungen.
(8 BE)
3.3
Bewerte unter Einbezug von Tabelle 3 den Einsatz von Glucose bzw. Xylit in Zahnpflegekaugummis unter gesundheitlichen Aspekten.
| Stoff | Glucose | Xylit |
|---|---|---|
| physiologischer Brennwert in |
||
| Karies fördernde Wirkung | stark | keine |
| abführende Wirkung | keine | bei Konsum großer Mengen |
Tab. 3: Ausgewählte Eigenschaften von Glucose und Xylit
Brennwert Glucose entnommen aus: htps://de.wikipedia.org/wiki/Glucose\#Brennwert;
Brennwert Xylit entnommen aus: https://de.wikipedia.org/wiki/Xylit
Brennwert Xylit entnommen aus: https://de.wikipedia.org/wiki/Xylit
(4 BE)
4
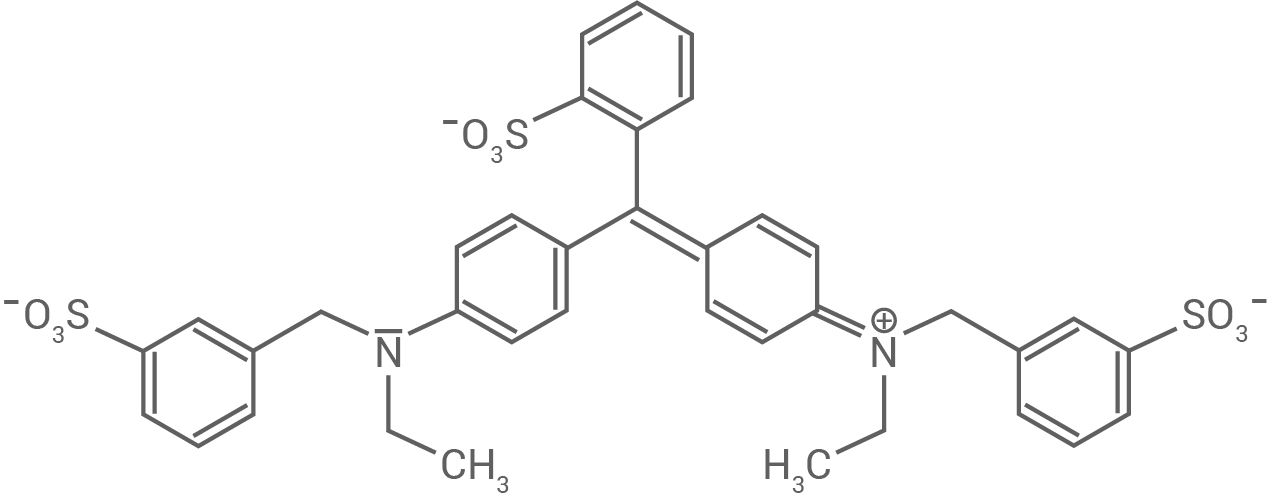
Zahnpflegekaugummis enthalten häufig den Farbstoff E133 (Abb. 4):
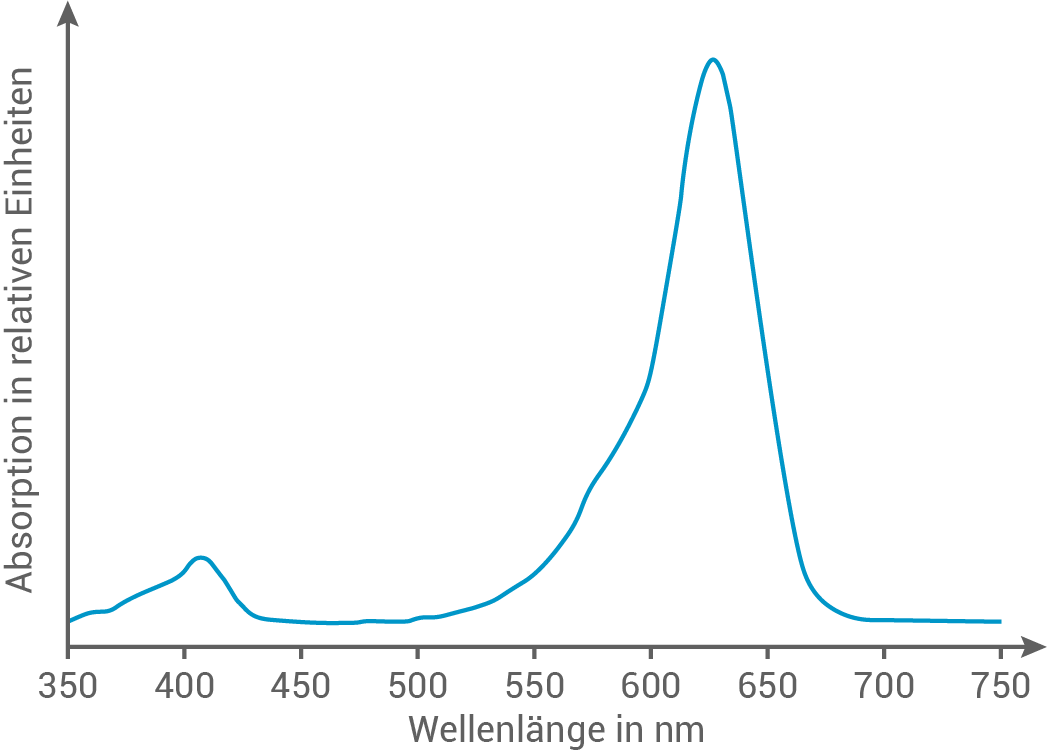 Leite aus Abbildung 5 und Tabelle 4 die Farbe von E133 ab und erkläre den Zusammenhang zwischen Molekülstruktur und Farbigkeit anhand einer weiteren mesomeren Grenzstrukturformel.
Leite aus Abbildung 5 und Tabelle 4 die Farbe von E133 ab und erkläre den Zusammenhang zwischen Molekülstruktur und Farbigkeit anhand einer weiteren mesomeren Grenzstrukturformel.

Abb 4. Strukturformel des Farbstoffs F133

Abb. 5: Absorptionsspektrum des Farbstoffs E133
(8 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Einfluss des Verzehrs auf das Gleichgewicht
Durch den Konsum säurehaltiger Getränke gelangen Oxonium-Ionen  in die Mundhöhle, wo sie mit Hydroxid-Ionen
in die Mundhöhle, wo sie mit Hydroxid-Ionen  aus der beschriebenen Gleichgewichtsreaktion reagieren. Diese Reaktion führt zu einer Verringerung der Hydroxid-Ionen-Konzentration, wodurch sich das Gleichgewicht gemäß dem Prinzip von Le Chatelier verschiebt. Dadurch wird die Bildung von Hydroxid-Ionen in der Rückreaktion gefördert, was wiederum den Abbau von Hydroxylapatit begünstigt. Der Verzehr säurehaltiger Getränke unterstützt folglich den Abbau von Hydroxylapatit und ist daher nachteilig für die Zahngesundheit.
aus der beschriebenen Gleichgewichtsreaktion reagieren. Diese Reaktion führt zu einer Verringerung der Hydroxid-Ionen-Konzentration, wodurch sich das Gleichgewicht gemäß dem Prinzip von Le Chatelier verschiebt. Dadurch wird die Bildung von Hydroxid-Ionen in der Rückreaktion gefördert, was wiederum den Abbau von Hydroxylapatit begünstigt. Der Verzehr säurehaltiger Getränke unterstützt folglich den Abbau von Hydroxylapatit und ist daher nachteilig für die Zahngesundheit.
1.2
Berechnung des fehlenden pH-Werts
Zunächst wird die zugegebene Stoffmenge an Salzsäure berechnet:
![\(\begin{array}[t]{rll}
n (HCl)&=& c (HCl) \cdot V(HCl) & \\[5pt]
&=& 0,005\,\text{mol} \cdot \text{L}^{-1} \cdot 3,0 \cdot 10^{-3} \,\text{L} & \\[5pt]
&=& 0,000015 \,\text{mol}
\end{array}\)](https://mathjax.schullv.de/e102ca53a8e2beb2e47692d990d07da2f6dae9b6990498e4532765d7b52045b3?color=5a5a5a) Salzsäure ist eine starke Säure und wird vollständig protolysiert, deswegen gilt:
Salzsäure ist eine starke Säure und wird vollständig protolysiert, deswegen gilt:
 Für die Oxonium-Ionen-Konzentration in der Wasserprobe nach Zugabe der Salzsäure folgt:
Für die Oxonium-Ionen-Konzentration in der Wasserprobe nach Zugabe der Salzsäure folgt:
![\(\begin{array}[t]{rll}
c(H_3O^+) &=& \dfrac{n(H_3O^+)}{V(HCl) + V(\text{Probe})} & \\[5pt]
&=& \dfrac{0,000015\,\text{mol}}{0,003\,\text{L} + 0,001 \,\text{L}} & \\[5pt]
&=& 0,00375\,\text{mol} \cdot \text{L}^{-1}
\end{array}\)](https://mathjax.schullv.de/14ddf8a308d881e69562125d56ae0d120537bf8869e108fa55560a04f1148cc9?color=5a5a5a) Daraus kann der pH-Wert berechnet werden:
Daraus kann der pH-Wert berechnet werden:
![\(\begin{array}[t]{rll}
pH&=& -\lg c (H_3O^+) & \\[5pt]
&=& -\lg \,0,00375 & \\[5pt]
&=& 2,43
\end{array}\)](https://mathjax.schullv.de/fec78899cd075276531d2accf11cb3cfee35534560d29f9b7c48ba2b6be27625?color=5a5a5a) Nach Zugabe der Salzsäurelösung beträgt der pH-Wert
Nach Zugabe der Salzsäurelösung beträgt der pH-Wert  Erklärung der unterschiedlichen pH-Werte
Durch die Säurezugabe sinkt der pH-Wert in der Speichelprobe nicht so stark wie in der Vergleichsprobe mit Wasser. Dies kann durch die Anwesenheit von Ionen im Speichel, wie zum Beispiel Phosphat-Ionen, erklärt werden. Die zugegebenen Oxonium-Ionen geben Protonen an die Phosphat-Ionen ab, wodurch Hydrogenphosphat-Ionen und Wasser entstehen. Dies bewirkt eine Verringerung der Oxonium-Ionen-Konzentration, was zu einem Anstieg des pH-Werts führt und als Pufferwirkung bezeichnet wird.
Erklärung der unterschiedlichen pH-Werte
Durch die Säurezugabe sinkt der pH-Wert in der Speichelprobe nicht so stark wie in der Vergleichsprobe mit Wasser. Dies kann durch die Anwesenheit von Ionen im Speichel, wie zum Beispiel Phosphat-Ionen, erklärt werden. Die zugegebenen Oxonium-Ionen geben Protonen an die Phosphat-Ionen ab, wodurch Hydrogenphosphat-Ionen und Wasser entstehen. Dies bewirkt eine Verringerung der Oxonium-Ionen-Konzentration, was zu einem Anstieg des pH-Werts führt und als Pufferwirkung bezeichnet wird.
2
Zuordnung der Titrationskurve
Beim ersten Wendepunkt der Titrationskurve, dem Halbäquivalenzpunkt der Titration, sind genau die Hälfte der Säuremoleküle neutralisiert worden. Daher ist die Konzentration der nicht dissoziierten Säuremoleküle gleich der Konzentration der entsprechenden Säureanionen.
Es gilt:![\(\begin{array}[t]{rll}
c\,\text{(HA)}&=& c\,\text{(A}^-\text{)}& \\[5pt]
pH&=& pK_S
\end{array}\)](https://mathjax.schullv.de/ee3dd50a0e7d6b7703866dcd9bdc3049d7df5a5a0b86d5ac1af83f83ff26d121?color=5a5a5a) Das Volumen am Halbäquivalenzpunkt beträgt
Das Volumen am Halbäquivalenzpunkt beträgt  also die Hälfte des Volumens der Natronlauge, das für das Erreichen des Äquivalenzpunktes benötigt wird.
also die Hälfte des Volumens der Natronlauge, das für das Erreichen des Äquivalenzpunktes benötigt wird.
Die Titrationskurve zeigt am Halbäquivalenzpunkt einen pH-Wert von und entspricht dem
und entspricht dem  -Wert von 2-Hydroxypropansäure (Milchsäure).
-Wert von 2-Hydroxypropansäure (Milchsäure).
Es gilt:
Die Titrationskurve zeigt am Halbäquivalenzpunkt einen pH-Wert von
3.1
Art der glykosidischen Bindung
Die Monomere des Xylan-Moleküls  -1,4-glykosidisch miteinander verknüpft.
Fischer-Projektionsformeln
-1,4-glykosidisch miteinander verknüpft.
Fischer-Projektionsformeln
|
|
|
D-Xylose
|
Xylit
|
3.2
Durchführung und Ergebnis der Silberspiegel-Probe
Die zu untersuchende Substanz wird mit einer ammoniakalischen Silbernitrat-Lösung versetzt und das Gemisch anschließend vorsichtig in z.B. einem Wasserbad erwärmt. Die Probe ist positiv, wenn festes Silber ausfällt und beispielsweise als glänzender Überzug an der Gefäßwand haften bleibt.
Xylose besitzt eine Aldehydgruppe, die die Silberionen des Silbernitrats zu Silber reduzieren kann, wobei sie selbst oxidiert wird. Im Xylit hingegen fehlt eine solche Aldehydgruppe, die oxidiert werden könnte, weshalb der Test hier negativ ausfällt.
Allgemeine Redoxgleichung einer positiven Probe
3.3
Bewertung des Einsatzes von Glucose bzw. Xylit
Der Ersatz von Glucose durch den Süßstoff Xylit reduziert die Energiezufuhr und verhindert die Bildung von Karies an den Zähnen. Zudem ist die abführende Wirkung durch die geringen Xylit-Mengen in Kaugummis vernachlässigbar und stellt daher aus gesundheitlicher Sicht die bessere Alternative dar.
4
Ableitung der Farbe
Das Absorptionsspektrum von E133 zeigt ein Absorptionsmaximum bei etwa  Dies bedeutet, dass der Farbstoff gemäß Tabelle 4 rotes Licht absorbiert und daher für das menschliche Auge in der Komplementärfarbe blaugrün erscheint.
Zusammenhang zwischen Molekülstruktur und Farbigkeit
Das Farbstoffmolekül verfügt über einen Chromophor, also ein ausgedehntes System konjugierter Doppelbindungen. Die zugehörigen Elektronen sind über mehrere
Dies bedeutet, dass der Farbstoff gemäß Tabelle 4 rotes Licht absorbiert und daher für das menschliche Auge in der Komplementärfarbe blaugrün erscheint.
Zusammenhang zwischen Molekülstruktur und Farbigkeit
Das Farbstoffmolekül verfügt über einen Chromophor, also ein ausgedehntes System konjugierter Doppelbindungen. Die zugehörigen Elektronen sind über mehrere  -Atome delokalisiert und können durch Lichtquanten aus dem sichtbaren Bereich des elektromagnetischen Spektrums angeregt werden. Aufgrund dieses Phänomens erscheint der Stoff E133 für Menschen farbig.
Weitere mesomere Grenzstrukturformel
-Atome delokalisiert und können durch Lichtquanten aus dem sichtbaren Bereich des elektromagnetischen Spektrums angeregt werden. Aufgrund dieses Phänomens erscheint der Stoff E133 für Menschen farbig.
Weitere mesomere Grenzstrukturformel