B1 Aromatisiertes Mineralwasser
Aromatisiertes Mineralwasser wird meist in PET-Flaschen abgefüllt und verkauft. Aus Gründen der Nachhaltigkeit wird das neuartige biobasierte Polymer PEF (Polyethylenfuranoat) als Alternative zu PET diskutiert.
1
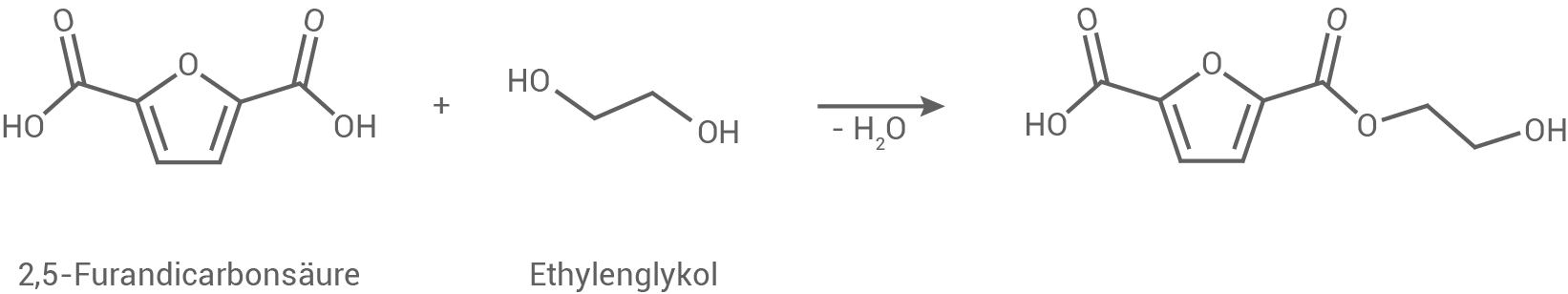
PEF (Abb. 1) kann gänzlich aus Monomeren synthetisiert werden, die aus pflanzlichen Rohstoffen gewonnen werden können.
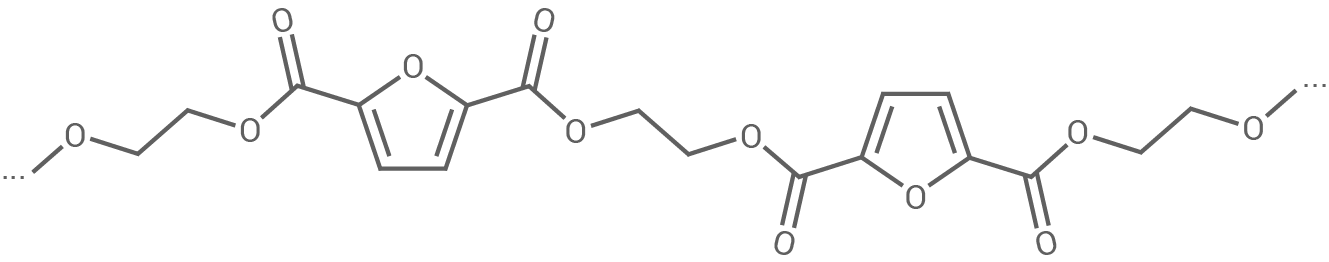

Abb. 1: Strukturfformelausschnitt von PEF
1.1
Formuliere die Reaktionsgleichung für die Bildung eines Dimers aus den Monomeren von PEF.
(5 BE)
1.2
Ordne PEF aufgrund des thermischen Verhaltens einer Kunststoffklasse begründet zu.
(5 BE)
2
In einigen Eigenschaften unterscheidet sich PET von PEF (Tab. 1). Im Gegensatz zu PET, das aus Erdölprodukten hergestellt wird, wird PEF aus nachwachsenden Rohstoffen synthetisiert.
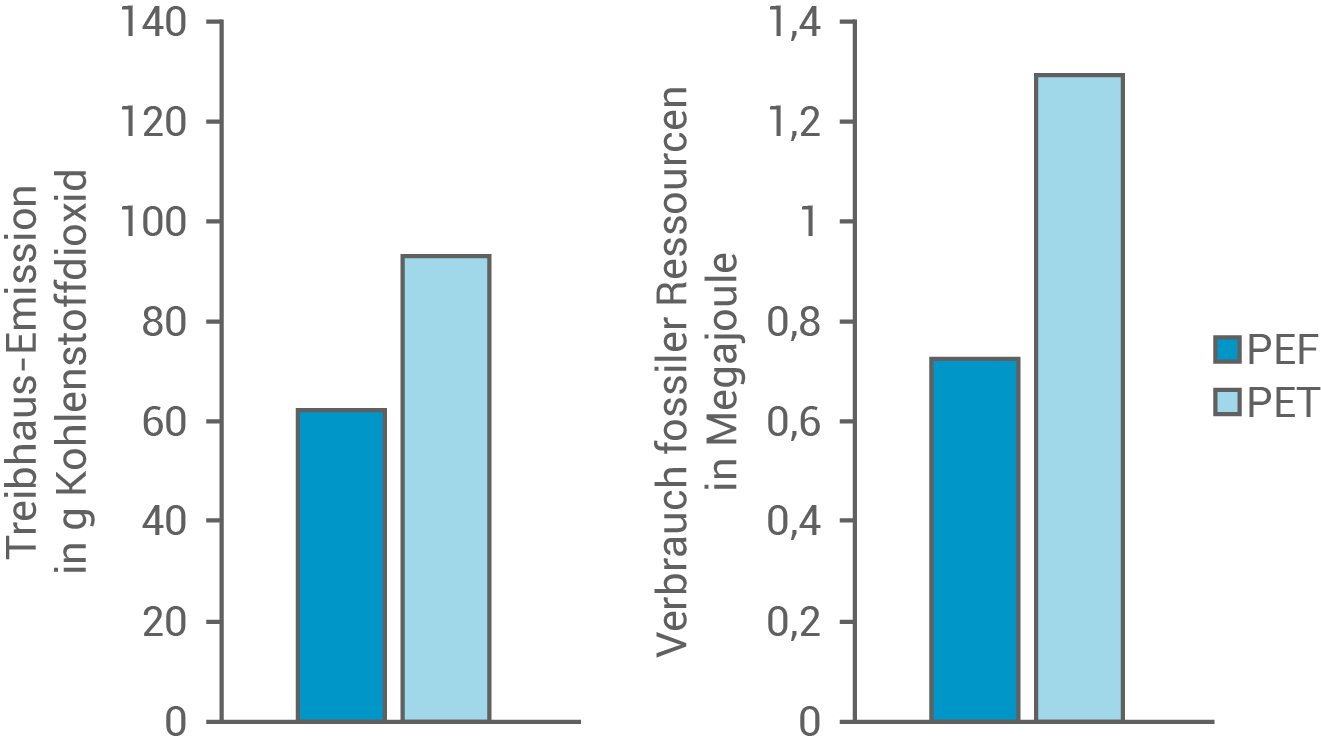 Beurteile anhand von vier Aspekten auch mithilfe von Tabelle 1 und Abbildung 2 den Ersatz des bisher verwendeten Flaschenmaterials PET durch PEF.
Beurteile anhand von vier Aspekten auch mithilfe von Tabelle 1 und Abbildung 2 den Ersatz des bisher verwendeten Flaschenmaterials PET durch PEF.
Tab. 1: Vergleich ausgewăhlter Eigenschaften von PET und PEF
nach: Papageorgiou, D. G., Tsetsou, L, et al. (2021). A New Era in Engineering Plastics: Compatibility and Perspectives of sustainable allipharomatic poly(ethylene terephthalate)/Poly(ethylene 2,5furandicarboxylate) blends, Polymers, 13(7), 1070.
| Eigenschaft | PET | PEF |
|---|---|---|
| Dichte in |
||
| Schmelztemperaturen in |
||
| Zugfestigkeit in MPa |

Abb. 2: Treibhausgas-Emissionen und Verbrauch fossiler Ressourcen bei der Herstellung je einer  PET-bzw. PEF-Flasche
Middendorf, E. (2022). Neues bio-basiertes Polymer PEF hat niedrigen
PET-bzw. PEF-Flasche
Middendorf, E. (2022). Neues bio-basiertes Polymer PEF hat niedrigen  Fußabdruck; https://www.neue-verpackung.de/markt/neues-bio-basiertes-polymer-pef-hat-niedrigen-co2-fussabdruck-831.html, 26:10.23.
Fußabdruck; https://www.neue-verpackung.de/markt/neues-bio-basiertes-polymer-pef-hat-niedrigen-co2-fussabdruck-831.html, 26:10.23.
(6 BE)
3
In der Getränkeproduktion wird Mineralwasser bei einem Druck von ca.  mit Kohlenstoffdioxid versetzt. Die Anreicherung mit Kohlenstoffdioxid erfolgt entsprechend folgender Teilreaktionen des Kohlensäure-Gleichgewichts (Abb. 3):
Die Löslichkeit von Kohlenstoffdioxid in Getränken ist sowohl durch den Druck als auch durch die Temperatur beeinflussbar:
mit Kohlenstoffdioxid versetzt. Die Anreicherung mit Kohlenstoffdioxid erfolgt entsprechend folgender Teilreaktionen des Kohlensäure-Gleichgewichts (Abb. 3):
Die Löslichkeit von Kohlenstoffdioxid in Getränken ist sowohl durch den Druck als auch durch die Temperatur beeinflussbar:
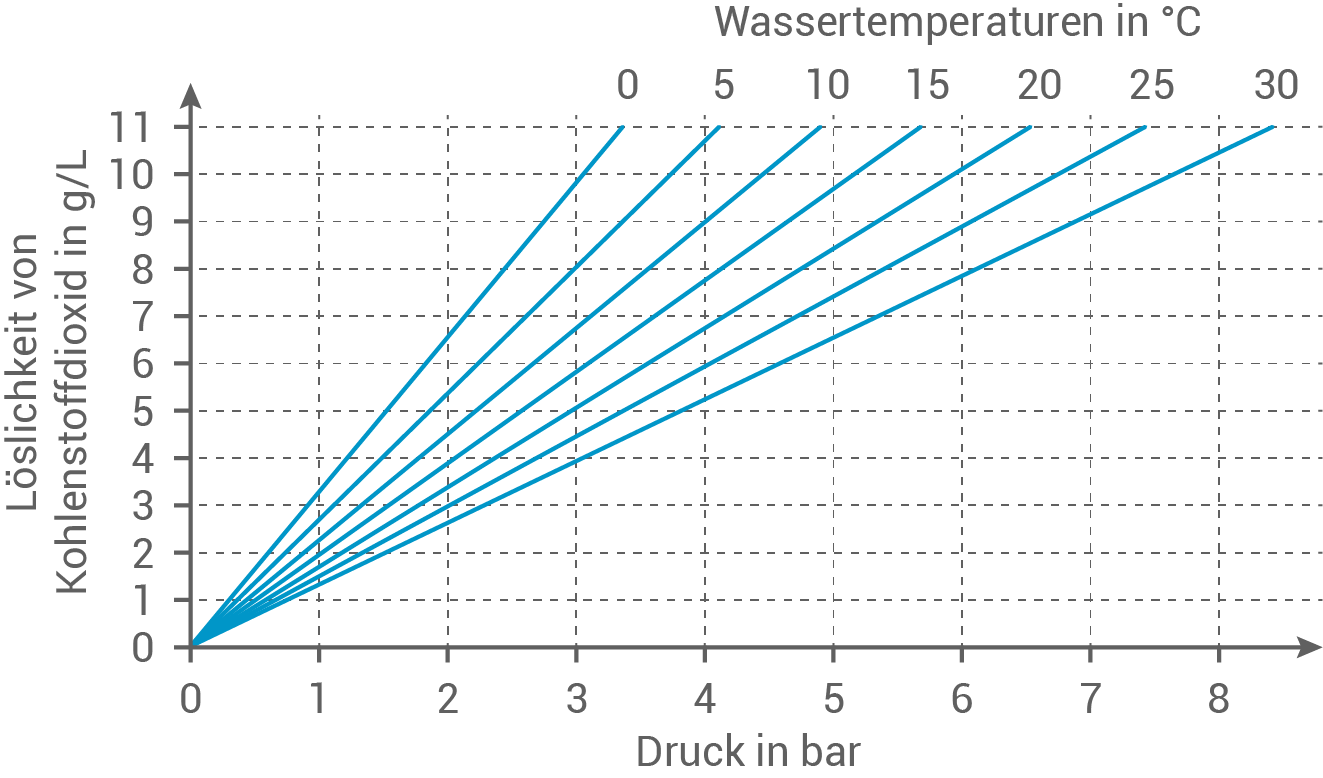

Abb. 4: Löslichkeit von Kohlenstoffdioxid in Wasser in Abhängigkeit von Temperatur und Druck
nach: von Borstel, G.; Böhm., A. Einfluss des Drucks auf die Löslichkeit von Kohlenstoffdioxid; https://www.Incu.de/index.php?cmd=courseManager\&mod=contentText\&action=attempt\ &courseld=25\&u nitld=350\&contentld=1203\#content_headline, 18.06.2023.
3.1
Zeichne mithilfe des Diagramms aus Abbildung 4 ein weiteres Diagramm, das die Löslichkeit von Kohlenstoffdioxid in Abhängigkeit von der Temperatur bei einem Druck von  darstellt. Beurteile, wie sich eine Kühlung während des Abfüllprozesses auswirken würde.
darstellt. Beurteile, wie sich eine Kühlung während des Abfüllprozesses auswirken würde.
(5 BE)
3.2
Begründe mithilfe des Massenwirkungsgesetzes den geringen Einfluss der Reaktion B auf die Anreicherung des Mineralwassers mit Kohlenstoffdioxid.
(4 BE)
4
Manchen Mineralwassersorten werden Aromen, z. B. Erdbeeraroma, zugesetzt. Das natürliche Erdbeeraroma entsteht durch das Zusammenspiel vieler verschiedener Verbindungen. Drei Bestandteile des Erdbeeraromas sowie ihre Strukturformeln und Löslichkeiten sind in Tabelle 2 gegenübergestellt:
Tab. 2: Struktuformeln und Löslichkeiten ausgewählter Bestandteile des Erdbeeraromas
nach: https://echa.europa.eu/, 26.10.23.
| Name | Strukturformel | Löslichkeit in Wasser in g/L (bei 20 °C) |
|---|---|---|
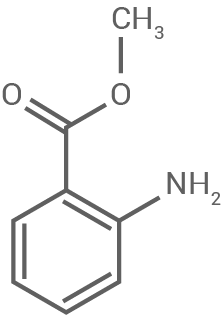
| Anthranilsäure-methylester |
|
|
| β-Damascenon |
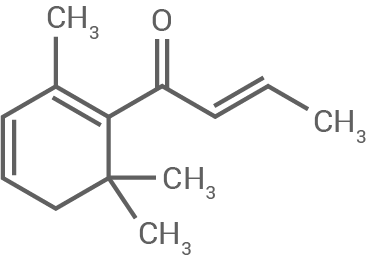
|
|
| Furaneol |
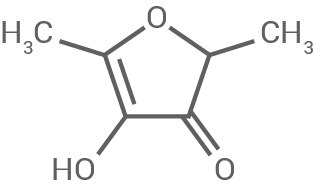
|
4.1
Stelle mithilfe der Strukturformeln eine Hypothese zur Ursache der unterschiedlichen Wasserlöslichkeit von Anthranilsäuremethylester und β-Damascenon auf.
(4 BE)
4.2
Definiere den Begriff optische Aktivität. Beurteile, ob es sich bei Furaneol um eine optisch aktive Substanz handelt.
(5 BE)
4.3
Anthranilsäuremethylester kann gemäß folgendem Reaktionsschema synthetisiert werden.
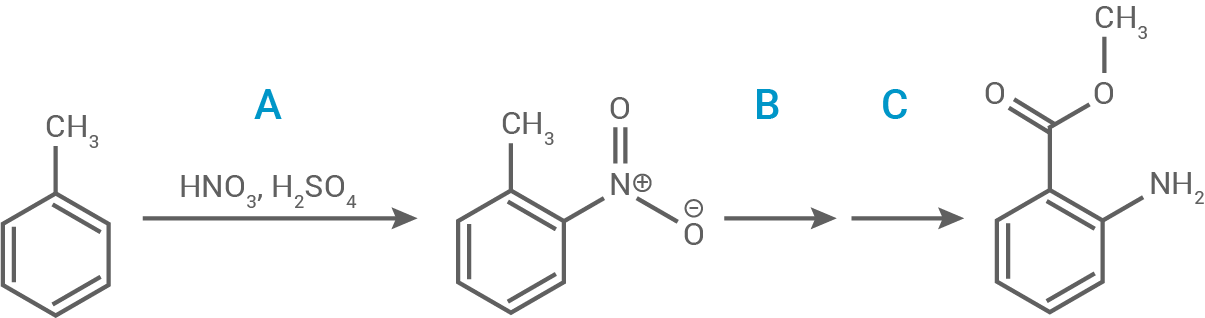 Formuliere den Reaktionsmechanismus für Reaktionsschritt A unter Verwendung mesomerer Grenzstrukturformeln und benenne den Reaktionstyp. Als reaktives Teilchen fungiert das Nitronium-Ion
Formuliere den Reaktionsmechanismus für Reaktionsschritt A unter Verwendung mesomerer Grenzstrukturformeln und benenne den Reaktionstyp. Als reaktives Teilchen fungiert das Nitronium-Ion 

Abb. 5: Reaktionsschema zur Synthese von Anthranilsäuremethylester aus Toluol
(6 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Reaktionsgleichung zur Bildung eines Dimers aus den Monomeren von PEF
Die Monomere von PEF (Polyethylenfuranoat) sind Ethylenglykol und 2,5-Furandicarbonsäure. Die Bildung eines Dimers erfolgt durch eine Kondensationsreaktion unter Abspaltung von Wasser, wobei eine Esterbindung entsteht:

1.2
Kunststoffklasse basierend auf dem thermischen Verhalten von PEF
PEF gehört zu den thermoplastischen Kunststoffen. Diese Kunststoffe zeichnen sich dadurch aus, dass sie beim Erhitzen weich werden und geformt werden können. Molekülstruktur erklären.
Die Struktur von PEF basiert auf der Verknüpfung von Ethylenglykol und 2,5-Furandicarbonsäure über Esterbindungen. Diese lineare Struktur sorgt dafür, dass die Polymerketten keine verzweigten oder stark vernetzten Bereiche aufweisen. Dadurch können sich die Polymerketten bei steigender Temperatur relativ zueinander bewegen, was zur Erweichung und Verformbarkeit führt.
Im Gegensatz dazu bleiben die mechanischen Eigenschaften bei Raumtemperatur stabil, da zwischen den Ketten schwache intermolekulare Kräfte wie Van-der-Waals-Kräfte und Dipol-Dipol-Wechselwirkungen bestehen. Beim Erhitzen werden diese Kräfte überwunden, sodass die Ketten mobil werden. Dies ist ein typisches Merkmal von Thermoplasten.
Zusätzlich sorgt die furanoide Struktur von PEF für eine hohe Steifigkeit und thermische Stabilität, was PEF zu einem idealen Material für Anwendungen wie Verpackungen macht, bei denen sowohl Stabilität als auch Verformbarkeit gefordert sind.
2
Beurteilung von PEF im Vergleich zu PET
 -Fußabdruck und die Verwendung nachwachsender Ressourcen. Die höhere Zugfestigkeit und die niedrigeren Verarbeitungstemperaturen sprechen ebenfalls für PEF. Allerdings könnte die niedrigere Schmelztemperatur Einschränkungen bei Anwendungen mit hohen Temperaturanforderungen mit sich bringen.
Die Dichte von PEF ist mit
-Fußabdruck und die Verwendung nachwachsender Ressourcen. Die höhere Zugfestigkeit und die niedrigeren Verarbeitungstemperaturen sprechen ebenfalls für PEF. Allerdings könnte die niedrigere Schmelztemperatur Einschränkungen bei Anwendungen mit hohen Temperaturanforderungen mit sich bringen.
Die Dichte von PEF ist mit  geringfügig höher als die von PET
geringfügig höher als die von PET  Dies könnte die Verpackungsmasse erhöhen, hat jedoch nur einen geringen Einfluss auf die praktischen Anwendungen und wurde deshalb hier nicht betrachtet.
Dies könnte die Verpackungsmasse erhöhen, hat jedoch nur einen geringen Einfluss auf die praktischen Anwendungen und wurde deshalb hier nicht betrachtet.
- Schmelztemperaturen: PET weist mit
eine höhere Schmelztemperatur auf als PEF mit
Dies bedeutet, dass PEF bei niedrigeren Temperaturen verarbeitet werden kann, was Energie spart.
- Zugfestigkeit: PEF hat eine höhere Zugfestigkeit
im Vergleich zu PET
was die Stabilität von PEF-Flaschen verbessern könnte.
- Ökobilanz: Abbildung 2 zeigt, dass PEF im Vergleich zu PET eine deutlich geringere Treibhausgas-Emission aufweist und damit umweltfreundlicher ist.
- Nachhaltigkeit: PEF wird aus nachwachsenden Rohstoffen hergestellt, während PET auf Erdöl basiert. Demnach ist neben einer geringeren Treibhausgasemission auch der Verbrauch fossiler Ressourcen weniger als bei PET.
3.1
Temperaturabhängigkeit der Löslichkeit von Kohlenstoffdioxid bei konstantem Druck
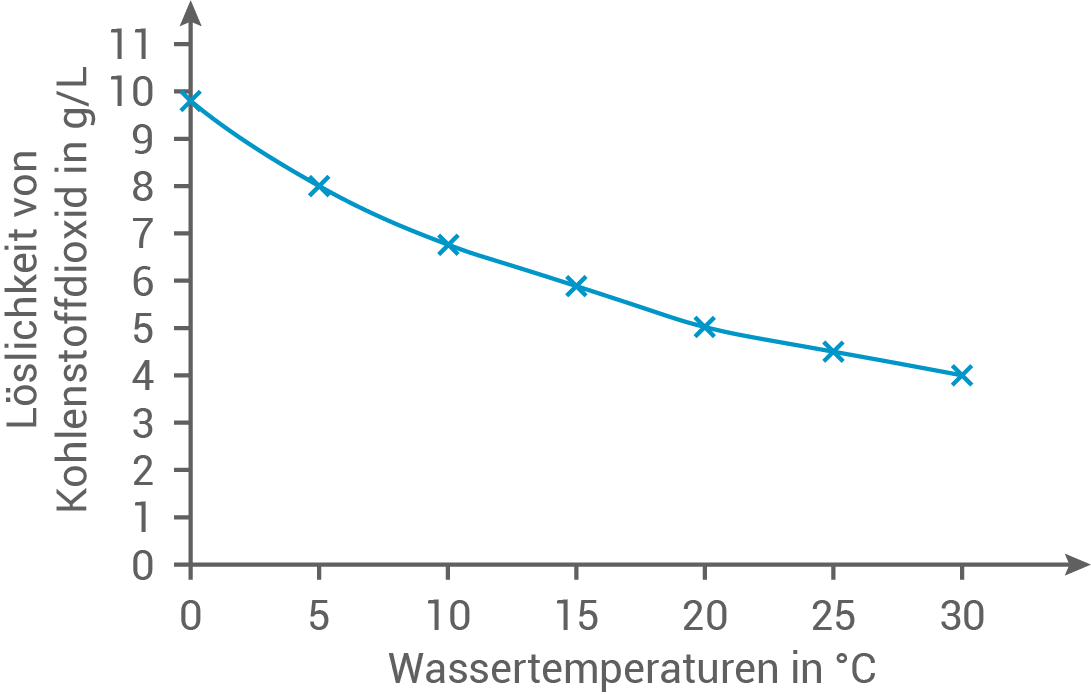 Beurteilung der Auswirkungen einer Kühlung während des Abfüllprozesses
Eine Kühlung während des Abfüllprozesses würde die Löslichkeit von Kohlenstoffdioxid im Mineralwasser deutlich erhöhen. Dies lässt sich aus der Temperaturabhängigkeit der Löslichkeit ableiten: je niedriger die Temperatur, desto höher die Menge an gelöstem Kohlenstoffdioxid im Wasser.
Dadurch ließen sich einerseits
Beurteilung der Auswirkungen einer Kühlung während des Abfüllprozesses
Eine Kühlung während des Abfüllprozesses würde die Löslichkeit von Kohlenstoffdioxid im Mineralwasser deutlich erhöhen. Dies lässt sich aus der Temperaturabhängigkeit der Löslichkeit ableiten: je niedriger die Temperatur, desto höher die Menge an gelöstem Kohlenstoffdioxid im Wasser.
Dadurch ließen sich einerseits  -Verluste verringern und die Stabilität der Kohlensäure verbessern, was den Geschmack und die Qualität des Mineralwassers bewahren würde. Andererseits könnte der erforderliche Druck reduziert werden, was zu einem geringeren Energiebedarf führen würde. Zudem würde die technische Effizienz des Abfüllprozesses steigen, da weniger Gas entweicht und der Ablauf stabiler wird. Insgesamt würde die Kühlung die Produktqualität sichern und gleichzeitig die Produktionskosten senken.
-Verluste verringern und die Stabilität der Kohlensäure verbessern, was den Geschmack und die Qualität des Mineralwassers bewahren würde. Andererseits könnte der erforderliche Druck reduziert werden, was zu einem geringeren Energiebedarf führen würde. Zudem würde die technische Effizienz des Abfüllprozesses steigen, da weniger Gas entweicht und der Ablauf stabiler wird. Insgesamt würde die Kühlung die Produktqualität sichern und gleichzeitig die Produktionskosten senken.

Löslichkeit von Kohlenstoffdioxid in Abhängigkeit von der Temperatur bei einem Druck von 
3.2
Begründung des geringen Einflusses
Die Reaktion B, 

 ist ein chemisches Gleichgewicht, das durch das Massenwirkungsgesetz beschrieben wird.
Es gilt:
ist ein chemisches Gleichgewicht, das durch das Massenwirkungsgesetz beschrieben wird.
Es gilt:
![\(K = \dfrac{[H_2CO_3]}{[CO_2\,\text{(aq)}] \cdot [H_2O]}\)](https://mathjax.schullv.de/092068b14499d257f39c2b684be02585051efa95a21f72db0421403945038a24?color=5a5a5a) Da die Konzentration von Wasser in der Flüssigphase nahezu konstant ist, kann sie in die Gleichgewichtskonstante integriert werden.
Daraus folgt:
Da die Konzentration von Wasser in der Flüssigphase nahezu konstant ist, kann sie in die Gleichgewichtskonstante integriert werden.
Daraus folgt:
![\(K = \dfrac{[H_2CO_3]}{[CO_2\,\text{(aq)}]}\)](https://mathjax.schullv.de/eebbd87c2fc74b3aabea2a704154af1d75d07e132caf1bfad74e46a89dd78218?color=5a5a5a) Die Gleichgewichtskonstante für Reaktion B ist jedoch sehr klein
Die Gleichgewichtskonstante für Reaktion B ist jedoch sehr klein  was darauf hindeutet, dass nur ein kleiner Anteil des gelösten
was darauf hindeutet, dass nur ein kleiner Anteil des gelösten  in Kohlensäure
in Kohlensäure  umgewandelt wird. Die meiste Menge bleibt als physikalisch gelöstes
umgewandelt wird. Die meiste Menge bleibt als physikalisch gelöstes  im Wasser.
Aufgrund dieses geringen Gleichgewichtswerts hat die Reaktion B nur einen minimalen Einfluss auf die Gesamtkonzentration des
im Wasser.
Aufgrund dieses geringen Gleichgewichtswerts hat die Reaktion B nur einen minimalen Einfluss auf die Gesamtkonzentration des  im Mineralwasser. Die Hauptmenge des
im Mineralwasser. Die Hauptmenge des  bleibt in gelöster Form erhalten und steht für die Carbonisierung zur Verfügung.
bleibt in gelöster Form erhalten und steht für die Carbonisierung zur Verfügung.
4.1
Hypothese zur Ursache der unterschiedlichen Wasserlöslichkeit
Die unterschiedliche Wasserlöslichkeit von Anthranilsäuremethylester und β-Damascenon kann mithilfe der chemischen Strukturen erklärt werden.
Anthranilsäuremethylester enthält polare funktionelle Gruppen, darunter eine Aminogruppe  und eine Estergruppe
und eine Estergruppe  Diese Gruppen können Wasserstoffbrückenbindungen mit Wassermolekülen eingehen, was die Löslichkeit erhöht. Zusätzlich verstärken die polaren Wechselwirkungen zwischen den Molekülen und dem Lösungsmittel Wasser die Hydrophilie.
β-Damascenon hingegen besitzt eine überwiegend unpolare Struktur mit einem hohen Anteil an Kohlenwasserstoffketten. Diese Struktur verringert die Möglichkeit, Wasserstoffbrückenbindungen einzugehen, was die Wasserlöslichkeit erheblich reduziert. Stattdessen zeigen die Moleküle eine bessere Löslichkeit in unpolaren Lösungsmitteln wie Fetten oder Ölen.
Diese Gruppen können Wasserstoffbrückenbindungen mit Wassermolekülen eingehen, was die Löslichkeit erhöht. Zusätzlich verstärken die polaren Wechselwirkungen zwischen den Molekülen und dem Lösungsmittel Wasser die Hydrophilie.
β-Damascenon hingegen besitzt eine überwiegend unpolare Struktur mit einem hohen Anteil an Kohlenwasserstoffketten. Diese Struktur verringert die Möglichkeit, Wasserstoffbrückenbindungen einzugehen, was die Wasserlöslichkeit erheblich reduziert. Stattdessen zeigen die Moleküle eine bessere Löslichkeit in unpolaren Lösungsmitteln wie Fetten oder Ölen.
4.2
Definition der optischen Aktivität und Beurteilung von Furaneol
Optische Aktivität beschreibt die Fähigkeit eines Moleküls, die Schwingungsebene von linear polarisiertem Licht zu drehen. Diese Eigenschaft tritt auf, wenn ein Molekül mindestens ein chirales Zentrum besitzt, also ein Kohlenstoffatom, das mit vier verschiedenen Substituenten verbunden ist.
Furaneol besitzt ein chirales Zentrum, da in seiner Struktur ein asymmetrisches Kohlenstoffatom vorhanden ist. Dies macht Furaneol optisch aktiv. Solche Moleküle können in zwei Enantiomere vorliegen, die die Ebene des polarisierten Lichts in entgegengesetzte Richtungen drehen. Die optische Aktivität von Furaneol trägt zur sensorischen Wahrnehmung seiner süßen und karamellartigen Aromen bei.
4.3
Reaktionsmechanismus für Schritt A
Der Reaktionsschritt A ist eine Nitrierung, also eine elektrophile aromatische Substitution (SEAr), bei der das Nitronium-Ion  als Elektrophil wirkt und eine Nitrogruppe am Toluolring eingeführt wird.
als Elektrophil wirkt und eine Nitrogruppe am Toluolring eingeführt wird.
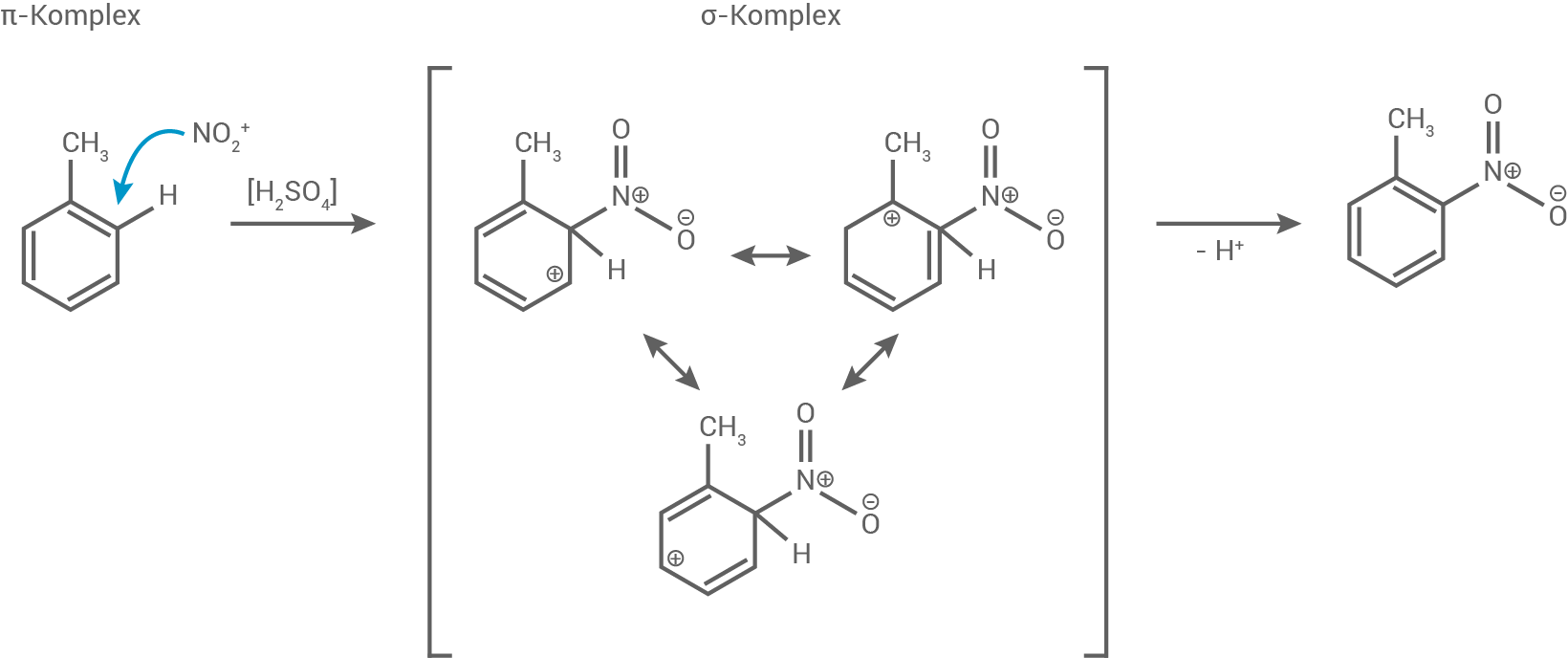

- Das Nitronium-Ion (
), das durch die Reaktion von Salpetersäure und Schwefelsäure gebildet wird, wirkt als starkes Elektrophil.
- Das Elektrophil greift den elektronendichten Benzolring an, bevorzugt in der ortho- oder para-Position (hier ortho) zum Methylrest, da dieser elektronenschiebend wirkt.
- Nach der Bindung des
entsteht ein positiv geladenes Zwischenprodukt, das durch mesomere Grenzstrukturen stabilisiert wird. Die mesomeren Grenzstrukturen zeigen die Delokalisierung der positiven Ladung über den Ring.
- Durch die Abgabe eines Protons
wird der aromatische Charakter des Rings wiederhergestellt, was zur Bildung des Nitro-Toluols führt.