A2 Peptidasen
Peptidasen sind Enzyme, die in allen lebenden Organismen vorkommen und die Hydrolyse von Peptidbindungen katalysieren. Sie sind entscheidend für die Verdauung von Proteinen im menschlichen Körper, spielen aber auch in der Biotechnologie eine Rolle, etwa als Waschmittelzusatz.
1
Bestimmte moderne Waschmittel enthalten Peptidasen, die durch Hydrolyse von Proteinen dafür sorgen, dass wasserlösliche Produkte entstehen. So lassen sich proteinhaltige Verschmutzungen leichter aus Kleidungsstücken auswaschen. Abbildung 1 zeigt die Ergebnisse einer Versuchsreihe zur Aktivität einer Peptidase aus dem Bakterium Streptomyces thermovulgaris.
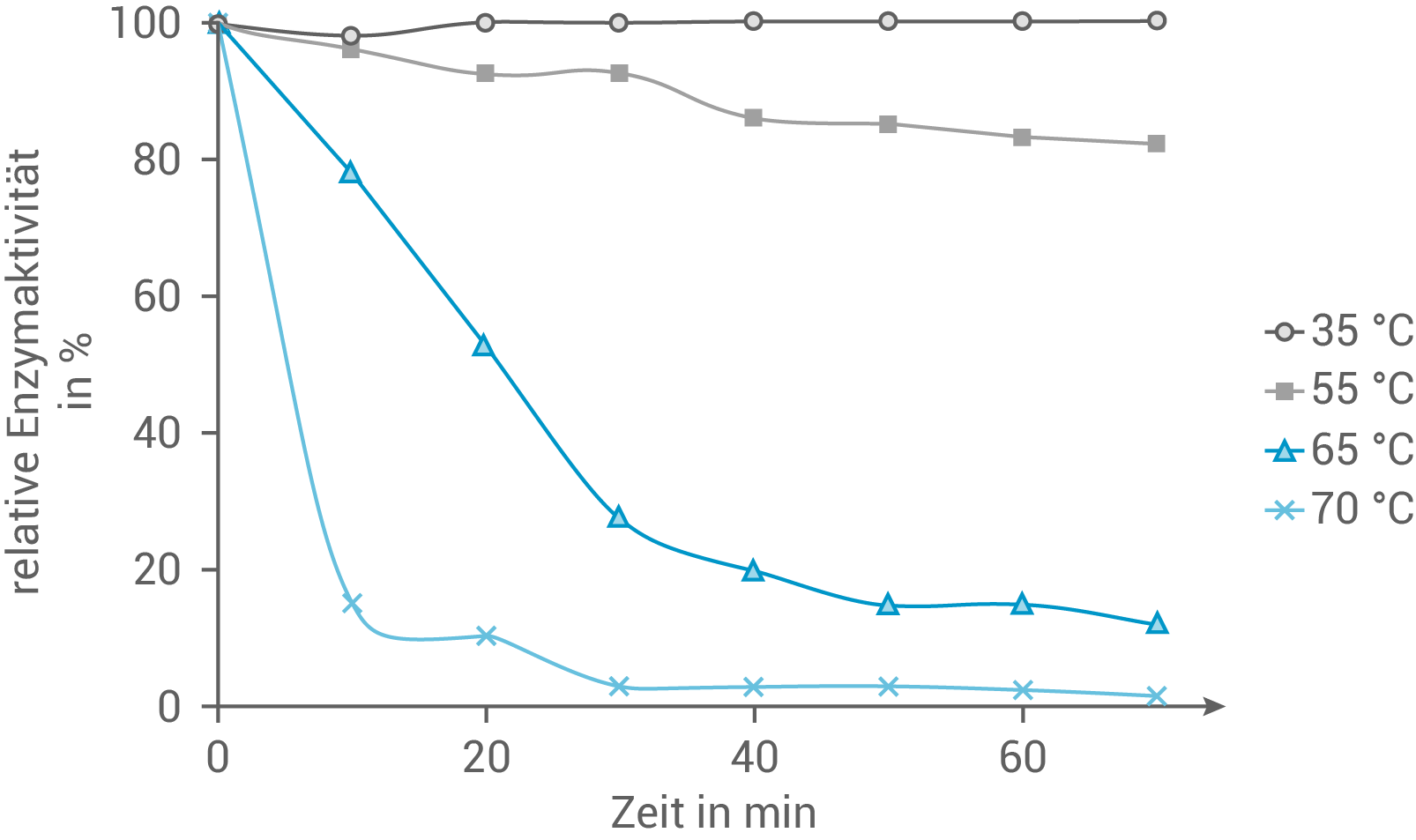 Beschreibe die in Abbildung 1 dargestellten Versuchsergebnisse und leite daraus eine Empfehlung für die Anwendung von Waschmitteln ab, die diese Peptidase enthalten.
Beschreibe die in Abbildung 1 dargestellten Versuchsergebnisse und leite daraus eine Empfehlung für die Anwendung von Waschmitteln ab, die diese Peptidase enthalten.

Abb. 1: Ergebnisse einer Versuchsreihe zur Aktivität einer Peptidase aus S. thermovulgaris in Abhängigkeit von der Zeit
nach: Senhaji-Dachtler, S. (2005). Extrazelluläre Proteasen aus Mikroorganismen: Reinigung, Charakterisierung und Fixierung auf Polyester (Doctoral dissertation, Universität Tübingen).
(4 BE)
2
In einer Versuchsreihe wird die pH-Abhängigkeit der Peptidase Trypsin untersucht. In jeweils einem Reagenzglas lässt man eine Lösung des Proteingemischs Gelatine erstarren. Auf diese Schicht wird zunächst Sand und anschließend eine Flüssigkeit aufgetragen (Abb. 2, Tab. 1).
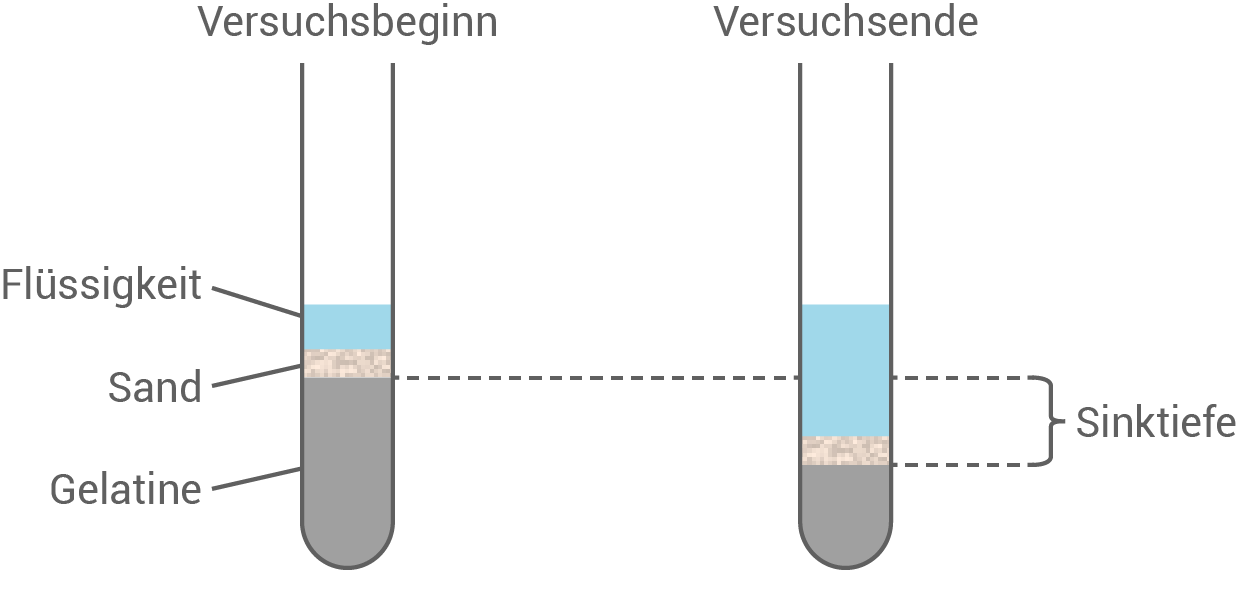 Tabelle 1 zeigt Informationen zu den durchgeführten fünf Versuchsansätzen.
Tabelle 1 zeigt Informationen zu den durchgeführten fünf Versuchsansätzen.
Erkläre die Versuchsergebnisse mithilfe einer Modellvorstellung zur Funktionsweise von Enzymen. Gehe auch auf die Bedeutung des Versuchsansatzes 1 ein.

Abb. 2: Versuchsanordnung zur Bestimmung der Trypsin-Aktivität
Tab. 1: Versuchsansätze zur Bestimmung der Trypsin-Aktivität in Abhängigkeit vom pH-Wert; die verwendete Trypsin-Lösung hat bei allen Ansätzen die gleiche Trypsin-Konzentration
| Ansatz | Flüssigkeit zu Versuchs-beginn |
pH-Wert der Flüssigkeit | Sinktiefe des Sandes in |
|---|---|---|---|
| Wasser | |||
| Trypsin-Lösung | |||
| Trypsin-Lösung | |||
| Trypsin-Lösung | |||
| Trypsin-Lösung |
(6 BE)
3
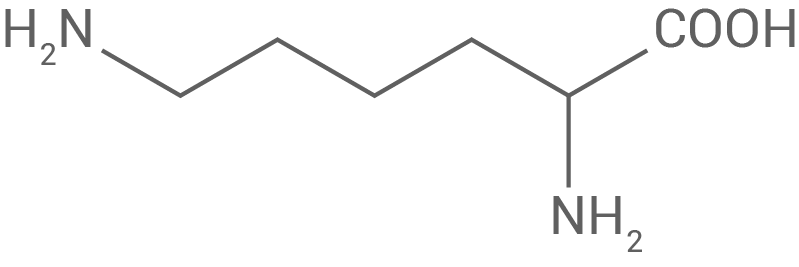
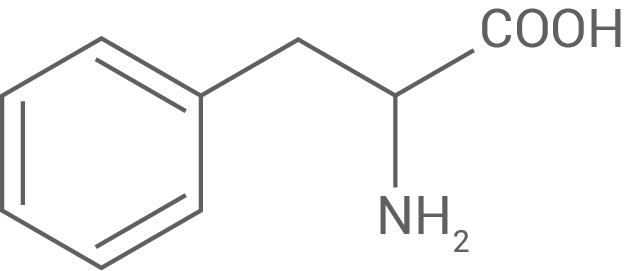
Die Enzyme Trypsin und Chymotrypsin katalysieren im menschlichen Darm die Hydrolyse von Proteinen. Die beiden Enzyme reagieren substratspezifisch: Trypsin katalysiert die Hydrolyse von Peptidbindungen nach Aminosäure-Bausteinen mit einer Aminogruppe im Rest, Chymotrypsin die Hydrolyse von Peptidbindungen nach Aminosäure-Bausteinen mit hydrophoben Resten. Tabelle 2 gibt Informationen zu den Aminosäuren Lysin und Phenylalanin.
Tab. 2: Strukturformeln und isoelektrische Punkte von Lysin und Phenylalanin
| Name | Lysin (Lys) | Phenylalanin (Phe) |
|---|---|---|
| Struktur-formel |
|
|
| iso-elektrischer Punkt |
3.1
Formuliere die Strukturformelgleichung der Hydrolyse des Dipeptid-Moleküls Lys-Phe.
Leite mithilfe der Tabelle 2 die jeweils überwiegend vorliegende Form der beiden Aminosäure-Moleküle im Dünndarm bei ab.
ab.
Leite mithilfe der Tabelle 2 die jeweils überwiegend vorliegende Form der beiden Aminosäure-Moleküle im Dünndarm bei
(7 BE)
3.2
Für die spezifische katalytische Aktivität der Enzyme Trypsin und Chymotrypsin ist eine in der Nähe des aktiven Zentrums gelegene „Tasche“ verantwortlich. Die unterschiedlichen Reste der Aminosäure-Bausteine der „Taschen“ beider Enzym-Moleküle bilden unterscheidliche Wechselwirkungen zu den Resten der Lysin- und Phenylalanin-Bausteine der jeweiligen Substrat-Moleküle aus.
Stelle jeweils eine Hypothese zum Bau der Reste in den „Taschen“ der Trypsin- und Chymotrypsin-Moleküle auf, welche die Spezifität der Enzyme erklärt.
Stelle jeweils eine Hypothese zum Bau der Reste in den „Taschen“ der Trypsin- und Chymotrypsin-Moleküle auf, welche die Spezifität der Enzyme erklärt.
(4 BE)
4
Am Zentrum für Meeres- und Klimaforschung der Universität Hamburg wird über standardisierte Messungen der Aktivität der Peptidase Trypsin der Ernährungszustand von Fischlarven bestimmt, da es einen Zusammenhang zwischen aufgenommener Nahrung und der Menge an gebildetem Trypsin gibt.
4.1
Für die Messung werden die Larven in einer Puffer-Lösung homogenisiert. Der Puffer wird hergestellt, indem  Ammoniak-Lösung
Ammoniak-Lösung  der Konzentration
der Konzentration  mit
mit  Salzsäure der Konzentration
Salzsäure der Konzentration  versetzt werden. Berechne den pH-Wert der eingesetzten Puffer-Lösung.
versetzt werden. Berechne den pH-Wert der eingesetzten Puffer-Lösung.
(7 BE)
4.2
Um die Menge des von den Larven hergestellten Trypsins zu bestimmen, wird folgendes Experiment durchgeführt: Das gewonnene Trypsin wird mit einem Substrat versetzt und die Trypsin-Aktivität ermittelt. Zur Bestimmung der Trypsin-Aktivität wird die Stoffmenge des hydrolysierten Substrats  (hS) nach bestimmten Zeiträumen ermittelt (Tab. 3):
(hS) nach bestimmten Zeiträumen ermittelt (Tab. 3):
Zeichne mit den Werten aus Tabelle 3 ein Diagramm und ermittle die mittlere Reaktionsgeschwindigkeit im Zeitraum von  bis
bis 
Tab. 3: Stoffmenge des hydrolysierten Substrats nach bestimmten Zeiträumen
nach: Ueberschär, B. (1999). Die Trypsinaktivität als biochemische Indikator zur Bestimmung des Ernährungszustandes sowie der Freßaktivität von Fischlarven und seine Anwendung in Feldstudien (Doctoral dissertation, Universităt Hamburg).
| Zeit in min | |||||||
|---|---|---|---|---|---|---|---|
(5 BE)
4.3
Wissenschaftler versuchen pflanzliche Proteinquellen, etwa Soja, in der Fischzucht einzusetzen. Dabei stellten sie fest, dass in der Sojabohne kleine Proteine vorkommen, die unter der Bezeichnung Bowman-Birk-Inhibitoren bekannt geworden sind. Forschende haben die Hypothese aufgestellt, dass diese Proteine als kompetitive Hemmstoffe des Trypsins wirken.
Skizziere ein Diagramm, das den vermuteten Einfluss der Bowman-Birk-Inhibitoren auf die Trypsin-Aktivität in Abhängigkeit von der Substratkonzentration zeigt. Beschreibe eine experimentelle Vorgehensweise zur Überprüfung der Hypothese.
Skizziere ein Diagramm, das den vermuteten Einfluss der Bowman-Birk-Inhibitoren auf die Trypsin-Aktivität in Abhängigkeit von der Substratkonzentration zeigt. Beschreibe eine experimentelle Vorgehensweise zur Überprüfung der Hypothese.
(7 BE)
(40 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Beschreibung der Versuchsergebnisse und Ableitung einer Anwendungsempfehlung
Die in der Abbildung dargestellten Ergebnisse zeigen signifikante Unterschiede in der Enzymaktivität bei verschiedenen Temperaturen. Bei  und
und  bleibt die Enzymaktivität konstant hoch, was darauf hindeutet, dass die Peptidase unter milden Temperaturen stabil und effektiv arbeitet. Diese Temperaturbereiche sind ideal für die meisten Waschprozesse, da sie eine ausreichende Reinigungswirkung bieten, ohne zusätzliche Energie für das Heizen des Wassers zu benötigen.
Bei höheren Temperaturen, insbesondere bei
bleibt die Enzymaktivität konstant hoch, was darauf hindeutet, dass die Peptidase unter milden Temperaturen stabil und effektiv arbeitet. Diese Temperaturbereiche sind ideal für die meisten Waschprozesse, da sie eine ausreichende Reinigungswirkung bieten, ohne zusätzliche Energie für das Heizen des Wassers zu benötigen.
Bei höheren Temperaturen, insbesondere bei  und darüber, zeigt die Peptidase einen deutlichen und schnellen Abfall in der Aktivität schon innerhalb der ersten 20 Minuten. Dies weist auf eine thermische Denaturierung des Enzyms hin, bei der die Proteinstruktur der Peptidase beschädigt wird, was zu einem Verlust der enzymatischen Funktion führt. Für Waschmittel, die in heißem Wasser verwendet werden, wäre diese Peptidase daher weniger geeignet.
Auf Grundlage dieser Versuchsergebnisse wird empfohlen, Waschmittel, die diese spezielle Peptidase enthalten, vor allem für Kaltwäsche und Waschprogramme mit moderaten Temperaturen zu formulieren.
und darüber, zeigt die Peptidase einen deutlichen und schnellen Abfall in der Aktivität schon innerhalb der ersten 20 Minuten. Dies weist auf eine thermische Denaturierung des Enzyms hin, bei der die Proteinstruktur der Peptidase beschädigt wird, was zu einem Verlust der enzymatischen Funktion führt. Für Waschmittel, die in heißem Wasser verwendet werden, wäre diese Peptidase daher weniger geeignet.
Auf Grundlage dieser Versuchsergebnisse wird empfohlen, Waschmittel, die diese spezielle Peptidase enthalten, vor allem für Kaltwäsche und Waschprogramme mit moderaten Temperaturen zu formulieren.
2
Erklärung der Ergebnisse aus Trypsin-Aktivitätsversuchen
Trypsin, ein proteolytisches Enzym, das spezifisch die C-terminale Seite bestimmter Aminosäuren wie Lysin und Arginin in Peptidketten spaltet, zeigt eine ausgeprägte pH-Abhängigkeit in seiner Aktivität. Diese Abhängigkeit ist eng mit der Struktur des Enzyms und der Ionisierung seiner aktiven Stelle verbunden.
Bei einem neutralen pH-Wert von  zeigt Trypsin minimale Aktivität, was durch das Verbleiben des Sandes auf der Oberfläche der Gelatine deutlich wird. Dies lässt darauf schließen, dass die ionischen Zustände der funktionellen Gruppen im aktiven Zentrum des Trypsins bei diesem pH-Wert nicht optimal für die Substratbindung und -spaltung sind.
Im leicht alkalischen Bereich, insbesondere bei
zeigt Trypsin minimale Aktivität, was durch das Verbleiben des Sandes auf der Oberfläche der Gelatine deutlich wird. Dies lässt darauf schließen, dass die ionischen Zustände der funktionellen Gruppen im aktiven Zentrum des Trypsins bei diesem pH-Wert nicht optimal für die Substratbindung und -spaltung sind.
Im leicht alkalischen Bereich, insbesondere bei  erreicht Trypsin seine maximale Aktivität, was durch das tiefe Eindringen des Sandes in die Gelatine illustriert wird. Bei diesem pH-Wert sind die Histidinreste im aktiven Zentrum des Trypsins ideal ionisiert, was eine effiziente Bindung und Hydrolyse der Peptidbindungen ermöglicht. Die Konformation des aktiven Zentrums ist optimal auf das Substrat abgestimmt, was die katalytische Effizienz maximiert.
Bei einem höheren pH-Wert von
erreicht Trypsin seine maximale Aktivität, was durch das tiefe Eindringen des Sandes in die Gelatine illustriert wird. Bei diesem pH-Wert sind die Histidinreste im aktiven Zentrum des Trypsins ideal ionisiert, was eine effiziente Bindung und Hydrolyse der Peptidbindungen ermöglicht. Die Konformation des aktiven Zentrums ist optimal auf das Substrat abgestimmt, was die katalytische Effizienz maximiert.
Bei einem höheren pH-Wert von  nimmt die Aktivität des Trypsins wieder ab. Obwohl das Enzym weiterhin aktiv ist, führen Veränderungen in der Ionisierung und Konformation des aktiven Zentrums dazu, dass die Effizienz der Substratbindung und -spaltung reduziert wird. Dies zeigt, dass die strukturelle Integrität und Ladungsverteilung des aktiven Zentrums entscheidend für die enzymatische Aktivität sind und durch den pH-Wert beeinflusst werden können.
nimmt die Aktivität des Trypsins wieder ab. Obwohl das Enzym weiterhin aktiv ist, führen Veränderungen in der Ionisierung und Konformation des aktiven Zentrums dazu, dass die Effizienz der Substratbindung und -spaltung reduziert wird. Dies zeigt, dass die strukturelle Integrität und Ladungsverteilung des aktiven Zentrums entscheidend für die enzymatische Aktivität sind und durch den pH-Wert beeinflusst werden können.
3.1
Strukturformelgleichung für die Hydrolyse des Dipeptids Lys-Phe
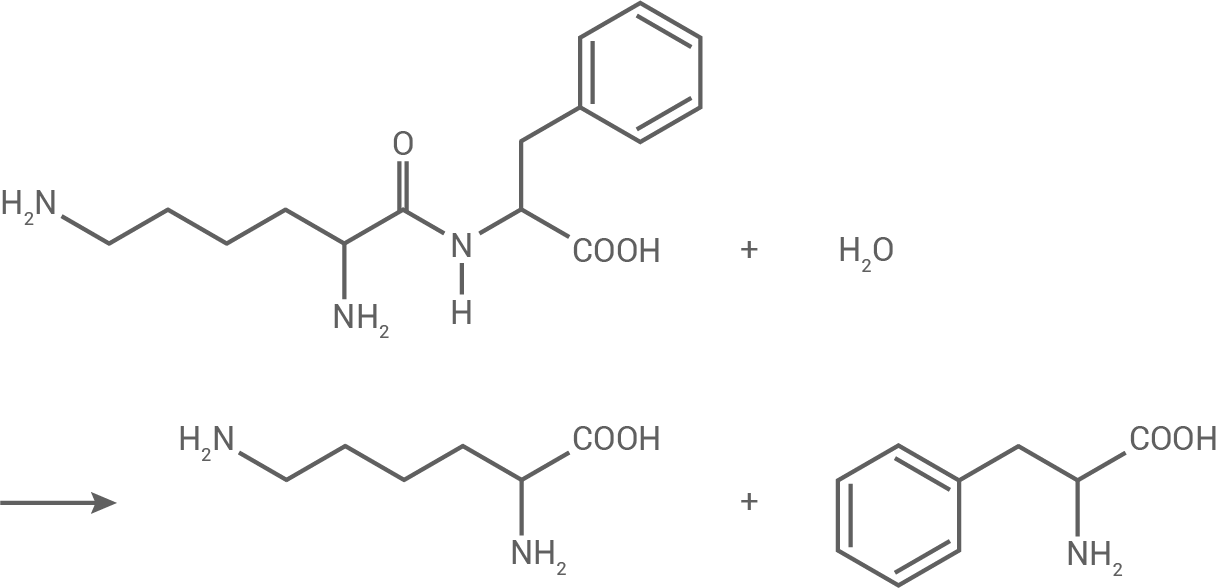 Vorliegende Form im Dünndarm
Bei
Vorliegende Form im Dünndarm
Bei  liegen Lysin und Phenylalanin jeweils in zwitterionischen Formen vor, wobei sich ihre Ladungszustände aufgrund ihrer unterschiedlichen isoelektrischen Punkte unterscheiden.
Lysin, dessen isoelektrischer Punkt bei
liegen Lysin und Phenylalanin jeweils in zwitterionischen Formen vor, wobei sich ihre Ladungszustände aufgrund ihrer unterschiedlichen isoelektrischen Punkte unterscheiden.
Lysin, dessen isoelektrischer Punkt bei  liegt, zeigt eine positive Nettoladung, da der pH-Wert von
liegt, zeigt eine positive Nettoladung, da der pH-Wert von  unter diesem Punkt liegt. Bei diesem pH-Wert ist die primäre Aminogruppe an der Seitenkette des Lysins protoniert
unter diesem Punkt liegt. Bei diesem pH-Wert ist die primäre Aminogruppe an der Seitenkette des Lysins protoniert  während die Carboxylgruppe deprotoniert ist
während die Carboxylgruppe deprotoniert ist  Dies macht Lysin insgesamt positiv geladen.
Phenylalanin hingegen, mit einem isoelektrischen Punkt von
Dies macht Lysin insgesamt positiv geladen.
Phenylalanin hingegen, mit einem isoelektrischen Punkt von  ist bei
ist bei  neutral, da sein pH-Wert weit über dem isoelektrischen Punkt liegt. Hierbei ist die Carboxylgruppe deprotoniert
neutral, da sein pH-Wert weit über dem isoelektrischen Punkt liegt. Hierbei ist die Carboxylgruppe deprotoniert  und die Aminogruppe protoniert
und die Aminogruppe protoniert  was zu einer zwitterionischen, aber insgesamt neutralen Form führt.
was zu einer zwitterionischen, aber insgesamt neutralen Form führt.

3.2
Hypothesen zur Struktur und Spezifität der aktiven Taschen von Trypsin und Chymotrypsin
| Trypsin |
|---|
| Die aktive Tasche von Trypsin ist darauf ausgerichtet, basische Aminosäuren wie Lysin und Arginin zu erkennen. Diese Spezifität lässt sich durch die Präsenz von negativ geladenen oder polar ungeladenen Aminosäureresten innerhalb der Tasche erklären. Es wird angenommen, dass Aminosäuren wie Aspartat oder Glutamat in der Tasche vorhanden sind, deren Carboxylatgruppen starke elektrostatische Wechselwirkungen mit den positiv geladenen Seitenketten von Lysin eingehen können. Diese Interaktionen ermöglichen es Trypsin, seine Substrate präzise zu erkennen und effizient zu spalten. |
| Chymotrypsin |
|---|
| Im Gegensatz dazu ist Chymotrypsin darauf spezialisiert, auf der C-terminalen Seite von aromatischen Aminosäuren wie Phenylalanin zu spalten. Die aktive Tasche von Chymotrypsin könnte hydrophobe Aminosäurereste enthalten, die mit den großen aromatischen Ringen von Phenylalanin, Tryptophan oder Tyrosin interagieren. Phenylalanin selbst könnte durch hydrophobe Wechselwirkungen und Van-der-Waals-Kräfte zur Bindung und Stabilisierung dieser spezifischen Substrate beitragen. Diese Eigenschaften der Tasche ermöglichen es Chymotrypsin, aromatische Substrate effektiv zu binden und die Peptidbindung gezielt zu hydrolysieren. |
4.1
Berechnung des pH-Werts der Pufferlösung
Zur Berechnung des pH-Werts der Pufferlösung, die durch Mischen von Ammoniaklösung mit Salzsäure hergestellt wird, wird die Henderson-Hasselbalch-Gleichung verwendet:
![\(pH = pK_S + \log \left( \dfrac{[NH_3]}{[NH_4^+]} \right) \)](https://mathjax.schullv.de/cce6737259753007f547cbc8821f0b16c2ce5ee4ea393f6dc60926fae3a36bda?color=5a5a5a) Die Reaktion von Ammoniak
Die Reaktion von Ammoniak  mit Salzsäure
mit Salzsäure  führt zur Bildung von Ammoniumionen
führt zur Bildung von Ammoniumionen  Ursprünglich wurde die Pufferlösung mit
Ursprünglich wurde die Pufferlösung mit  einer
einer  Ammoniaklösung und
Ammoniaklösung und  einer
einer  Salzsäure hergestellt. Nach der Reaktion bleiben
Salzsäure hergestellt. Nach der Reaktion bleiben 
 unverbraucht, während
unverbraucht, während 
 aus der neutralisierten
aus der neutralisierten  -Menge entsteht. Der
-Menge entsteht. Der  -Wert von Ammonium beträgt
-Wert von Ammonium beträgt  basierend auf dem
basierend auf dem  -Wert von Ammoniak
-Wert von Ammoniak  Daraus folgt:
Daraus folgt:
![\(\begin{array}[t]{rlll}
pH &=& 9,25 + \log \left( \dfrac{0,2}{1} \right) \\[5pt]
&\approx& 9,25 - 0,7 \\[5pt]
&\approx& 8,55
\end{array}\)](https://mathjax.schullv.de/f1f7126d1c7c45a4b0e26deefb112140a71f2bcb59879f6dd4869fba6bae2e40?color=5a5a5a) Der pH-Wert der Pufferlösung liegt daher bei ungefähr
Der pH-Wert der Pufferlösung liegt daher bei ungefähr  was zeigt, dass die Lösung leicht basisch ist.
was zeigt, dass die Lösung leicht basisch ist.
4.2
Diagramm zur Stoffmenge des hydrolysierten Substrats
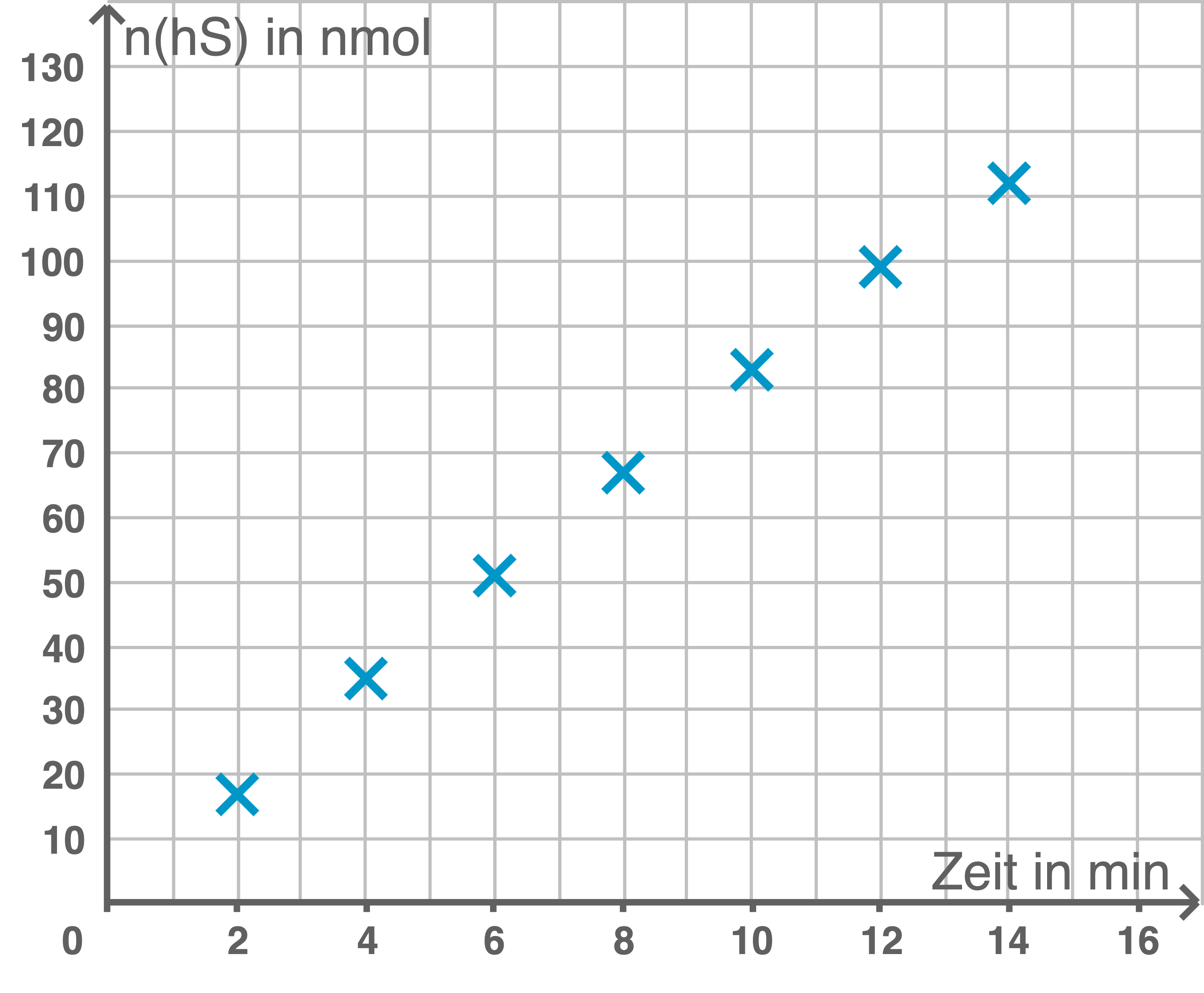 Berechnung der mittleren Reaktionsgeschwindigkeit
Die mittlere Reaktionsgeschwindigkeit im Zeitraum von
Berechnung der mittleren Reaktionsgeschwindigkeit
Die mittlere Reaktionsgeschwindigkeit im Zeitraum von  bis
bis  wird berechnet, indem die Änderung der Stoffmenge des hydrolysierten Substrats durch die Änderung der Zeit geteilt wird:
wird berechnet, indem die Änderung der Stoffmenge des hydrolysierten Substrats durch die Änderung der Zeit geteilt wird:
![\(\begin{array}[t]{rlll}
\bar{v} &=& \dfrac{n_{t=10} - n_{t=4}}{10\,\text{min} - 4\,\text{min}} & \\[5pt]
&=& \dfrac{83\,\text{nmol} - 35\,\text{nmol}}{6\,\text{min}} & \\[5pt]
&=& \dfrac{48\,\text{nmol}}{6\,\text{min}} & \\[5pt]
&=& 8 \,\text{nmol} \cdot \text{min}^{-1}
\end{array}\)](https://mathjax.schullv.de/1e86906c60b30c8aeec45915352a2d0d252ce28c14c2d4d2b40c6521b2af54e0?color=5a5a5a) Die mittlere Reaktionsgeschwindigkeit beträgt
Die mittlere Reaktionsgeschwindigkeit beträgt 

4.3
Diagramm des vermuteten Einflusses der Bowman-Birk-Inhibitoren auf die Trypsin-Aktivität
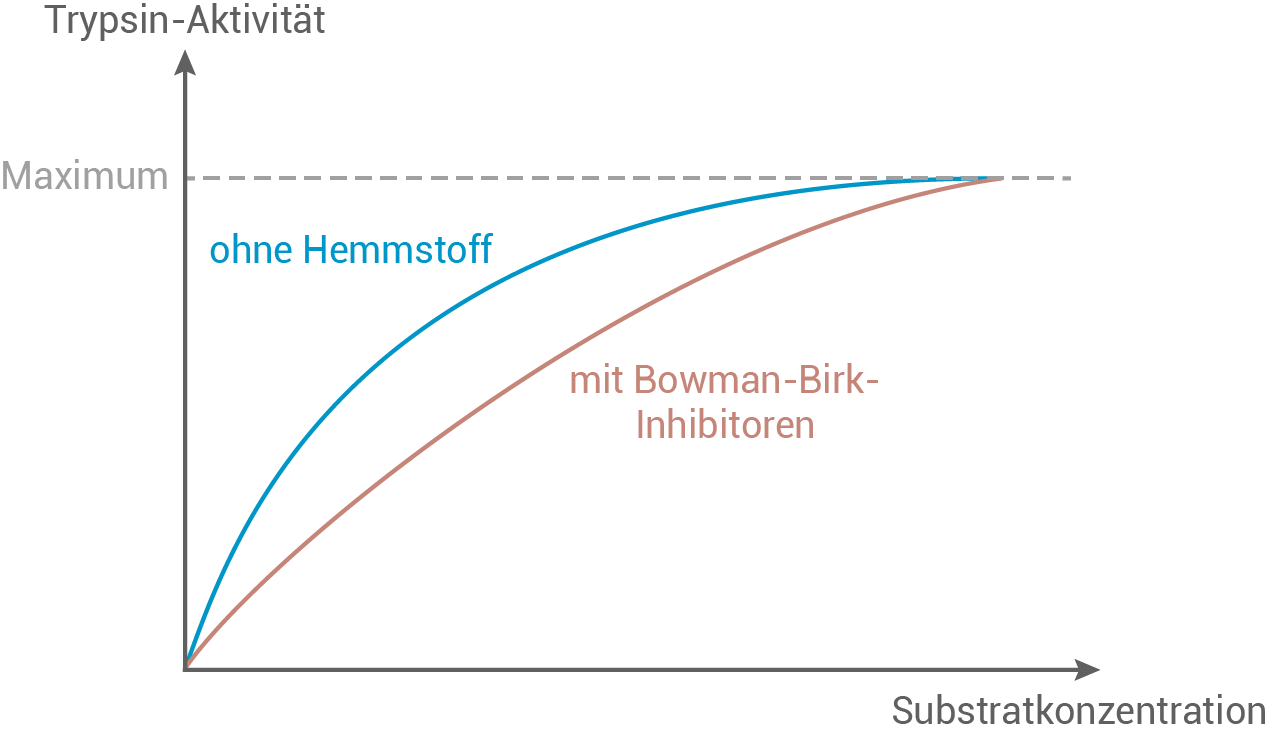 Beschreibung einer experimentellen Vorgehensweise
Die Hypothese, dass Bowman-Birk-Inhibitoren kompetitive Hemmstoffe wirken, basiert auf der Annahme, dass die Inhibitoren sich an das aktive Zentrum des Enzyms binden und so die Bindung des natürlichen Substrats blockieren, was die Enzymaktivität reduziert.
Um die Hypothese zu überprüfen, könnte der folgende experimentelle Ansatz durchgeführt werden:
Eine definierte Menge Trypsin wird in einem Puffer bei
Beschreibung einer experimentellen Vorgehensweise
Die Hypothese, dass Bowman-Birk-Inhibitoren kompetitive Hemmstoffe wirken, basiert auf der Annahme, dass die Inhibitoren sich an das aktive Zentrum des Enzyms binden und so die Bindung des natürlichen Substrats blockieren, was die Enzymaktivität reduziert.
Um die Hypothese zu überprüfen, könnte der folgende experimentelle Ansatz durchgeführt werden:
Eine definierte Menge Trypsin wird in einem Puffer bei  gelöst, da dieser pH-Wert optimal für die Enzymaktivität ist. Als Substrat wird eine Substanz verwendet, die bei Spaltung durch Trypsin ein farbiges Produkt freisetzt, das mithilfe eines Photometers gemessen werden kann.
Ein Beispiel hierfür ist Benzoyl-Arginin-p-nitroanilid (BAPNA), das bei Spaltung eine gelbe Färbung entwickelt.
Es werden mehrere Reaktionsansätze vorbereitet: In einigen wird nur Trypsin mit dem Substrat gemischt, um die normale Enzymaktivität zu messen. In den anderen Ansätzen wird zusätzlich der Bowman-Birk-Inhibitor in verschiedenen Konzentrationen hinzugegeben. Die Farbentwicklung (Reaktionsgeschwindigkeit) wird für alle Ansätze gemessen.
Wenn der Bowman-Birk-Inhibitor kompetitiv hemmt, sollte die Reaktionsgeschwindigkeit bei Zugabe des Inhibitors geringer sein als ohne Inhibitor. Diese Hemmung zeigt sich insbesondere bei niedrigen Substratkonzentrationen deutlich, während bei sehr hohen Substratkonzentrationen die Hemmung aufgehoben wird, da das Substrat mit dem Inhibitor um die Bindung an Trypsin konkurriert.
Die Ergebnisse können in einem Diagramm dargestellt werden, in dem die Reaktionsgeschwindigkeit gegen die Substratkonzentration aufgetragen wird. Eine Verschiebung der Kurve bei Zugabe des Inhibitors nach rechts zeigt die typische kompetitive Hemmung.
gelöst, da dieser pH-Wert optimal für die Enzymaktivität ist. Als Substrat wird eine Substanz verwendet, die bei Spaltung durch Trypsin ein farbiges Produkt freisetzt, das mithilfe eines Photometers gemessen werden kann.
Ein Beispiel hierfür ist Benzoyl-Arginin-p-nitroanilid (BAPNA), das bei Spaltung eine gelbe Färbung entwickelt.
Es werden mehrere Reaktionsansätze vorbereitet: In einigen wird nur Trypsin mit dem Substrat gemischt, um die normale Enzymaktivität zu messen. In den anderen Ansätzen wird zusätzlich der Bowman-Birk-Inhibitor in verschiedenen Konzentrationen hinzugegeben. Die Farbentwicklung (Reaktionsgeschwindigkeit) wird für alle Ansätze gemessen.
Wenn der Bowman-Birk-Inhibitor kompetitiv hemmt, sollte die Reaktionsgeschwindigkeit bei Zugabe des Inhibitors geringer sein als ohne Inhibitor. Diese Hemmung zeigt sich insbesondere bei niedrigen Substratkonzentrationen deutlich, während bei sehr hohen Substratkonzentrationen die Hemmung aufgehoben wird, da das Substrat mit dem Inhibitor um die Bindung an Trypsin konkurriert.
Die Ergebnisse können in einem Diagramm dargestellt werden, in dem die Reaktionsgeschwindigkeit gegen die Substratkonzentration aufgetragen wird. Eine Verschiebung der Kurve bei Zugabe des Inhibitors nach rechts zeigt die typische kompetitive Hemmung.
