HT 2 – Genetik
Thema: Genetik der Blütenfarben des Gewöhnlichen Kohlröschens
1.
Fasse auf Basis von Material A die Aspekte zur Blütenfärbung des Gewöhnlichen Kohlröschens zusammen. Leite auf dieser Grundlage mögliche genetische Ursachen für das Zustandekommen der unterschiedlichen Blütenfarben ab (Material A).
(12 Punkte)
2.
Erläutere die Regulation des ANS-Gens (Material B). Nimm kritisch Stellung, ob sich die bei anderen Pflanzenarten gewonnenen Erkenntnisse auf die Funktionsweise des MYB1-Transkriptionsfaktors beim Gewöhnlichen Kohlröschen übertragen lassen (Material B).
(13 Punkte)
3.
Ermittle für die in Tabelle 1 dargestellten Nukleotidsequenzen die zugehörigen mRNA- und Aminosäuresequenzen sowie die Mutationstypen (Materialien C und E). Werte die in Material C gezeigten Daten aus und entwickle eine Hypothese zu den Auswirkungen der Mutationen sowohl auf molekularer als auch auf phänotypischer Ebene (Materialien A bis C).
(22 Punkte)
4.
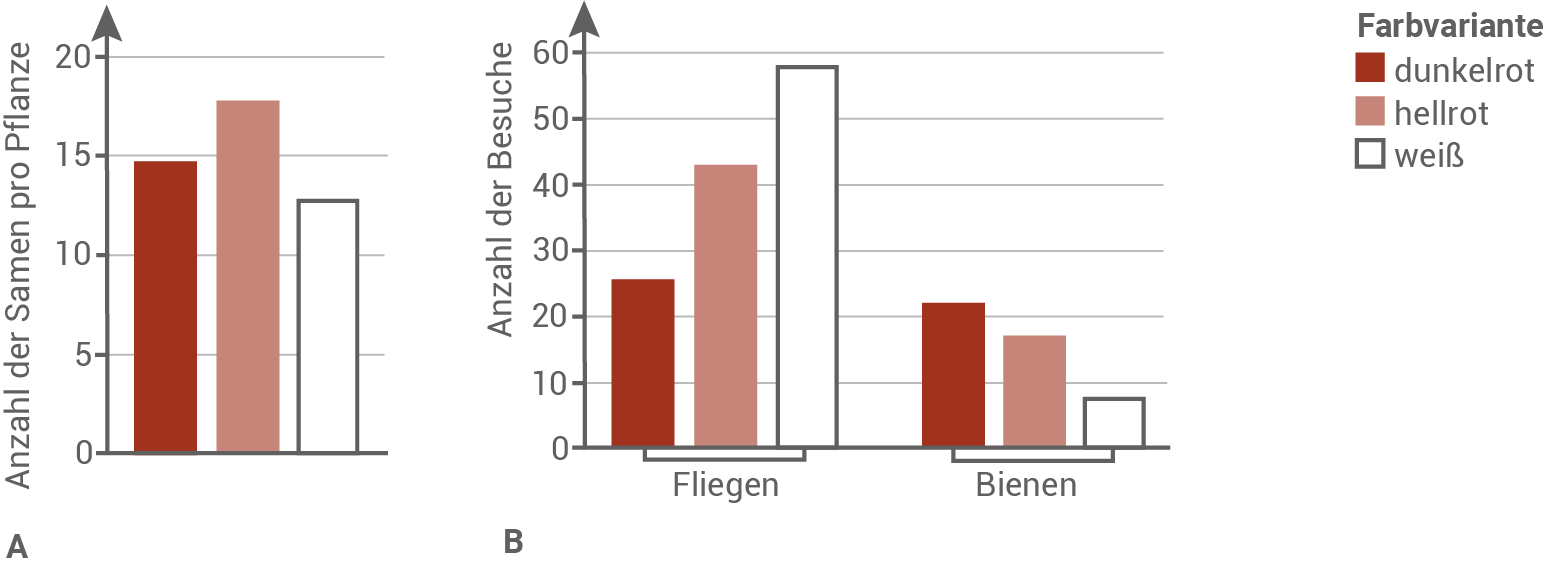
Fasse die in Material D gezeigten Ergebnisse kurz zusammen und analysiere diese im Hinblick auf die Bedeutung der Bestäuber (Material D). Entwickle auf dieser Basis eine Hypothese zur Erklärung der Anteile der Farbvarianten von 1997 bis 2016 und ihrer zukünftigen Entwicklung auch unter Berücksichtigung der MYB1-Allelverteilung (Material C und D ).
(19 Punkte)
Material A: Blütenfarben beim Gewöhnlichen Kohlröschen
Das Gewöhnliche Kohlröschen (Gymnadenia rhellicani) ist eine Orchidee, die in Bergregionen der Alpen bis in den Balkan vorkommt. Die mehrjährige Art besitzt einen Blütenstand mit zahlreichen, in der Regel dunkelroten Einzelblüten, die von Insekten wie Fliegen und Bienen bestäubt werden. Ohne Bestäubung entwickeln sich bei dieser Art keine Samen.
Am Puflatsch, einer Erhebung in Norditalien, findet man beim Gewöhnlichen Kohlröschen neben Pflanzen mit dunkelroten Blüten auch Pflanzen mit hellroter und weißer Blütenfarbe. Innerhalb der Population bestehen keine Unterschiede in der räumlichen Verteilung, verschiedene Farbvarianten kommen oft in unmittelbarer Nähe vor.
Die Färbung der Blüten beim Gewöhnlichen Kohlröschen ändert sich im Laufe des Lebens einer Pflanze nicht.
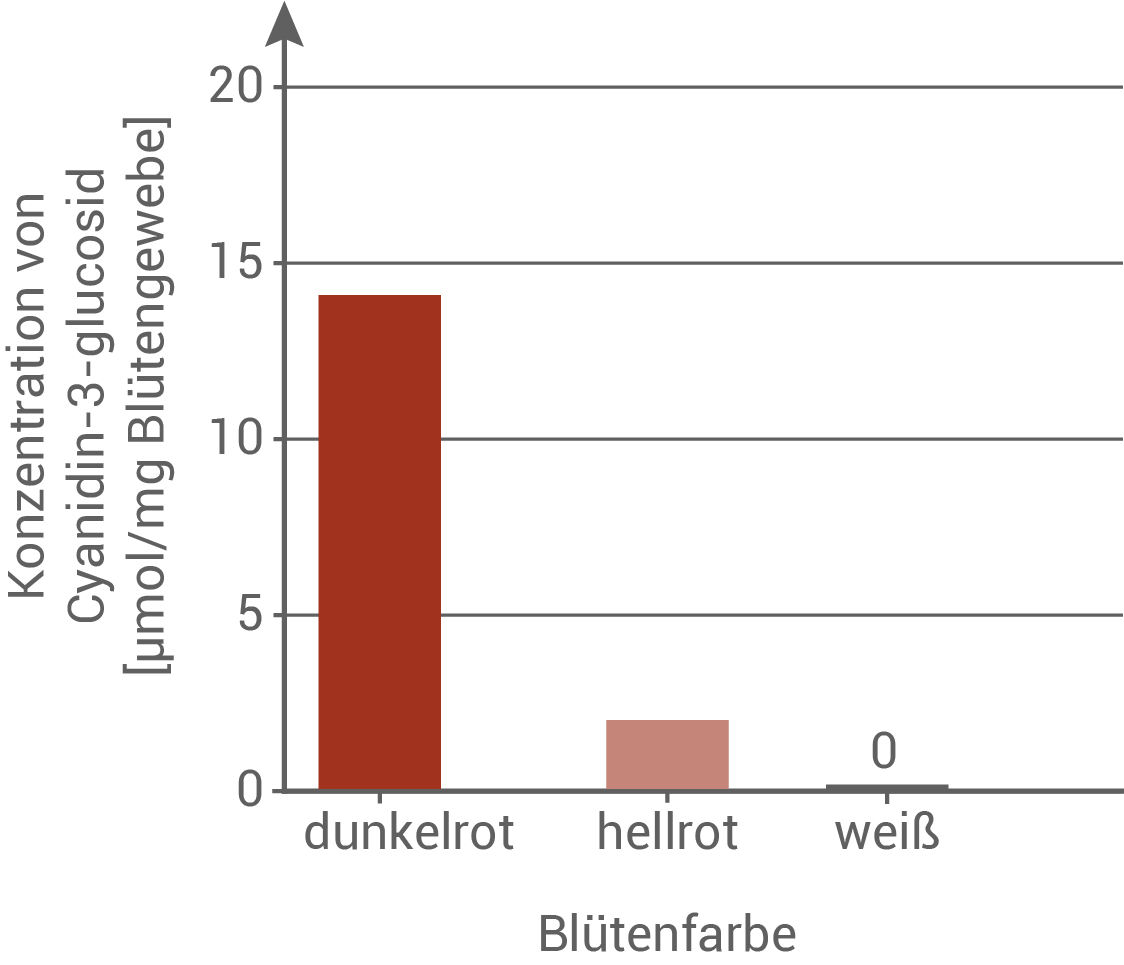
Abb. 1: Konzentration von Cyanidin-3-glucosid in Blüten des Gewöhnlichen Kohlröschens bei verschiedenen Farbvarianten

Abb. 2: Syntheseweg von Cyanidin-3-glucosid. Leukocyanidin ist farblos.
Material B: Regulation des ANS-Gens
Im Gewöhnlichen Kohlröschen wird die Synthese von Cyanidin-3-glucosid aus Leukocyanidin durch das Enzym Anthocyanidin-Synthase (ANS) katalysiert. Die Anthocyanidin-Synthase wird vom ANS-Gen codiert. Die Regulation des ANS-Gens ist in anderen Pflanzenarten gut untersucht. Dort sind unter anderem MYB-Transkriptionsfaktoren an der Regulation beteiligt. Im Gewöhnlichen Kohlröschen wurde der MYB1-Transkriptionsfaktor identifiziert. Weil MYB1 große Aminosäuresequenz-Übereinstimmungen mit bekannten MYB-Transkriptionsfaktoren anderer Pflanzenarten zeigt, wird der in Abbildung 3 dargestellte Mechanismus auch beim Gewöhnlichen Kohlröschen vermutet.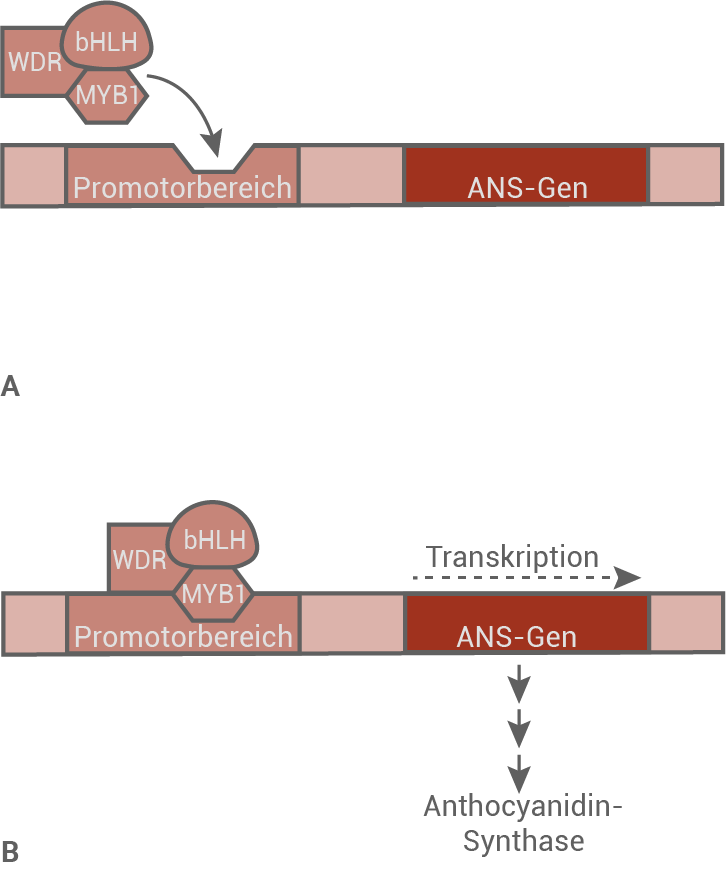
Abb. 3: Modell zur Regulation der Transkription des ANS-Gens durch spezifische Transkriptionsfaktoren.
A ohne Bindung und B mit Bindung der Transkriptionsfaktoren;
weitere, allgemein zur Transkription notwendige Faktoren sind aus Gründen der Übersichtlichkeit nicht gezeigt.
A ohne Bindung und B mit Bindung der Transkriptionsfaktoren;
weitere, allgemein zur Transkription notwendige Faktoren sind aus Gründen der Übersichtlichkeit nicht gezeigt.
Material C: MYB1-Allele und Blütenphänotyp
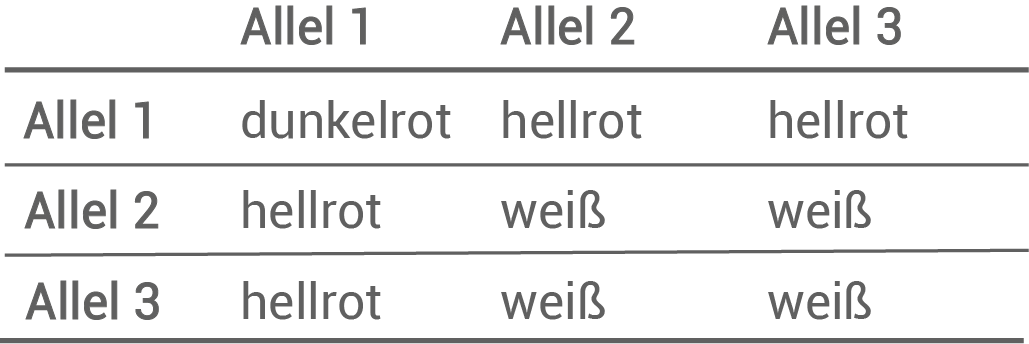
In der Population am Puflatsch wurden unterschiedliche Allele des MYB1-Gens gefunden, die im Gewöhnlichen Kohlröschen in unterschiedlichen Kombinationen vorkommen. Das MYB1-Protein besteht aus 262 Aminosäuren. DNA-Sequenzen der Allele und der Zusammenhang zwischen Allelkombination und Blütenfarbe des Gewöhnlichen Kohlröschens am Puflatsch wurden näher untersucht (Tabellen 1 und 2).
Tab. 1: Ausschnitt aus dem nicht-codogenen Strang des MYB1-Gens des Gewöhnlichen Kohlröschens

Tab. 2: Blütenphänotypen bei verschiedenen MYB1-Allelkombinationen
Material D: Entwicklung der Population am Puflatsch
Der prozentuale Anteil der Farbvarianten am Puflatsch wird seit 1997 wissenschaftlich erfasst und ausgewertet. In einer Studie wurden darüber hinaus Daten zum Besuch von Bestäubern und zur Anzahl der Samen pro Pflanze bei den verschiedenen Phänotypen erhoben. Untersuchungen von Bienen und Fliegen zeigten außerdem, dass an Bienen dreimal häufiger Blütenpollen zu finden waren als an Fliegen.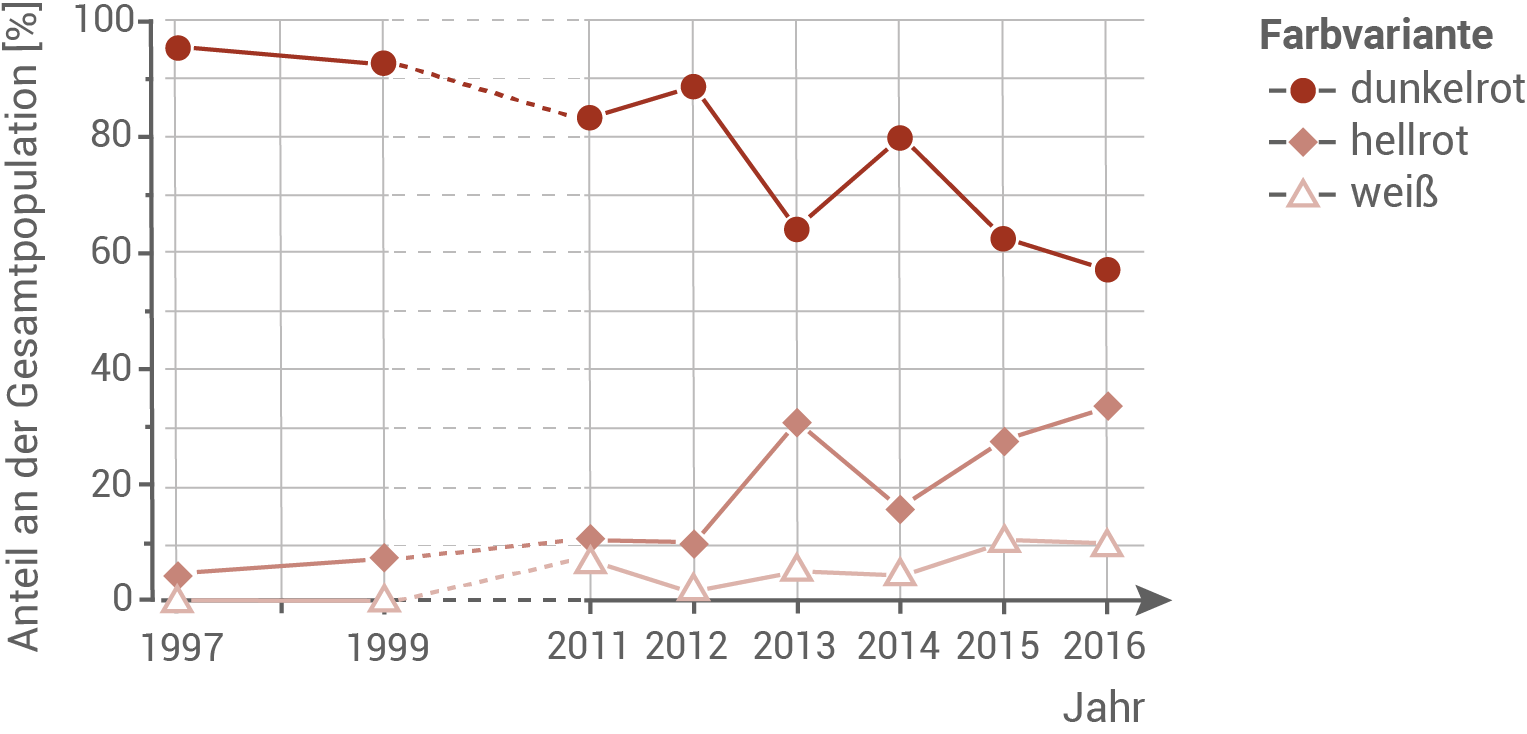
Abb. 4: Anteile der drei Farbvarianten des Gewöhnlichen Kohlröschens an der Gesamtpopulation am Puflatsch zwischen 1997 und 2016
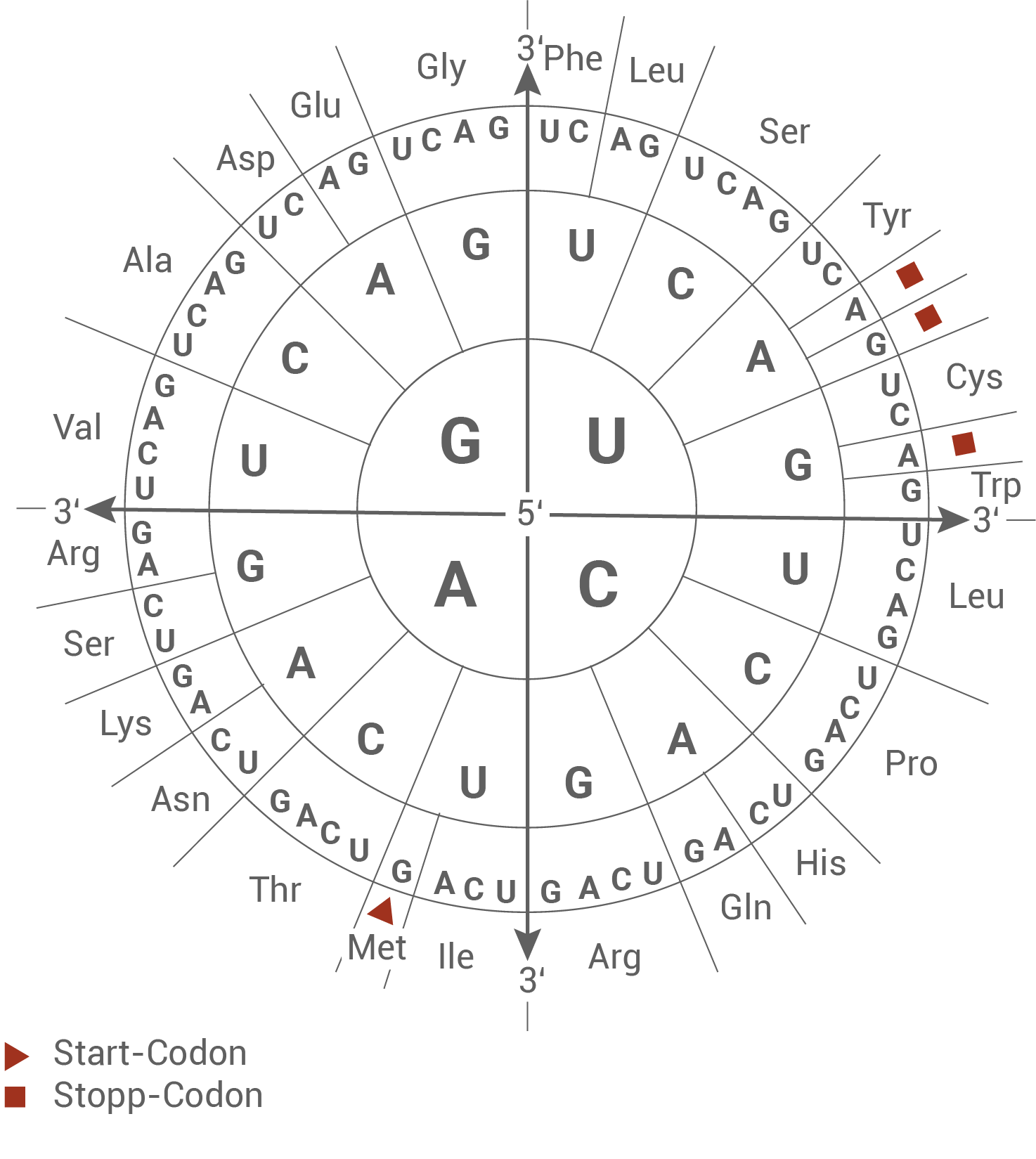
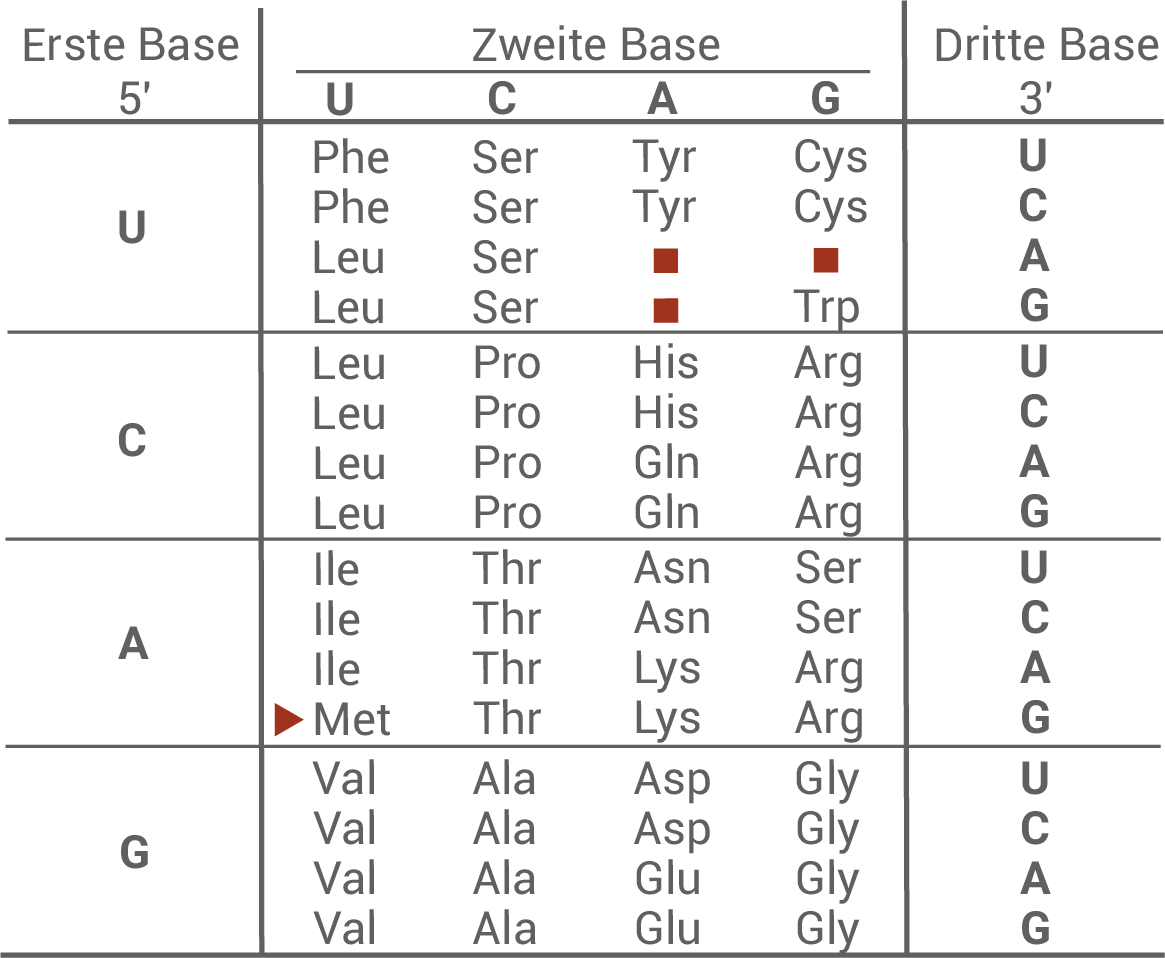
Material E: Codesonne und Tabelle zum genetischen Code
| Ala | Alanin |
|---|---|
| Arg | Arginin |
| Asn | Asparagin |
| Asp | Asparaginsäure |
| Cys | Cystein |
| Gln | Glutamin |
| Glu | Glutaminsäure |
| Gly | Glycin |
| His | Histidin |
| Ile | Isoleucin |
| Leu | Leucin |
| Lys | Lysin |
| Met | Methionin |
| Phe | Phenylalanin |
| Pro | Prolin |
| Ser | Serin |
| Thr | Threonin |
| Trp | Tryptophan |
| Tyr | Tyrosin |
| Val | Valin |
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
Hinweis: Die aufgeführten Lösungen sind stichpunktartig notiert. In der Prüfung ist ein die Stichpunkte inhaltlich umfassender Fließtext erforderlich, um die volle Punktzahl zu erreichen.
1
Aspekte zur Blütenfärbung des Gewöhnlichen Kohlröschens:
- In der Regel besitzt das Gewöhnliche Kohlröschen dunkelrote Blüten.
- Für die Färbung ist das rote Cyanidin-3-glucosid verantwortlich, welches in den Blütenzellen innerhalb eines mehrschrittigen Prozesses mithilfe von Enzymen synthetisiert wird.
- Am Puflatsch gibt es Individuen mit hellroten oder weißen Blüten. Die hellroten Blüten weisen eine deutlich geringere Cyanidin-3-glucosid Konzentration auf, und die weißen Blüten besitzen kein Cyanidin-3-glucosid.
- Die Pflanzen, die in ihrer Färbung vom Wildtyp abweichen, weisen höchstwahrscheinlich eine Mutation auf, die den Syntheseweg von Cyanidin-3-glucosid beeinträchtigt.
- Mutationen könnten dafür sorgen, dass andere Aminosäuren in die Polypeptidkette eingebaut werden. Dies könnte wiederum zu einer Funktionsbeeinträchtigungen des betroffenen Enzyms führen.
- Im Fall der weißen Blüten könnte Enzym 6 im Syntheseweg inaktiviert sein. Somit würde sich das farblose Leukocyanidin in den Zellen anreichern, und die Blüte erschiene weiß.
- Hellrote Blüten könnten durch eine eingeschränkte Funktionstüchtigkeit des Enzym 6 entstehen, da sich so nur wenig Farbstoff in der Blüte anreichert, und sie damit hellrot erscheinen lässt.
2
Regulation des ANS-Gens:
- Das ANS-Gen wird durch einen Proteinkomplex reguliert. Dieser Komplex setzt sich aus den drei spezifischen Transkriptionsfaktoren WDR, bHLH und MYB1 zusammen.
- Die Transkription des ANS-Gens erfolgt erst nach erfolgreicher Bindung des Proteinkomplexes an die DNA.
- Damit ist für die positive Regulation des Gens die Bindung des MYB1/bHLH/WDR-Transkriptionsfaktor-Komplex an den Promotor zwingend erforderlich.
- Da der beim Gewöhnlichen Kohlröschen gefundene MYB1-Transkriptionsfaktor eine ähnliche Aminosäuresequenz wie der MYB-Transkriktionsfaktor bei anderen Arten aufweist, könnten seine räumliche Struktur und seine Eigenschaften ebenfalls dem MYB-Transkriptionsfaktor ähneln.
- Der Sequenzbereich, an dem der Komplex bindet, könnte an einer ähnlichen Stelle sitzen, wie beim MYB-Transkriptionsfaktor.
- Ein Rückschluss auf die Funktion alleine aufgrund der ähnlichen Aminosäuresequenz ist allerdings eher unsicher, da auch der Austausch weniger Aminosäuren die Funktionsweise stark beeinflussen kann. Die Funktion des Transkriptionsfaktors sollte daher zusätzlich zum Beispiel durch Experimente überprüft werden.
- Ein weiterer Punkt, der gegen eine Analogie der beiden Transkriptionsfaktoren spricht, ist, dass nicht geklärt ist, wie MYB1 bzw. MYB mit anderen an der Transkription beteiligten Faktoren interagieren. Dies könnte ihre Wirkungsweise bei der Transkription beeinflussen.
3
Zugehörige mRNA– und Aminosäuresequenzen und Mutationstypen:


- Alle drei Allele unterscheiden sich jeweils an der dritten Base des 221. Basentripletts.
- Dabei weist Allel 1 auf dem nicht-codogenen Strang die Base Cytosin auf, das 2. Allel Guanin und das 3. Allel Adenin. Somit liegen Punktmutationen (Substitutionen) vor.
- Es handelt sich um Nonsense-Mutationen, da bei den Allelen 2 und 3 diese Mutationen zur Entstehung eines Stopp-Codons führen.
- Individuen mit dunkelroten Blüten sind homozygot für Allel 1, welches kein vorzeitiges Stopp-Codon aufweist.
- Individuen mit hellroten Blüten kommen nur durch eine Kombination des Allel 1 mit Allel 2 oder Allel 3 zustande. Daher sind sie immer heterozygot und besitzen immer auch ein Allel mit vorzeitigem Stopp-Codon.
- Individuen mit weißer Blütenfarbe sind entweder homozygot für Allel 2 oder 3, oder heterozygot für Allel 2 in Kombination mit Allel 3 und umgekehrt. Somit besitzen sie immer zwei Allele, die eine Mutation im Triplett 221 aufweisen.
- Für die rote Blütenfarbe ist der Farbstoff Cyanidin-3-glucosid verantwortlich. Dieser wird aus der farblosen Vorstufe Leucyanidin mithilfe des Enzyms Anthocyanidin-Synthase (ANS) katalysiert. Dieses Enzym wird durch das ANS-Gen codiert. Die Transkription des ANS-Gen wird durch den Transkriptionsfaktor MYB1 gesteuert.
- Für die positive Regulation des ANS-Gens muss zum einen die Bindung des Transkriptionsfaktors an die Promotorregion des Gens erfolgen, und zum anderen muss MYB1 an die anderen beiden Transkriptionsfaktoren binden.
- Kommt es zu einer Mutation, die dafür sorgt, dass vorzeitig ein Stoppcodon eingefügt wird, entsteht ein verkürztes MYB1-Gen. Dies kann wiederum die Funktionstüchtigkeit des Proteinkomplexes stören, und die Bindung an die Promotorregion verhindern. Die DNA wird an dieser Stelle dann nicht transkribiert.
- In Pflanzen mit hellroten Blüten wird dementsprechend weniger ANS-Enzym gebildet, und somit weniger Farbstoff hergestellt.
- Pflanzen mit weißen Blüten fehlt das MYB1-Protein. Es kann dadurch keine ANS-Synthase und auch kein Cyanidin-3-glucosid gebildet werden.
4
Zusammenfassung der Ergebnisse aus Material D:
- Von 1997 bis 2016 ist der prozentuale Anteil an Pflanzen mit dunkelroten Blüten gesunken. Im selben Zeitraum ist der Anteil der Pflanzen mit hellroten Blüten gestiegen. Im Jahr 1997 waren Pflanzen mit weißen Blüten nur vereinzelt zu finden. Ihr Anteil stieg bis 2016 geringfügig an.
- Pflanzen mit hellroten Blüten bilden im Schnitt mehr Samen als Pflanzen mit dunkelroten und weißen Blüten.
- Im Allgemeinen werden die Blüten des Gewöhnlichen Kohlröschens häufiger von Fliegen angeflogen als von Bienen. Die Fliegen besuchen bevorzugt die weißen Blüten, während Bienen die dunkelroten Blüten anfliegen. Bei hellroten Blüten liegen die Anzahl der Besuche von Fliegen und Bienen jeweils im mittleren Wertebereich.
- Fliegen bestäuben häufiger hellrote Blüten als dunkelrote Blüten. Bienen fliegen dunkelrote Blüten jedoch nur ein wenig öfter an, als hellrote Blüten.
- Somit werden hellrote Blüten in Summer häufiger bestäubt als dunkelrote oder weiße Blüten. Dies könnte eine Erklärung dafür sein, warum Pflanzen mit hellroten Blüten mehr Samen bilden können.
- Sehr häufig werden weiße Blüten von Fliegen besucht, aber eher selten von Bienen. Da Fliegen weniger effiziente Bestäuber sind, bilden Pflanzen mit weißen Blüten im Schnitt weniger Samen als Pflanzen mit hellroten oder dunkelroten Blüten.
- Die Vorlieben der jeweiligen Bestäuber stellen einen Selektionsfaktor für die Population des Gewöhnlichen Kohlröschens dar.
- Es ist deutlich zu erkennen, dass zu Beginn der Untersuchung deutlich mehr Individuen mit dunkelroter Blütenfarbe, als mit hellroter oder weißer Blütenfarbe existierten. Im Laufe der Zeit nahm die Anzahl der dunkelrot blühenden Individuen stark ab, wohingegen der Anteil an Pflanzen mit hellroten Blüten stark und der der Pflanzen mit weißen Blüten leicht zunahm.
- Daraus lässt sich schließen, dass es zu Beginn nur wenige Blüten gab, die eine Mutation heterozygot, und noch weniger Individuen, die eine Mutation homozygot besaßen.
- Die Pflanzen mit hellroter Blütenfarbe bildeten zu gleichen Teilen Keimzellen mit Allel 1 und Keimzellen mit Allel 2 bzw. 3.
- Die Präferenz der Bestäuber für die veränderte Blütenfarbe könnte dafür gesorgt haben, dass vermehrt die mutierten Allele in den Genpool eingebracht wurden.
- Somit stieg sowohl die Anzahl der Blüten mit hellroter als auch mit weißer Farbe.
- Da die Wahrscheinlichkeit für Allelkombinationen, die Allel 1 heterozygot beinhalten, aufgrund der Häufigkeit von Allel 1 deutlich höher ist als für ein weißes Kombinationsereignis, stieg die Anzahl an Pflanzen mit hellroten Blüten schneller an, als die von weißen Blüten.
- Werden die Allele 2 und 3 mit der Zeit immer häufiger, so steigt am Puflatsch innerhalb der Population auch die Wahrscheinlichkeit, dass entsprechende Pollen durch Bestäuber verbreitet werden. Die Häufigkeit von Allel 1 nimmt hingegen im Laufe der Zeit ab.
- Es lässt sich vermuten, dass auf lange Sicht die Anzahl der hellroten und weißen Individuen weiter zunehmen wird.
- Pflanzen mit hellroten Blüten werden dabei überwiegen, da die Entstehung des heterozygoten Genotyps wahrscheinlicher ist als die eines homozygoten. Somit werden dunkelrote und weiße Blüten einen vergleichsweise geringeren Anteil an der Population am Puflatsch haben.