HT 1 – Signaltransduktion, Evolution
Thema: Chemotaktile Wahrnehmung bei Octopus
1.
Stelle kurz die experimentelle Vorgehensweise dar und werte Abbildung 1 hinsichtlich der Bedeutung der Reizarten für Octopus aus (Material A).
(10 Punkte)
2.
Fasse die in den Abbildungen 2 und 3 dargestellten Ergebnisse zusammen und erkläre die Signaltransduktion bei Mechano- und Chemorezeptorzellen von Octopus bimaculoides (Material B). Deute diese Versuchsergebnisse im Hinblick auf die Bedeutung der verschiedenen Reizarten unter Berücksichtigung der neuronalen Informationsverarbeitung im Ganglion bei Octopus bimaculoides (Materialien A und B).
(22 Punkte)
3.
Stelle die Patch-Clamp-Technik dar. Werte Tabelle 1 im Hinblick auf die Spezifität der beiden CR-Proteine aus (Material C). Erläutere die Bedeutung der ausgewählten CR-Proteine und der Mechanorezeptoren für das Verhalten von Octopus bimaculoides unter natürlichen Bedingungen (Materialien A bis C).
(20 Punkte)
4.
Analysiere den Stammbaum in Abbildung 4 bezüglich der Evolution der ausgewählten Rezeptorproteine (Material D) und entwickle eine Hypothese zur Entwicklung der CR-Proteine mithilfe der Synthetischen Evolutionstheorie (Materialien A bis D).
(14 Punkte)
Material A: Jagdverhalten bei Octopus
Die Vertreter der Gattung Octopus leben in Tiefen bis zu 200 Meter vorwiegend am Meeresboden. Sie besitzen einen Kopf, acht Arme, die mit jeweils zwei Reihen von Saugnäpfen besetzt sind, und einen Eingeweidesack mit Tintenblase. Oktopusse sind Jäger, die vorwiegend Krebstiere, Muscheln und Schnecken und manchmal Fische mithilfe ihrer Arme erbeuten. Beständig suchen sie mit ihren beweglichen Armen auf und im Untergrund nach Nahrung. Bei Gefahr entleert der Octopus seine Tintenblase und flüchtet vor Feinden wie etwa Kalmaren im Schutz des tintengefärbten Wassers. Oktopusse verfügen über empfindliche Sinnesorgane und ein leistungsfähiges Gehirn. Sie besitzen zwei hoch entwickelte Linsenaugen und können Wasserströmungen über ein Seitenlinienorgan wahrnehmen. Insbesondere die Arme mit den Saugnäpfen sind sehr stark von Neuronen durchzogen. Die Zellkörper dieser Neuronen liegen gemeinsam in einer Verdickung, dem Ganglion, an der Basis des jeweiligen Arms. Die Bewegung jedes Arms kann von dessen eigenem Ganglion und daher unabhängig vom Gehirn gesteuert werden. In Experimenten mit dem Gewöhnlichen Kraken (Octopus vulgaris) wurde im Aquarium die Häufigkeit des zuerst geöffneten Schraubgefäßes ermittelt (Abbildung 1). Als Nahrung bevorzugte O. vulgaris ohne Schraubgefäß immer Sardellen. Bei blickdichten Gefäßen mit Deckeln ohne Löcher wurden beide Gefäße annähernd gleich häufig zuerst geöffnet.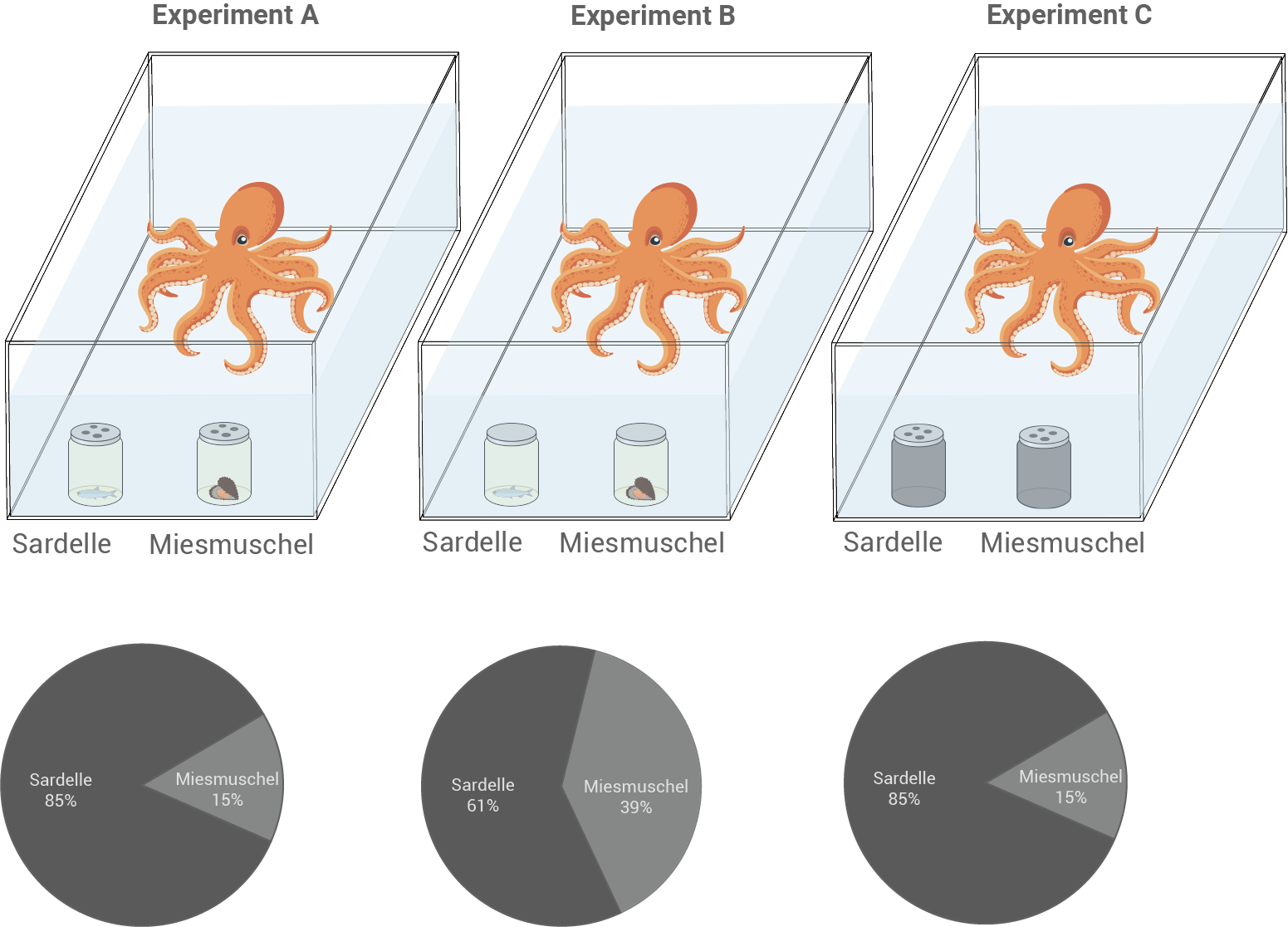
Abb. 1: Verhaltensexperimente mit Octopus vulgaris. Die Kreisdiagramme geben die Häufigkeit des unter den jeweiligen Bedingungen zuerst geöffneten Gefäßes an.
Material B: Neurophysiologische Untersuchungen bei Zelltypen von Saugnäpfen
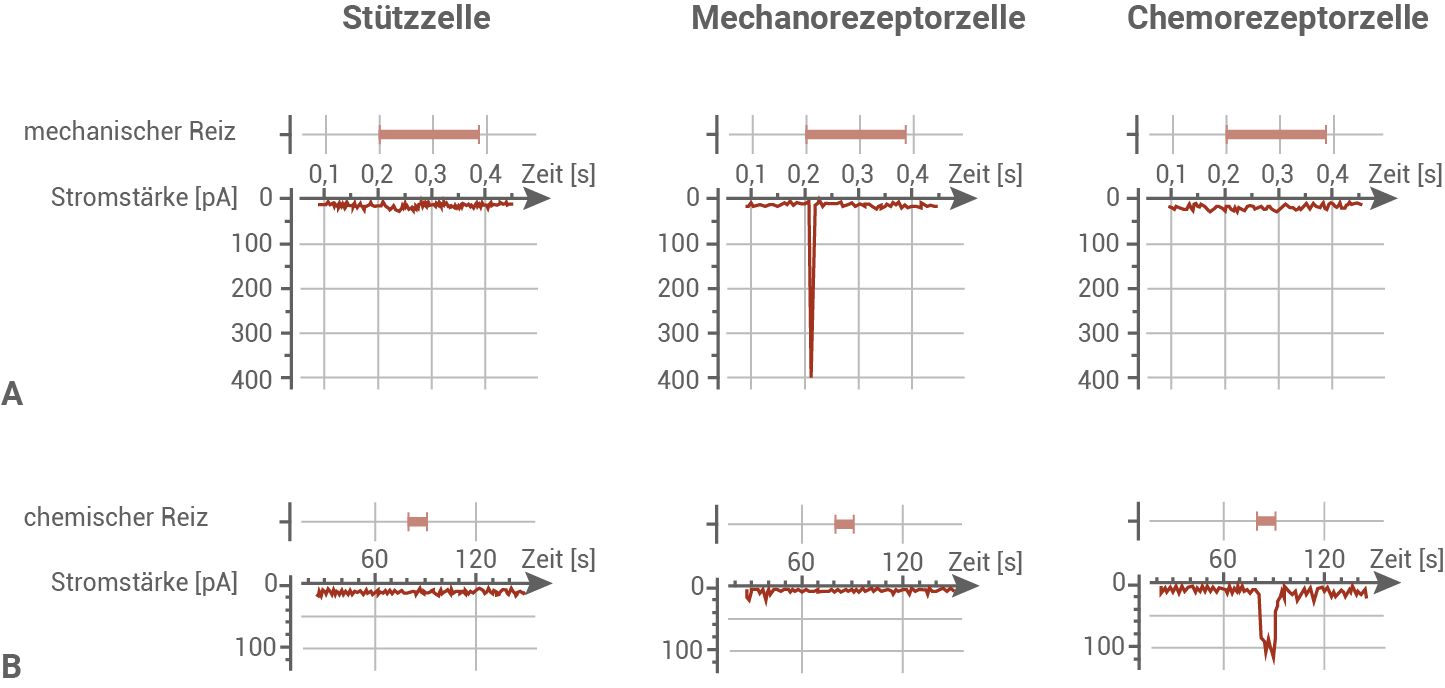
Die Saugnäpfe der Arme des Kalifornischen Zweipunktkraken (Octopus bimaculoides) wurden genauer analysiert. Hier treten drei Zelltypen auf, die sich in ihrem Aufbau und ihrer neurophysiologischen Reaktion auf verschiedene Reizarten unterscheiden lassen. Untersucht wurde der reizabhängige Einstrom von Kationen wie etwa Natriumionen in den jeweiligen Zelltyp mithilfe elektrophysiologischer Messungen (Abbildung 2).
Um die elektrophysiologischen Eigenschaften der drei Zelltypen zu untersuchen, wurden die verschiedenen Zelltypen unterschiedlich starken künstlichen Reizströmen ausgesetzt und die jeweilige Reaktion gemessen (Abbildung 3).
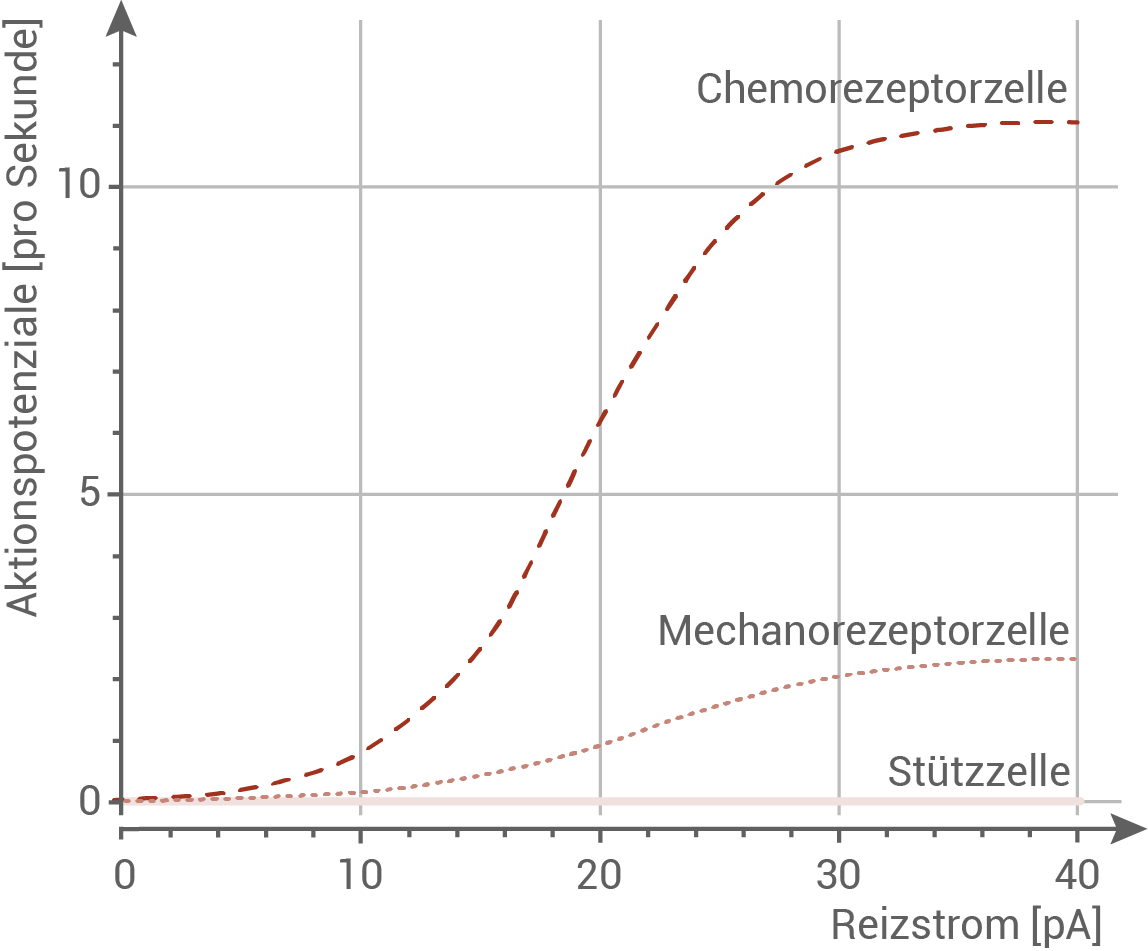
Abb. 3: Elektrophysiologische Reaktion der Zelltypen des Saugnapfs bei unterschiedlich starken Reizströmen.
pA= Pico-Ampere
pA= Pico-Ampere
Material C: Spezifität der Chemorezeptorproteine
Molekulare Analysen der Chemorezeptorzellen führten zur Identifikation einer Vielzahl von Chemorezeptorproteinen, den CR-Proteinen, bei Octopus bimaculoides. Allgemein sind Chemorezeptorproteine Transmembranproteine, die von außen kommende Stoffe zu Beginn der Signaltransduktion spezifisch binden. Bei O. bimaculoides bilden die unterschiedlichen CR-Proteine Ionenkanäle, die nach Aktivierung für Kationen permeabel werden. Um die Spezifität dieser CR-Proteine genauer zu analysieren, wurden ihre Reaktionen auf unterschiedliche chemische Substanzen wie zum Beispiel Oktopus-Tinte elektrophysiologisch untersucht, auch mithilfe der Patch-Clamp-Technik. Die Ergebnisse der Experimente für ausgewählte CR-Proteine sind in Tabelle 1 zusammengefasst. Im Wasser werden gut wasserlösliche (hydrophile) Stoffe schneller gleichmäßig in einem großen Volumen verteilt. Schlecht wasserlösliche (hydrophobe) Stoffe bleiben länger in der Nähe der Stoffquelle. Fischextrakt enthält sowohl hydrophile als auch hydrophobe Stoffe. Physiologisch bedeutende hydrophobe Substanzen sind zum Beispiel Atractylon und Polygodial. Diese beiden hydrophoben Stoffe werden auch von Muscheln oder Schnecken insbesondere bei Bedrohung abgegeben.
Tab. 1: Reaktion von zwei CR-Proteinen auf verschiedene Substanzen
Material D: Evolution von CR-Proteinen
Acetylcholin-gesteuerte Natriumionen-Kanäle chemischer Synapsen, kurz bezeichnet als ACh-Rezeptorproteine, kommen in vielen Variationen in den unterschiedlichen neuronalen Geweben bei Wirbellosen und Wirbeltieren vor. Sie weisen alle einen Bereich auf, der den Liganden Acetylcholin binden kann. Die verschiedenen Varianten dieser ACh-Rezeptorproteine werden zum Beispiel beim Menschen oder auch beim Octopus durch eine Vielzahl unterschiedlicher Genkopien codiert. Die CR-Proteine von Octopus bimaculoides zeigen Sequenzübereinstimmungen zu Acetylcholin-gesteuerten Natriumionen-Kanälen erregender chemischer Synapsen, reagieren aber nicht auf den Liganden Acetylcholin. Die CR-Proteine findet man nur bei Octopus und anderen Kopffüßern in großer Vielfalt, aber nicht bei anderen Wirbellosen und auch nicht bei Wirbeltieren. Durch Genverdopplungen können aus einem Ursprungsgen mehrere Genkopien entstehen, die sich evolutiv unterschiedlich entwickeln können. Solche Vorgänge führen zur Bildung von Genfamilien wie zum Beispiel bei den hier verglichenen Rezeptorproteinen. Abbildung 4 zeigt einen vereinfachten phylogenetischen Stammbaum ausgewählter ACh-Rezeptorproteine und CR-Proteine von O. bimaculoides.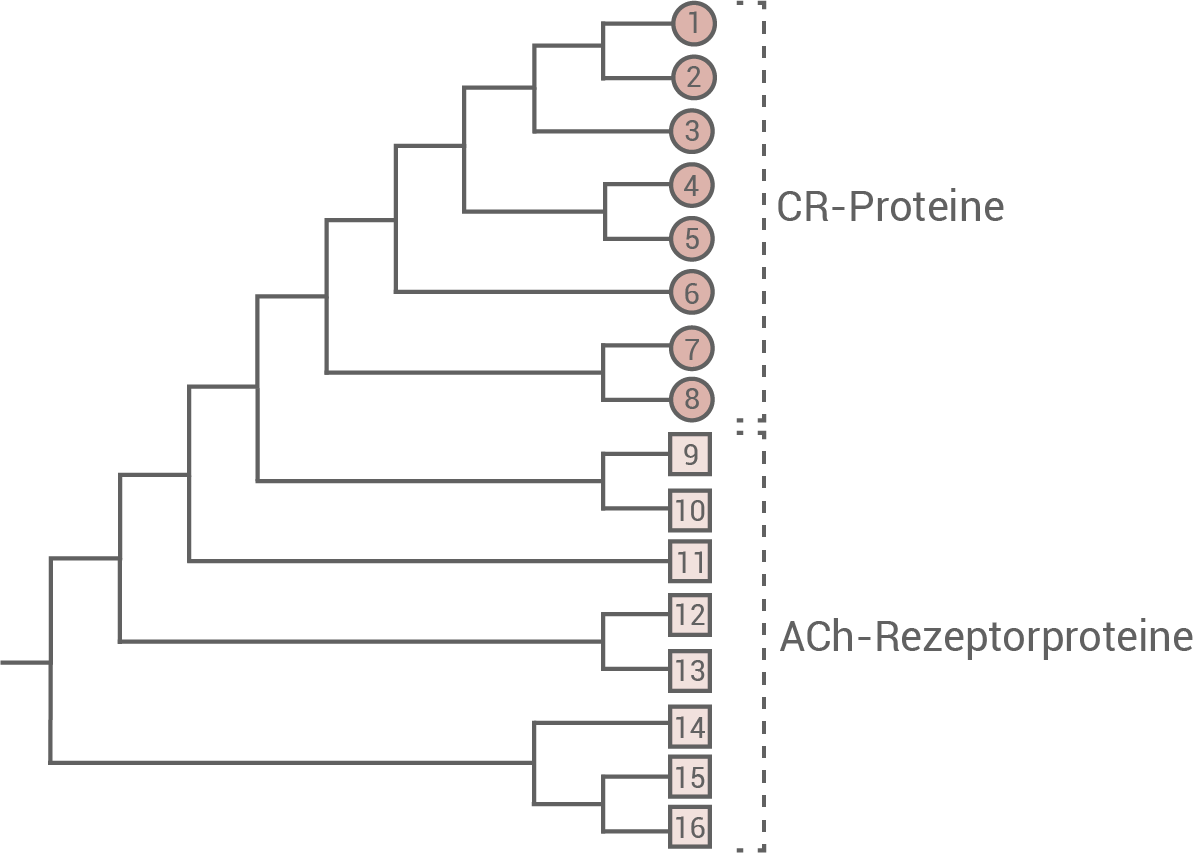
Abb. 4: Vereinfachter phylogenetischer Stammbaum von ausgewählten, nummerierten ACh-Rezeptorproteinen und CR-Proteinen von Octopus bimaculoides
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
Hinweis: Die aufgeführten Lösungen sind stichpunktartig notiert. In der Prüfung ist ein die Stichpunkte inhaltlich umfassender Fließtext erforderlich, um die volle Punktzahl zu erreichen.
1
Experimentelle Vorgehensweise:
- Octopus vulgaris wurde im Experiment die Wahl zwischen zwei Gefäßen mit unterschiedlichen Nahrungsquellen – Sardellen als bevorzugte Nahrung und Miesmuscheln als Alternative – gegeben.
- Die Gefäße, die die Nahrung enthielten, waren unterschiedlich gestaltet. Gefäße mit Löchern im Deckel ermöglichten eine chemische, durchsichtige Gefäße eine optische Erfassung der Nahrungsquelle durch Octopus vulgaris. Es wurde untersucht, welche Reaktion chemische und visuelle Reize bei Octopus vulgaris hervorrufen.
- Dabei wurde erfasst, welches Gefäß als erstes von Octopus vulgaris geöffnet wurde.
- Kann Octopus vulgaris durch Löcher im Deckel der Gefäße einen chemischen Reiz erfassen, so öffnet er in 85 % aller Fälle zuerst das Gefäß mit der Sardelle.
- Stehen Octopus vulgaris keine chemischen, lediglich visuelle Reize zur Verfügung, so wird in 61 % aller Fälle das Gefäß mit der Sardelle, und in 39 % aller Fälle das Gefäß mit der Mieschmuschel zuerst geöffnet.
- Man kann daraus schließen, dass Octopus vulgaris sich bei der Nahrungssuche bevorzugt auf die Signale seiner chemosensiblen Sinneszellen verlässt.
2
Zusammenfassung der in Abbildung 2 und 3 dargestellten Ergebnisse
Abbildung 2:
Abbildung 2:
- Die Stützzellen bei Octopus bimaculoides reagieren weder auf mechanische Reize (Verbiegung der Zellspitze um 1
), noch auf chemische Reize (Fischextrakt).
- Mechanorezeptorzellen sind in der Lage, auf mechanische Reize durch einen kurzen und starken Kationeneinstrom (Stromstärke von 400 pA für 0,025 s) zu reagieren, zeigen allerdings keine Antwort auf chemische Reize.
- Chemorezeporzellen dagegen reagieren auf Fischextrakt als chemischen Reiz mit einem längerem und weniger starken Kationeneinstrom (Stromstärke von ca. 140 pA für 24 s), nicht aber auf einen mechanischen Reiz.
- Die Stützzelle bei Octopus bimaculoides reagiert bei keiner Stromstärke des Reizstromes mit der Ausbildung von Aktionspotenzialen.
- Die Mechanorezeptorzelle zeigt ab ca. 15 pA die Ausbildung von Aktionspotenzialen, mit zunehmender Stromstärke steigt die Frequenz der Aktionspotenziale bis auf etwa 2 Aktionspotenziale pro Sekunde an.
- Die Chemorezeptorzelle reagiert ab einer Stromstärke von ca. 10 pA auf den Reizstrom, und steigt mit zunehmender Stromstärke stark an. Bei 40 pA werden etwa 11 Aktionspotenziale pro Sekunde ausgelöst.
- Wird die Mechanorezeptorzelle durch Auslenkung gereizt, so löst dieser Reiz einen kurzen und starken Einstrom von Natriumionen in die Sinneszelle aus. Ein Rezeptorpotenzial wird gebildet, und es entstehen viele Aktionspotenziale pro Sekunde.
- Wird die Chemozepeztorzelle durch Fischextrakt gereizt, kommt es zu einem langen und schwächeren Natriumioneneinstrom. In der Sinneszelle werden Aktionspotenziale niedrigerer Frequenz ausgelöst.
- Durch den Kationeneinstrom depolarisiert die jeweilige Sinneszelle. Das resultierende Rezeptorpotenzial wird innerhalb der Rezeptorzelle weitergegeben, und führt am Axon zu einer Öffnung spannungsgesteuerter Natriumionenkanäle. Die Erregung wird über das Axon weitergeleitet.
- Chemo- und Mechanorezeptorzellen reagieren nur auf ihren adäquaten Reiz. So können bei der anschließenden neuronalen Verarbeitung im Ganglion des Oktopus verschiedene Reizarten unterschieden werden.
- Auf einen einheitlichen elektrischen Reizstrom reagieren Mechano- und Chemorezeptorzellen mit der Ausbildung unterschiedlich frequenter Aktionspotenziale. Auch auf diese Weise kann Oktopus die verschiedenen Reizarten unterscheiden.
- Die neuronale Verarbeitung der verschiedenen Reizarten im Ganglion des Oktopusarms kann direkt die passende Reaktion des Arms hervorrufen. Die Sinneszellen an den Saugnäpfen von Oktopus steuern damit die Bewegung der Saugnäpfe und des Oktopusarms.
3
Die Patch-Clamp-Technik:
- Mit der Patch-Clamp-Technik lassen sich Ionenströme durch Ionenkanäle im Bereich weniger pico-Ampere messen. Idealerweise wird dazu eine feine Saugpipette mit Messelektrode so auf der Zellmembran eines Neurons platziert, dass genau ein Ionenkanal enthalten ist.
- Der Unterdruck in der Pipette sorgt für einen abgedichteten Rand. Wird das Neuron nun einem Reiz ausgesetzt, so kann der Ionenfluss durch den Kanal über die Änderung der Stromstärke ermittelt werden.
- Beide CR-Proteine sind in der Lage, chemische Signale einer potenziellen Beute (wie bspw. Fischextrakt), zu erkennen.
- CR518 reagiert zudem spezifisch auf hydrophobe Stoffe, wie Atractyon und Polygodial, die von Beutetieren bei Bedrohung abgegeben werden. Da sie sich als hydrophobe Substanzen eher schlecht im Wasser verteilen, liegen sie in der Nähe des Beutetieres in hohen Konzentrationen vor.
- CR840 zeigte keine Aktivierung durch Atractylon und Polygodial, und muss somit eine andere Spezifität aufweisen.
- Beim Aussetzen der Proteine mit Fischextrakt und Oktopustinte zeigte CR518 keine Aktivierung und CR840 eine mittlere Aktivierung. Daraus kann man schließen, dass Tinte CR518 stark und CR840 in geringem Umfang hemmt. Somit unterscheiden sich die beiden Proteine auch hinsichtlich ihrer Fähigkeit an bestimmte Liganden zu binden.
- Die für beutespezifische chemische Signalstoffe (wie Atractylon und Polygodial) empfindlichen CR518 Proteine, lösen bei Reizung eine hohe Aktionspotenzialfrequenz aus. Dies führt zu einer gezielten Lokalisation der Beute und kann damit den Jagderfolg erhöhen.
- Eine Kombination aus mechanischer Reizung durch Berühren der Beute und chemischer Reizung, zum Beispiel durch Atractylon oder Polygodial, könnte ebenfalls den Jagderfolg erhöhen, da die Beute so sehr spezifisch erkannt werden kann. Die Verarbeitung der Reize im Ganglion des jeweiligen Arms ist vorteilhaft für eine schnelle Reaktion und damit für den Jagderfolg.
- Der Oktopus sucht häufig auch im Untergrund nach Nahrung. Hier spielen visuelle Reize eine sehr geringe Rolle. Damit ist eine spezifische Erkennung und schnelle Auswertung mechanischer und chemischer Reize von Vorteil. Wie im Verhaltensexperiment in Material A gezeigt, verlässt sich Oktopus bei schlechten Sichtverhältnissen auf seine Fähigkeit, chemische Reize auszuwerten.
- Dass beide CR-Proteine durch Tinte gehemmt werden, legt die Vermutung nahe, dass Oktopus in Anwesenheit von Tinte die Jagd unterbricht, und eine Fluchtreaktion ausgelöst wird. Das liegt vermutlich daran, dass Oktopusse bei Bedrohung selbst Tinte ausstoßen und fliehen.
4
Analyse des Stammbaumes:
- Alle dargestellten Proteine entspringen einer gemeinsamen Stammform eines ACh-Rezeptorproteins. Innerhalb der Untergruppen existiert eine Vielfalt verschieden mutierter CR- bzw- ACh-Rezeptorproteine.
- Die Gruppe der ACh-Rezeptorproteine stellt dabei die evolutionär ältere Gruppe dar, da sich die CR-Proteine erst nach einigen Mutationsschritten von den ACh-Rezeptorproteinen abgegrenzt haben.
- Aus der Gruppe der ACh-Rezeptorproteine zweigt die Entwicklungslinie ab, die zu der Gruppe der CR-Proteine führt. Da sie nur bei Octopus-Arten und anderen Kopffüßern bekannt sind, handelt es sich vermutlich um eine abgeleitete Form von ligandengesteuerten Ionen-Kanälen.
- Die durch Genverdopplung entstandenen Duplikate sind an unterschiedlichen Stellen mutiert. Ist davon zufälligerweise der Abschnitt betroffen, der für die Ligandenbindung mit Acetylcholin zuständig ist, so entwickelt dieses neu entstandene Protein unter Umständen eine andere Ligandenspezifität, und kann Acetylcholin nicht mehr binden.
- Bei Octopus war es von Vorteil, eine Genvariante mit hoher chemischer Sensitivität für beutespezifische Substanzen zu besitzen. Aufgrund des höheren Jagderfolges erhöhte sich die reproduktive Fitness der Individuen mit dem mutierten Protein.
- Eine höhere reproduktive Fitness führt auf Dauer wiederum zu einer höheren Anzahl an Individuen, die das mutierte Gen tragen, und an die nächste Generation weitergeben. Durch die Verschiebung der Allelfrequenz konnte sich diese Genvariante durchsetzen.