Teil B – Soda und Ammoniak
1
Soda  wird in großen Mengen zur Herstellung von Glas und Seife benötigt. Es wird seit ca. 1860 in einem vom Belgier SOLVAY entwickelten Verfahren aus Steinsalz
wird in großen Mengen zur Herstellung von Glas und Seife benötigt. Es wird seit ca. 1860 in einem vom Belgier SOLVAY entwickelten Verfahren aus Steinsalz  und Kalkstein
und Kalkstein  hergestellt, wobei Natriumhydrogencarbonat als Zwischenprodukt entsteht. Dieses wird nach folgender Reaktionsgleichung zu Soda umgesetzt.
hergestellt, wobei Natriumhydrogencarbonat als Zwischenprodukt entsteht. Dieses wird nach folgender Reaktionsgleichung zu Soda umgesetzt.




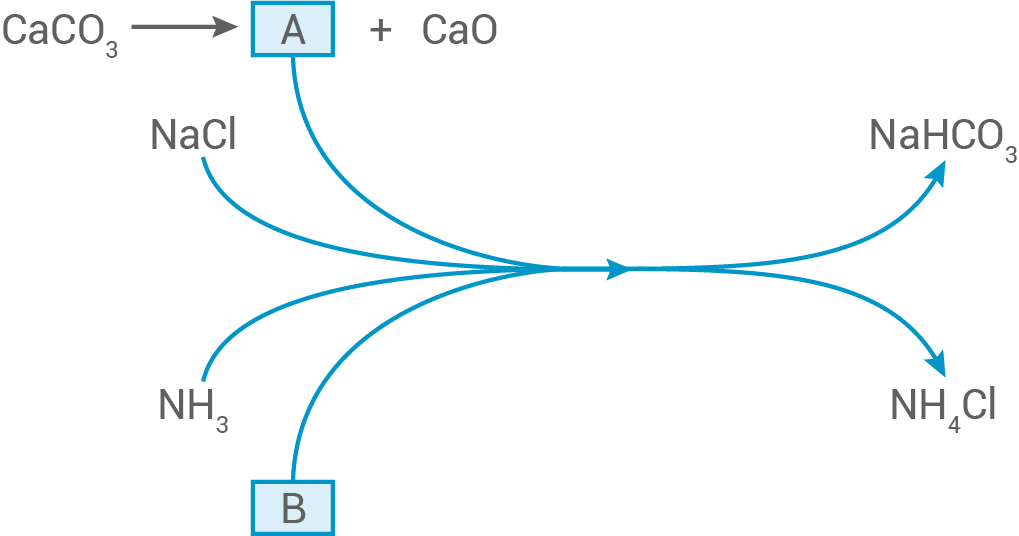
 Im Fließschema sind zwei Reaktionsschritte des SOLVAY-Verfahrens dargestellt.
Im Fließschema sind zwei Reaktionsschritte des SOLVAY-Verfahrens dargestellt.

1.1
Nenne die beiden im Fließschema fehlenden Stoffe A und B.
(02 BE)
1.2
Erkläre die unterschiedliche Löslichkeit von Natriumhydrogencarbonat in reinem Wasser und in einer Natriumchloridlösung.
(02 BE)
1.3
Ermittle rechnerisch mithilfe der GIBBS-HELMHOLTZ-Gleichung die molare freie Reaktionsenthalpie für die Gewinnung von Soda aus Natriumhydrogencarbonat bei einer Temperatur  Leite eine Aussage zum freiwilligen Ablauf der Reaktion bei dieser Temperatur ab.
Leite eine Aussage zum freiwilligen Ablauf der Reaktion bei dieser Temperatur ab.
(04 BE)
1.4
Berechne die Masse an Soda, die aus  Natriumhydrogencarbonat hergestellt werden kann.
Natriumhydrogencarbonat hergestellt werden kann.
(02 BE)
1.5
Soda wird auch zur Regulierung des pH-Werts in Schwimmbecken verwendet.
Begründe mithilfe einer Reaktionsgleichung, ob bei Zugabe von Natriumcarbonat zum Wasser der pH-Wert erhöht oder gesenkt wird.
(02 BE)
2
Die Gewinnung von gasförmigem Ammoniak aus einer Ammoniumchloridlösung kann in einer Gleichgewichtsreaktion erfolgen, deren Hinreaktion endotherm verläuft.
2.1
Begründe zwei verschiedene Reaktionsbedingungen, um eine hohe Ausbeute an Ammoniak zu erreichen.
(02 BE)
2.2
Erläutere diese Reaktion als Säure-Base-Reaktion nach BRØNSTED.
(03 BE)
2.3
Ammoniak wird industriell nach dem HABER-BOSCH-Verfahren aus den Elementen hergestellt.
Entwickle die Reaktionsgleichung für diese Gleichgewichtsreaktion. Leite mithilfe des Massenwirkungsgesetzes die Änderung der Stoffmengenkonzentration an Ammoniak bei Erhöhung der Stoffmengenkonzentration an Wasserstoff ab.
(04 BE)
2.4
Begründe mithilfe Ihrer Kenntnisse über zwischenmolekulare Kräfte den Unterschied der Siedetemperaturen von Ammoniak  und Stickstoff
und Stickstoff 
(03 BE)
3
Material 1: Ammoniak als Energieträger
Das Power-to-Ammonia-Verfahren macht erneuerbare Energie transport- und speicherfähig, indem man diese chemisch in Form von Ammoniak speichert. Die Energie kann wieder freigesetzt werden, wenn Ammoniak direkt als kohlenstofffreier Kraftstoff verbrannt wird oder als Wasserstofflieferant dient. Bereits im Space-Shuttle-Programm kamen Ammoniak-Sauerstoff-Raketen (XLR-99) zum Einsatz.
Nutzbare Energiedichte einiger Kraftstoffe bei Verbrennung:
Außerdem werden Brennstoffzellen auf Ammoniak-Basis erprobt. Prototypen von LKWs und Schiffen werden mit Ammoniak-Luft-Brennstoffzellen betrieben.
| Energieträger | Energiedichte |
| Ammoniak | |
| Diesel | |
| Benzin | |
| Methan |
3.1
Entwickle die Reaktionsgleichung für die Reaktion im Raketenmotor XLR-99, bei der Ammoniak und Sauerstoff zu Stickstoffdioxid und Wasserdampf reagieren.
(01 BE)
3.2
In Ammoniak-Sauerstoff-Brennstoffzellen werden die Ausgangsstoffe Ammoniak und Sauerstoff im alkalischen Milieu zu Stickstoff und Wasser umgesetzt.


 Entwickle die Teilgleichungen für die Reaktionen an Anode und Kathode.
Entwickle die Teilgleichungen für die Reaktionen an Anode und Kathode.
Wähle eine der Aufgaben 3.3 oder 3.4 aus und bearbeite diese.
(02 BE)
3.3
Berechne die elektrische Arbeit, die theoretisch von einer Ammoniak-Sauerstoff-Brennstoffzelle verrichtet wird, die bei einer Spannung von  pro Tag
pro Tag  Ammoniak verbraucht.
Ammoniak verbraucht.
Beurteile die nutzbare Energiedichte im Vergleich zur Verbrennung von Kraftstoffen (M1).
Beurteile die nutzbare Energiedichte im Vergleich zur Verbrennung von Kraftstoffen (M1).
(03 BE)
3.4
Erläutere, dass sich ein Niederschlag aus Kupfer -hydroxid bei Zugabe von Ammoniaklösung im Überschuss auflöst.
-hydroxid bei Zugabe von Ammoniaklösung im Überschuss auflöst.
(03 BE)
(30 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Fehlende Stoffe im Fließschema
| A: | Kohlenstoffdioxid |
| B: | Wasser |
1.2
Unterschiedliche Löslichkeit von Natriumhydrogencarbonat
Natriumhydrogencarbonat  löst sich in reinem Wasser, wobei es dabei in seine Ionen dissoziiert:
löst sich in reinem Wasser, wobei es dabei in seine Ionen dissoziiert:


 Wird
Wird  hinzugefügt
hinzugefügt  -Lösung
-Lösung ist Natriumhydrogencarbonat sehr gering löslich. Dies liegt daran, dass die
ist Natriumhydrogencarbonat sehr gering löslich. Dies liegt daran, dass die  -Ionenkonzentration dann in einer
-Ionenkonzentration dann in einer  -Lösung erhöht ist und zu einem sogenannten gemeinsamen Ioneneffekt führt.
Der gemeinsame Ioneneffekt erklärt, dass die Anwesenheit eines gemeinsamen Ions
-Lösung erhöht ist und zu einem sogenannten gemeinsamen Ioneneffekt führt.
Der gemeinsame Ioneneffekt erklärt, dass die Anwesenheit eines gemeinsamen Ions  hier
hier  die Löslichkeit eines Salzes, das dieses Ion enthält, verringert. In einer Lösung mit bereits hohem
die Löslichkeit eines Salzes, das dieses Ion enthält, verringert. In einer Lösung mit bereits hohem  -Gehalt wird das Gleichgewicht der Dissoziation von
-Gehalt wird das Gleichgewicht der Dissoziation von  nach links verschoben.
nach links verschoben.
Da die Konzentration von bereits erhöht ist, wird weniger
bereits erhöht ist, wird weniger  dissoziieren, um die Konzentration nicht weiter zu erhöhen. Dies führt zu einer geringeren Löslichkeit von Natriumhydrogencarbonat in einer Natriumchloridlösung im Vergleich zu reinem Wasser.
dissoziieren, um die Konzentration nicht weiter zu erhöhen. Dies führt zu einer geringeren Löslichkeit von Natriumhydrogencarbonat in einer Natriumchloridlösung im Vergleich zu reinem Wasser.
Da die Konzentration von
1.3
Berechnung der molaren freien Reaktionsenthalpie
Die GIBBS-HELMHOLTZ-Gleichung lautet:
 Hierbei sind:
Hierbei sind:
 und
und  Wir benötigen die Entropieänderung
Wir benötigen die Entropieänderung  welche sich aus den Reaktionsprodukten und -edukten berechnen lässt:
Damit kann nun die molare freie Reaktionsenthalpie berechnet werden:
Da
welche sich aus den Reaktionsprodukten und -edukten berechnen lässt:
Damit kann nun die molare freie Reaktionsenthalpie berechnet werden:
Da  läuft die Reaktion bei
läuft die Reaktion bei  freiwillig ab.
freiwillig ab.
1.4
Masse an Soda aus  Natriumhydrogencarbonat
Zunächst wird die Stoffmenge an Natriumhydrogencarbonat mithilfe von
Natriumhydrogencarbonat
Zunächst wird die Stoffmenge an Natriumhydrogencarbonat mithilfe von  berechnet:
berechnet:
![\(\begin{array}[t]{rll}
n(NaHCO_3)&=& \dfrac{m(HCO_3)}{M(HCO_3)} & \\[5pt]
&=& \dfrac{1\ 000 \ 000 \,\text{g}}{84 \,\text{g} \cdot \text{mol}^{-1}} & \\[5pt]
&\approx& 11\ 905 \,\text{mol}
\end{array}\)](https://mathjax.schullv.de/a4b772e489efca194b4195d0ed2879d62fb007463a771b9d7637691040ab772c?color=5a5a5a) Aus der Reaktionsgleichung lässt sich nun das Stoffmengenverhältnis ableiten.
Aus der Reaktionsgleichung lässt sich nun das Stoffmengenverhältnis ableiten.
Es gilt: Damit folgt:
Aus
Damit folgt:
Aus  Natriumhydrogencarbonat können ca.
Natriumhydrogencarbonat können ca.  Soda hergestellt werden.
Soda hergestellt werden.
Es gilt:
1.5
Einfluss von auf den pH-Wert
 zeigt, dass Natriumcarbonat alkalisch wirkt und den pH-Wert des Wassers erhöht.
zeigt, dass Natriumcarbonat alkalisch wirkt und den pH-Wert des Wassers erhöht.
- In Wasser dissoziiert Natriumcarbonat:
- Das Carbonat-Ion reagiert mit Wasser weiter:
2.1
Reaktionsbedingungen für eine hohe Ammoniakausbeute
Das es sich um eine Gleichgewichtsreaktion handelt, lässt sich das Prinzip des kleinsten Zwangs anwenden.
- Hohe Temperatur: Da die Hinreaktion endotherm ist, begünstigt eine höhere Temperatur die Bildung von Ammoniak.
- Entfernung des Produkts: Durch kontinuierliches Entfernen des gebildeten Ammoniaks aus der Reaktion wird das Gleichgewicht nach rechts verschoben, um den Verlust des Produkts auszugleichen.
2.2
Säure-Base-Reaktion nach BRØNSTED
Die Reaktionsgleichung für die Ammoniakgewinnung aus einer Ammoniumchloridlösung lautet:


 Nach BRØNSTED ist eine Säure ein Protonendonator und eine Base ein Protonenakzeptor:
Nach BRØNSTED ist eine Säure ein Protonendonator und eine Base ein Protonenakzeptor:
fungiert in dieser Reaktion als Base, die die Protonen aufnimmt.
ist dabei die konjugierte Säure und gibt Protonen
ab.
fungiert als konjugierte Base von Wasser und nimmt Protonen auf.
reagiert hier demnach als Säure.
2.3
Reaktionsgleichung für das HABER-BOSCH-Verfahren


 Massenwirkungsgesetz und Ableitung
Massenwirkungsgesetz und Ableitung
![\(K= \dfrac{[NH_3]^2}{[N_2] \cdot [H_2]^3 }\)](https://mathjax.schullv.de/36aedb7f0219e2293b3a204dc4d6ec1f4c1f70bf862886502430f8e2ca041be1?color=5a5a5a) Durch Erhöhung der Stoffmengenkonzentration an
Durch Erhöhung der Stoffmengenkonzentration an  wird der Nenner in der Massenwirkungsgleichung größer und
wird der Nenner in der Massenwirkungsgleichung größer und  somit kleiner. Das bedeutet eine Verschiebung des Gleichgewichts nach rechts, wodurch die Ausbeute an Ammoniak steigt.
somit kleiner. Das bedeutet eine Verschiebung des Gleichgewichts nach rechts, wodurch die Ausbeute an Ammoniak steigt.
2.4
Siedetemperaturen von Ammoniak und Stickstoff
- In
herrscht zwischen dem Stickstoff- und Wasserstoffatom eine hohe Elektronegativitätsdifferenz, wodurch starke Wasserstoffbrückenbindungen ausgebildet werden können. Zudem besitzt Ammoniak aufgrund seiner trigonal-pyramidalen Struktur ein permanentes Dipolmoment.
- Diese starken zwischenmolekularen Kräfte erfordern mehr Energie, um die Moleküle in die Gasphase zu überführen, was zu einer höheren Siedetemperatur führt.
ist ein unpolares Molekül und kann daher nur schwache VAN-DER-WAALS-Kräfte ausbilden.
- Aufgrund der schwachen zwischenmolekularen Kräfte wird daher viel weniger Energie benötigt, um die Moleküle in die Gasphase zu überführen, was zu einer niedrigeren Siedetemperatur führt.
3.1
Reaktionsgleichung für XLR-99



3.2
Teilgleichungen für die Brennstoffzellenreaktion
3.3
Berechnung der elektrischen Arbeit einer Ammoniak-Sauerstoff-Brennstoffzelle
Zunächst wird die Stoffmenge an Ammoniak berechnet:
![\(\begin{array}[t]{rll}
n (NH_3)&=& \dfrac{m (NH_3)}{M(NH_3)} & \\[5pt]
&=& \dfrac{1000\,\text{g}}{17\,\text{g} \cdot \text{mol}^{-1}} & \\[5pt]
&\approx& 58,3 \,\text{mol}
\end{array}\)](https://mathjax.schullv.de/ed5fea8a28cef926cb1e11f47625d48fbfe86da3a732ff4ac466b16c7fed3279?color=5a5a5a) Mithife der der FARADAY-Konstante folgt für die elektrische Arbeit:
Mithife der der FARADAY-Konstante folgt für die elektrische Arbeit:


![\(\begin{array}[t]{rll}
W\,_\text{el} &=& U \cdot F \cdot z \cdot n & \\[5pt]
\end{array}\)](https://mathjax.schullv.de/4fe1192d3b12ecbeefecb2513e2ccefa37cc6876a49fa22dbe6cc31ab1981ba5?color=5a5a5a) Die Ladungszahl lässt sich aus der Reaktionsgleichung ableiten und beträgt
Die Ladungszahl lässt sich aus der Reaktionsgleichung ableiten und beträgt  Von einer Ammoniak-Sauerstoff-Brennstoffzelle werden theoretisch ca.
Von einer Ammoniak-Sauerstoff-Brennstoffzelle werden theoretisch ca.  elektrische Arbeit verrichtet.
Beurteilung der nutzbaren Energiedichte
Verglichen mit der Verbrennung von Ammoniak, die eine Energiedichte von
elektrische Arbeit verrichtet.
Beurteilung der nutzbaren Energiedichte
Verglichen mit der Verbrennung von Ammoniak, die eine Energiedichte von  hat, ist die theoretische elektrische Arbeit von
hat, ist die theoretische elektrische Arbeit von  vergleichbar. In der Praxis können jedoch Effizienzverluste in der Brennstoffzelle auftreten, wodurch die reale nutzbare Energiedichte etwas niedriger ausfallen könnte.
vergleichbar. In der Praxis können jedoch Effizienzverluste in der Brennstoffzelle auftreten, wodurch die reale nutzbare Energiedichte etwas niedriger ausfallen könnte.
3.4
Auflösung von Kupfer -hydroxid in Ammoniaklösung
Ein Niederschlag aus Kupfer
-hydroxid in Ammoniaklösung
Ein Niederschlag aus Kupfer -hydroxid
-hydroxid  löst sich bei Zugabe von Ammoniaklösung im Überschuss auf, da sich der lösliche Tetraamin-Kupfer
löst sich bei Zugabe von Ammoniaklösung im Überschuss auf, da sich der lösliche Tetraamin-Kupfer -Komplex bildet:
-Komplex bildet:


![\([Cu(NH_3)_4]^{2+} + 2\, OH^-\)](https://mathjax.schullv.de/00dfbb5e55ac343d4403bebb95be4c71a37e79a98fe43dcb155427517be8881e?color=5a5a5a)