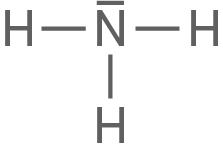
Teil A – Ammoniak
1
Ammoniak  konnte erstmals 1913 bei der BASF in Ludwigshafen im HABER-BOSCH-Verfahren großtechnisch
konnte erstmals 1913 bei der BASF in Ludwigshafen im HABER-BOSCH-Verfahren großtechnisch
in einer Gleichgewichtsreaktion aus den Elementen Stickstoff und Wasserstoff hergestellt werden.
in einer Gleichgewichtsreaktion aus den Elementen Stickstoff und Wasserstoff hergestellt werden.
1.1
Entwickle die Reaktionsgleichung für die Herstellung des Ammoniaks.
(01 BE)
1.2
Die Gleichgewichtskonstante  für die Ammoniaksynthese sinkt mit steigender Temperatur.
Leite anhand des Massenwirkungsgesetzes ab, ob es sich bei der Ammoniaksynthese um eine exo- oder endotherme Reaktion handelt.
für die Ammoniaksynthese sinkt mit steigender Temperatur.
Leite anhand des Massenwirkungsgesetzes ab, ob es sich bei der Ammoniaksynthese um eine exo- oder endotherme Reaktion handelt.
Gib die Einheit der Gleichgewichtskonstante an.
an.
Gib die Einheit der Gleichgewichtskonstante
(04 BE)
2
Mit der technischen Gewinnung von Ammoniak konnte 1922 die erste Produktionsanlage für die Herstellung von Harnstoff  in Betrieb genommen werden.
in Betrieb genommen werden.
Harnstoff ist ein Feststoff, der sich gut in Wasser löst. Erkläre einer der Eigenschaften anhand der LEWIS-Formel von Harnstoff.
Harnstoff ist ein Feststoff, der sich gut in Wasser löst. Erkläre einer der Eigenschaften anhand der LEWIS-Formel von Harnstoff.
(02 BE)
3
In wässrigen Lösungen liegt ein chemisches Gleichgewicht zwischen Ammoniak-Molekülen und Ammonium-Ionen vor.
3.1
Erläutere am Beispiel der Reaktion von Ammoniak mit Wasser die Säure-Base-Theorie nach BRØNSTED.
(03 BE)
3.2
Erkläre die Abhängigkeit der Gleichgewichtslage vom pH-Wert.
(02 BE)
4
Ammoniak wird u.a. zur Herstellung von Anilin (Benzenamin,  ) aus Phenol (Benzenol,
) aus Phenol (Benzenol,  ) eingesetzt.
) eingesetzt.
4.1
Entwickle für die beschriebene Reaktion die Reaktionsgleichung.
Verwende für die organischen Stoffe Strukturformeln.
Verwende für die organischen Stoffe Strukturformeln.
(01 BE)
4.2
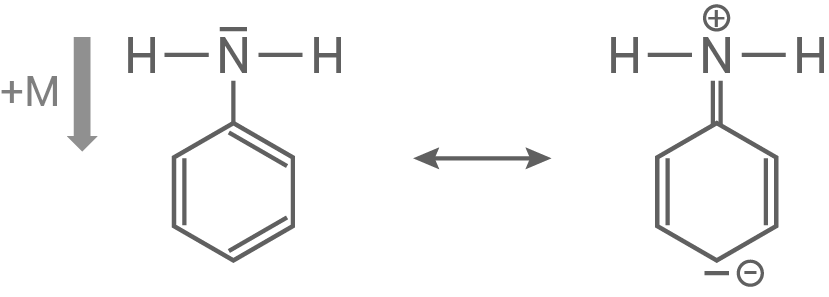
Anilin ist eine wesentlich schwächere Base als Ammoniak.
Erkläre diesen Sachverhalt mit deinen Kenntnissen über mesomere Effekte.
(02 BE)
(15 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Reaktionsgleichung für die Herstellung von Ammoniak



1.2
Gleichgewichtskonstante
Das Massenwirkungsgesetz (MWG) zeigt die Lage des chemischen Gleichgewichts und lässt sich wie folgt formulieren:
![\(\begin{array}[t]{rll}
K_c&=& \dfrac{(c_{\text{Produkte}})^\nu }{(c_{\text{Edukte}})^\nu } & \\[5pt]
&=& \dfrac{c^2_{NH_3}}{c_{N_2} \cdot c^3_{H_2}} & \\[5pt]
&=& \dfrac{\text{mol}^2 \cdot \text{L}^{-2}}{\text{mol} \cdot \text{L}^{-1} \cdot \text{mol}^3 \cdot \text{L}^{-3}} & \\[5pt]
&=& \text{L}^2 \cdot \text{mol}^{-2}
\end{array}\)](https://mathjax.schullv.de/dd544b5ea4caf873a3f9c7767e41940367d00417b9c9ff7ed38151d4adb999ac?color=5a5a5a)
- Der
-Wert beeinflusst die Ausbeute von Ammoniak bei der Ammoniaksynthese
- Ein kleinerer
-Wert führt zu einem kleineren Zähler und größeren Nenner im chemischen Gleichgewicht.
- Folglich führt eine steigende Temperatur zu weniger Ammoniak und die Rückreaktion wird begünstigt.
- Diese Reaktion ist also exotherm – niedrige Temperaturen begünstigen die Ammoniakbildung
- Das MWG zeigt
als Einheit von
2
Eigenschaften von Harnstoff
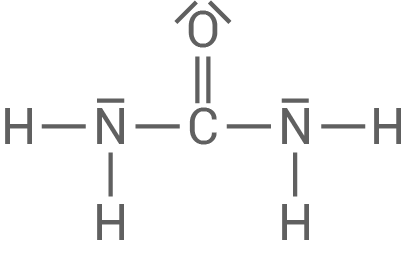

Lewis-Formel von Harnstoff
- Harnstoff ist aufgrund seiner polarisierten Atombindungen in Wasser gut löslich.
- Es werden Wasserstoffbrückenbindungen mit den Wassermolekülen ausgebildet, was zu einer besseren Löslichkeit führt.
- Die Festigkeit von Harnstoff als Feststoff wird durch die Ausbildung von
Wasserstoffbrückenbindungen am Sauerstoffatom erklärt.
- Diese Wasserstoffbrückenbindungen führen zu einer kristallinen Struktur.
3.1
Säure-Base-Theorie nach BRØNSTED
Die Säure-Base-Theorie nach BRØNSTED betrachtet auf Teilchenebene eine Säure als Protonendonator und eine Base als Protonenakzeptor. Im Zuge einer Säure-Base-Reaktion findet ein Protonenaustausch statt:
- Wasser fungiert hierbei als Säure und überträgt ein Proton auf das als Base reagierende Ammoniak.
- Das Wasser stellt hier den Protonendonator und das Ammoniak den Protonenakzeptor dar.
- Durch diesen Austausch wird das Wasser-Molekül zum Hydroxid-Ion, während das Ammoniak-Molekül zum Ammonium-Ion wird.
3.2
Abhängigkeit der Gleichgewichtslage vom pH-Wert
Der pH-Wert wird beschrieben durch folgenden Zusammenhang:
 Damit wird gezeigt:
Damit wird gezeigt:
- Je höher die Konzentration an Hydronium/Oxonium-Ionen
desto niedriger der pH-Wert.
- Je höher die Konzentration an Hydroxid-Ionen
, desto höher der pH-Wert.
- Ein hoher pH-Wert verschiebt demnach das chemische Gleichgewicht auf die linke Seite und begünstigt die Ammoniakbildung.
- Ein niedriger pH-Wert dagegen, verschiebt das chemische Gleichgewicht auf die Seite der Ammonium-Ionen.
4.1
Reaktionsgleichung für die Herstellung von Anilin


4.2
Erklärung der Basenstärke über die mesomeren Effekte
- Basen fungieren als Protonenakzeptoren.
- Während Ammoniak in der Lage ist, ein weiteres Proton durch sein nicht bindendes Elektronenpaar aufzunehmen, ist dies bei Anilin erschwert.
- Der
-Effekt des Stickstoffatoms erweitert das bestehende Mesomerie des Kohlenstoffrings und hemmt dadurch die Protonenaufnahme am Stickstoffatom.
- Dies führt dazu, dass Anilin als Base eine geringere Stärke aufweist. Anilin: