Teil C – Experimente: Metalle und Säuren, Alkohole und Ester
Hinweis: Von den nachfolgenden Aufgabenteilen C1 und C2 soll in der Prüfung nur einer bearbeitet werden.
Aufgabe C1
Metalle finden u.a. bei elektrochemischen Prozessen weitreichende Anwendung.
1
Beschreibe anhand einer Modellvorstellung den Bau von Metallen.
(02 BE)
2
Experiment A
Baue eine galvanische Zelle aus zwei Kupfer-Halbzellen mit je ca. Kupfer
Kupfer -sulfatlösung
-sulfatlösung  auf. Gib anschließend in eine der beiden Kupfer-Halbzellen ca.
auf. Gib anschließend in eine der beiden Kupfer-Halbzellen ca.  Ammoniaklösung und miß nach dem Umrühren die Zellspannung.
Ammoniaklösung und miß nach dem Umrühren die Zellspannung.
Baue eine galvanische Zelle aus zwei Kupfer-Halbzellen mit je ca.
2.1
Führe das Experiment durch. Gib deine Beobachtungen sowie den Messwert an.
(03 BE)
2.2
Erläutere die Veränderung der Zellspannung nach Zugabe der Ammoniaklösung.
Hinweis: Die Zellspannung beträgt vor der Zugabe der Ammoniaklösung 
(03 BE)
3
Bestimme kalorimetrisch die Reaktionsenthalpie der elektrochemischen Fällung (Zementation) von Kupfer aus einer Kupfer -sulfatlösung mit Zink.
Experiment B
-sulfatlösung mit Zink.
Experiment B
Versetze in einem Kalorimetergefäß einer Kupfer
einer Kupfer -sulfatlösung der Stoffmengenkonzentration
-sulfatlösung der Stoffmengenkonzentration  mit der bereitgestellten Menge Zinkpulver im Überschuss.
mit der bereitgestellten Menge Zinkpulver im Überschuss.
Bestimme die Temperaturänderung. Hinweis: Die Dichte und die spezifische Wärmekapazität der Lösung entsprechen näherungsweise denen von Wasser. Der Kalorimeterwert bleibt unberücksichtigt.
Versetze in einem Kalorimetergefäß
Bestimme die Temperaturänderung. Hinweis: Die Dichte und die spezifische Wärmekapazität der Lösung entsprechen näherungsweise denen von Wasser. Der Kalorimeterwert bleibt unberücksichtigt.
3.1
Führe das Experiment durch. Gibt deine Messwerte an.
(02 BE)
3.2
Berechne aus den Ergebnissen deiner kalorimetrischen Bestimmung die molare Reaktionsenthalpie der durchgeführten Zementation.
(02 BE)
3.3
Erläutere die elektrochemischen Grundlagen der durchgeführten Zementation.
(03 BE)
(15 BE)
Aufgabe C2
Säuren und Alkohole sind Ausgangsstoffe zur Herstellung von Estern. Ethansäure- und Methansäureester dienen u.a. als Lösungsmittel.
1
Untersuche einen der Ausgangsstoffe. Dieser wird dir in Gefäß I bereitgestellt.
1.1
Experiment A
Bestätige experimentell, dass es sich bei der bereitgestellten Lösung um eine verdünnte Säurelösung handelt.
Wähle dazu aus den gegebenen Chemikalien eine aus und fordere diese an.
Bestätige experimentell, dass es sich bei der bereitgestellten Lösung um eine verdünnte Säurelösung handelt.
Wähle dazu aus den gegebenen Chemikalien eine aus und fordere diese an.
Chemikalien:
Calciumcarbonatstücke, Kupferspan, Magnesiumspan
Führe das Experiment durch. Gib deine Beobachtungen an.
Calciumcarbonatstücke, Kupferspan, Magnesiumspan
(02 BE)
1.2
Erläutere deine Beobachtungen bei Experiment A.
(01 BE)
1.3
Im Gegensatz zu Ethansäure wirkt Methansäure reduzierend.
Experiment B
Untersuche, welche der beiden genannten Säuren sich im Gefäß I befindet. Dir steht dafür konzentrierte Schwefelsäure und verdünnte Kaliumpermanganatlösung zur Verfügung. Führe das Experiment durch. Gib deine Beobachtungen an.
Untersuche, welche der beiden genannten Säuren sich im Gefäß I befindet. Dir steht dafür konzentrierte Schwefelsäure und verdünnte Kaliumpermanganatlösung zur Verfügung. Führe das Experiment durch. Gib deine Beobachtungen an.
(02 BE)
1.4
Entscheide, um welche der beiden Säuren es sich bei Experiment B handelt.
Begründe.
Begründe.
(02 BE)
2
Einen Hinweis auf das Vorliegen eines Esters erhält man durch folgendes Experiment.
2.1
Experiment C
Versetze ca. Ethansäureethylester in einem Reagenzglas mit zwei Tropfen Phenolphthaleinlösung. Gib anschließend zwei Tropfen Natriumhydroxidlösung in das Reagenzglas.
Ethansäureethylester in einem Reagenzglas mit zwei Tropfen Phenolphthaleinlösung. Gib anschließend zwei Tropfen Natriumhydroxidlösung in das Reagenzglas.
Erwärme das Stoffgemisch in einem Wasserbad auf ca. Entnimm das Reagenzglas dem Wasserbad in kurzen Zeitabständen und schüttle die Lösung. Gib nach einer sichtbaren Veränderung des Stoffgemisches nochmals zwei Tropfen Natriumhydroxidlösung in das Reagenzglas. Erwärme und schüttle erneut.
Führe das Experiment durch. Gib deine Beobachtungen an.
Entnimm das Reagenzglas dem Wasserbad in kurzen Zeitabständen und schüttle die Lösung. Gib nach einer sichtbaren Veränderung des Stoffgemisches nochmals zwei Tropfen Natriumhydroxidlösung in das Reagenzglas. Erwärme und schüttle erneut.
Führe das Experiment durch. Gib deine Beobachtungen an.
Versetze ca.
Erwärme das Stoffgemisch in einem Wasserbad auf ca.
(02 BE)
2.2
Erläutere deine Beobachtungen bei Experiment C.
(03 BE)
3
Ein positiver Verlauf der Iodoformprobe ist ein Hinweis auf das Vorliegen von Ethanol.
Bei der Reaktion von Ethanol mit Iod und Kaliumhydroxid entstehen Iodoform (Triiodmethan), das Kaliumsalz der Methansäure (Kaliummethanoat), Kaliumiodid und Wasser.
3.1
Entwickle die Reaktionsgleichung.
(01 BE)
3.2
Leite den Hybridisierungzustand des Kohlenstoff-Atoms aus dem Bau des Iodoform-Moleküls ab.
(02 BE)
(15 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Lösung C1
1
Bau von Metallen
- Metallatome sind regelmäßig im Metallgitter angeordnet und geben dabei ihre Außenelektronen ab, wodurch sie zu positiv geladenen Metall-Ionen werden.
- Die abgegebenen Elektronen bilden das Elektronengas, das im Metallgitter frei beweglich ist.
- Es wirken starke Anziehungskräfte zwischen den freien Elektronen und den Metall-Ionen.
2.1
Experiment A
Aufbau einer galvanischen Zelle aus zwei Kupfer-Halbzellen mit je ca. Kupfer
Kupfer -sulfatlösung.
-sulfatlösung.
Vor Zugabe der Ammoniaklösung beträgt die Zellspannung Beobachtungen: Wird in eine der beiden Kupfer-Halbzellen eine Ammoniaklösung gegeben, entsteht ein blauer Niederschlag. Durch Umrühren löst sich der Niederschlag wieder auf und verfärbt die Lösung tiefblau.
Messung der Zellspannung: Nachdem die Ammoniaklösung zugegeben wurde, beträgt die Zellspannung
Beobachtungen: Wird in eine der beiden Kupfer-Halbzellen eine Ammoniaklösung gegeben, entsteht ein blauer Niederschlag. Durch Umrühren löst sich der Niederschlag wieder auf und verfärbt die Lösung tiefblau.
Messung der Zellspannung: Nachdem die Ammoniaklösung zugegeben wurde, beträgt die Zellspannung 
Aufbau einer galvanischen Zelle aus zwei Kupfer-Halbzellen mit je ca.
Vor Zugabe der Ammoniaklösung beträgt die Zellspannung
2.2
Veränderung der Zellspannung
- Durch Zugabe der Ammoniaklösung wurde die Kupfer
-Ionen-Konzentration in der entsprechenden Halbzelle verringert, wodurch eine Anode entstand, die mehr Kupfer lösen konnte.
- Die andere Halbzelle fungierte als Kathode, wobei eine messbare Spannung entstand und ein Konzentrationsgefälle erzeugt wurde.
- Somit wurde ein Konzentrationselement ausgebildet.
- Die zugehörige Reaktionsgleichung lautet:
3.1
Bestimme kalorimetrisch die Reaktionsenthalpie der elektrochemischen Fällung (Zementation) von Kupfer aus einer Kupfer -sulfatlösung mit Zink.
Experiment B
-sulfatlösung mit Zink.
Experiment B
Reaktion einer Kupfer -sulfatlösung mit einem Überschuss an Zinkpulver in einem Kalorimeter.
Messwert (hier) :
-sulfatlösung mit einem Überschuss an Zinkpulver in einem Kalorimeter.
Messwert (hier) : 
Reaktion einer Kupfer
3.2
Berechnung der molaren Reaktionsenthalpie
Mit der kalorimetrischen Grundgleichung ergibt sich für die Berechnung:
Die Reaktionsenthalpie für die durchgeführten Zementation beträgt ca. 
3.3
Elektrochemische Grundlage der Zementation
Es findet folgende Reaktion statt:



- Chemische Zementation beschreibt das Ausfällen eines edleren Metalls aus einer Lösung durch ein weniger edles Metall, das elektrochemisch vor dem ausgefällten Metall in der Spannungsreihe steht und an seiner Stelle in Lösung geht.
- Zink ist unedler als Kupfer und besitzt ein geringeres Elektrodenpotenzial:
- Dadurch kann Zink das edlere Metall Kupfer aus einer Salzlösung ausfällen – Zink geht also als Zink
-Ion in Lösung und Kupfer fällt aus.
Lösung C2
1.1
Experiment A
Anforderung: Magnesiumspan oder Calciumcarbonatstücke;
Kupferspan ist hier nicht geeignet, da Kupfer ein zu positives Elektrodenpotenzial besitzt. Durchführung: Magnesiumspan oder Calciumcarbonatstücke in eine verdünnte Säurelösung geben. Beobachtung: Es entwickelt sich ein Gas.
Anforderung: Magnesiumspan oder Calciumcarbonatstücke;
Kupferspan ist hier nicht geeignet, da Kupfer ein zu positives Elektrodenpotenzial besitzt. Durchführung: Magnesiumspan oder Calciumcarbonatstücke in eine verdünnte Säurelösung geben. Beobachtung: Es entwickelt sich ein Gas.
1.2
Erläuterung der Beobachtungen
Wird Magnesium in verdünnte Säure gegeben, entsteht gasförmiger Wasserstoff:


 oder
Wird Calciumcarbonat in verdünnte Säure gegeben, entsteht gasförmiger Kohlenstoffdioxid:
oder
Wird Calciumcarbonat in verdünnte Säure gegeben, entsteht gasförmiger Kohlenstoffdioxid:



1.3
Experiment B
Durchführung: Es werden eine verdünnte Kaliumpermanganatlösung und einige Tropfen Schwefelsäure zu der sich in Gefäß I befindenden Säure gegeben. Beobachtung: Die Kaliumpermanganatlösung entfärbt sich nicht.
Durchführung: Es werden eine verdünnte Kaliumpermanganatlösung und einige Tropfen Schwefelsäure zu der sich in Gefäß I befindenden Säure gegeben. Beobachtung: Die Kaliumpermanganatlösung entfärbt sich nicht.
1.4
Entscheidung für Experiment B
- Es ist keine Entfärbung beobachtbar, womit keine Reaktion stattfindet.
- Würde es sich um Methansäure handeln, hätte seine reduzierende Wirkung die Lösung entfärbt – in Gefäß I befindet sich also Ethansäure, deren Carboxylgruppe nicht reduzierend wirkt.
2.1
Experiment C
Beobachtung: Die Lösung verfärbt sich nach Zugabe von Natriumhydroxid rot und entfärbt sich anschließend wieder.
Beobachtung: Die Lösung verfärbt sich nach Zugabe von Natriumhydroxid rot und entfärbt sich anschließend wieder.
2.2
Erläuterung der Beobachtungen
- Wird die Natriumhydroxidlösung zu Ethansäureethylester mit Phenolphthalein gegeben, verfärbt sich das Gemisch rot.
- Beim Erwärmen spaltet die Lauge den Ester und verbraucht dabei das Natriumhydroxid.
- Daraufhin entfärbt sich die Lösung.

3.1
Reaktionsgleichung


3.2
Hybridisierungzustand des Kohlenstoff-Atoms
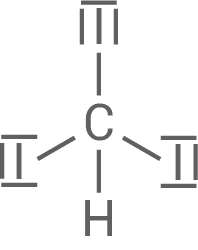
- Das Kohlenstoff-Atom im Iodoform (Triiodmethan) bildet immer vier Bindungen und benötigt dafür eine
-Hybridisierung.
- Es gibt jeweils eine
-Bindung zwischen dem Kohlenstoff-Atom und den drei Iodatomen bzw. dem Wasserstoffatom.
- Die Größe der Iodatome verursacht einen gestauchten tetraedrischen Bindungswinkel im Molekül.

Idoform (Triiodmethan)