Teil B – Silber
1
Elementares Silber kann aus Silbererzen durch Cyanidlaugerei gewonnen werden. Aus einer Lösung mit Dicyanidoargentat -Ionen entstehen durch Ausfällung mit Zink Tetracyanidozinkat
-Ionen entstehen durch Ausfällung mit Zink Tetracyanidozinkat -Ionen und Silber.
Entwickle die Reaktionsgleichung in Ionenschreibweise.
-Ionen und Silber.
Entwickle die Reaktionsgleichung in Ionenschreibweise.
Beschreibe mithilfe einer Modellvorstellung die chemische Bindung in einem komplexen Ion.
Beschreibe mithilfe einer Modellvorstellung die chemische Bindung in einem komplexen Ion.
(03 BE)
2
Silber kommt in der Natur elementar oder in verschiedenen Verbindungen vor. Qualitative Untersuchungen des Erzes Stephanit ergaben die elementare Zusammensetzung 
Die quantitative Analyse einer Stoffprobe lieferte folgende Werte:
Berechne die Verhältnisformel von Stephanit.
Die quantitative Analyse einer Stoffprobe lieferte folgende Werte:
| Masse der Silber |
|
| Masse der Antimon |
|
| Masse der Sulfid-Ionen: |
(02 BE)
3
Aufgrund der antibakteriellen Wirkung verschiedener Silberverbindungen werden u. a. medizinische Gefäßprothesen damit beschichtet. Dies erfolgt z.B. durch das Aufbringen von Silber -acetat (Silber
-acetat (Silber -ethanoat) auf die aus einem Polyester hergestellten Prothesen. Ausgangsstoffe für die Herstellung des Polyesters Dacron® sind Ethan-1,2-diol und Terephthalsäure.
-ethanoat) auf die aus einem Polyester hergestellten Prothesen. Ausgangsstoffe für die Herstellung des Polyesters Dacron® sind Ethan-1,2-diol und Terephthalsäure.
3.1
Entwickle einen Strukturausschnitt dieses Kunststoffs.
Begründe die Zuordnung des Polyesters Dacron® zu einer Kunststoffklasse.
Begründe die Zuordnung des Polyesters Dacron® zu einer Kunststoffklasse.
3.2
Mehr als  Silber
Silber -acetat führen im menschlichen Organismus zu Vergiftungserscheinungen.
Berechne das notwendige Volumen an Wasser zum Lösen dieser Masse.
-acetat führen im menschlichen Organismus zu Vergiftungserscheinungen.
Berechne das notwendige Volumen an Wasser zum Lösen dieser Masse.
(03 BE)
4
Silber -azid
-azid  ist eine hoch explosive Stickstoffverbindung des Silbers. Beim exothermen Zerfall entstehen Silber und Stickstoff.
ist eine hoch explosive Stickstoffverbindung des Silbers. Beim exothermen Zerfall entstehen Silber und Stickstoff.
4.1
Entwickle die Reaktionsgleichung für den Zerfall des Silber -azids. Stelle die Zusammenhänge zwischen der Änderung der inneren Energie, der Reaktionsenthalpie und der Volumenarbeit am Beispiel dieser Reaktion grafisch dar.
-azids. Stelle die Zusammenhänge zwischen der Änderung der inneren Energie, der Reaktionsenthalpie und der Volumenarbeit am Beispiel dieser Reaktion grafisch dar.
(03 BE)
4.2
Gib eine LEWIS-Formel des linearen Azid-Ions an.
(01 BE)
5
Die Bestimmung von Stoffmengenkonzentrationen an Silber -Ionen in stark verdünnten Lösungen kann z.B. elektrochemisch erfolgen.
-Ionen in stark verdünnten Lösungen kann z.B. elektrochemisch erfolgen.
Das betrachtete Konzentrationselement besteht aus einer Standard-Silberhalbzelle (Halbzelle A) und einer zweiten Silberhalbzelle (Halbzelle B) mit wechselnder Stoffmengenkonzentration an Silber -Ionen, die jeweils geringer als in der Standardhalbzelle ist.
-Ionen, die jeweils geringer als in der Standardhalbzelle ist.
Das betrachtete Konzentrationselement besteht aus einer Standard-Silberhalbzelle (Halbzelle A) und einer zweiten Silberhalbzelle (Halbzelle B) mit wechselnder Stoffmengenkonzentration an Silber
5.1
Beschreibe die Ausbildung des Elektrodenpotenzials in einer Silberhalbzelle.
(03 BE)
5.2
Skizziere das Konzentrationselement. Beschrifte die Skizze.
(02 BE)
5.3
Für das Konzentrationselement wurde aus den Messwerten folgende Graphik erstellt.
Interpretiere die graphische Darstellung.
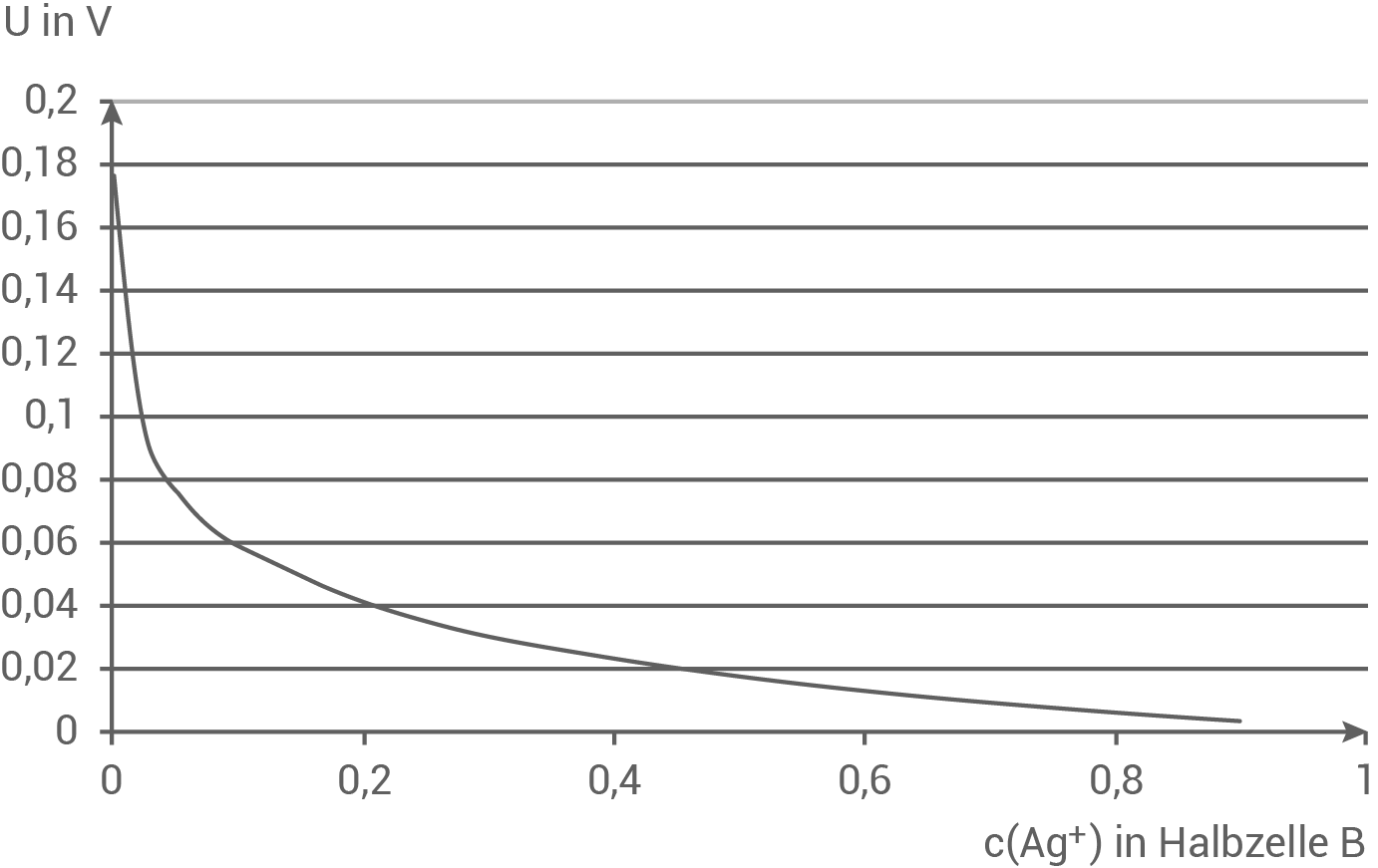

(03 BE)
5.4
Berechne die Stoffmengenkonzentration der Silber -Ionen in der Halbzelle B bei
-Ionen in der Halbzelle B bei 
Wähle eine der Aufgaben 6 oder 7 aus und bearbeite diese.
(02 BE)
6
Lichtempfindliche Silbersalze werden u.a. in hochwertigen Filmen analoger Kameras eingesetzt. Zum Entwickeln der Filme verwendet man Hydrochinon (Benzen-1,4-diol).
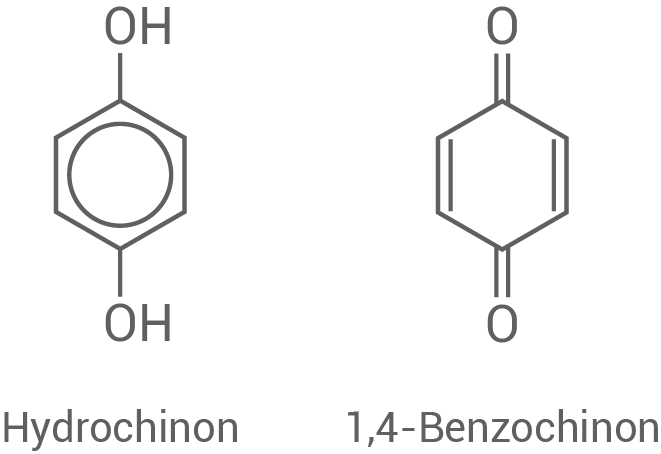

6.1
Bei der Entwicklung der Filme werden Silber -Ionen reduziert. Hydrochinon wird dabei im basischen Milieu zu 1,4-Benzochinon oxidiert.
Entwickle für diese Reaktion die Reaktionsgleichung in Ionenschreibweise.
-Ionen reduziert. Hydrochinon wird dabei im basischen Milieu zu 1,4-Benzochinon oxidiert.
Entwickle für diese Reaktion die Reaktionsgleichung in Ionenschreibweise.
(01 BE)
6.2
Begründe, dass sich trotz annähernd gleicher molarer Massen die Schmelztemperaturen von Hydrochinon und 1,4-Benzochinon um mehr als  unterscheiden.
unterscheiden.
(02 BE)
6.3
Hydrochinon und Resorcin (Benzen-1,3-diol) sind isomere Verbindungen.
Erläutere am Beispiel der beiden Stoffe diesen Sachverhalt.
(02 BE)
7
Silber reagiert mit konzentrierter Salpetersäure nach folgender Reaktionsgleichung.




7.1
Berechne die molare Standardreaktionsenthalpie.
(02 BE)
7.2
Beurteile mithilfe der GIBBS-HELMHOLTZ-Gleichung den freiwilligen Ablauf der Reaktion unter Standardbedingungen.
(03 BE)
(30 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Reaktionsgleichung
![\(2\,[Ag(CN)_2]^- + Zn \)](https://mathjax.schullv.de/fa1cc27f3e9714ff6f57a58ec561f14c9e6352b442d13cf1086e32cc90458135?color=5a5a5a)

![\([Zn(CN)_4]^{2-} + 2\,Ag\)](https://mathjax.schullv.de/07c4aa052bc4fc92cbbc4d526c1d95cc79bbeff638ef1e68b2e2e17471fc0ca6?color=5a5a5a) Chemische Bindung in einem komplexen Ion (nur eine Modellvorstellung verlangt)
Chemische Bindung in einem komplexen Ion (nur eine Modellvorstellung verlangt)
- Modell der elektrostatischen Wechselwirkung:
Die Bildung des komplexen Ions basiert auf der elektrostatischen Anziehung zwischen dem positiv geladenen Zentral-Ion
bzw.
und den negativ geladenen Liganden
- Modell der koordinativen Bindung: Hier basiert die Bildung des komplexen Ions auf gemeinsamen Elektronenpaaren, also koordinativen Bindungen zwischen dem Zentral-Ion und dem Liganden, wobei die Bindungselektronen aus einem freien Elektronenpaar des Liganden stammen.
2
Berechnung der Verhältnisformel von Stephanit
Die Verhältnisformel ergibt sich aus den Stoffmengen:
Es gilt nun, dass die kleinste Stoffmenge die Atomzahl  erhält.
erhält.
Daraus folgt das Verhältnis der Atomzahlen: Für die Verhältnisformel ergibt sich also:
Daraus folgt das Verhältnis der Atomzahlen: Für die Verhältnisformel ergibt sich also:
3.1
Strukturausschnitt
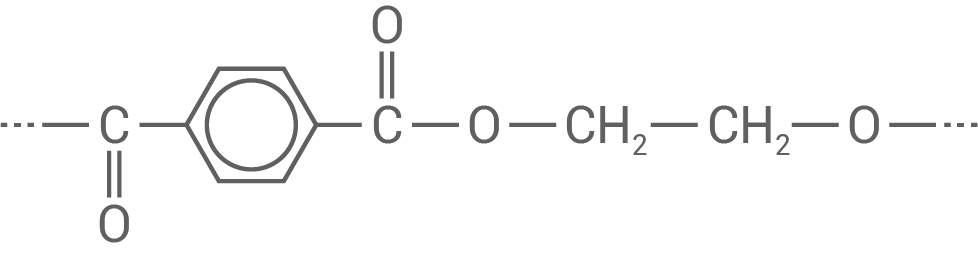 Zuordnung zu einer Kunststoffklasse
Zuordnung zu einer Kunststoffklasse

- Dieses Polymer wird durch Veresterung aus Terephtalsäure und Ethandiol gebildet, wobei Wasser abgespalten wird.
- Es entstehen lange, unverzweigte Ketten – diese Struktur ist charakteristisch für thermoplastisches Verhalten.
- Beim Polyester Dacron® handelt es sich um ein thermoplastisches Polykondensat.
3.2
Berechnung des Volumens
Für die Berechnung wird zunächst die Reaktionsgleichung betrachtet:


 Weiterhin gilt basierend auf dem Löslichkeitsprodukt:
Weiterhin gilt basierend auf dem Löslichkeitsprodukt:
![\(\begin{array}[t]{rll}
c(Ag^+)&=& c(CH_3COO^-) & \\[5pt]
&=& c_0(AgCH_3COO)& \\[5pt]
&=& \sqrt{K_L(AgCH_3COO)}& \\[5pt]
&=& \sqrt{2,0 \cdot 10^{-3} \,\text{mol}^2 \cdot \text{L}^{-2} } & \\[5pt]
&=& 0,0447 \,\text{mol} \cdot \text{L}^{-1}
\end{array}\)](https://mathjax.schullv.de/75be103ffe9e102a1a92053f7e0e527932298150c7db20aa25afb430a3295ed7?color=5a5a5a)
![\(\begin{array}[t]{rll}
m{Ag^+}&=& n(Ag^+) \cdot M(AgCH_3COO) & \\[5pt]
&=& 0,0447 \,\text{mol} \cdot 167 \,\text{g} \cdot \text{mol}^{-1} & \\[5pt]
&=& 7,465 \,\text{g}
\end{array}\)](https://mathjax.schullv.de/1f7f2b9bf081a44a33ab1399ee8113314965b19e1d52996654acfacf38fdd2ea?color=5a5a5a) Es lösen sich also
Es lösen sich also  Silberacetat, bezogen auf
Silberacetat, bezogen auf  Wasser.
Damit folgt:
Wasser.
Damit folgt:

![\(\begin{array}[t]{rll}
V&=&\dfrac{0,75\,\text{g} \cdot \,\text{L}}{7,465\,\text{g}} & \\[5pt]
&=& 0,1005\,\text{L} & \\[5pt]
&\approx& 100\,\text{mL}
\end{array}\)](https://mathjax.schullv.de/b2de2494a1637888c788206dbb0becd4f9fc8ffbbc178076764babd7dea0a311?color=5a5a5a)
4.1
Reaktionsgleichung für den Zerfall des Silber -azids
-azids


 Darstellung der Zusammenhänge
Darstellung der Zusammenhänge
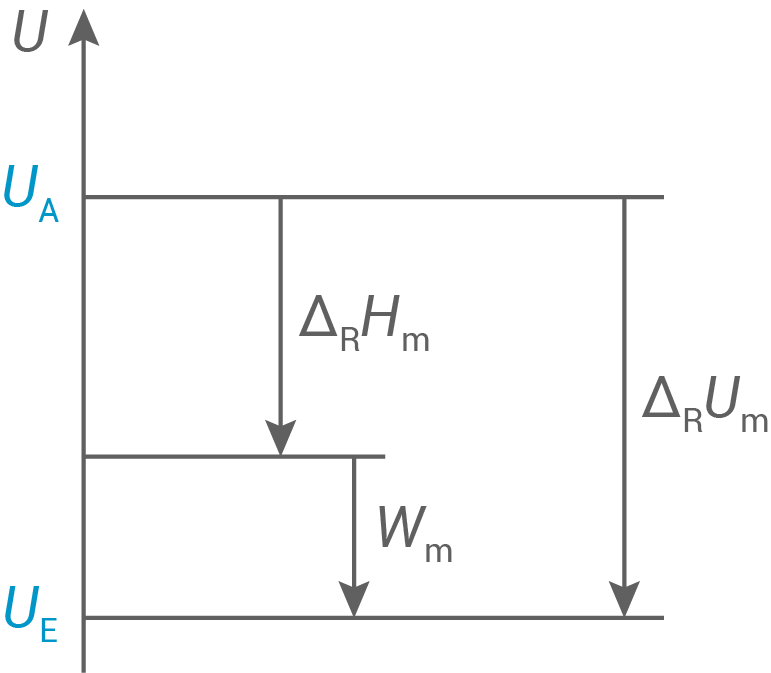

| innere Energie der Stoffe vor der Reaktion | |
| innere Energie der Stoffe am Ende der Reaktion |
- Die Reaktion (Explosion) findet unter isobaren Bedingungen statt.
- Die molare Reaktionsenergie
setzt sich aus der molaren Reaktionsenthalpie
und der Volumenarbeit
zusammen.
- Die innere Energie wird bei einer Explosion kleiner und die Volumenarbeit erhält ein negatives Vorzeichen, da das Stickstoffgas schnell expandiert und dabei die Luft nach außen verdrängt.
4.2
LEWIS-Formel des linearen Azid-Ions


5.1
Ausbildung des Elektrodenpotenzials
- Das Elektrodenpotenzial resultiert aus der Bildung einer elektrochemischen Doppelschicht, welche sich bildet, wenn eine Silberelektrode in eine wässrige Silbersalzlösung getaucht wird.
- Hierbei gehen die Silber-Ionen durch Elektronenabgabe der Silberatome im Blech in geringem Maße in Lösung.
- Die positiv geladenen Ladungsträger in der Lösung ziehen sich an, während die Elektronen, die bei der Oxidation abgegeben werden, im Metall verbleiben und dieses negativ aufladen.
- Aufgrund der entgegengesetzten Ladungen befinden sich die negativen Ladungen hauptsächlich auf der Metalloberfläche, während an der Metalloberfläche in der Lösung eine Schicht positiv geladener, hydratisierter Silber-Ionen entsteht.
- Die Trennung der Ladungen in den beiden Schichten resultiert in einem Potenzial zwischen dem Metall und der Elektrolytlösung.
5.2
Skizze des Konzentrationselements
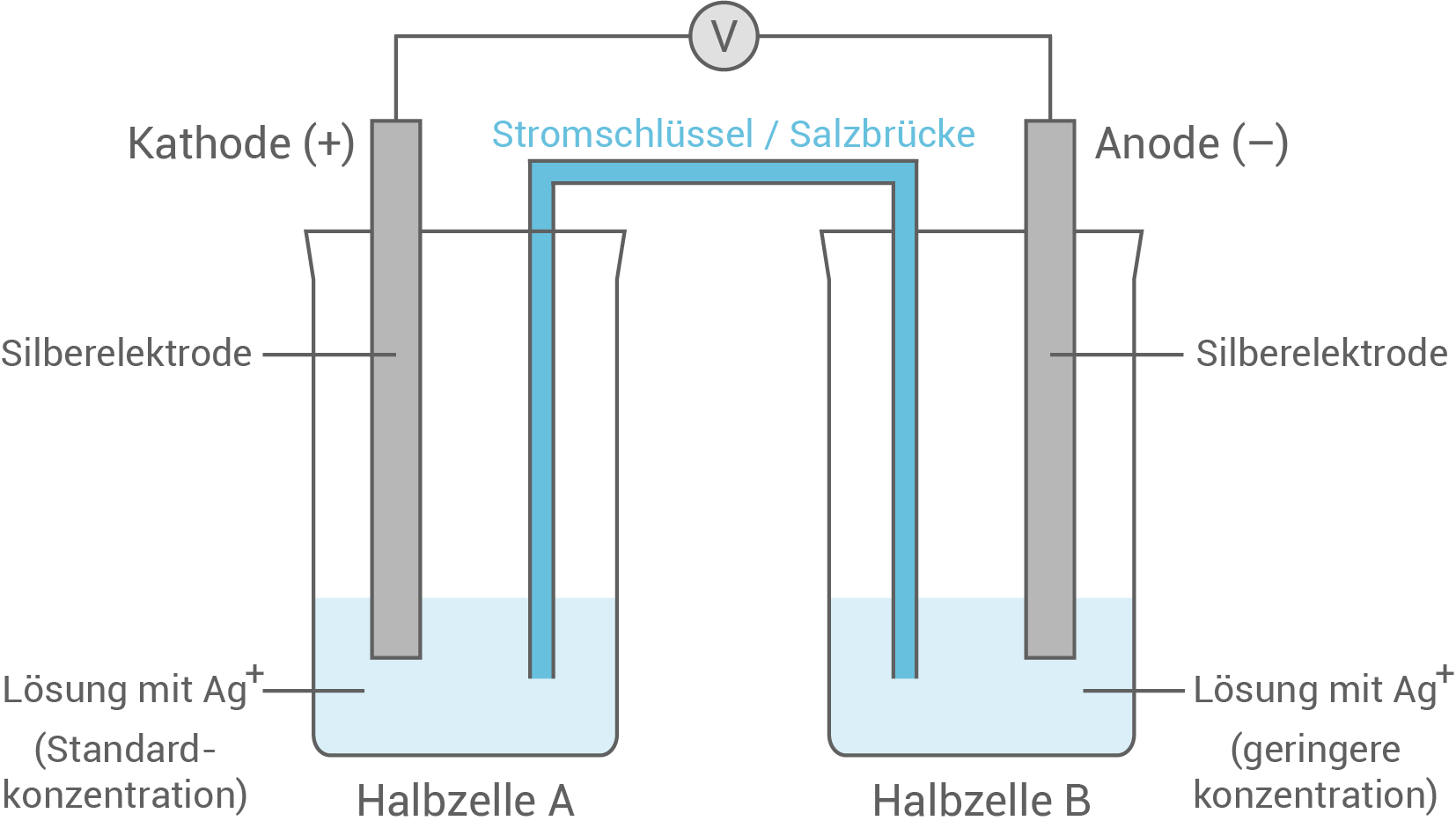

5.3
Interpretation der graphischen Darstellung
- Das vorliegende Diagramm zeigt die gemessene Zellspannung im Konzentrationselement in Abhängigkeit von der Stoffmengenkonzentration der Silber-Ionen in Halbzelle B.
- Es ist zu sehen, dass mit zunehmendem höherer Silber-Ionen-Gehalt in Halbzelle B, die Zellspannung sinkt.
- Die Zellspannung
wird durch die Differenz des Elektrodenpotenzials zwischen der Kathode und der Anode definiert:
- Die Standard-Silberhalbzelle ist immer die Kathode, da sie eine höhere Konzentration an Silber-Ionen aufweist.
- Mit zunehmender Konzentration der Silber-Ionen in Halbzelle B steigt deren Elektrodenpotenzial, was zur Abnahme der Differenz der Elektrodenpotenziale von Kathode und Anode führt und somit zur Verringerung der Zellspannung.
5.4
Berechnung der Stoffmengenkonzentration der Silber -Ionen
Zunächst wird aus der gegebenen Zellspannung das Elektrodenpotenzial berechnet:
-Ionen
Zunächst wird aus der gegebenen Zellspannung das Elektrodenpotenzial berechnet:

![\(\begin{array}[t]{rll}
E(Ag/Ag^+)&=& E^0(Ag/Ag^+) - \Delta U &\\[5pt]
&=& 0,8\,\text{V} - 0,177\,\text{V} &\\[5pt]
&=& 0,623 \,\text{V}
\end{array}\)](https://mathjax.schullv.de/11aa0a5ab782e6d8904fce8c3801ce94675f600dd4cd57d8e512a79d77aade6c?color=5a5a5a) Mit der NERNST-Gleichung ergibt sich nun:
Die Stoffmengenkonzentration der Silber
Mit der NERNST-Gleichung ergibt sich nun:
Die Stoffmengenkonzentration der Silber -Ionen beträgt bei einer Zellspannung von
-Ionen beträgt bei einer Zellspannung von  also
also 
6.1
Reaktionsgleichung
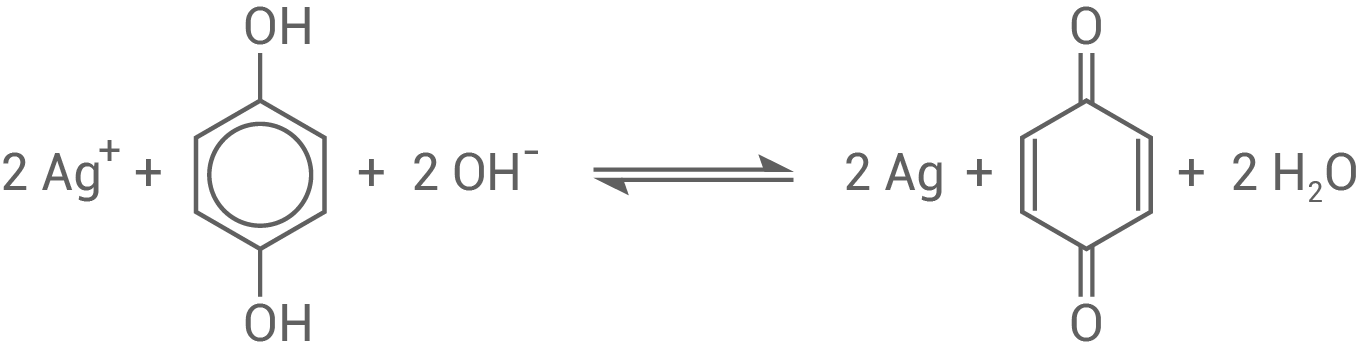
6.2
Begründung der unterschiedlichen Schmelztemperaturen
- Aufgrund der starken Polarität der Bindung zwischen dem Sauerstoff- und Wasserstoffatom der Hydroxylgruppe im Hydrochinon können sich zwischen den Molekülen starke Wasserstoffbrückenbindungen bilden.
- Im Gegensatz dazu wirken zwischen den Molekülen des 1,4-Benzochinons aufgrund der weniger polaren Bindung zwischen dem Sauerstoff- und Kohlenstoffatom nur deutlich schwächere Dipol-Dipol-Wechselwirkungen.
- Dies führt dazu, dass der Schmelzpunkt des Hydrochinons im Vergleich zum 1,4-Benzochinon um
höher liegt.
6.3
Erläuterung isomerer Verbindungen
- Isomere Verbindungen sind chemische Verbindungen, die sich in ihrer chemischen Struktur unterscheiden, aber die gleiche Summenformel haben.
- Hydrochinon (links) und Resorcin (rechts) besitzen beide die Summenformel
unterscheiden sich jedoch in der Verknüpfung der Atome:
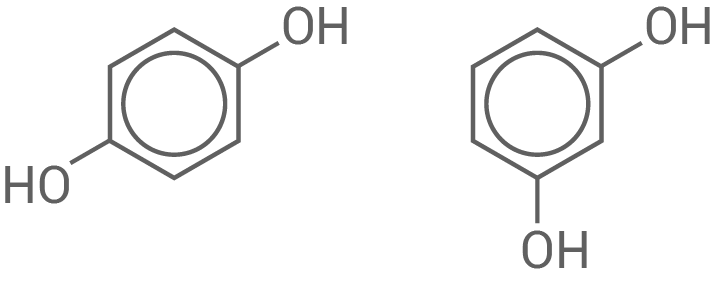
- Die Strukturen zeigen verschiedene Stellungen der Hydroxylgruppen.
- Bei den beiden Verbindungen handelt es sich um Konstitutionsisomere, genauer gesagt Stellungsisomere.
7.1
Berechnung der molaren Standardreaktionsenthalpie
Für die Berechnung gilt der Satz von HESS:
Im Anhang sind die molaren Standarbildungsenthalpien der Ausgangsstoffe  und der Reaktionsprodukte
und der Reaktionsprodukte  gegeben. Die molaren Standarbildungsenthalpien von Elementen sind Null.
Für die Reaktion von Silber mit konz. Salpetersäure beträgt die molare Standardreaktionsenthalpie also
gegeben. Die molaren Standarbildungsenthalpien von Elementen sind Null.
Für die Reaktion von Silber mit konz. Salpetersäure beträgt die molare Standardreaktionsenthalpie also 
7.2
Beurteilung des freiwilligen Ablaufs
Für die Beurteilung wird die GIBBS-HELMHOLTZ-Gleichung betrachtet:

- Ist
für eine Reaktion
ist sie exergonisch und läuft freiwillig ab;
beiist die Reaktion endergonisch und läuft nicht freiwillig ab.
- Bei dieser Reaktion nimmt die Enthalpie zu
sie ist endotherm;
Die Entropie nimmt ebenfalls zuder Ordnungszustand nimmt ab
- Damit diese Silberreaktion also freiwillig abläuft
muss folgende Bedingung erfüllt sein:
- Unter Standardbedingungen ergibt sich:
- Damit ist die Bedingung erfüllt und die Reaktion von Silber mit konz. Salpetersäure verläuft unter Standardbedingungen freiwillig ab – sie ist exergonisch.