Teil A – Sorbinsäure
Sorbinsäure  ist eine ungesättigte Carbonsäure. Sie wird u. a. als Lebensmittelzusatzstoff (E 200, Konservierungsstoff) verwendet.
ist eine ungesättigte Carbonsäure. Sie wird u. a. als Lebensmittelzusatzstoff (E 200, Konservierungsstoff) verwendet.
1
Gib den systematischen Namen von Sorbinsäure an. Beurteile, ob es sich bei Sorbinsäure um eine optisch aktive Verbindung handelt.
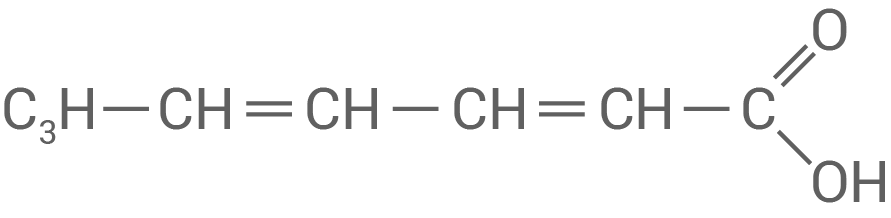
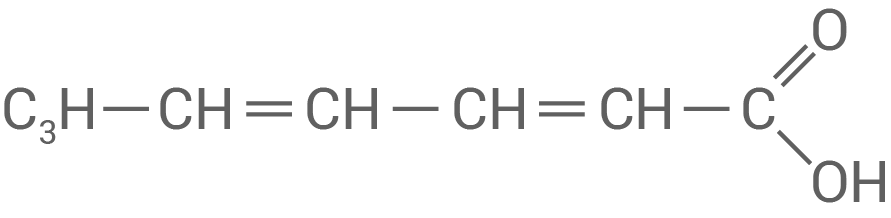
Sorbinsäure
(02 BE)
2
Ein Kohlenstoffatom im Sorbinsäure-Molekül ist  -hybridisiert.
Erläutere ausgehend vom Grundzustand eines Kohlenstoff-Atoms die Ausbildung dieses Hybridisierungszustands.
-hybridisiert.
Erläutere ausgehend vom Grundzustand eines Kohlenstoff-Atoms die Ausbildung dieses Hybridisierungszustands.
(03 BE)
3
Sorbinsäure löst sich in Wasser. Die Löslichkeit ist u.a. vom pH-Wert abhängig.
3.1
Entwickle die Reaktionsgleichung für die Protolyse von Sorbinsäure in Wasser.
Gib die Gleichung für das Massenwirkungsgesetz an.
Gib die Gleichung für das Massenwirkungsgesetz an.
(02 BE)
3.2
Begründe den Einfluss der Zugabe von Basen bzw. Säuren auf die Löslichkeit der Sorbinsäure.
(02 BE)
4
Erläutere einen Nachweis für Mehrfachbindungen zwischen den Kohlenstoff-Atomen im Sorbinsäure-Molekül. Verwende Strukturformeln.
(03 BE)
5
Neben Sorbinsäure wird auch Benzoesäure  als Konservierungsstoff eingesetzt. Benzoesäure kann technisch aus Toluol (Methylbenzen) durch eine katalytische Reaktion mit Luftsauerstoff hergestellt werden. Als Nebenprodukt entsteht Wasser.
Entwickle die Reaktionsgleichung mit Strukturformeln.
als Konservierungsstoff eingesetzt. Benzoesäure kann technisch aus Toluol (Methylbenzen) durch eine katalytische Reaktion mit Luftsauerstoff hergestellt werden. Als Nebenprodukt entsteht Wasser.
Entwickle die Reaktionsgleichung mit Strukturformeln.
Begründe die vorliegende Reaktionsart.
Begründe die vorliegende Reaktionsart.
(03 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Sorbinsäure
Systematischer Name: Hexa-2,4-diensäure
Optische Aktivität
- Eine Substanz ist optisch aktiv, wenn mind. ein
-Atom vier verschiedene Substituenten besitzt, also asymmetrisch ist und somit ein chirales Zentrum besitzt.
- Die Strukturformel von Sorbinsäure zeigt, dass kein asymmetrisches
-Atom vorhanden ist und diese Säure somit nicht optisch aktiv ist.
2
Ausbildung des Hybridisierungszustands
- In der Sorbinsäure ist das sechste
-Atom
-hybridisiert, dabei befinden sich im Grundzustand zwei Außenelektronen im
-Oribital und die anderen beiden im
-Orbital (energetisch höher).
- Elektronenkonfiguration:
- In dieser Konfiguration liegen die beiden
-Orbitale (
und
) ungepaart vor und zwischen den
- und
-Orbitalen herrscht ein großer Energieunterschied.
- Es ist dadurch also nicht möglich, vier Bindungen zu den Nachbaratomen auszubilden.
- Bei der Hybridisierung wird ein
-Elektron in das unbesetzte
-Orbital angehoben, was jedoch ein instabiler Übergangszustand ist.
- Es folgt eine Angleichung der einfach besetzten
- und
-Orbitale, wodurch vier energie- und formgleiche
-Hybridorbitale entstehen.
- Es sind also ein
-Orbital und drei
-Orbitale an der Hybridisierung beteiligt.
- Die Orbitale, also
-Bindungen, bilden nach dem Modell der Elektronenpaarabstoßung eine tetraedrische Struktur.
3.1
Reaktionsgleichung für die Protolyse von Sorbinsäure


 Massenwirkungsgesetz
Massenwirkungsgesetz

3.2
Löslichkeit von Sorbinsäure
- Durch Zugabe einer Base wird die Löslichkeit der Sorbinsäure gesteigert, während sie durch Zugabe einer Säure reduziert wird.
- Dies liegt daran, dass die vorhandenen Hydroxid-Ionen
bei Zugabe einer Base die Konzentration der Hydronium-Ionen
in der Lösung verringern, indem sie sie neutralisieren:
- Wird also durch Zugabe einer Base, die Hydroxid-Ionenkonzentration
erhöht,
- Durch Zugabe einer Base wird dem Protolysegleichgewicht der Sorbinsäure ein Reaktionsprodukt entzogen, wodurch die Hinreaktion, also die weitere Protolyse der Säure, begünstigt wird (Prinzip des kleinsten Zwangs).
- Die erhöhte Löslichkeit der Sorbinsäure kommt dadurch zustande, dass das entstehende Sorbat-Anion aufgrund seiner geladenen Carboxylatgruppe besser in Wasser löslich ist.
- Im Gegensatz dazu erhöht die Zugabe einer Säure die Konzentration der Hydronium-Ionen, was die Rückreaktion begünstigt.
- Das Gleichgewicht verschiebt sich dann in Richtung der nicht protolysierten Säure mit einem hydrophoben Rest, was dazu führt, dass die Sorbinsäure sich schwerer löst.
4
Nachweis für Mehrfachbindungen
Möglichkeit 1:
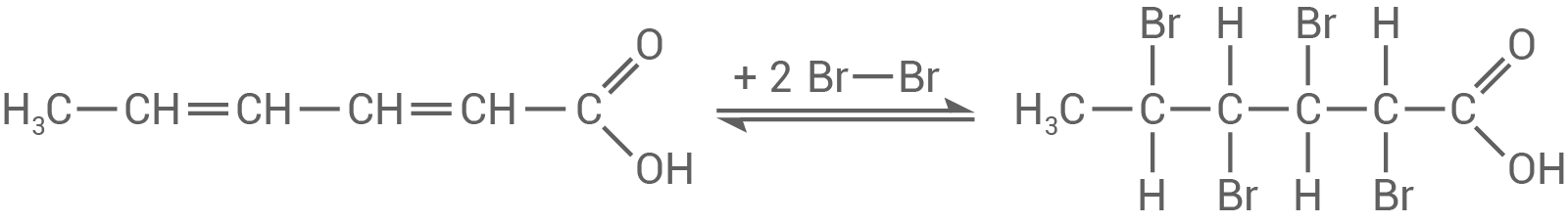 Möglichkeit 2:
Möglichkeit 2:
- Um Mehrfachbindungen nachzuweisen, kann Bromwasser verwendet werden.
- Dieses ist gelbbraun und zeigt einen positiven Nachweis, wenn sich nach Zugabe zur Sorbinsäure das Gemisch entfärbt.
- Dabei findet eine Additionsreaktion statt, bei der die Bromatome die Doppelbindungen in der Sorbinsäure aufspalten und anlagern:

- Mehrfachbindungen lassen sich auch mit dem BAYER'schen Reagenz nachweisen, welches sich aus Natriumcarbonat und Kaliumpermanganatlösung zusammensetzt.
- Diese schwach basische Kaliumpermanganatlösung färbt die zu untersuchende Lösung bei einem positiven Nachweis braun – es entsteht Mangan
-oxid, also Braunstein.
- Das Mangan wird reduziert und gleichzeitig werden die
-Atome mit den Doppelbindungen oxidiert.
- Folglich werden die Doppelbindungen aufgespalten und es entsteht ein Diol.
5
Reaktionsgleichung
 Reaktionsart
Reaktionsart

- Um die Reaktionsart zu bestimmen, werden zunächst die Elektronenübergänge auf Teilchenebene betrachtet, die durch Veränderungen der Oxidationszahlen (siehe Reaktionsgleichung)erkennbar sind.
- Das
-Atom der Methylgruppe wird oxidiert und die Oxidationszahl ändert sich von -3 auf +3.
- Der Sauerstoff hingegen wird reduziert und ändert seine Oxidationszahl von ± 0 auf -2.
- Hierbei fungiert Toluol als Elektronendonator und der Sauerstoff als Elektronenakzeptor.
- Es findet also eindeutig ein Elektronenübergang statt – es handelt sich um eine Redoxreaktion.