Teil A – Fragen zu allen Bereichen
1
Kreuze in den Aufgaben 1.1 bis 1.4 die jeweils richtige Antwort an.
1.1
Auf das Teilchen  trifft nicht zu:
trifft nicht zu:
| Die relative Teilchenmasse beträgt rund |
|
| Im Atomkern sind |
|
| In der Elektronenhülle sind |
|
| Die Elektronenkonfiguration ist |
1.2
Dieses Teilchen reagiert nicht als BRØNSTED-Säure:
1.3
Diese Reaktion ist keine Redoxreaktion:
1.4
Für die Redoxpaare mit den Standardpotenzialen




 gilt:
gilt:
| Kupfer |
|
| Silber-Atome sind das stärkste Oxidationsmittel in der Reihe. | |
| Elektronen gehen freiwillig von Silber-Atomen auf Zink |
|
| Die Hinreaktion |
(04 BE)
2
In der Abbildung ist modellhaft eine Strukturformel einer organischen Verbindung aus den Elementen Kohlenstoff, Wasserstoff und Sauerstoff dargestellt.
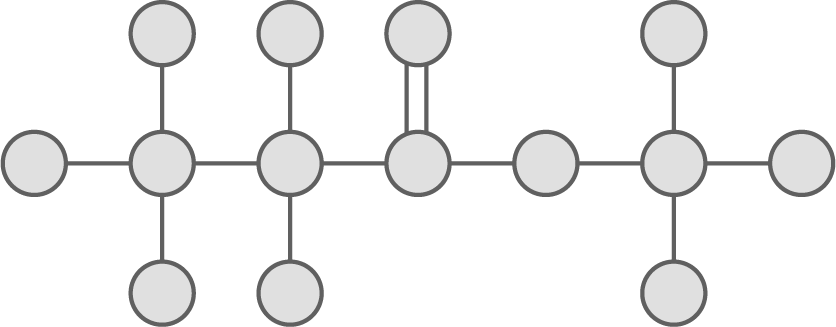 Entwickle unter Verwendung von Strukturformeln die Reaktionsgleichung für die Herstellung dieser organischen Verbindung. Gib den systematischen Namen der oben dargestellten Verbindung.
Entwickle unter Verwendung von Strukturformeln die Reaktionsgleichung für die Herstellung dieser organischen Verbindung. Gib den systematischen Namen der oben dargestellten Verbindung.

(03 BE)
3
Schwefeltrioxid ist ein Ausgangsstoff für die Schwefelsäureherstellung. Es wird nach dem Kontaktverfahren in einer Gleichgewichtsreaktion aus Schwefeldioxid und Sauerstoff gewonnen.
3.1
Entwickle die Reaktionsgleichung für das Kontaktverfahren.
(01 BE)
3.2
Erkläre den Einfluss einer Temperaturerhöhung und des Einsatzes eines Katalysators auf die Reaktionsgeschwindigkeit.
Nutze für die Erklärung des Temperatureinflusses Modellvorstellungen im Teilchenbereich.
Nutze für die Erklärung des Temperatureinflusses Modellvorstellungen im Teilchenbereich.
(04 BE)
3.3
Schwefeldioxid-Moleküle werden in saurer Lösung von Permanganat-Ionen  zu Sulfat-Ionen oxidiert.
Entwickle ausgehend von den Teilgleichungen die Reaktionsgleichung in Ionenschreibweise.
zu Sulfat-Ionen oxidiert.
Entwickle ausgehend von den Teilgleichungen die Reaktionsgleichung in Ionenschreibweise.
(03 BE)
(15 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Auf das Teilchen  trifft nicht zu:
trifft nicht zu:
| Die relative Teilchenmasse beträgt rund |
|
| Im Atomkern sind |
|
| In der Elektronenhülle sind |
|
| Die Elektronenkonfiguration ist |
1.2
Dieses Teilchen reagiert nicht als BRØNSTED-Säure:
1.3
Diese Reaktion ist keine Redoxreaktion:
1.4
Für die Redoxpaare mit den Standardpotenzialen




 gilt:
gilt:
| Kupfer |
|
| Silber-Atome sind das stärkste Oxidationsmittel in der Reihe. | |
| Elektronen gehen freiwillig von Silber-Atomen auf Zink |
|
| Die Hinreaktion |
2
Reaktionsgleichung für die Herstellung
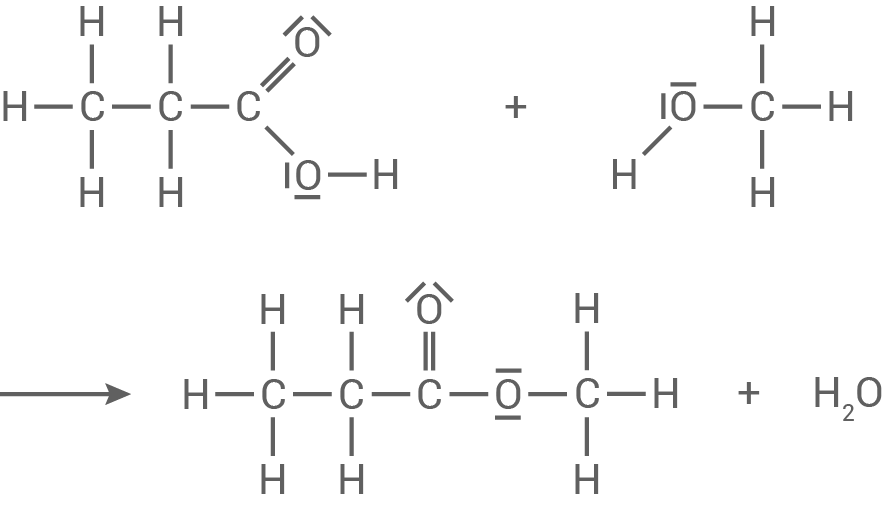 Systematischer Name
Es handelt sich um Propansäuremethylester / Propylmethanoat
Systematischer Name
Es handelt sich um Propansäuremethylester / Propylmethanoat

3.1
Reaktionsgleichung für das Kontaktverfahren



3.2
Temperaturerhöhung
- Zunahme der Anzahl an Teilchen mit kinetischer Mindestenergie
- Steigende Anzahl wirksamer Zusammenstöße, höhere Reaktionsgeschwindigkeit
- Herabsetzung der Aktivierungsenergie
- Verkürzung der Reaktionszeit, höhere Reaktionsgeschwindigkeit
3.3
Reaktionsgleichung mit Teilgleichungen