Teil B – Schwermetall-Ionen in Seen
Das Wasser in künstlich angelegten Tagebauseen hat oft einen pH-Wert im sauren Bereich und einen hohen Gehalt an gelösten
Schwermetall-Ionen, vor allem Eisen-Ionen. Die Tagebauseen werden z.B. als Ausflugsziele oder Naturschutzgebiete wieder nutzbar gemacht.
Schwermetall-Ionen, vor allem Eisen-Ionen. Die Tagebauseen werden z.B. als Ausflugsziele oder Naturschutzgebiete wieder nutzbar gemacht.
1
Begründe die Notwendigkeit der Anhebung des pH-Werts oder der Entfernung der Schwermetall-Ionen aus dem Seewasser.
(01 BE)
2
Hydratisierte Eisen -Ionen reagieren mit in Wasser gelösten Sauerstoff-Molekkülen vereinfacht nach folgender Reaktionsgleichung. Das bei dieser Reaktion entstehende Eisen
-Ionen reagieren mit in Wasser gelösten Sauerstoff-Molekkülen vereinfacht nach folgender Reaktionsgleichung. Das bei dieser Reaktion entstehende Eisen -hydroxid ist schwer löslich.
-hydroxid ist schwer löslich.
![\(4\, [Fe(H_2O)_6]^{2+}\,+\, O_2 \)](https://mathjax.schullv.de/2a854983cb064a222fb385f19782e79e99d5390190f6298a82c259e5cdd9dcb9?color=5a5a5a)


2.1
Beschreibe die Bindungsverhältnisse im komplexen Ion mithilfe einer Modellvorstellung.
(02 BE)
2.2
Begründe die leichte Oxidierbarkeit der Eisen -Ionen zu Eisen
-Ionen zu Eisen -Ionen unter Einbeziehung einer Elektronenkonfiguration in PAULING-Schreibweise (Kästchenschreibweise).
-Ionen unter Einbeziehung einer Elektronenkonfiguration in PAULING-Schreibweise (Kästchenschreibweise).
Wähle eine der Aufgaben 2.3 oder 2.4 aus und bearbeite diese.
(03 BE)
2.3
Berechne die Stoffmengenkonzentration an Eisen -Ionen in einem Liter gesättigter Eisen
-Ionen in einem Liter gesättigter Eisen -hydroxidlösung.
-hydroxidlösung.
(03 BE)
2.4
Erläuter einen Nachweis von Eisen -Ionen in wässrigen Lösungen.
-Ionen in wässrigen Lösungen.
(03 BE)
3
Der pH-Wert einer wässrigen Eisen -salzlösung mit
-salzlösung mit ![\(c_0 \big([Fe(H_2O)_6]^{2+}\big)\)](https://mathjax.schullv.de/34abf55adfb9936ff31e68d0936daaf02d7d5a810fe8ffccecfa48cfebbe7c32?color=5a5a5a) beträgt
beträgt 
3.1
Entwickle für die erste Protolysestufe des Protolysegleichgewichts die Reaktionsgleichung in Ionenschreibweise.
Benenne das bei der Protolyse gebildete komplexe Ion.
Benenne das bei der Protolyse gebildete komplexe Ion.
(02 BE)
3.2
Berechne mithilfe des Massenwirkungsgesetzes die Säurekonstante  der hydratisierten Eisen
der hydratisierten Eisen -Ionen.
-Ionen.
(03 BE)
4
Die Neutralisation der Seen kann mit unterschiedlichen Stoffen erfolgen.
Material
Als Neutralisationsmittel werden Calciumoxid  Calciumcarbonat
Calciumcarbonat  Calciumhydroxid
Calciumhydroxid  und Natriumcarbonat
und Natriumcarbonat  eingesetzt.
eingesetzt.
Der Wirkungsgrad des Neutralisationsmittels wird durch das sogenannte Neutralisationsmitteläquivalent bestimmt. Es gibt an, wie viel Mol Hydroxid-Ionen pro Kilogramm Neutralisationsmittel zur Neutralisation entsprechend der Reaktionsgleichung frei werden.
Beispiel:
bestimmt. Es gibt an, wie viel Mol Hydroxid-Ionen pro Kilogramm Neutralisationsmittel zur Neutralisation entsprechend der Reaktionsgleichung frei werden.
Beispiel:



![\(\begin{array}[t]{rll}
N_{\text{eq}}&=& \dfrac{n (OH^-)}{m(Ca(OH)_2)} & \\[5pt]
&=& \dfrac{n (OH^-)}{n(Ca(OH)_2) \cdot M(Ca(OH)_2) } & \\[5pt]
&=& \dfrac{2\,\text{mol}}{1\,\text{mol} \cdot 74\,\text{g} \cdot \text{mol}^{-1}} & \\[5pt]
&\approx & 27\dfrac{\,\text{mol}}{\,\text{kg}}
\end{array}\)](https://mathjax.schullv.de/60c999dca8a4776e2a6f063a017c448a821509178b9b15552e48022a6dc4b7d3?color=5a5a5a) Das am häufigsten eingesetzte Neutralisationsmittel ist Calciumoxid. Es entsteht bei der thermischen Zersetzung von Calciumcarbonat (Kalkbrennen).
Das am häufigsten eingesetzte Neutralisationsmittel ist Calciumoxid. Es entsteht bei der thermischen Zersetzung von Calciumcarbonat (Kalkbrennen).




 Im Handel gibt es u.a. wasserfreies Natriumcarbonat sowie kristallwasserhaltiges Natriumcarbonat-Decahydrat
Im Handel gibt es u.a. wasserfreies Natriumcarbonat sowie kristallwasserhaltiges Natriumcarbonat-Decahydrat  Beide Salze unterscheiden sich in ihren molaren Lösungsenthalpien.
Beide Salze unterscheiden sich in ihren molaren Lösungsenthalpien.



Der Wirkungsgrad des Neutralisationsmittels wird durch das sogenannte Neutralisationsmitteläquivalent
Calciumhydroxid
4.1
Ordne die im Material aufgeführten Neutralisationsmittel einer Stoffklasse zu.
Leite aus dem Bau der Stoffe zwei typische Eigenschaften ab.
Leite aus dem Bau der Stoffe zwei typische Eigenschaften ab.
(03 BE)
4.2
Berechne die Masse an einzusetzendem Calciumcarbonat, um  Tonnen Calciumoxid herzustellen.
Tonnen Calciumoxid herzustellen.
(02 BE)
4.3
Ermittle rechnerisch die Temperatur, ab der das Kalkbrennen exergonisch abläuft.
Wähle eine der Aufgaben 4.4 oder 4.5 aus und bearbeite diese.
(02 BE)
4.4
Zeige rechnerisch, dass Calciumoxid ein höheres Neutralisationsmitteläquivalent  als Calciumhydroxid hat.
als Calciumhydroxid hat.
(03 BE)
4.5
Begründe die unterschiedlichen molaren Lösungsenthalpien von wasserfreiem Natriumcarbonat und Natriumcarbonat-Decahydrat.
(03 BE)
5
Im Wasser eines Sees existieren verschiedene Puffersysteme. Beim Hydrogensulfat/Sulfat-Puffer werden im pH-Bereich von 2 bis 3 Hydrogensulfat-Ionen zu Sulfat-Ionen umgesetzt.
5.1
Erläuter am Beispiel dieses Puffers die Wirkungsweise einer Pufferlösung.
(04 BE)
5.2
Beschreibe den Nachweis der Sulfat-Ionen in wässriger Lösung.
(02 BE)
(30 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Begründung der Notwendigkeit
- Die meisten im Wasser lebenden Organismen haben einen Toleranzbereich, der sich um den neutralen pH-Wert herum befindet.
- Wenn der pH-Wert sinkt, nimmt die Anzahl der überlebensfähigen Lebewesen ab.
- Häufig bleiben nur noch Spezialisten übrig, was zu einer Abnahme der Artenvielfalt führt.
- Zusätzlich lösen sich bei niedrigerem pH-Wert im Wasser mehr giftige Schwermetalle aus dem Boden, was die Biodiversität weiter reduziert.
2.1
Bindungsverhältnisse im komplexen Ion
- Komplexverbindungen bestehen aus einem Zentralteilchen mit koordinativ gebundenen Liganden, die Elektronen als Donatoren zur Verfügung stellen und beide Bindungselektronen bei der Bindung beitragen.
- Im Hexaaquaeisen
-Ion dient das Eisen
-Ion als Zentralteilchen, um das sich sechs Wasser-Moleküle als Liganden koordinativ binden.
- Hierbei werden die Bindungen durch die freien Elektronenpaare des Sauerstoffatoms in den Wasser-Molekülen zum Zentralteilchen gebildet.
- Die Elektronenpaare, die ausschließlich von den Liganden stammen, füllen die freien Orbitale des Eisen
-Ions auf.
2.2
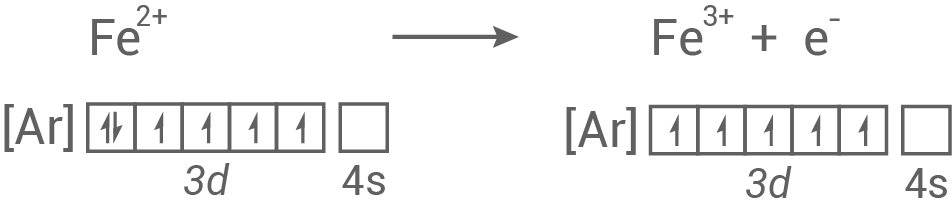
Begründung der leichten Oxidierbarkeit
- Bei einer Oxidation von Eisen
zu Eisen
-Ion wird ein Elektron abgegeben, womit das
-Unterniveau im Eisen
-Ion halb besetzt ist.
- Dadurch weist das Ion eine energetisch günstigere Besetzung auf und ist somit stabiler.
2.3
Berechnung der Stoffmengenkonzentration
Für die Berechnung wird das Löslichkeitsprodukt betrachtet:

![\([\text{mol}^{(m+n)}]\)](https://mathjax.schullv.de/fc07ac3e123e00abc61cd90f0fb5b34c82a7f471a55cd5e35d7d4639cc2bf331?color=5a5a5a) Weiterhin wird die Reaktionsgleichung aufgestellt:
Weiterhin wird die Reaktionsgleichung aufgestellt:


 Damit folgt:
Damit folgt:

 In einem Liter einer Eisen
In einem Liter einer Eisen -hydroxidlösung ist
-hydroxidlösung ist 
2.4
Nachweis von Eisen -Ionen
Möglichkeit 1:
Zugabe von gelbem Blutlaugensalz, wobei bei Überschuss der positive Nachweis einen tiefblauen Niederschlag zeigt.
-Ionen
Möglichkeit 1:
Zugabe von gelbem Blutlaugensalz, wobei bei Überschuss der positive Nachweis einen tiefblauen Niederschlag zeigt.
![\(4\,Fe^{3+}\,_\text{(aq)} + 3\,[Fe(CN)_6]^{-4}\,_\text{(aq)} \)](https://mathjax.schullv.de/25aee29f74d68a99357ccb29c5567a6da9e5d8f3a4f779816a13b18f6590d7db?color=5a5a5a)

![\(Fe_4 [Fe(CN)_6]_3 \,_\text{(s)}\)](https://mathjax.schullv.de/69601ef4ad4b1e827f7492aeed82eab503b304f1bc1c593a29cc98096e9bd98a?color=5a5a5a) Möglichkeit 2:
Zugabe einer Thiocyanat-Lösung, die bei positivem Nachweis eine blutrote Färbung der Lösung bewirkt.
Möglichkeit 2:
Zugabe einer Thiocyanat-Lösung, die bei positivem Nachweis eine blutrote Färbung der Lösung bewirkt.
![\([Fe(H_2O)_6]^{2+}\,_\text{(aq)} + 3\,SCN^-\,_\text{(aq)} \)](https://mathjax.schullv.de/d67f7e8e01215dacbac8625ccf7d8309798327fdb55bd3a823f47fbc163d9127?color=5a5a5a)

![\([Fe(SCN)_3(H_2O)_3]\,_\text{(aq)} + 3\, H_2O \,_\text{(l)} \)](https://mathjax.schullv.de/aadac6c1e3cc515c95d5429638e20c1611b16a08ce36507970258019785ddf3e?color=5a5a5a)
3.1
Reaktionsgleichung für die erste Protolysestufe
![\([Fe(H_2O)_6]^{2+}\,_\text{(aq)} + H_2O\,_\text{(l)}\)](https://mathjax.schullv.de/8c04f89bfcd56df81dc160a44f31f9ceb5f1fc721b1f173ff5ec404f88faf29e?color=5a5a5a)

![\([Fe(OH)(H_2O)_5]^+\,_\text{(aq)} + H_3O^+ \,_\text{(aq)}\)](https://mathjax.schullv.de/6126ad502e356a98f86bafbb52b65d30b70ba7d399bce3930718f5fcdfc725f9?color=5a5a5a) Hierbei bildet sich das Pentaaquahydroxidoeisen
Hierbei bildet sich das Pentaaquahydroxidoeisen -Ion.
-Ion.
3.2
Berechnung der Säurekonstanten  Aus dem MWG folgt:
Damit beträgt die Säurekonstante
Aus dem MWG folgt:
Damit beträgt die Säurekonstante  der hydratisierten Eisen
der hydratisierten Eisen -Ionen ca.
-Ionen ca. 
4.1
Zuordnung und Eigenschaften der Neutralisationsmittel
- Die Stoffe Calciumoxid
Calciumcarbonat
Calciumhydroxid
und Natriumcarbonat
zählen zu den Ionensubstanzen.
- Diese setzen sich aus Kationen und Anionen zusammen und bilden feste Ionengitter.
- Aufgrund der starken Anziehungskräfte zwischen den elektrisch entgegengesetzt geladenen Ionen besitzen sie hohe Schmelz- und Siedepunkte und sind spröde.
- Im festen Zustand leiten sie keinen elektrischen Strom. Erst bei der Schmelzung werden die Salze elektrisch leitfähig.
- Außerdem sind sie in polaren Lösungsmitteln löslich und leiten auch hier den elektrischen Strom.
4.2
Berechnung der Masse an einzusetzendem Calciumcarbonat
Zunächst wird die Reaktionsgleichung aufgestellt, woraus sich die Verhältnisse ergeben:


 Die Masse kann nun aus den Stoffmengen und molaren Massen berechnet werden.
Die Masse kann nun aus den Stoffmengen und molaren Massen berechnet werden.
Es gilt: Und daraus folgt:
Es werden ca.
Und daraus folgt:
Es werden ca.  Calciumcarbonat benötigt, um
Calciumcarbonat benötigt, um  Calciumoxid herzustellen.
Calciumoxid herzustellen.
Es gilt:
4.3
Ermittlung der Temperatur
Ab welcher Temperatur das Kalkbrennen exergonisch abläuft, kann über die GIBBS-HELMHOLTZ-Gleichung ermittelt werden:
 Dafür wird die freie Enthalpie gleich
Dafür wird die freie Enthalpie gleich  gesetzt und nach
gesetzt und nach  umgestellt:
Das Kalkbrennen läuft ab ca.
umgestellt:
Das Kalkbrennen läuft ab ca.  exergonisch ab.
exergonisch ab.
4.4
Neutralisationsmitteläquivalent  Zunächst wird die Reaktionsgleichung betrachtet:
Zunächst wird die Reaktionsgleichung betrachtet:


 Es folgt:
Somit hat Calciumoxid
Es folgt:
Somit hat Calciumoxid  ein höheres Neutralisationsmitteläquivalent
ein höheres Neutralisationsmitteläquivalent  als Calciumhydroxid
als Calciumhydroxid 
4.5
Begründung der unterschiedlichen molaren Lösungsenthalpien
Die Lösungsenthalpie  kann durch die Differenz der Gitterenthalpie und der Hydratationsenthalpie bestimmt werden:
kann durch die Differenz der Gitterenthalpie und der Hydratationsenthalpie bestimmt werden:
 Für das wasserfreie Natriumcarbonat und Natriumcarbonat-Decahydrat ergibt sich:
Da die Ionen des Natriumcarbonat-Decahydrats bereits im wasserhaltigen Kristallgitter teilweise hydratisiert sind, ist der Betrag der Hydratationsenthalpie deutlich kleiner.
Für das wasserfreie Natriumcarbonat und Natriumcarbonat-Decahydrat ergibt sich:
Da die Ionen des Natriumcarbonat-Decahydrats bereits im wasserhaltigen Kristallgitter teilweise hydratisiert sind, ist der Betrag der Hydratationsenthalpie deutlich kleiner.
5.1
Wirkungsweise einer Pufferlösung
Das Puffergleichgewicht lässt sich wie folgt darstellen:



- Die Zugabe einer Säure führt dazu, dass die Hydronium-Ionen der Säure mit den Sulfat-Ionen reagieren, wodurch das Protolyse-Gleichgewicht in Richtung der Hydrogensulfat-Ionen verschoben wird.
- Die Zugabe einer Base führt dazu, dass die Hydroxid-Ionen der Base mit den Hydronium-Ionen reagieren, wodurch das Protolyse-Gleichgewicht in Richtung der Sulfat-Ionen verschoben wird.
5.2
Nachweis für Sulfat-Ionen
Sulfat-Ionen können durch eine Bariumchlorid-Lösung nachgewiesen werden, wobei Bariumsulfat entsteht und einen weißen Niederschlag bildet.


