Teil C – Experimente: Ammoniumchlorid und Oxalsäure
Hinweis: Von den nachfolgenden Aufgabenteilen C1 und C2 soll in der Prüfung nur einer bearbeitet werden.
Aufgabe C1
Ammoniumchlorid wird u.a. als Lebensmittelzusatzstoff (E 510, Säureregulator) verwendet.
1
Berechne den pH-Wert einer Ammoniumchloridlösung mit 
(02 BE)
2
Experiment A
Stelle aus Ammoniumchloridlösung mit
Ammoniumchloridlösung mit  eine Pufferlösung her.
eine Pufferlösung her.
Prüfe anschließend deren Wirksamkeit.
Stelle aus
Prüfe anschließend deren Wirksamkeit.
2.1
Fordere alle notwendigen Chemikalien schriftlich an.
Führe das Experiment durch.
Gib deine Beobachtungen an.
Führe das Experiment durch.
Gib deine Beobachtungen an.
(03 BE)
2.2
Begründe die Auswahl der angeforderten Chemikalien.
(02 BE)
2.3
Entwickle die Reaktionsgleichung für das Puffergleichgewicht.
(01 BE)
3
Experiment B
Bestimme kalorimetrisch die molare Lösungsenthalpie von Ammoniumchlorid. Zur Verfügung stehen dir u.a. des Salzes.
des Salzes.
Bestimme kalorimetrisch die molare Lösungsenthalpie von Ammoniumchlorid. Zur Verfügung stehen dir u.a.
3.1
Führe das Experiment durch. Gib deine Messwerte an.
(02 BE)
3.2
Berechne aus deinen Messwerten bei Experiment B die molare Lösungsenthalpie von Ammoniumchlorid.
Hinweis: Die Dichte und die spezifische Wärmekapazität der Lösung entspricht näherungsweise der von Wasser. Der Kalorimeterwert bleibt unberücksichtigt.
(02 BE)
3.3
Erkläre den Lösevorgang von Ammoniumchlorid in Wasser aus energetischer Sicht.
(03 BE)
(15 BE)
Aufgabe C2
1
Oxalsäure (Ethandisäure) ist die einfachste Dicarbonsäure.
1.1
Experiment A
Plane mit Oxalsäure und weiteren Chemikalien zwei Experimente so, dass diese einer Redoxreaktion und einer Fällungsreaktion zuzuordnen sind.
Dir stehen folgende Chemikalien zur Verfügung: destilliertes Wasser, Calciumchloridlösung, Kaliumpermanganatlösung und Schwefelsäure.
Plane mit Oxalsäure und weiteren Chemikalien zwei Experimente so, dass diese einer Redoxreaktion und einer Fällungsreaktion zuzuordnen sind.
Dir stehen folgende Chemikalien zur Verfügung: destilliertes Wasser, Calciumchloridlösung, Kaliumpermanganatlösung und Schwefelsäure.
(02 BE)
1.2
Führe die Experimente durch.
Notiere deine Beobachtungen.
Notiere deine Beobachtungen.
(02 BE)
1.3
Entwickle für beide Reaktionen die Reaktionsgleichungen in Ionenschreibweise.
(02 BE)
2
Vor der Verwendung von Natriumhydroxidlösung als Maßlösung muss deren genaue Stoffmengenkonzentration ermittelt werden.
Überprüfen Sie durch Titration von Oxalsäurelösung mit Natriumhydroxidlösung, ob die bereitgestellte Natriumhydroxidlösung die gewünschte Stoffmengenkonzentration besitzt.
besitzt.
Überprüfen Sie durch Titration von Oxalsäurelösung mit Natriumhydroxidlösung, ob die bereitgestellte Natriumhydroxidlösung die gewünschte Stoffmengenkonzentration
2.1
Entwickle für die Reaktion von Oxalsäurelösung mit Natriumhydroxidlösung die Reaktionsgleichung in Ionenschreibweise.
(01 BE)
2.2
Wähle mithilfe der gegebenen Titrationskurve aus der Tabelle einen Indikator aus, der für eine Titration von Oxalsäurelösung mit Natriumhydroxidlösung geeignet ist.
Begründen deine Entscheidung.
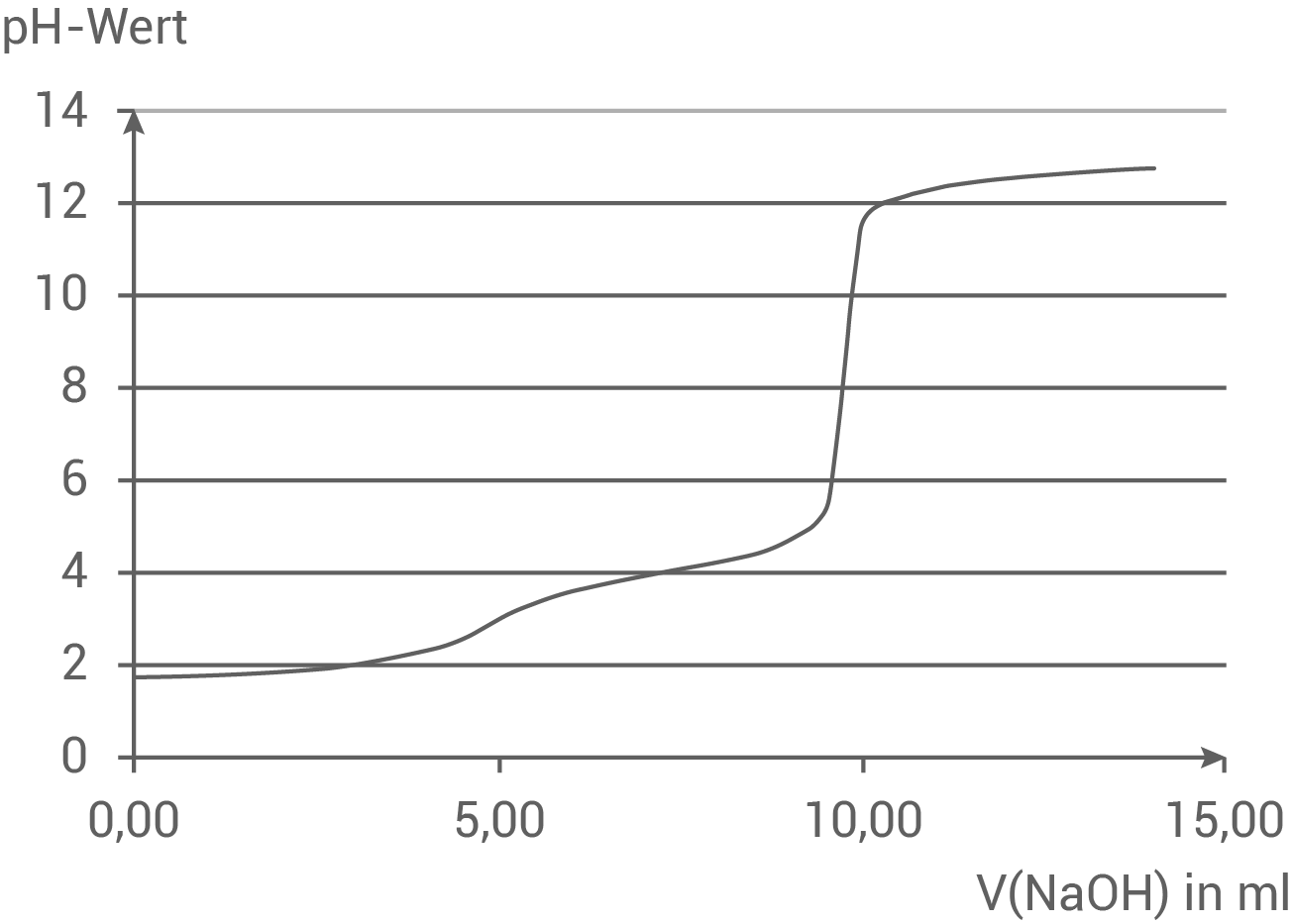
Begründen deine Entscheidung.

Titration von Oxalsäurelösung mit einer Natriumhydroxidlösung
| pH-Umschlags- | Farbänderung | |
| Methylorange Bromthymolblau Phenolphthalein | rot/gelb gelb/blau farblos/rot |
(01 BE)
2.3
Experiment B
Befülle die Bürette mit der zu untersuchenden Natriumhydroxidlösung. Miss genau Oxalsäurelösung der Stoffmengenkonzentration
Oxalsäurelösung der Stoffmengenkonzentration  ab.
Führe die Titration zweimal durch. Gib deine Messwerte an.
ab.
Führe die Titration zweimal durch. Gib deine Messwerte an.
Befülle die Bürette mit der zu untersuchenden Natriumhydroxidlösung. Miss genau
(03 BE)
2.4
Ermittle rechnerisch, ob die Natriumhydroxidlösung die gewünschte Stoffmengenkonzentration besitzt.
(02 BE)
2.5
Berechne die Masse an gelöstem Natriumhydroxid in  der untersuchten Lösung.
der untersuchten Lösung.
(02 BE)
(15 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Lösung C1
1
Berechnung des pH-Werts einer Ammoniumchloridlösung
Bei  handelt es sich um eine schwache Säure, deswegen gilt:
handelt es sich um eine schwache Säure, deswegen gilt:
 Der
Der  -Wert ergibt sich aus dem negativ dekadischen Logarithmus von
-Wert ergibt sich aus dem negativ dekadischen Logarithmus von  (Säurekonstante):
(Säurekonstante):
2.1
Experiment A
Anforderung:
Anforderung:
- Ammoniaklösung
- verdünnte Säurelösung (z.B.
)
- verdünnte Basenlösung (z.B.
)
- Universalindikatorlösung + pH-Skala
vorgegebene Ammoniumchloridlösung und
Ammoniaklösung miteinander vermischen, auf zwei Reagenzgläser aufteilen und mit ein paar Tropfen Universalindikatorlösung versetzen
- Reagenzglas 1 unter vorsichtigem Schütteln Salzsäure zutropfen bis keine Farbänderung mehr stattfindet
- analog: Reagenglas 2 unter vorsichtigem Schütteln Natronlauge zutropfen bis keine Farbänderung mehr stattfindet
- Die Anfangslösungen mit der Universalindikatorlösung zeigen eine blaugrüne Farbe – das entspricht etwa
- Die Zugabe von
bzw.
bewirkt keine Farbänderung – der pH-Wert bleibt nahezu konstant.
- Erst bei größeren Stoffmengen an zugegebener Säure- bzw. Basenlösung, verändert sich die Farbe und damit auch der pH-Wert.
2.2
Begründung der angeforderten Chemikalien
- Ammoniaklösung mit
: Herstellung einer Pufferlösung
eine Lösung mit Pufferwirkung setzt sich aus einer Säure und ihrer korrespondierenden Base zusammen
bei Äquimolarität liegt die größte Pufferwirkung vor, das bedeutet bei Lösungen gleicher Konzentration
- Verdünnte Säure- bzw. Basenlösung: Anzeigen der Pufferwirkung durch Zugabe
- Universalindikatorlösung + pH-Skala: Ermittlung und Überprüfung des pH-Wertes
2.3
Reaktionsgleichung für das Puffergleichgewicht



3.1
Experiment B
Durchführung:
Durchführung:
- Es wird ein bestimmtes Volumen an Wasser im Kalorimetergefäß vorgelegt und die Temperatur gemessen.
- Die zur Verfügung stehenden
Ammoniumchlorid werden unter ständigem Rühren zugegeben.
- Es wird die Temperatur betrachtet, bis sich das Salz komplett gelöst hat – die Temperatur sinkt.
3.2
Berechnung der molaren Lösungsenthalpie
Für die Berechnung muss zunächst die Gesamtmasse der Lösung ermittelt werden:
![\(\begin{array}[t]{rll}
m\,\text{(Lösung)}&=& m (H_2O) + m (NH_4Cl) & \\[5pt]
&=& 100\,\text{g} + 5\,\text{g} & \\[5pt]
&=& 105 \,\text{g}
\end{array}\)](https://mathjax.schullv.de/d1a039e346af485525abe03f58d03ee844b1d453e8c9723cf46610adc5946cc7?color=5a5a5a) Damit ergibt sich:
Die molare Lösungsenthalpie von Ammoniumchlorid beträgt (bei diesen Messwerten) ca.
Damit ergibt sich:
Die molare Lösungsenthalpie von Ammoniumchlorid beträgt (bei diesen Messwerten) ca. 
3.3
Lösevorgang von Ammoniumchlorid aus energetischer Sicht
- Beschrieben wird der Lösevorgang durch die Gitterenthalpie
und die Hydratationsenthalpie
- Wenn Ammoniumchlorid gelöst wird, gilt für die Lösungsenthalpie:
- Der Vorgang ist endotherm, wenn gilt:
hier:
- Die Gitterenthalpie stellt die Energie dar, die freigesetzt wird, wenn sich Ionen zu einem Gitter verbinden
- Beim Lösen von Ammoniumchlorid muss die Gitterenthalpie aufgewendet werden, um das Ionengitter zu zerstören.
- Die Hydratationsenthalpie beschreibt die Wärmeenergie, die bei der Hydratisierung von Ionen in einer wässrigen Lösung freigesetzt wird.
- Beim Lösen von Ammoniumchlorid in Wasser ist der Prozess endotherm, da die freigesetzte Energie bei der Hydratisierung der Ammonium-Chlorid-Ionen geringer ist als die Energie, die benötigt wird, um das Ionengitter zu zerstören.
- Der Umgebung wird Wärme entzogen – die Lösung kühlt sich ab.
Lösung C2
1.1
Experiment A
- Fällungsreaktion: Oxalsäure mit Calciumchloridlösung
- Redoxreaktion: Oxalsäure mit Kaliumpermanganatlösung (angesäuert mit Schwefelsäure)
1.2
Beobachtungen
- Fällungsreaktion: Zu der Oxalsäurelösung wird etwas Calciumchloridlösung zugetropft, wobei sich ein weißer kristalliner Niederschlag bildet.
- Redoxreaktion: Die Oxalsäurelösung wird mit ein paar Tropfen Schwefelsäure (verdünnt) zur Ansäuerung und anschließend mit wenigen Tropfen Kaliumpermanganatlösung versetzt. Das zunächst violette Gemisch hellt sich auf und wird schließlich wieder farblos.
1.3
Reaktionsgleichungen
- Fällungsreaktion: Oxalsäure mit Calciumchloridlösung
- Redoxreaktion: Oxalsäure mit Kaliumpermanganatlösung (angesäuert mit Schwefelsäure)
2.1
Reaktionsgleichung für Oxalsäure mit Natriumhydroxid



2.2
Indikatorwahl
- Die Titrationskurve zeigt zwei Umschlagpunkte, da Oxalsäure eine zweiprotonige Säure ist.
- Der erste Umschlagpunkt ist aufgrund des flachen Anstiegs schwer zu erkennen, weshalb bis zum zweiten Umschlagpunkt titriert wird, welcher im basischen Bereich liegt – der pH-Wert beträgt etwa
- Als Indikator eignet sich hier nur Phenolphthalein, da es im schwach basischen Bereich einen Farbumschlag von farblos zu rotviolett zeigt.
2.3
Experiment B

- Es werden
Oxalsäurelösung in einen Erlenmeyerkolben gegeben (mithilfe von Vollpipette und Pipettierball) und wenn nötig mit destilliertem Wasser aufgefüllt.
- Anschließend wird unter ständigem Rühren (Schwenken/Magnetrührer) Natronlauge zugetropft, bis sich die Lösung rosa gefärbt hat.
- Nun kann an der Bürette abgelesen werden, wie viel Natronlauge verbraucht wurde.
- Der Vorgang wird wiederholt.
- Der Mittelwert aus den beiden Messwerten ergibt das Endvolumen.
2.4
Ermittlung der Stoffmengenkonzentration
Es findet folgende Reaktion statt:


 Daraus ergeben sich folgende Stoffmengenverhältnisse:
Daraus ergeben sich folgende Stoffmengenverhältnisse:
Weiterhin gilt:
Damit erreicht die Lösung (hier) nicht die gewünschte Stoffmengenkonzentration von 
2.5
Berechnung der Masse an gelöstem Natriumhydroxid
Es gilt:
 Daraus folgt:
In
Daraus folgt:
In  der untersuchten Lösung sind
der untersuchten Lösung sind 
 gelöst.
gelöst.